|
|
Ειδικό αφιέρωμα για το έτος Χημείας 2011 |
[Μάρτιος - Απρίλιος 2011]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής - Κωνσταντίνος Ευσταθίου, Καθηγητής
|
ΣΥΝΤΟΜΗ ΙΣΤΟΡΙΑ ΤΗΣ ΧΗΜΕΙΑΣ ΜΕΡΙΚΟΙ ΑΠΟ ΤΟΥΣ ΚΥΡΙΟΤΕΡΟΥΣ ΣΤΑΘΜΟΥΣ ΤΗΣ ΕΞΕΛΙΞΗΣ ΤΗΣ ΕΠΙΣΤΗΜΗΣ ΤΗΣ ΧΗΜΕΙΑΣ |
1. Η Χημεία από τις Προϊστορικές Εποχές
|
Το ιερογλυφικό σύμβολο "δέρμα κροκοδείλου" km.t, που διαβάζεται "kem" ή "kmet", σημαίνει "μαύρο", αλλά αποδίδει και το όνομα της ίδιας της αρχαίας Αιγύπτου. |
Η ιστορία της Χημείας ξεκινάει από την εποχή που οι προϊστορικοί άνθρωποι άρχισαν να ενδιαφέρονται για τα υλικά που χρησιμοποιούσαν για να κατασκευάσουν τις καλύβες τους, τα κεραμικά και γυάλινα σκεύη, τα μεταλλικά αντικείμενα και άλλα είδη καθημερινής χρήσης. Συγχρόνως, οι άνθρωποι άρχισαν να πειραματίζονται για το πώς θα βελτίωναν τις ιδιότητες και την ποιότητα των υλικών και των αντικειμένων αυτών, αναμιγνύοντας μια ποικιλία συστατικών και εφαρμόζοντας διάφορους τρόπους επεξεργασίας. Κάπου εκεί θα πρέπει να αναζητηθούν οι απαρχές της Χημείας, σε καμιά περίπτωση βέβαια ως επιστήμης, αλλά σαν μια μεθοδολογία που βασιζόταν σε εμπειρικές παρατηρήσεις του τύπου "δοκιμής και λάθους". Ωστόσο, και το τυχαίο αποδίδει, όταν διατίθεται άφθονος χρόνος.
|
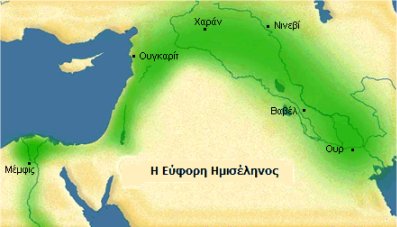
Η Εύφορη Ημισέληνος, είναι η περιοχή που περιλαμβάνει τη Μεσοποταμία, δηλ. τις κοιλάδες των ποταμών Τίγρη και Ευφράτη έως και τις περιοχές της Παλαιστίνης. Στις περιοχές αυτές, για πρώτη φορά, αναπτύχθηκαν τουλάχιστον πριν 10.000 χρόνια διάφοροι πολιτισμοί αγροτικού χαρακτήρα. |
Η ιστορία της Χημείας και τα εξελικτικά στάδιά της πέρασαν μέσα από τις εποχές των πανάρχαιων πολιτισμών των Σουμέριων και των Αιγυπτίων, τις φιλοσοφικές αναζητήσεις των υλιστικών φιλοσόφων της Αρχαίας Ελλάδας, των Ινδών και Κινέζων πειραματιστών και στη συνέχεια των Ρωμαίων και των Μουσουλμάνων, που ανακάλυψαν πλήθος νέων χημικών ουσιών και νέες πρακτικές μεθόδους παρασκευής τους.
Οι πρώτες χημικές γνώσεις διαδόθηκαν ταχύτατα στη Μεσαιωνική Ευρώπη, χάρις στους Αλχημιστές. Με μια πορεία μέσα από παρανοήσεις και λάθη, μέσα από ένα συνονθύλευμα μυστικισμού, προκαταλήψεων και παράξενων θρησκευτικών δοξασιών, κατάφερε να αναδειχθεί η Χημεία ως ένας αυτεξούσιος επιστημονικός κλάδος κάπου κατά τον 17ου αιώνα, χάρις στη δουλειά λίγων πραγματικά φωτισμένων ανθρώπων.
Η λέξη Αλχημεία προέρχεται από το αραβικό οριστικό άρθρο Αλ- και τη λέξη Χημεία (al-kimya). Η προέλευση της λέξης Χημεία παραμένει ακόμη και σήμερα αντικείμενο πολλών θεωριών και αναζητήσεων. Η επικρατέστερη εκδοχή είναι ότι σχετίζεται με τις λέξεις χημία και χυμεία.
Η "χημία" εικάζεται ότι προέρχεται από την αρχαία αιγυπτιακή λέξη κεμ (= μαύρος), διότι ως τέχνη και επιστήμη συνδέθηκε με την Αίγυπτο, που σύμφωνα με τον Πλούταρχο ονομαζόταν και ως Μαύρη Γη ή Μαύρη Χώρα. Ακόμη μπορεί να σχετίζεται με τη μετατροπή των "μαύρων" ορυκτών και μεταλλευμάτων σε χρήσιμες ουσίες και μέταλλα.
Η λέξη χυμεία (khymeia) προέρχεται από το ρήμα χέω και τη διαδικασία της χύτευσης και αφορούσε την ανάμιξη χρυσού και αργύρου με σύντηξη, έργο που εκτελούσαν οι χυμευτές. Σύμφωνα με την Βυζαντινή "Σούδα" (γλωσσικό-ετυμολογικό αλλά και γενικό εγκυκλοπαιδικό λεξικό των τελών του 10ου αιώνα) ως χυμεία ορίζεται "η του αργύρου και χρυσού κατασκευή". Επίσης, στη "Σούδα" αναφέρεται ότι παλαιότερα, ο Ρωμαίος Αυτοκράτορας Διοκλητιανός (245-312 μ.Χ.) είχε διατάξει την καταστροφή όλων των Αιγυπτιακών βιβλίων που σχετίζονταν με τη χυμεία, δηλ. τη σύντηξη χρυσού και αργύρου, για να μη συσσωρεύσουν οι Αιγύπτιοι πλούτο και "αποθρασυνθούν" κατά των Ρωμαίων.
Μια ακόμη εκδοχή για την προέλευση της λέξης "χημεία" προσφέρεται από έναν 'Ελληνα ή Αιγύπτιο αλχημιστή των πρωτοχριστιανικών αιώνων, τον Ζώσιμο τον Πανοπολίτη (4ος-5ος αιώνας μ.Χ.). Στο βιβλίο του με τίτλο Ιμούθ (μια από τις αποδόσεις του ονόματος του Φαραώ Imhotep, 2655-2600 π.Χ., σε ελληνικά κείμενα), γράφει για τη γένεση της Αλχημείας, σύμφωνα με την οποία ο "πρώτος των τεχνών" ήταν ο Χημεύ (με αιγυπτιακή γραφή: "Chêmi"), από τον οποίο προέρχεται "το όνομα της χημείας".
 |
|
|
Ο χρυσός και ο χαλκός είναι από τα λίγα μέταλλα που βρίσκονται στη φύση ελεύθερα. Το γεγονός αυτό σε συνδυασμό με το χαμηλό σημείο τήξεως, δικαιολογεί το γεγονός ότι ήταν τα πρώτα μέταλλα που γνώρισε και επεξεργάστηκε ο άνθρωπος. |
|
 |
 |
|
Διακοσμητικά μεταλλικά αντικείμενα (από χαλκό και κράματά του) από τον πολιτισμό των Σουμερίων (Πόλη Ούρ, Μεσοποταμία). |
|
Ανεξάρτητα πάντως της προέλευσης της λέξης Χημεία, το βέβαιο είναι οι δύο αρχαίοι πολιτισμοί της Αιγύπτου και της Ελλάδας συνέβαλαν αποφασιστικά στην προώθηση και εξέλιξη της Χημείας.
Πηγές από το Διαδίκτυο: (1) "Etymology of Chemistry" (Journal of Chemical Education). (2) "Chemistry (etymology)" (Wikipedia). (3) "Η Αλχημεία στα Βυζαντινά Χρόνια" (Νικόλαος Βασ. Λίτσας, Αρχαιολογία και Τέχνες, τχ. 107). (4) "Μαρτυρίες περί αλχημείας στο Βυζάντιο σε μη αλχημικά κείμενα" (Γεράσιμος Μεριανός, Σάντυ Σακκοράφου, στο "Επιστήμη και Τεχνολογία: Ιστορικές και Ιστοριογραφικές Μελέτες", Εκδοτική Αθηνών).
2. Η Απαρχή της Χημείας στη Μεσοποταμία
Η ιστορία της Χημείας ξεκινά από την εποχή της δημιουργίας των πρώτων αγροτικών πολιτισμών στην περιοχή των ποταμών Τίγρη και Ευφράτη, στην περιοχή η οποία στα ιστορικά δοκίμια αναφέρεται ως Εύφορη Ημισέληνος (Fertile Crescent).
Στην περιοχή της Εύφορης Ημισελήνου αναπτύχθηκαν οι πρώτοι αγροτικοί πολιτισμοί (8.000-10.000 π.Χ.). Τα νερά των ποταμών που πλημμύριζαν την κοιλάδα και η πλούσια σε θρεπτικά συστατικά λάσπη, βοηθούσαν τις συστηματικές αγροτικές καλλιέργειες και επομένως συνέβαλαν στη μόνιμη εγκατάσταση λαών που μέχρι τότε ζούσαν νομαδικά, αναζητώντας τροφή από κυνήγι και άγρια φρούτα και λαχανικά.
 Η Μεσοποταμία
έγινε το λίκνο πλούσιων πολιτισμών και δημιουργίας μεγάλων πόλεων, όπως η
Βαβέλ (Βαβυλώνα) και η
Ουρ.
Εκεί αναπτύχθηκε ο πανάρχαιος πολιτισμός των Σουμερίων (4η χιλιετηρίδα π.Χ.). Οι Σουμέριοι ανέπτυξαν τη γραφή σε εγχάρακτες πλάκες, την
κεραμική με τη χρήση του κεραμευτικού τροχού και τη μεταλλουργία για την κατασκευή οικιακών
εργαλείων και δοχείων, αλλά και όπλων.
Η Μεσοποταμία
έγινε το λίκνο πλούσιων πολιτισμών και δημιουργίας μεγάλων πόλεων, όπως η
Βαβέλ (Βαβυλώνα) και η
Ουρ.
Εκεί αναπτύχθηκε ο πανάρχαιος πολιτισμός των Σουμερίων (4η χιλιετηρίδα π.Χ.). Οι Σουμέριοι ανέπτυξαν τη γραφή σε εγχάρακτες πλάκες, την
κεραμική με τη χρήση του κεραμευτικού τροχού και τη μεταλλουργία για την κατασκευή οικιακών
εργαλείων και δοχείων, αλλά και όπλων.
Ευρήματα που ανάγονται στο 6.000 π.Χ., αποδεικνύουν πως από τότε ήταν ήδη γνωστές τεχνικές επεξεργασίας μεταλλευμάτων για την παρασκευή μεταλλικού χαλκού. Ακολούθησαν οι περισσότερες συστηματικές μεταλλουργικές πρακτικές και πιο εξελιγμένες τεχνικές της μεταλλουργίας (καθαρισμός μεταλλευμάτων με εφαρμογή υψηλών θερμοκρασιών, χύτευση, εμπλουτισμός).
Στη συνέχεια διαπίστωσαν ότι ο χαλκός που παρασκευαζόταν με αναγωγή ορυκτών χαλκού αναμιγμένων με ορυκτά κασσιτέρου, ήταν πολύ σκληρότερος και ανθεκτικότερος σε σχέση με τον καθαρό. Το γεγονός οδήγησε στην ανακάλυψη του κρατερώματος, κράματος χαλκού-κασσιτέρου (με 10 έως 20% κασσίτερο). 'Ετσι, ήδη από το 3.800-4.000 π.Χ. οι Σουμέριοι γνώριζαν τα κράματα.
ΣΗΜΕΙΩΣΗ: Συχνά το κρατέρωμα (bronze) συγχέεται με τον ορείχαλκο (brass), ο οποίος περιέχει ψευδάργυρο αντί κασσιτέρου, κράμα το οποίο εμφανίστηκε αρκετούς αιώνες αργότερα.
Με βάση αρχαιολογικά ευρήματα, εκτιμάται ότι κατά χρονολογική σειρά ανακαλύφθηκαν και άρχισε να γίνεται η χρήση των ακόλουθων μετάλλων (σε παρένθεση: η εκτιμούμενη χρονολογία κατασκευής/χρήσης του αρχαιότερου μεταλλικού αντικειμένου): Χρυσός (6.000 π.Χ.), χαλκός (4.200 π.Χ.), άργυρος (4.000 π.Χ.), μόλυβδος (3.500 π.Χ.), κασσίτερος (1.750 π.Χ.), σίδηρος (1.500 π.Χ.), υδράργυρος (750 π.Χ.). Ωστόσο, σχετικά πρόσφατα βρέθηκε μεταλλικός υδράργυρος σε γυάλινο φιαλίδιο σε αιγυπτιακό τάφο χρονολογούμενο από το 1.500 π.Χ.
Αξίζει να σημειωθεί ακόμη η αντιστοίχηση των μέχρι τότε γνωστών μετάλλων με τους μέχρι τότε γνωστούς πλανήτες. Η αντιστοίχηση αυτή συναντάται ίδια σε πολλούς πολιτισμούς, έτσι:
- Ο χρυσός συνδέεται με τον λαμπρό, αστραφτερό 'Ηλιο ή με κάθε αγαθή θεότητα του φωτός, όπως ο θεός των αρχαίων Ελλήνων Απόλλωνας.
- Ο υδράργυρος, ο "υγρός άργυρος", ευκίνητος και δύσκολος στη "σύλληψη", συνδέεται με τον πλανήτη Ερμή, τον πλανήτη που, λόγω της γειτνίασής του με τον ήλιο, είναι μετά δυσκολίας ορατός και μάλιστα ορισμένες μόνο εποχές του χρόνου. 'Ετσι, ο υδράργυρος συνδέεται με τον "φτεροπόδαρο" θεό Ερμή ή άλλες ανάλογες θεότητες άλλων πολιτισμών. Ο αντίστοιχος θεός των Λατίνων, Mercurius, δίνει το όνομά του στον υδράργυρο σε πολλές λατινογενείς γλώσσες.
- Ο χαλκός συνδέεται με τον πλανήτη Αφροδίτη. Από το νησί της Αφροδίτης (Venus για τους Λατίνους), την Κύπρο, που αποτελούσε μια κύρια πηγή χαλκού κατά την αρχαιότητα, προέρχεται η λατινική ονομασία cuprum του χαλκού.
- Ο άργυρος συνδέεται με την "ασημόχρωμη" Σελήνη, Luna για τους Λατίνους. Τις ενώσεις του αργύρου οι αλχημιστές τις χαρακτήριζαν "σεληνιακές" (lunar).
- Ο σίδηρος, ίσως εξαιτίας της κοκκινόχρωμης σκουριάς του, συνδέεται με τον "ερυθρό" πλανήτη 'Αρη. Ο 'Αρης (Mars για τους Λατίνους), πολεμική θεότητα, κατανικά τους εχθρούς του με σιδηρά όπλα.
- Ο κασσίτερος, αυτό το "θαυματουργό" και αρκετά δυσεύρετο και επομένως πολύτιμο κατά την αρχαιότητα μέταλλο, που όταν αναμιχθεί σε σχετικά μικρή αναλογία με τον χαλκό παρέχει το σκληρό κρατέρωμα, συνδέεται με τον πλανήτη Δία. Ο αντίστοιχος θεός της σοφίας και δύναμης Jupiter για τους Λατίνους και Tinia για τους Ετρούσκους, από το όνομα του οποίου έλκει ο κασσίτερος την αγγλική του ονομασία tin.
- Ο μόλυβδος, ένα "τοξικό" μέταλλο, συνδέεται με τον πλανήτη Κρόνο (Saturnus για τους Λατίνους). Ο Κρόνος θεωρείται κακότροπη, μοχθηρή και "δηλητηριώδης" θεότητα. Μέχρι και σήμερα χρησιμοποιείται ο όρος saturnism, που σημαίνει δηλητηρίαση από μόλυβδο.

Αρχαιότατη είναι η αντιστοίχηση του ήλιου και των τότε γνωστών πλανητών με τα τότε γνωστά μέταλλα. Να σημειωθεί ότι στην αρχαιότητα δεν θεωρούσαν τη Γη ως πλανήτη.
(τα μεγέθη των πλανητών δεν βρίσκονται υπό ενιαία κλίμακα).
Τότε περίπου άρχισε να γίνεται αισθητή και η ανάγκη για καύσιμα, τόσο για τις καθημερινές ανάγκες των πληθυσμών, όσο και για τη μεταλλουργία. Οι ανάγκες αυτές σε μεγάλο μέρος τους καλύπτονταν από την άσφαλτο και άλλα πισσώδη υλικά, που αφθονούσαν στην περιοχή της Μεσοποταμίας και ανάβλυζαν από ρωγμές των εδαφών.
 |
 |
|
Αριστερά: Η τυχαία ανακάλυψη του γυαλιού από Φοίνικες ναυτικούς. Δεξιά: Ορισμένα γυάλινα φιαλίδια (πιθανώς αρωμάτων) της ρωμαϊκής εποχής, όταν είχε εξελιχθεί πλέον κατά πολύ η τέχνη της υαλουργίας. |
|
Παράλληλα, οι κάτοικοι των περιοχών αυτών άρχισαν να ασχολούνται με τη βαφική. Χρησιμοποιούσαν χρώματα, που παρασκεύαζαν από εκχυλίσματα καρπών και φλοιών δέντρων ή από έγχρωμα ορυκτά υλικά, για να βάφουν υφάσματα, αλλά και το ίδιο το δέρμα τους για καλλωπιστικούς λόγους. Σύντομα διαπίστωσαν τις απορρυπαντικές ιδιότητες της στάχτης ξύλων. Βρήκαν τρόπους να παραλαμβάνουν τα αιθέρια έλαια από αρωματικά φυτά και τους καρπούς τους και να παρασκευάζουν αρώματα και καλλυντικά.
Η βυρσοδεψία ήταν μια ακόμη δραστηριότητα. Μέσω της χρήσης χημικών υλικών, βελτίωναν σημαντικά την ποιότητα και την αντοχή των δερμάτινων προϊόντων.
|
Αρχαία αιγυπτιακή τοιχογραφία με απεικόνιση εργασιών σε διάφορα εργαστήρια. |
'Οταν διαπίστωσαν πως στις φωτιές που άναβαν καίγοντας ξύλα στην άμμο, έβρισκαν ανάμεσα στις στάχτες κάτι περίεργες σχεδόν διαφανείς συμπαγείς μάζες (αποτέλεσμα της σύντηξης της άμμου με τα ανθρακικά άλατα του καλίου από τη στάχτη των ξύλων), άρχισαν να σκέφτονται πως θα μπορούσαν να αξιοποιήσουν αυτό το περίεργο νέο υλικό, το οποίο δεν ήταν άλλο από το γυαλί.
Οι παραπάνω τέχνες και τεχνικές βελτιώθηκαν με πειραματισμό και βαθμιαία καθιερώθηκαν μεθοδολογίες και πρακτικές που μεταβιβάζονταν από γενεά σε γενεά. Οι αρχαίοι τεχνίτες δεν είχαν βέβαια ιδέα για τη χημεία των υλικών, αλλά είχαν αποκτήσει με την πάροδο των χρόνων έναν πλούτο από πρακτικές γνώσεις.
Πηγές από το Διαδίκτυο: (1) "The Fertile Crescent" (University of Victoria, Canada). (2) "Sumerians" (AncientScripts.com). (3) "History of Metallurgy". (4) "A Short History of Metals" (Alan W. Cramb, Carnegie Mellon University). (5) "A Brief History of Glass" (GlassOnLine.com).
3. Η Χημεία κατά την Περίοδο της Αρχαίας Αιγύπτου
Η Αρχαία Αίγυπτος χαρακτηρίσθηκε από τον πλούσιο αρχαίο πολιτισμό της που εξελίχθηκε από τις προϊστορικές εποχές (περίπου 3.300 π.Χ.) μέχρι το 31 π.Χ., όταν η Αίγυπτος κατέστη επαρχία της Ρωμαϊκής Αυτοκρατορίας.
Η Αίγυπτος, με τα πολυάριθμα σταθερά βασίλεια και με τα πολιτισμικά επιτεύγματα (3.200 π.Χ.: γραφή με ιερογλυφικά, 3.100 π.Χ.: χρήση δεκαδικού συστήματος αρίθμησης, 3.100 π.Χ.: κελάρια κρασιού, 2.700 π.Χ.: χειρουργική τεχνική, 2.500 π.Χ.: κατασκευή της μεγάλης πυραμίδας της Giza), αποτέλεσε χώρο πλούσιο σε εξελίξεις στην ιστορία της Χημείας. Πολλές τεχνικές που είχαν ήδη αναπτυχθεί και καθιερωθεί στη Μεσοποταμία μεταφέρθηκαν και εξελίχθηκαν ακόμη περισσότερο στην Αρχαία Αίγυπτο.
Μερικές τεχνικές της αρχαίας Αιγυπτιακής χημείας προξενούν και σήμερα το ενδιαφέρον για τον πλούτο των γνώσεων που διέθεταν οι Αιγύπτιοι για πολλά υλικά και τις ιδιότητές τους. Ακόμη, εντύπωση κάνουν οι λεπτομερειακές καταγραφές διάφορων τεχνικών και των αποτελεσμάτων διάφορων δοκιμών. Οι γνώσεις πολλών από αυτών των τεχνικών, είχαν την έννοια της τέχνης παρά της επιστήμης και αποτελούσαν αποκλειστικό προνόμιο της τάξης των ιερέων.
|
Αιματίτης, Fe2O3 |
Ορυχείο κίτρινης ώχρας, ένυδρο Fe2O3 |
Αζουρίτης, Cu3(OH)2(CO3)2 |
Μαλαχίτης, Cu2CO3(OH)2 |
Κιννάβαρι, HgS |
|
Ερυθρά σανδαράχη (realgar), As2S2 |
Κίτρινη σανδαράχη (orpiment), As2S3 |
Αντιμονίτης, Sb2S3 |
Γαληνίτης, PbS |
Γύψος, CaSO4.2H2O |
|
Μερικά από τα ορυκτά που χρησιμοποιούσαν οι αρχαίοι πολιτισμοί για την παρασκευή ανεξίτηλων χρωμάτων. |
||||
|
Αρχαίο αιγυπτιακό κόσμημα από ύαλο κοβαλτίου (εποχή Φαραώ Αμενχοτέπ, 1390-1350 π.Χ.). |
Η σύγχρονη Ιατρική οφείλει πολλά στους αρχαίους Αιγυπτίους. Στην αρχή, επειδή ο άνθρωπος δεν μπορούσε να εξηγήσει όλα όσα του συνέβαιναν, άρχισε να τα αποδίδει σε υπερφυσικές δυνάμεις. Οι αρρώστιες θεωρήθηκαν έργα κακών πνευμάτων ή τιμωρία από μια θεότητα. Ο Imhotep (2655-2600 BC), 'Ιμυθες για τους αρχαίους 'Ελληνες, υπήρξε ο πιο διάσημος Αιγύπτιος ιατρός-παθολόγος, που ήταν συγχρόνως αστρονόμος και αρχιτέκτονας. Ο Imhotep χρησιμοποιούσε διάφορες χημικές ουσίες για θεραπείες ασθενειών. Αργότερα, ο Imhotep λατρεύτηκε ως θεός της Θεραπείας και της Ιατρικής.
Οι Αιγύπτιοι ανέπτυξαν τις τεχνικές της μεταλλουργίας και έγιναν εξειδικευμένοι τεχνικοί για την κατεργασία του χρυσού από μεταλλεύματα και της ανάμιξής του με άλλα μέταλλα για βελτίωση των μηχανικών ιδιοτήτων χρυσών αντικειμένων. Γνώριζαν την παρασκευή κρατερώματος (bronze) από χαλκό και κασσίτερο. Ευρήματα σιδηρών αντικειμένων σε πυραμίδες δίνουν την εντύπωση ότι γνώριζαν και τρόπους παρασκευής χάλυβα (ατσάλι) ήδη από το 2.900 π.Χ.
Η υαλουργία υπήρξε ένας ακόμη τομέας στον οποίο οι αρχαίοι Αιγύπτιοι έκαναν σημαντικές προόδους. Τα ευρήματα μεγάλων φούρνων υαλουργίας (ανασκαφές στην περιοχή Tel-El-Amarna, χρονολογούμενοι γύρω στο 1400 π.Χ.) και τα διάφορα είδη υάλινων σκευών και κοσμημάτων από έγχρωμο γυαλί δείχνουν μια υψηλή τεχνική κατάρτιση και γνώση αυτών των υλικών. 'Ετσι φαίνεται ότι γνώριζαν την κατασκευή μολυβδούχου υάλου (κρυστάλλου), όπως επίσης και την προσθήκη κοβαλτιούχων ορυκτών στην τηγμένη ύαλο για τον βαθυκύανο χρωματισμό της (ύαλος κοβαλτίου). Ακόμη, γνώριζαν να κατασκευάζουν υαλώματα (σμάλτα) από οξείδια διαφόρων μετάλλων και να εφυαλώνουν με αυτά πήλινα δοχεία, πλακίδια και άλλα πήλινα αντικείμενα.
Οι αρχαίοι Αιγύπτιοι σημείωσαν εξαιρετικές προόδους στην υφαντουργία, γνώριζαν την κατασκευή υφασμάτων από βαμβάκι και μαλλί και τρόπους χρώσης τους με φυσικές ουσίες. Τυπικά ανόργανα υλικά που χρησιμοποιούσαν σε βαφές ήταν ο αιματίτης (Fe2O3) για κόκκινο χρώμα, βαθυκύανο τριμμένο γυαλί (ύαλος κοβαλτίου) για μπλε, βασικά ανθρακικά άλατα χαλκού για γαλάζιο χρώμα (αζουρίτης) και πράσινο χρώμα (μαλαχίτης), κίτρινη ώχρα (ένυδρο Fe2O3) για κίτρινο. Με τα ίδια χρώματα και τα υλικά που χρησιμοποιούσαν έβαφαν ανάκτορα, ναούς, σπίτια και τάφους.
Οι Αιγύπτιοι ανέπτυξαν τεχνικές και μεθόδους για την παρασκευή χρωστικών ουσιών από ανόργανα υλικά και από φυτικές ουσίες. Χρησιμοποίησαν τη φωτιά για την ανάμιξη και τη συνθετική παρασκευή χρωμάτων (με υγρές χημικές μεθόδους και χημικά στάδια). 'Ηδη από το 3.000 π.Χ., χρησιμοποιούσαν ορυκτά, όπως ο γαληνίτης (PbS) και ο αντιμονίτης (Sb2S3) σε ψιμύθια (καλλυντικά προσώπου, μέικ-απ). Για παράδειγμα, χρησιμοποιούσαν ένα μίγμα σκόνης αντιμονίτη και λίπους ως καλλυντική βαφή με την οποία έβαφαν μαύρο το περίγραμμα των ματιών. Πιθανολογείται ότι αυτή η ευρύτατα διαδεδομένη στους αρχαίους Αιγυπτίους αντιμονιούχος βαφή προλάμβανε επίσης διάφορες μολυσματικές οφθαλμικές ασθένειες.
Οι Αιγύπτιοι γνώριζαν επίσης και τον υδράργυρο, αφού χρησιμοποιούσαν το ορυκτό κιννάβαρι (HgS) για την ερυθρά χρώση υφασμάτων. Οι γνώσεις αυτές μεταφέρθηκαν και εφαρμόσθηκαν και στην Αρχαία Ελλάδα, αλλά ήταν ήδη τόσο προχωρημένες τεχνικές που δεν χρειάσθηκε να βελτιωθούν.
Τέλος, οι αρχαίοι Αιγύπτιοι ανέπτυξαν τεχνικές για την παρασκευή αρωμάτων και ελαιωδών αλοιφών για το δέρμα. Οι τεχνικές που χρησιμοποιούσαν, οι ανακαλύψεις και οι συνθέσεις τους αξιοποιήθηκαν και από άλλους πολιτισμούς που ακολούθησαν τον Αιγυπτιακό.
|
(1) |
(2) |
(3) |
(4) |
(5) |
|
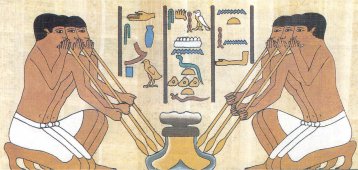
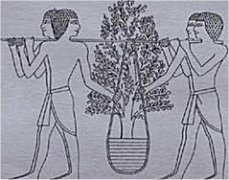
Αρχαία Αίγυπτος: (1) Γυάλινο δοχείο. (2) Μεταλλικό δακτυλίδι. (3) Υαλουργικές εργασίες. (4) Συλλογή φιαλιδίων με καλλυντικά. (5) Μεταφορά φυτών μυρτιάς για την παρασκευή αρωμάτων |
||||

Αρχαία αιγυπτιακά σύμβολα (ιερογλυφικά) διάφορων μετάλλων και υλικών
4. Οι Αρχαίοι 'Ελληνες Φιλόσοφοι και η Συμβολή τους στη Χημεία
Η αρχαία Ελλάδα και ο πολιτισμός της είναι ασφαλώς η συνέχεια του πολιτισμού της αρχαίας Αιγύπτου με μια όμως πολύ μεγαλύτερη δυναμική. Οι αρχαίοι 'Ελληνες αξιοποίησαν πολλά από τα επιτεύγματα των Αιγυπτίων στις τεχνικές της μεταλλουργίας, της υαλουργίας, της βαφής υφασμάτων και των αρωματικών υλών. Οι τεχνικές αυτές ήταν ήδη εξαιρετικά εξελιγμένες και δεν χρειάστηκαν ουσιαστικά να προσθέσουν νέες βελτιώσεις ή κάποιες αλλαγές στις μεθοδολογίες.
Τους αρχαίους Έλληνες απασχολούσε όχι τόσο το "πώς", αλλά το "γιατί", δηλ. η αναζήτηση της αλήθειας και των αιτίων. Σύμφωνα με τους αρχαιολόγους, η συνεισφορά των Αρχαίων Ελλήνων και διανοητών στις φυσικές επιστήμες ήταν κυρίως οι θεωρητικές έννοιες. Στην αρχαία Ελλάδα πραγματοποιήθηκε για πρώτη φορά η απόδοση των φυσικών φαινομένων σε φυσικά αίτια και η απόρριψη των υπερφυσικών δυνάμεων, που επικαλούνταν άλλοι λαοί, και η αντικατάστασή τους από φυσικούς νόμους.
|
|
|
|
 |
 |
|
|
Εμπεδοκλής (495 - 435 π.Χ.) |
Λεύκιππος (5ος αιώνα π.Χ., δάσκαλος του Δημόκριτου) |
Δημόκριτος (460-370 π.Χ.) |
Πλάτων (428-348 π.Χ.) |
Αριστοτέλης (384-322 π.Χ.) |
Επίκουρος (341 - 270 π.Χ.) |
Οι ιδέες των αρχαίων Ελλήνων φιλοσόφων ήταν η απαρχή πολλών σημερινών εννοιών των φυσικών επιστημών. Η αρχαία ελληνική φυσική φιλοσοφία είχε μεγάλη επίδραση και στη σύγχρονη χημεία, είτε άμεσα, είτε έμμεσα, έστω και μέσω των παραδοξοτήτων της αλχημείας. Μερικές από αυτές τις ιδέες που βρήκαν εφαρμογή στη χημεία ακόμη και σήμερα είναι:
|
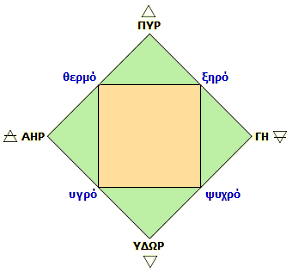
Το κλασικό διάγραμμα ενός τετραγώνου εγγεγραμμένου σε ένα άλλο. Στις γωνίες του ενός βρίσκονται τα βασικά στοιχεία και στις γωνίες του άλλου βρίσκονται οι ιδιότητές τους. |
(α) Η έννοια του στοιχείου. Η θεωρία των τεσσάρων βασικών στοιχείων ή ριζωμάτων (γη, ύδωρ, πυρ και αήρ) διατυπώθηκε από τον Εμπεδοκλή (495-435 π.Χ., από Ακράγαντα, Σικελία). Τα τέσσερα στοιχεία ήταν μέρος της φιλοσοφικής του συμβολής και ιδιαίτερα το ποίημα (2.000 στίχοι) "Περί Φύσεως". Τα πάντα είναι συνδυασμοί αυτών των τεσσάρων στοιχείων. Τα στοιχεία συνδέονται μεταξύ τους με σχέσεις "φιλότητας" (φιλία, έλξη, τάση προς συνένωση) ή σχέσεις "νείκους" (εχθρότητα, άπωση, τάση προς διάσπαση).
Στα στοιχεία αυτά αποδίδονται κυκλικά οι ιδιότητες "υγρό", "θερμό", "ξηρό" και "ψυχρό" ως πρωτεύουσες ή δευτερεύουσες. Ο "αήρ" είναι πρωτίστως "υγρός" και δευτερευόντως "θερμός", το "πυρ" είναι πρωτίστως "θερμό" και δευτερευόντως "ξηρό", η "γη" είναι πρωτίστως "ξηρή" και δευτερευόντως "ψυχρή" και το "ύδωρ" είναι πρωτίστως "ψυχρό" και δευτερευόντως "υγρό".
(β) Η έννοια του ατόμου. Η ατομική θεωρία για τη συγκρότηση ύλης διατυπώθηκε αρχικά από τον Λεύκιππο (5ος αιώνας π.Χ., Μίλητος). Για τον Λεύκιππο είναι λίγα πράγματα γνωστά. 'Εζησε κατά την περίοδο (περίπου) 480-420 π.Χ. Παρακολούθησε την Ιονική σχολή φιλοσοφίας, σπούδασε και στην Ελέα (σήμερα Velia, στη νότια Ιταλία) και φαίνεται ότι επηρεάστηκε κυρίως από τον προσωκρατικό φιλόσοφο Ζήνωνα τον Ελεάτη (490;-430; π.Χ.). Ίδρυσε σχολή στα 'Αβδηρα της Θράκης. Η ατομική θεωρία του Λεύκιππου διατυπώθηκε πιο συστηματικά από τον μαθητή του Δημόκριτο (460-370 π.Χ., 'Αβδηρα, Θράκη). Η ατομική θεωρία όριζε ότι τα άτομα είναι τα έσχατα μόρια της ύλης.
Τα άτομα (: α-στερητικό + τομή) είναι άτμητα, άφθαρτα, αναλλοίωτα και κινούνται αδιάκοπα στον χώρο. Υπάρχουν άπειρα είδη ατόμων σε συνεχή κίνηση και οποιαδήποτε μεταβολή της ύλης δεν είναι παρά ένα είδος ανασυνδυασμού των ατόμων. Οι ιδιότητες των υλικών καθορίζονται από το σχήμα των ατόμων. Τα άτομα των υγρών είναι σφαιρικά, γι'αυτό και τα υγρά απλώνονται στις επιφάνειες. Αντίθετα, τα άτομα των στερεών έχουν ακανόνιστο σχήμα γι'αυτό και τα στερεά σώματα διατηρούν τη μορφή τους.
Η έννοια του ατόμου στη σύγχρονη χημεία έμελλε να καθιερωθεί 24 αιώνες αργότερα με τη διατύπωση της ατομικής θεωρίας (1808) από τον διάσημο χημικό, φυσικό και μαθηματικό John Dalton.
(γ) Η διατήρηση της μάζας. Η θεωρία της αφθαρσίας της ύλης που διατύπωσαν παράλληλα ο Δημόκριτος και ο Διογένης ο Απολλωνιάτης (5ος αιώνας π.Χ.). Χαρακτηριστική ρήση του Δημοκρίτου: "Μηδέν εκ του μη όντος γίγνεσθαι μηδ ες το μη ον φθείρεσθαι".
Οι ιδέες αυτές διαδόθηκαν κυρίως με τη διδασκαλία του Επίκουρου και αργότερα από το εκτενές φιλοσοφικό ποίημα του Λουκρητίου (Τίτος Λουκρήτιος Κάρος, 98-53 π.Χ., Ρωμαίος φιλόσοφος) που είχε τίτλο De Rerum Natura (Περί της Φύσεως των Πραγμάτων), όπου και εξηγούσε τις αρχές της ατομικής θεωρίας του Δημόκριτου.
 |
 |
|
Πλάτωνας και Αριστοτέλης. Λεπτομέρεια από τον εκπληκτικό πίνακα του Raphael "Η Σχολή των Αθηνών" (1510). |
|
Ο Επίκουρος (Σάμος 341 - Αθήνα 270 π.Χ.) ήταν 'Ελληνας φιλόσοφος, ο οποίος ίδρυσε τη φιλοσοφική σχολή που έμεινε γνωστή ως "Επικούρειος Κήπος". Στόχος του Επίκουρου ήταν η αναζήτηση των αιτιών της ανθρώπινης δυστυχίας και των εσφαλμένων δοξασιών που την προκαλούν, όπως η δεισιδαιμονία.
Βασικές αρχές της διδασκαλίας του Επίκουρου είναι οι εξής: Με τον θάνατο έρχεται το τέλος όχι μόνο του σώματος αλλά και της ψυχής - οι θεοί ούτε επιβραβεύουν, ούτε τιμωρούν τους ανθρώπους. Το σύμπαν είναι άπειρο και αιώνιο - τα γενόμενα στον κόσμο συμβαίνουν τελικά, με βάση τις κινήσεις και τις αλληλεπιδράσεις των ατόμων που βρίσκονται σε έναν κενό χώρο.
Οι υλιστικές απόψεις του Επίκουρου πολεμήθηκαν άγρια από μεταγενέστερους φιλοσόφους και θεολόγους. Ο ίδιος κατασυκοφαντήθηκε και χαρακτηρίστηκε ως άτομο με ροπή προς τις ηδονές και τις απολαύσεις. Θα πρέπει να σημειωθεί ότι οι υλιστικές ιδέες και η αντίληψη περί ατόμων και αφθαρσίας της ύλης αναπτύχθηκαν περίπου την ίδια περίοδο από Ινδούς φιλοσόφους (Βεδική φιλοσοφία), αλλά με αρκετά πιο ήπιους τόνους και με ποιητική διάθεση.
Οι ατομικές θεωρίες του Δημόκριτου για την ύλη έμειναν στο περιθώριο για πολλούς αιώνες. Οι υλιστικές θεωρίες περί ατόμων, αφθαρσίας της ύλης και των στοιχείων δεν είχαν προοπτική διάδοσης, αφού έπεσαν στη δυσμένεια των φιλοσόφων Πλάτωνα (428-348 π.Χ.) και Αριστοτέλη (384-322 π.Χ.).
Ο Αριστοτέλης, ο πολυγραφότερος διαλεκτικός φιλόσοφος της αρχαιότητας, επηρέασε με τις θεωρίες του τη δυτική φιλοσοφική και επιστημονική σκέψη μέχρι και τον 17ο αιώνα. Ο Αριστοτέλης μελέτησε και έγραψε για πολλούς κλάδους (φιλοσοφία, ψυχολογία, λογική, πολιτική, φυσική, βιολογία, κ.α.). 'Εγραψε πολλά βιβλία για τη Φυσική (φυσική ακρόαση, περί ουρανού, περί γενέσεως και φθοράς, μετεωρολογικά και περί κόσμου) και τη Βιολογία (περί ζώων ιστορίας, περί ζώων μορίων, περί ζώων πορείας, περί ζώων κινήσεως, περί ζώων γενέσεως και περί φυτών).
Η φιλοσοφία του Αριστοτέλη κλείνει προς τον ιδεαλισμό και θέτει τον υλισμό σε μια μάλλον παθητική μοίρα. Σύμφωνα με τις θεωρίες του κάθε πράγμα αποτελείται από ύλη και πνεύμα, που είναι μεταξύ τους αδιάσπαστα ενωμένα. Η ύλη είναι παθητική και μόνη της παρέχει τη δυνατότητα, ενώ το πνεύμα ενεργητικό, και αποτελεί τη δύναμη που μεταβάλλει τη δυνατότητα σε πραγματικότητα.
Ο κόσμος, κατά τον Αριστοτέλη, είναι ενιαίος και αιώνιος και το σύμπαν ή ο κόσμος είναι σφαιρικός με κέντρο τη Γη. Η θεωρία αυτή ταίριαζε με τις θρησκευτικές αντιλήψεις και η γεωκεντρική εικόνα επικράτησε μέχρι την εποχή του Γαλιλαίου. Μέσω της τυπικής λογικής βλέπει την αντικειμενική πραγματικότητα "στατικά" και όχι μέσα στην αέναη μεταβολή και κίνησή της. Ο Αριστοτέλης διετύπωσε τη θεωρία της ύπαρξης του πέμπτου στοιχείου της φύσης (πέραν των τεσσάρων: γη, ύδωρ, πυρ και αήρ, που πίστευαν οι 'Ιωνες φιλόσοφοι). Ο Αριστοτέλης πρόσθεσε τον αιθέρα (: καθαρός, φρέσκος αέρας, καθαρός ουρανός, το υλικό που συμπληρώνει το σύμπαν πάνω από τη γήινη σφαίρα) στο κέντρο του κλασικού τετραγώνου των στοιχείων.
Ο αιθέρας παρουσιάζει κάποιες ιδιαιτερότητες ως στοιχείο, είναι: αγέννητος, αγήραντος, άφθαρτος, αΐδιος (αιώνιος), αναυξής και αναλλοίωτος. Πολύ αργότερα ο αιθέρας θα ταυτισθεί με τη Φιλοσοφική Λίθο των αλχημιστών. Επιπλέον εντοπίζεται στον "άνω τόπο", όπου κατοικούν οι θεότητες.
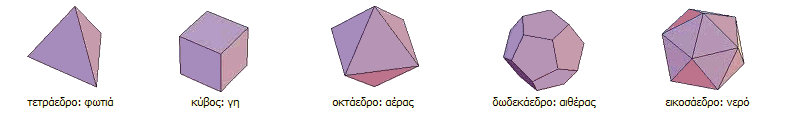
Να σημειωθεί στο σημείο αυτό, ότι η πρώτη αναφορά στην έννοια στοιχείον έγινε από τον Πλάτωνα, περίπου το 360 π.Χ. στον διάλογό του "Τίμαιος", όπου περιλαμβάνεται μια συζήτηση πάνω στη σύνθεση των ανόργανων και των οργανικών σωμάτων, μια πρωταρχική προσέγγιση πάνω στη χημεία. Ο Πλάτωνας θεωρούσε ότι το μικρότερο σωματίδιο κάθε στοιχείου αντιστοιχούσε σε ένα από τα πέντε κανονικά πολύεδρα, δηλ. κυρτά πολύεδρα με έδρες κανονικά πολύγωνα και ίσες όλες μεταξύ τους, τα οποία είναι γνωστά και ως "Πλατωνικά στερεά": το τετράεδρο (η φωτιά), ο κύβος (η γη), το οκτάεδρο (ο αέρας), το δωδεκάεδρο (ο αιθέρας) και το εικοσάεδρο (το νερό).
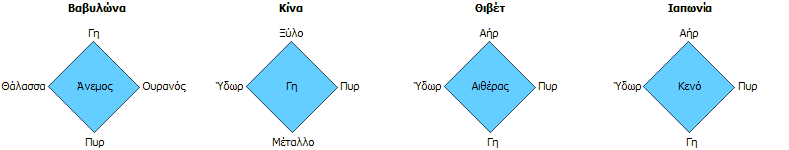
Τα βασικά στοιχεία σύμφωνα με άλλους πολιτισμούς
Ο Αριστοτέλης δέχεται ότι η παθητική ύλη συνδυάζεται με την ενεργητική αρχή, την εντελέχεια (ετυμολογία: εν + τέλος + έχω, η ενυπάρχουσα σε κάθε ον τάση για τελειότητα) ή ψυχή, που τη διαμορφώνει και της δίνει κίνηση. Με την αναντίρρητη κυριαρχία του Αριστοτέλη στις φυσικές επιστήμες, οι ιδέες του επηρέασαν τη μελλοντική ιστορία των φυσικών επιστημών. Οι θεωρίες του αποτέλεσαν το υπόβαθρο της αντίληψης του κόσμου από τους θρησκευτικούς καθοδηγητές της Χριστιανικής εκκλησίας και ιδιαίτερα του Αγίου Αυγουστίνου. Η φιλοσοφική σκέψη ταίριαζε και μπορούσε να διατηρηθεί κάτω από τον μανδύα των δογματικών θρησκευτικών αντιλήψεων, αφού η φύση γίνονταν κατανοητή όχι με την παρατήρηση και το πείραμα, αλλά από τα αναγραφόμενα στα θρησκευτικά βιβλία.

Ο προσωκρατικός φιλόσοφος Ζήνων ο Ελεάτης δείχνει στους μαθητές του τις πόρτες της αλήθειας (veritas) και του ψεύδους (falsitas). Τοιχογραφία στη Βιβλιοθήκη El Escorial της Μαδρίτης.
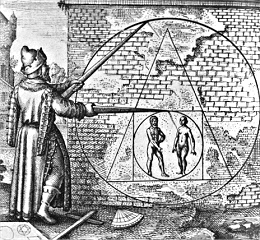
5. Οι 'Ελληνες Αλχημιστές
|
|
 |
|
|
Απεικονίσεις του Τρισμέγιστου Ερμή από διάφορα αλχημιστικά συγγράμματα |
||
Ως ο αρχαιότερος 'Ελληνας αλχημιστής αναφέρεται ο Ερμής ο Τρισμέγιστος (Λατ. Mercurius ter Maximus). Το πιο πιθανό είναι να πρόκειται για φανταστικό πρόσωπο, μια ενσάρκωση θεότητας που συνδύαζε τον θεό των Ελλήνων Ερμή με τον σεληνιακό θεό των Αιγυπτίων Θωθ (Thoth), θεό-προστάτη των αστρολόγων και των αλχημιστών. Οι αλχημιστές του μεσαίωνα απέδιδαν στον Τρισμέγιστο Ερμή πλήθος ανακαλύψεων (γλώσσα, αλφάβητο, γεωμετρία, αριθμητική, ιατρική). Του απέδιδαν την τριπλή ιδιότητα του μέγιστου των φιλοσόφων, του μέγιστου των βασιλέων και του μέγιστου των ιερέων. Στον Τρισμέγιστο Ερμή αποδίδονται πολλά ελληνικά συγγράμματα της Ελληνιστικής Αιγύπτου που γράφηκαν κατά τη ρωμαϊκή εποχή.
Στη λατρεία του Τρισμέγιστου Ερμή επιδίδεται το φιλοσοφικό κίνημα του ερμητισμού (hermetism), το οποίο ξεκίνησε από την Ελληνιστική Αίγυπτο. Ο ερμητισμός ήταν ένα μεταφυσικό σύστημα και ένα σώμα συστηματοποιημένων μαγικών, μαντικών, αστρολογικών και αλχημιστικών πρακτικών. Κύριο χαρακτηριστικό του ερμητισμού ήταν η αντίσταση στην κυριαρχία τόσο της καθαρής λογικής, όσο και κάθε δογματικής πίστης.
Η έκφραση ερμητική τέχνη, αποτελεί όρο τον οποίο χρησιμοποιούσαν οι αλχημιστές για να περιγράψουν την τέχνη τους, που στην αρχαιότητα μόνο ιερείς είχαν το δικαίωμα να ασκούν και να γνωρίζουν τα μυστικά της. Οι αλχημιστές συχνά πραγματοποιούσαν αποστάξεις και χρειάζονταν καλά "σφραγισμένες" αποστακτικές συσκευές (άμβυκες) ή ερμητικά κλειστές.
Οι αλχημιστές θεωρούσαν τους εαυτούς τους Ερμητικούς, έχοντας αποδεχθεί τη φιλοσοφία του Ερμή του Τρισμέγιστου, του ερμητισμού και χαρακτήριζαν τις γνώσεις τους ως ερμητικές (Hermetica ή Corpus Hermeticum).
 |
 |
|
Αριστερά: Ο Θεός Σέραπις ή Όσιρις, αποκαλούμενος και "Χριστός", από αιώνες π.Χ. Δεξιά: 'Ο,τι έχει απομείνει από το Σεράπειο της Αλεξάνδρειας, έναν πραγματικό ναό της γνώσης, που τον κατέστρεψε ο θρησκευτικός φανατισμός. |
|
'Ενας διάσημος αλχημιστής της Ελληνιστικής Αιγύπτου ήταν ο Ζώσιμος ο Πανοπολίτης (Zosimos of Panopolis). Γεννήθηκε στην Πανόπολη (σήμερα El Akhmim) της νότιας Αιγύπτου κατά τέλη του 4ου μ.Χ. Οι αλχημιστές των ισλαμικών χωρών, αλλά και της Ευρώπης του μεσαίωνα, όπως και οι νεότεροί τους, τον θεωρούσαν ως έναν από τους μεγαλύτερους αλχημιστές όλων των εποχών.
Ο Ζώσιμος συνέγραψε πλήθος συγγραμμάτων (αναφέρονται εικοσιοκτώ βιβλία) πολλά από τα οποία μεταφράστηκαν στην Αραβική και Συριακή γλώσσα, ωστόσο μόνο τμήματα από αυτά έχουν σωθεί. Στα αποσπάσματα αυτά γίνεται αναφορά στην οξείδωση του υδραργύρου, σε κάποιο περίεργο βάμμα το οποίο μετατρέπει τον άργυρο σε χρυσό, όπως και σε κάποιο ιερό ύδωρ ("πανάκεια") που θεραπεύει κάθε αρρώστια. Αυτά τα αποσπάσματα επηρέασαν τους μετέπειτα αλχημιστές και τους ώθησαν στη μανιώδη αναζήτηση αυτών των ουσιών.
Στον ναό του θεού Σέραπη, το Σεράπειο (Serapeum) της Αλεξάνδρειας φαίνεται πως υπήρχαν άφθονα συγγράμματα Ελλήνων αλχημιστών και γενικότερα επιστημόνων. Δυστυχώς ο ναός αυτός καταστράφηκε το 391 μ.Χ. από πλήθη φανατικών χριστιανών, που είχαν απαγορέψει την είσοδο των πολιτών στους αρχαίους ναούς, σε ένα γενικότερο πλαίσιο διωγμών των εθνικών και των παγανιστών, δηλ. των οπαδών των αρχαίων θρησκειών.
Οι διωγμοί εκείνης της εποχής οδήγησαν πολλούς 'Eλληνες σοφούς να καταφύγουν στην Περσία, τη μόνη χώρα εκείνης της εποχής που ήταν προοδευτική και ανοικτή σε κάθε φιλοσοφικό ρεύμα ή θρησκευτικό κίνημα. Οι 'Ελληνες αυτοί και οι γνώσεις που μετέφεραν συνέβαλαν ουσιαστικά στη μετέπειτα εκπληκτική ανάπτυξη της επιστήμης και τεχνολογίας των ισλαμικών χωρών.
Οι καταστροφές του Σεραπείου και της Βιβλιοθήκης της Αλεξάνδρειας (που ολοκληρώθηκε το 642 μ.Χ. από τους 'Αραβες) είχαν ως αποτέλεσμα την απώλεια σωρευμένης επιστημονικής γνώσης αιώνων. Κύριο αποτέλεσμα αυτών των διωγμών ήταν η Ευρώπη να βυθιστεί στον Σκοτεινό Μεσαίωνα για τους επόμενους αιώνες. Κανείς δεν μπορεί να γνωρίζει σε ποιο στάδιο εξέλιξης θα βρισκόταν η σημερινή επιστήμη και τεχνολογία, αλλά και ο κόσμος γενικότερα, αν δεν γίνονταν οι καταστροφές αυτές.
 |
 |
 |
 |
|
Απεικόνιση της Βιβλιοθήκης της Αλεξάνδρειας και των αιθουσών της με τους πάπυρους [πηγή]. Κανείς δεν μπορεί να γνωρίζει σε ποιο στάδιο εξέλιξης θα βρισκόταν η σημερινή επιστήμη και τεχνολογία, αν δεν χάνονταν οι γνώσεις αιώνων που βρίσκονταν σωρευμένες στη βιβλιοθήκη αυτή κατά την καταστροφή της. |
|||
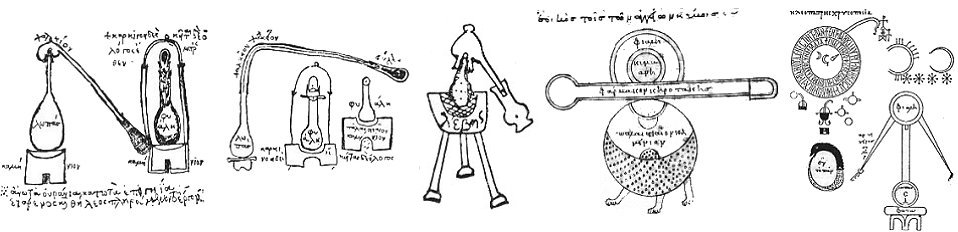
Εικόνες αλχημιστικών σκευών από Ελληνικά χειρόγραφα (το περίεργο δεξιό σκεύος αναφέρεται ως "συσκευή παρασκευής χρυσού της Κλεοπάτρας",
στην ίδια εικόνα απεικονίζεται και το μυστικιστικό σύμβολο του ουροβόρου όφεως).
 |
 |
 |
| Το πιο γνωστό "χημικό επίτευγμα" των Βυζαντινών χρόνων, σίγουρα είναι το περίφημο "υγρό πυρ" (ignis graecus, greek fire). Η σύνθεσή του ήταν επτασφράγιστο μυστικό και μόνο εικασίες ως προς αυτήν μπορούν σήμερα να γίνουν. Δεν φαίνεται πάντως να ήταν ένα απλό καύσιμο μίγμα νάφθας και θείου. Υπάρχουν μαρτυρίες που αναφέρουν την αυτανάφλεξή του όταν ερχόταν σε επαφή με το νερό. 'Ετσι, διατυπώθηκε η υπόθεση ότι ένα δραστικό συστατικό του θα πρέπει να ήταν το φωσφίδιο του ασβεστίου (Ca3P2). Το φωσφίδιο αυτό σε επαφή με το νερό υδρολύεται παρέχοντας το αέριο φωσφίνη (PH3). Η φωσφίνη αυταναφλέγεται στον αέρα προκαλώντας ανάφλεξη και στα υπόλοιπα καύσιμα υλικά του μίγματος. Τώρα, το πώς θα μπορούσε να παρασκευασθεί αυτό το φωσφίδιο, που απαιτεί ισχυρότατα αναγωγικές συνθήκες ή ακόμη και μεταλλικό ασβέστιο για τη σύνθεσή του, παραμένει μυστήριο. | ||
Πηγές από το Διαδίκτυο: (1) "The History of Ancient Chemistry" (Lois Fruen, www.realscience.breckschool.org). (2) "Atoms and Atheism - the changing ways that Christians have viewed the nature of matter".
6. Η Χημεία κατά την Περίοδο των Ρωμαίων
 |
 |
|
(α) Τίτος Λουκρήτιος Κάρος (98-55 π.Χ.). (β) Εξώφυλλο του 1ου τόμου του έργου του De Rerum Natura (έκδοση 1656). |
|
Η συνεισφορά των Ρωμαίων στη Χημεία ήταν μάλλον περιορισμένη, αφού κυρίως ενδιαφέρονταν κυρίως για τις πρακτικές εφαρμογές των τεχνικών που ήδη ήταν γνωστές. Οι Ρωμαίοι φιλόσοφοι που συνέβαλαν κυρίως σε θέματα φυσικής και χημείας ήταν ο Λουκρήτιος και ο Πλίνιος.
Ο Τίτος Λουκρήτιος Κάρος (Titus Lucretius Carus, 98-55 π.Χ.) ήταν Ρωμαίος ποιητής και φιλόσοφος. Διατύπωσε τα διδάγματα της επικούρειας φιλοσοφίας σε ένα μνημειώδες ποίημα 7.415 στίχων στη λατινική γλώσσα, το De Rerum Natura ("Περί της Φύσεως των πραγμάτων"), το μόνο γνωστό του έργο. Ο Λουκρήτιος διαδραμάτισε σημαντικό ρόλο στη μετάδοση των ελληνικών φιλοσοφικών ιδεών και ιδιαίτερα των ατομικών θεωριών του Επίκουρου και κατ' επέκταση των υλιστικών θεωριών του Δημοκρίτου.
Ο Λουκρήτιος είχε εξαιρετικά ορθολογικές φιλοσοφικές αντιλήψεις για μια εποχή που κυριαρχούσαν μεταφυσικές ιδέες και δεισιδαιμονίες. Ο στόχος του έργου ήταν να απαλλάξει τον νου των ανθρώπων από την προκατάληψη και το φόβο του θανάτου και απ' ό,τι άλλο αυτά συνεπάγονταν.
Ανέπτυξε διεξοδικά τις θέσεις του Επίκουρου, τον οποίον και αποθεώνει, και εκφράζει τις επικούρειες απόψεις του για τη μεταφυσική, την υλιστική ατομική θεωρία και, γενικότερα, την υπεροχή των φυσικών φαινομένων ως κεντρικής ερμηνείας της λειτουργίας του κόσμου.
Ο Λουκρήτιος αντιπαθούσε και έβλεπε ως αβάσιμο κάθε είδος δεισιδαιμονίας, καθώς δεν πίστευε ότι το Σύμπαν κυβερνάται από θεϊκές παρεμβάσεις ή υπερφυσικές δυνάμεις. Αντίθετα, πίστευε πως τα πάντα έχουν μια λογική εξήγηση.
Ο Πλίνιος ο Πρεσβύτερος (Pliny the Elder, 23-79 μ.Χ.), στο έργο του Φυσική Ιστορία (Naturalis Historiae, 77-79 μ.Χ.), διακρίνει τα φυσικά από τα χημικά φαινόμενα και επίσης εξετάζει θέματα ζωολογίας, βοτανικής, μεταλλουργίας και ορυκτών. Η "Φυσική Ιστορία" (31 βιβλία) του είναι ένα πλήρες εγκυκλοπαιδικό σύγγραμμα φιλοσοφίας (ιδιαιτέρως φυσικής φιλοσοφίας), στο οποίο συνοψίζεται όλη η γνώση της εποχής του, ανθολογημένη από διάσπαρτα προγενέστερα ελληνικά και λατινικά συγγράμματα, στους τομείς της μεταφυσικής, της αστρονομίας, των μαθηματικών, της γεωγραφίας, της εθνογραφίας, της ανθρωπολογίας, της ζωολογίας, της βοτανολογίας, της φαρμακολογίας, της ηφαιστειολογίας, της ορυκτολογίας κ.α.
Στην περιγραφή των φυτών, ο Πλίνιος μπόρεσε να συλλέξει αρκετές πληροφορίες για θεραπείες με βότανα. Στο τέλος του έργου του, ως ο μοναδικός Ρωμαίος μετά τον Λουκρήτιο, που είχε για θέμα του ολόκληρο το βασίλειο της Φύσης, προσεύχεται για τις ευλογίες της παγκόσμιας μητέρας. Κατά τους αιώνες που ακολούθησαν η "Φυσική Ιστορία" του χρησιμοποιήθηκε από αναρίθμητους σοφούς ως έγκυρη πηγή τόσο σε θέματα φυσικής φιλοσοφίας, όσο και ιατρικής.
 |
 |
 |
 |
|
(α) Πλίνιος ο Πρεσβύτερος (23-79 μ.Χ.) (β) Εξώφυλλο του 1ου τόμου της Φυσικής Ιστορίας του Πλίνιου (έκδοση 1669). (γ) Το κιννάβαρι (HgS) οι Ρωμαίοι το εξόρυσσαν από τα ορυχεία του Almaden στην Ισπανία. Για την εξόρυξη του πολύτιμου αυτού ορυκτού αυτού χρησιμοποιούσαν μόνο κατάδικους, αφού η εργασία στα ορυχεία αυτά ισοδυναμούσε με καταδίκη σε θάνατο, λόγω της μεγάλης περιεκτικότητας της ατμόσφαιρας του ορυχείου σε ατμούς υδραργύρου. Ο Πλίνιος ήταν από τους πρώτους που αναγνώρισαν την τοξικότητα αυτού του πολύτιμου ορυκτού (το χρησιμοποιούσαν ως κόκκινη βαφή), αλλά και γενικότερα της επικινδυνότητας κάθε εργασίας με τον υδράργυρο. (δ) Ο θάνατος του Πλίνιου αποδίδεται στην επιθυμία του να μελετήσει την έκρηξη του Βεζούβιου που κατέστρεψε την Πομπηία και το Ερκουλάνουμ το 79 μ.Χ. |
|||
Ο Πλίνιος έκανε αρκετές αναφορές σε μέταλλα και στην κατεργασία τους. Σε αυτά περιλαμβάνονται ο χρυσός, ο άργυρος, ο σίδηρος, ο μόλυβδος, ο κασσίτερος, ο υδράργυρος και το αντιμόνιο. Αναγνώρισε τις τοξικές ιδιότητες του υδραργύρου, όπως και τις διαφορές στις ιδιότητες μεταξύ του κοινών μορφών σιδήρου και του χάλυβα.
Σημαντική υπήρξε και η συνεισφορά του Πλίνιου στον τομέα των ορυκτών και των ιδιοτήτων διαφόρων μεταλλευμάτων. Μεταξύ πολλών άλλων συνεισφορών του σε θέματα χημείας και μεταλλουργίας, εισήγαγε μέθοδο διάκρισης της καθαρότητας πολύτιμων μετάλλων, όπως και ένα σύστημα χαρακτηρισμού της σκληρότητας των ορυκτών, ως ένα "πρώιμο" σύστημα της σημερινής κλίμακας σκληρότητας Mohs.
|
'Ενα παράξενο σκεύος που χρονολογείται στα μέσα του 3ου π.Χ. αιώνα και βρέθηκε κοντά στη Βαγδάτη. Πιθανολογείται πως πρόκειται για ένα είδος μπαταρίας (γαλβανικό στοιχείο) με κάθοδο ένα χάλκινο κύλινδρο και άνοδο μια σιδηρά ράβδο [πηγή]. |
Ο θάνατος του Πλίνιου κατά πάσα πιθανότητα οφείλεται στην επιθυμία του να παρατηρήσει για όσο το δυνατόν μεγαλύτερο χρονικό διάστημα την έκρηξη του ηφαιστείου Βεζούβιου, που κατέστρεψε το 79 μ.Χ. την Πομπηία και το επίνειό της το Ερκουλάνουμ.
7. Η Χημεία στην Αρχαία Ινδία και τα Ιερά Κείμενα Vedas
Στην αρχαία Ινδία αναπτύχθηκε μεγάλος αριθμός χημικών διεργασιών και τεχνικών. Οι Ινδοί πειραματίσθηκαν με πλήθος διάφορων υλικών, ιδιαίτερα με φάρμακα από φυτικά εκχυλίσματα και έκαναν χρήσιμες παρατηρήσεις για τη φύση και τις ιδιότητες χημικών ουσιών για ιατρικούς σκοπούς. Οι γνώσεις αυτές αξιοποιήθηκαν αργότερα κατά την ονομαζόμενη Χρυσή Ισλαμική Περίοδο (Islamic Golden Age), δηλ. κατά την περίοδο 750-1250 μ.Χ., από τους Μουσουλμάνους, οι οποίοι βελτίωσαν πολλές ινδικής προέλευσης τεχνικές μεταλλουργίας, παρασκευής αρωμάτων και χρήσης βοτάνων και καρυκευμάτων.
Οι Ινδοί κατείχαν γνώσεις πυρομεταλλουργίας και της κατεργασίας μεταλλικών αντικειμένων από κρατέρωμα, ίσως και από το 2.300 π.Χ και αργότερα, από το 1500 π.Χ., αντικειμένων από σίδηρο. Από την πρώτη χιλιετία π.Χ., οι Ινδοί είχαν γίνει ειδικοί στην κατεργασία και παρασκευή υψηλής ποιότητας χάλυβα, ο οποίος ήταν πολυτιμότερος και από τον ίδιο τον χρυσό σε ορισμένες περιοχές της Ευρώπης και της Μέσης Ανατολής. Μόλις τον 17ο αιώνα μ.Χ., οι Ευρωπαίοι μελέτησαν τον τύπο αυτό χάλυβα που τους επέτρεψε να τυποποιήσουν και να βελτιώσουν τις δικές τους διεργασίες παρασκευής χάλυβα, γεγονός που είχε ως άμεσο αποτέλεσμα την ονομαζόμενη Βιομηχανική Επανάσταση, η οποία ως βάση είχε τη χρήση χάλυβα για την κατασκευή εργαλείων, μηχανών, γεφυρών, κ.λπ.
Εκτός όμως από τη συμβολή των Ινδών στη χημεία των μετάλλων και της κατεργασίας τους, οι αλχημιστές τους (η ινδική αλχημεία είναι γνωστή ως Rasa Shastra, που στην κυριολεξία σημαίνει "η επιστήμη του υδραργύρου") ήταν διάσημοι για τα επιτεύγματά τους. 'Ηταν γνωστοί για την ποικιλία χρωστικών υλών που χρησιμοποιούσαν, την υαλουργία, την παρασκευή ενός είδους τσιμέντου, τη χημική κατεργασία δέρματος και την παρασκευή σαπουνιού.
Κατά τον 5ο - 7ο αιώνα μ.Χ., όταν η δυτική και βόρεια Ευρώπη ζούσε τις Σκοτεινές Περιόδους της ιστορίας της (Dark Ages), οι Ινδοί είχαν ήδη αναπτύξει ένα εκπληκτικό τεχνολογικό πολιτισμό και έκαναν χρήση πολλών χημικών τεχνικών. Περιγραφές των τεχνικών αυτών βρίσκονται στις Βέδες (Vedas, ~300 π.Χ., veda: γνώση, στα σανσκριτικά), που είναι αρχικά κείμενα Ινδουϊσμού και τα οποία είχαν μεγάλη επιρροή στον Βουδισμό και άλλες θρησκείες. Στις Βέδες βρίσκονται ύμνοι, μαγικές συνταγές και περιγράφονται τελετουργικές καταστάσεις από την Αρχαία Ινδία. Οι Βέδες συγκαταλέγονται μεταξύ των αρχαιότερων θρησκευτικών κειμένων και εκτός της πνευματικής τους αξίας είναι πλούσιες πηγές πληροφοριών για την καθημερινή ζωή των αρχαίων Ινδών.
 |
 |
 |
 |
| O περίφημος σιδερένιος στύλος (iron pillar) του Delhi, ύψους 7 μ. και βάρους 7 τόνων. Κατασκευασμένος κατά τον 4ο αιώνα μ.Χ. και εκτεθειμένος στα καιρικά στοιχεία επί 1600 και πλέον χρόνια, παραμένει ανοξείδωτος. Τυπική απόδειξη των μεταλλουργικών γνώσεων των αρχαίων Ινδών. | Εικόνες αρχαίων κειμένων από τις Βέδες. | Τυπικά προϊόντα (φυσικές βαφές, φυτικά δηλητήρια), της Ινδικής Αλχημείας (Rasa Shastra). | |
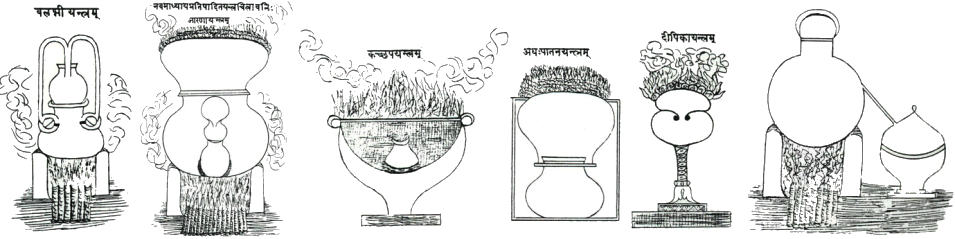
Σκεύη Ινδών Αλχημιστών (σχέδια από ινδικά αλχημιστικά κείμενα)
Πηγές από το Διαδίκτυο: (1) "Indian
Alchemy"
(The Alchemy Web Site). (2) "Indian
Alchemy" (indianalchemy.com)
8. Ιστορία της Χημείας και Κινέζικος Πολιτισμός
|
Αριστερά: Χρονολογίες στην Κινέζικη Αλχημεία. Δεξιά: Ο Wei Po Yang, "πατέρας" της Κινέζικης αλχημείας. |
Οι Ευρωπαίοι για πολλές δεκαετίες αγνοούσαν τη συνεισφορά του Κινέζικου πολιτισμού σε θέματα επιστήμης, αλχημείας και το γεγονός ότι στην Κίνα είχαν παρασκευασθεί χημικά υλικά πολύ πριν ακόμη ανακαλυφθούν στη Δύση.
'Οπως οι αλχημιστές στη Δύση έτσι και στην Κίνα οι αλχημιστές από αρχαιοτάτων χρόνων επεξεργάζονταν μέταλλα και χρησιμοποιούσαν βότανα, αρώματα και φυτικά σκευάσματα για ιατρικούς σκοπούς. Η Κινέζικη αλχημεία ήταν ένα μίγμα πρακτικών εφαρμογών και Ταοϊστικών δοξασιών για τις ιδέες της ισορροπίας και της αρμονίας. Επίσης, πολλές κινεζικές αλχημιστικές πρακτικές σχετίζονταν με την ολιστική προσέγγιση της παραδοσιακής Κινέζικης ιατρικής για την υγεία του ανθρώπου, σύμφωνα με την οποία ακόμη και ορυκτά και ανόργανα υλικά μπορούν να συμβάλλουν σε θεραπευτικές τεχνικές.
Υπάρχουν ιστορικές ενδείξεις ότι οι Κινέζοι ενδιαφέρονταν για την αλχημεία από τον 4ο αιώνα π.Χ. 'Ηδη από το 175 π.Χ. είχε εκδοθεί επίσημο διάταγμα που προειδοποιούσε τους αλχημιστές να μην κατασκευάζουν κίβδηλα χρυσά νομίσματα, πράξη που θα επέσυρε τη θανατική τους καταδίκη.
'Οπως και στις άλλες περιοχές του πλανήτη, ο χρυσός και η μετατροπή άλλων ευτελών μετάλλων σε χρυσό ήταν ένας από τους κύριους στόχους πολλών Κινέζων αλχημιστών. Υπάρχουν αναφορές για έναν αλχημιστή, ονομαζόμενο Zou Yan (305 - 240 π.Χ.), που υποσχόταν σε πλούσιους Κινέζους και άρχοντες πρόσθετα πλούτη, δύναμη και τιμές, όπως και την ικανότητα επίκλησης υπερφυσικών δυνάμεων για να πετύχουν οι ηγεμονικές τους επιδιώξεις.
|
Ο μετασχηματισμός φθηνών μετάλλων σε χρυσό υπήρξε ένας από τους κύριους στόχους των αλχημιστών όλου του κόσμου. Ποτέ δεν μπόρεσε η Χημεία μόνη της να το πετύχει, ωστόσο η επιδίωξη αυτή προσέφερε πολλές νέες γνώσεις. |
'Ενας άλλος αλχημιστής παρουσιάσθηκε το 133 π.Χ. στο βασιλικό παλάτι υποσχόμενος το ελιξίριο της αθανασίας. Η ιδέα της παράτασης της ζωής και της αθανασίας είχε γίνει το κεντρικό σημείο δράσης πολλών Κινέζων αλχημιστών, κατά τρόπον αντίστοιχο της ιδέας της Φιλοσοφικής Λίθου (Philosopher's Stone) των αλχημιστών στη Δύση. Ιστορικά ντοκουμέντα δείχνουν ότι το 60 π.Χ. ο αυτοκράτορας Suan ανέθεσε σε έναν αλχημιστή, με το όνομα Liu Tsiang, να χρησιμοποιήσει τις δυνάμεις του για να αυξήσει τα χρόνια ζωής του με την παρασκευή αλχημιστικού χρυσού. Αν και απέτυχε να πραγματοποιήσει τις υποσχέσεις του, μόλις απέφυγε την εκτέλεση.
Το αρχαιότερο κινεζικό αλχημιστικό κείμενο πάνω γράφτηκε από τον Wei Po Yang (140 μ.Χ.). Σε αυτό γίνεται αναφορά στις αντίθετες, πλην όμως συμπληρωματικές δυνάμεις Yin και Yang. Η Κινέζικη αλχημεία δανείστηκε πολλές ιδέες από την παραδοσιακή ιατρική που στηρίζονταν στις βασικές αρχές του Ταοϊσμού. Η φιλοσοφία αυτή στηρίζονταν στην αντίληψη των αντίθετων δυνάμεων, το Yin και Yang, που τα θεωρούσαν ενεργά στοιχεία (Yin = αρσενικό - ενεργό, Yang = θηλυκό - παθητικό).
|
Πανάρχαιο κινεζικό φιλοσοφικό σύμβολο αρμονίας Yin Yang |
Το Yin Yang είναι ένα πανάρχαιο σύμβολο. Εμφανίστηκε για πρώτη φορά σε κινέζικα ιστορικά έγγραφα ηλικίας περίπου 3000 χρόνων. H αυθεντική ονομασία του συμβόλου αυτού, που όλοι οι άνθρωποι είναι οικείοι μαζί του με την ονομασία Yin Yang, είναι Tai Chi Tu.
Στο Yin Yang o κύκλος συμβολίζει την ολότητα και το άπειρο του Chi (ζωτική ενέργεια). Δεν υπάρχει ούτε αρχή ούτε τέλος, διαπερνά μέσα από την ολότητα. Ο εξωτερικός αυτός κύκλος είναι το Σύμπαν που εμπεριέχει το Yang (φως) και το Yin (σκοτάδι). Η διαχωριστική γραμμή ανάμεσα σε αυτούς τους δύο κυκλικούς τομείς είναι καμπυλοειδής. Αυτό δηλώνει μια αέναη κίνηση και ροή του Yin μέσα στο Yang και αντίστροφα. H αναλογία των χρωμάτων είναι ίδια, επομένως τα δύο στοιχεία εξισορροπούν μεταξύ τους.
Οι Κινέζοι αλχημιστές έγραψαν αρκετά έργα Αλχημείας (Ko-Huang, 254-334 μ.Χ.), με περιγραφές χημικών διεργασιών που αφορούσαν την παρασκευή διάφορων υλικών, ελιξίριων ζωής, τον "μετασχηματισμό" μετάλλων και την περιγραφή βοτάνων με μαγικές θεραπευτικές ιδιότητες. Γνώριζαν το κιννάβαρι (HgS), τις θειούχες ενώσεις του αρσενικού (ερυθρά σανδαράχη, As2S2, και κίτρινη σανδαράχη, As2S3), την κιμωλία, τη χρωστική πορφύρα από ένα όστρακο, το θείο, την πυρίτιδα, την άσφαλτο και πλήθος αλάτων. Επίσης περιγράφουν διάφορες τεχνικές μετασχηματισμού ευτελών μετάλλων σε χρυσό. Σε όλες αυτές τις διαδικασίες χρησιμοποιούσαν τεχνικές απόσταξης, σύντηξης και εξάχνωσης.
Ο αριθμός πέντε φαίνεται πως υπήρξε ο ιερός αριθμός της κινεζικής αλχημείας. Οι Κινέζοι αλχημιστές υποστήριζαν την ύπαρξη πέντε στοιχείων: ξύλο, πυρ, γη, μέταλλο και νερό και τα συνδυάζανε με πέντε χρώματα. Επίσης είχαν πέντε κατευθύνσεις (πορείες) που τα συνέδεαν με πέντε μέταλλα: χρυσός, άργυρος, μόλυβδος, χαλκός και σίδηρος. Ως αποτέλεσμα, κάθε αλχημιστική τεχνική χωριζόταν σε πέντε στάδια ή διαδικασίες.
 |
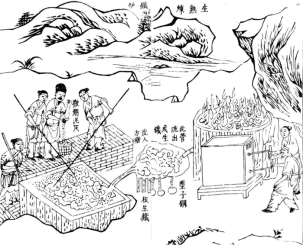 |
 |
|
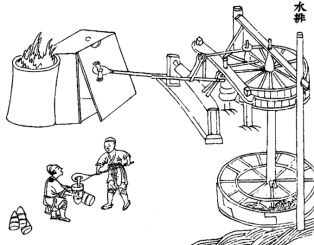
Χρήση νερόμυλου για τη διαβίβαση αέρα σε υψικάμινο χάλυβα |
Παρασκευή χάλυβα, στάδιο απομάκρυνσης σκωρίας |
Μεταλλικά κινεζικά σπαθιά (τα περισσότερα από σίδηρο) |
 |
 |
 |
 |
|
Η πυρίτιδα ανακαλύφθηκε από τους Κινέζους κατά τον 8ο μ.Χ. αιώνα. Ενώ αρχικά χρησιμοποιήθηκε για ψυχαγωγία (πυροτεχνήματα), σύντομα διαπιστώθηκε η χρησιμότητά της στις πολεμικές επιχειρήσεις. 'Ηδη από τον 13ο αιώνα οι Κινέζοι χρησιμοποιούσαν πυροβόλα όπλα. |
|||
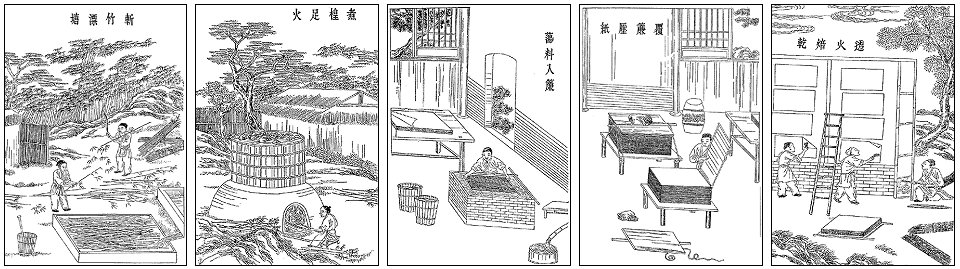
Παρασκευή χαρτιού από φυτικές ίνες, όπως απεικονίζεται σε κινεζικό χειρόγραφο του Cai Lun (105 π.Χ.). Αν η τεχνική αυτή γινόταν έγκαιρα γνωστή στην περιοχή των χωρών της Μεσογείου,
μεγάλες ποσότητες Αρχαιοελληνικής Γραμματείας και τεχνολογικών γνώσεων της Ελληνιστικής Περιόδου θα είχαν διασωθεί.
Πηγές από το Διαδίκτυο: (1) "Ancient Chinese Alchemy" (Experiment-Resorces.com). (2) "Chemistry in Ancient China: Alchemy" (Hu Zhang)
 |
 |
 |
|
|
Geber (Jaber Ibn Hayan, 721(;)-815, Βαγδάτη) |
Αβικένας (Ibn Sina Avicenna, 980-1037, Περσία) |
Αβερρόης (Ibn Rushd Averroes, 1126 Cordova Ισπανίας - 1198, Marrakes) |
|
9. Ιστορία της Χημείας στις Ισλαμικές Χώρες και Αλχημεία
Οι 'Αραβες και οι Πέρσες χρησιμοποίησαν με επιτυχία πρώτοι τις διάφορες ανακαλύψεις, που παρέλαβαν από τους Ινδούς, τους Κινέζους και τους Αιγύπτιους (πυρίτιδα, πυξίδα, χαρτί, άρδευση χωραφιών, αρώματα, χρωστικές ύλες, καλλιέργεια δένδρων) και τα μετέφεραν στην Ευρώπη, όταν κατέλαβαν την Ισπανία. Οι 'Αραβες και οι Πέρσες αλχημιστές δεν μετέφεραν απλώς γνώσεις από την Ανατολή, αλλά συνέβαλαν ουσιαστικά στη Χημεία, όπως και σε άλλες θετικές επιστήμες, μια εποχή (μεσαίωνας 700-1400 μ.Χ.), που στην Ευρώπη κυριαρχούσαν η δεισιδαιμονία και οι θρησκευτικές προκαταλήψεις. Εκείνες τις "σκοτεινές εποχές", ο ισλαμικός κόσμος ήταν αυτός που κράτησε τη δάδα της επιστήμης αναμμένη.
Σε αντίθεση με τα ελάχιστα αποσπάσματα που διασώθηκαν από τους αλχημιστές της Ελληνορωμαϊκής περιόδου και από τα οποία ελάχιστα συμπεράσματα μπορούν να εξαχθούν ως προς τα πειράματα που διεξήγαγαν, οι Πέρσες και οι 'Αραβες κρατούσαν λεπτομερείς σημειώσεις των πειραμάτων και των παρατηρήσεών τους. Μέχρι τότε η αλχημεία ήταν ένα μίγμα φιλοσοφικών θεωριών, αλληγοριών, συμβόλων και κωδικοποιημένων γλωσσών.
Κατά την περίοδο των αλχημιστών των Ισλαμικών χωρών (από τον 8ο αιώνα μ.Χ. και μετά), η αλχημεία άρχισε να γίνεται μια συστηματική τεχνική με συγκεκριμένες πρακτικές πλευρές. Οι 'Αραβες και οι Πέρσες αλχημιστές των Ισλαμικών χωρών ανακάλυψαν και περιέγραψαν με κάθε λεπτομέρεια ένα πλήθος χημικών αντιδραστηρίων, που στη συνέχεια χρησιμοποίησαν οι Ευρωπαίοι αλχημιστές, όπως το νιτρικό και το θειικό οξύ και η ποτάσα (potash, K2CO3). Επίσης, τελειοποίησαν πολλές τεχνικές, όπως την υφαντουργία, τη μεταλλουργία, την παρασκευή χρωστικών υλών, την αγγειοπλαστική, την υαλουργία και την αρωματοποιία. Ονομαστά αραβικά προϊόντα ήταν τα λινά υφάσματα, οι μουσελίνες της Μοσούλης και τα περίφημα ξίφη της Δαμασκού, για τα οποία η μεταλλουργική τεχνική κατασκευής τους παραμένει ακόμη ένα επιστημονικό αίνιγμα.
 |
Τα περίφημα χαλύβδινα "Δαμασκηνά σπαθιά" (Damascus' swords), με τα χαρακτηριστικά μοτίβα τους, υπήρξαν διάσημα για την αντοχή τους και την εξαιρετικά αιχμηρή λεπίδα τους. Η παράδοση λέει ότι μπορούσαν με ένα κτύπημα να κόψουν τα ευρωπαϊκής κατασκευής σπαθιά, όπως και βράχους. Η κατασκευή τους (1100-1700 μ.Χ.) παραμένει ένα "μεταλλουργικό μυστήριο" παρά το πλήθος των σχετικών ερευνών. |
Επίσης, οι αλχημιστές των Ισλαμικών χωρών ανακάλυψαν σπουδαίες θεωρίες και τεχνικές για την ιατρική, τη γεωμετρία, την αστρονομία. Επινόησαν την άλγεβρα (al-jabr: επανόρθωση, αποκατάσταση), μελέτησαν το εκκρεμές και εισήγαγαν τα ψηφία-σύμβολα του δεκαδικού συστήματος αρίθμησης (αραβικά ψηφία). Τέλος, συνέβαλαν στην ανάπτυξη της οπτικής και της τριγωνομετρίας και βέβαια της αλχημείας.
Ο Πέρσης Τζαμπίρ Ιμπν Χαγιάν (Jaber Ibn Hayan, 721(;)-815, Βαγδάτη), μετέπειτα γνωστός στην Ευρώπη ως Geber, γνωστός και ως ο πρώτος των αλχημιστών, εισήγαγε τη μεθοδική και πειραματική προσέγγιση μιας αλχημιστικής επιστημονικής έρευνας που πραγματοποιούνταν σε ένα εργαστήριο. Ο Geber θεωρείται ως ο πατέρας της Αλχημείας. Ο Geber θεωρούσε ότι όλα τα μέταλλα αποτελούνταν από υδράργυρο και θείο και ότι ο υδράργυρος καθόριζε τη μεταλλικότητά τους και το θείο την αναφλεξιμότητά τους.
Οι ανακαλύψεις του Geber υπήρξαν πολύ σημαντικές και καταγράφηκαν στα πολυάριθμα βιβλία και σημειώσεις που άφησε. Μεταξύ άλλων, ανακάλυψε την ποτάσα, περιέγραψε μέθοδο απομόνωσης του καυστικού νατρίου, όπως και των ισχυρών οξέων, δηλ. του θειικού, του νιτρικού και του υδροχλωρικού οξέος. Στον Geber αποδίδεται η απομόνωση του αρσενικού και του αντιμονίου. Βελτίωσε τις τεχνικές κρυστάλλωσης, απόσταξης, σύντηξης, εξάχνωσης και εξάτμισης. Επίσης, εφηύρε ένα είδος άκαυστου χαρτιού, βρήκε ένα τρόπο προστασίας του σιδήρου από την οξείδωση, όπως έναν τρόπο διαχωρισμού του χρυσού από τον άργυρο με τη βοήθεια οξέων.
Συνολικά αποδίδεται στο Geber συγγραφή 3.000 εργασιών (Jabirian corpus). Πιστεύεται ότι ο Geber έγραψε πάνω από 200 βιβλία, πολλά από τα οποία μεταφράστηκαν στα λατινικά και για αιώνες υπήρξαν για τους Ευρωπαίους αλχημιστές πηγές ανεκτίμητων πληροφοριών για διάφορες χημικές ουσίες. Σε πολλά από αυτά αναφέρεται στους 'Ελληνες "αλχημιστές" Δημόκριτο, Σωκράτη, Πλάτωνα, Αριστοτέλη, Πυθαγόρα και Γαληνό.
|
Φανταστικές καλλιτεχνικές απεικονίσεις του Geber. |
O διάσημος 'Αγγλος φιλόσοφος και αλχημιστής Roger Bacon (1214-1294) αναγνώρισε τον Geber ως τον πρωτοπόρο δάσκαλο της επιστήμης της Χημείας, ενώ, πολύ αργότερα, ο Γάλλος χημικός Marcellin Berthelot (1827-1907) είπε ότι ο Αριστοτέλης καθιέρωσε τη φιλοσοφία της λογικής και ο Geber τη Χημεία.
Ονομαστοί αλχημιστές, φιλόσοφοι και ιατροί ήταν ο Πέρσης Αβικένας (Ibn Sina Avicenna, 980-1037, Περσία) και ο 'Αραβας Αβερρόης (Ibn Rushd Averroes, 1126 Cordova Ισπανίας - 1198 Marrakes, Μαρόκο). O Αβικένας είχε συντάξει ένα μεγάλο κατάλογο των μέχρι τότε γνωστών ουσιών, όπου περιέγραφε και τη φαρμακολογική δράση τους. Ο Αβερρόης έγραψε μια ιατρική εγκυκλοπαίδεια και σχεδόν για όλα τα έργα του Αριστοτέλη. Πρέπει να σημειωθεί ότι οι Πέρσες και 'Αραβες θεωρούσαν τον Αριστοτέλη μεγάλο φιλόσοφο, τα έργα του οποίου διασώθηκαν και έγιναν γνωστά στην Ευρώπη από αραβικές μεταφράσεις και σχολιασμούς.
Αυτοί οι Πέρσες και 'Αραβες σοφοί θεωρούνται ότι ήταν οι πρώτοι που ασχολήθηκαν συστηματικά με τη Χημεία και τις χημικές τεχνικές και συνέβαλαν αποφασιστικά στην πρόοδο της επιστήμης της Χημείας. Διέσωσαν τις αρχαίες γνώσεις αλχημείας και τις εμπλούτισαν. Ωστόσο, δεν υπήρξαν αποκλειστικά αλχημιστές. Αυτοί οι άνθρωποι ήταν στην κυριολεξία "πανεπιστήμονες", ήταν φιλόσοφοι και συγχρόνως γιατροί, θεολόγοι και συγχρόνως φυσικοί, μαθηματικοί και αστρονόμοι, ποιητές και συγχρόνως μηχανικοί. 'Ηταν ένα σπάνιο είδος ανθρώπων, που η προσφορά τους στην πρόοδο της ανθρωπότητας υπήρξε ανεκτίμητη.
Μέχρι τον 13ο αιώνα τεράστια ποσότητα γνώσης είχε σωρευθεί στη βιβλιοθήκη της Βαγδάτης της μεγαλύτερης πόλης εκείνης της εποχής (με περίπου 1,5 εκατομμύριο κατοίκους). Δυστυχώς, το 1258 η Βαγδάτη καταστράφηκε από τους Μογγόλους του Hulagu Khan, εγγονού του Τζέκις Χαν, και μαζί με την πόλη καταστράφηκε και η βιβλιοθήκη της. Χαρακτηριστικά αναφέρεται ότι τα νερά του ποταμού Τίγρη, ο οποίος διασχίζει τη Βαγδάτη, "βάφτηκαν μαύρα" από το μελάνι των χειρογράφων που πετάχτηκαν σ' αυτόν. Η καταστροφή αυτή οδήγησε στην απώλεια τεράστιας ποσότητας επιστημονικής γνώσης και ήταν αντίστοιχη με εκείνη της καταστροφής του Σεραπείου, όπως και της βιβλιοθήκης της Αλεξάνδρειας, αρκετούς αιώνες πριν. Επίσης, η καταστροφή αυτή σηματοδότησε το τέλος της επιστημονικής και γενικά της πνευματικής άνθησης του Ισλάμ.
Σελίδες από αραβικά αλχημιστικά κείμενα
Πηγές από το Διαδίκτυο: (1) "Ibn Rushd: Bridging Islamic Traditions and Greek Thought" (Martin Nick). (2) "Geber (Abu Musa Jabir ibn Hayyan)". (3) "Islamic Alchemy - The History of Chemistry" (experiments-rsources.com)

'Αμβυκας: Η τυπική διαχρονική συσκευή απόσταξης σε διάφορες "εκδοχές" (αρχαία ελληνική λέξη: άμβυξ, αραβική παραλλαγή: al ambic ή alambic και ως αντιδάνειο: λαμπίκος ή λαμπίκο).
 |
 |
|
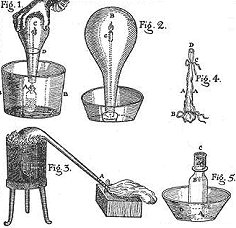
Αριστερά: Αλχημιστής σε αναζήτηση της Φιλοσοφικής Λίθου. Ζωγραφικός πίνακας (1771) του Joseph Wright, όπου απεικονίζεται ο αλχημιστής Hennig Brand (1630-1710)να ανακαλύπτει τον φωσφόρο. Αυτό συνέβη "κατά λάθος", όταν ο Brand αναζητούσε τη Φιλοσοφική Λίθο στο στερεό υπόλειμμα μεγάλης ποσότητας ούρων. Δεξιά: Δείγματα ερυθρού και λευκού φωσφόρου. |
|
10. Ιστορία της Χημείας κατά την Περίοδο των Αλχημιστών
Η λέξη Αλχημεία, όπως
αναφέρθηκε στην εισαγωγή, προέρχεται από το οριστικό αραβικό άρθρο Αλ και τη
Χημεία. Λιγότερο πιθανές, αλλά
ενδιαφέρουσες είναι άλλες θεωρίες για την προέλευσή της. 'Ετσι, πολλοί
πιστεύουν ότι έχει κινεζική προέλευση ή ακόμη και ελληνική (Αριστοτέλης: 'Εστι
δε πάσι αρχή μία και ουσία: Αρχή μία
![]() Αρχημία
Αρχημία
![]() Αλχημία
Αλχημία
![]() Αλχημεία).
Αλχημεία).
|
Το αλχημιστικό σύμβολο της φιλοσοφικής λίθου (σύνθεση άλλων επιμέρους συμβόλων). |
Η
ανάπτυξη της Αλχημείας και των αλχημιστών ήταν κάτι το αναμενόμενο κατά τον Μεσαίωνα,
αφού οι ειδικές γνώσεις σε θέματα μεταλλουργίας γενικά και χρήσεις των φαρμακευτικών βοτάνων για
τη θεραπεία ασθενειών, υπήρξαν πάντοτε
σημαντικοί παράγοντες πλουτισμού. Η επιστήμη της Χημείας από αντικείμενο επιστημονικής γνώσης
και αναζήτησης μετατράπηκε σε εμπορευματικό προϊόν με μεγάλη ζήτηση και
χρηματική αξία.
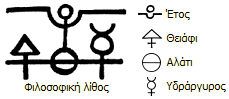
Οι αλχημιστές πίστευαν ότι υπάρχουν τέσσερα βασικά στοιχεία-ουσίες: η φωτιά,
ο αέρας, η γη και το νερό και τρία αιθέρια στοιχεία: το θειάφι, το αλάτι και
ο υδράργυρος. Η Αλχημεία ήταν ιδιαίτερα διαδεδομένη στη μεσαιωνική Ευρώπη.
Πολλά από τα αλχημιστικά βιβλία ήταν γεμάτα με ανούσια μαγικά ξόρκια,
επικλήσεις και άλλα αποκρυφιστικά στοιχεία.
Οι
σημαντικότεροι στόχοι των αλχημιστών ήταν η ουτοπική μετατροπή (μετουσίωση) των κοινών μετάλλων σε χρυσό ή ασήμι,
όπως και η δημιουργία του
ελιξιρίου της
ζωής (από την αρχαία ελληνική λέξη: ξήριον -ουσία που
"ξηραίνει" τα τραύματα- και στη συνέχεια την αραβική: el iksir), το οποίο θα θεράπευε όλες τις ασθένειες και θα παρέτεινε τη ζωή του
ανθρώπου. Η
Φιλοσοφική Λίθος
(lapis
philosophorum)
ήταν μια μυθική ουσία και βασικό συστατικό για την επίτευξη των στόχων
αυτών. Για τους αλχημιστές η φιλοσοφική λίθος αντιπροσώπευε το πέμπτο στοιχείο ή την
πέμπτη ουσία ή την
πεμπτουσία
(quinta essentia ή quintessence),
την ύπαρξη της οποίας δεχόταν ο Αριστοτέλης.
Επίσης, οι
αλχημιστές αναζητούσαν ένα είδος "παγκόσμιου" διαλύτη, δηλαδή μια ουσία που θα
μπορούσε να διαλύσει κάθε άλλη (azoth,
alkahest). 'Ολες αυτές οι
παράδοξες έννοιες και ουσίες συχνότατα συγχέονταν μεταξύ τους, συχνά σημαίνανε το ίδιο
πράγμα και συνδυάζανε όλες τις παραπάνω ιδιότητες.
Οι αλχημιστές δεν επεδίωκαν μόνο τη βελτίωση κάποιων ιδιοτήτων των υλικών ή την παράταση του χρόνου ζωής, αλλά έδιναν και μια πνευματική διάσταση στις αναζητήσεις τους. Για παράδειγμα, η μετατροπή του "ευτελούς" μολύβδου σε "ευγενή" χρυσό, παραλληλιζόταν με την ψυχική ανύψωση και τον εξευγενισμό του πνεύματος.
Τα εργαστήρια των αλχημιστών ήταν γεμάτα με όργανα απόσταξης, φούρνους, φιάλες με χημικές ουσίες, παράδοξα εκχυλίσματα, διαλύτες και οξέα και πολλά συγγράμματα χημείας κυρίως Αραβικής προέλευσης. Πολλές υπήρξαν οι "παράπλευρες" χημικές ανακαλύψεις των αλχημιστών κατά τη διάρκεια των παράδοξων αναζητήσεών τους. Τυπικό παράδειγμα αποτελεί η ανακάλυψη του φωσφόρου (1669) από τον Γερμανό αλχημιστή Hennig Brand (1630-1710), όταν θέρμανε σε υψηλή θερμοκρασία το στερεό υπόλειμμα, το οποίο συνέλεξε μετά την εξάτμιση μιας μεγάλης ποσότητας ούρων. Προφανώς, στην υψηλή θερμοκρασία του φούρνου πραγματοποιήθηκε αναγωγή των φωσφορικών αλάτων από τον άνθρακα των οργανικών ουσιών του υπολείμματος. Από 4.500 λίτρα ούρων παρέλαβε περίπου 120 g φωσφόρου, που αντιστοιχούν περίπου στο 20% της υπάρχουσας ποσότητας φωσφόρου στην "πρώτη ύλη", μια αρκετά καλή απόδοση λαμβανομένων υπόψη των σχετικών δυσχερειών. 'Οταν ο Brand διαπίστωσε αυτή η κηρώδης ουσία καιγόταν με έντονο λαμπρό φως και κυρίως ότι από μόνη της εξέπεμπε ένα απαλό πρασινοκίτρινο φως ορατό στο σκοτάδι, την ονόμασε phosphorus mirabilis (θαυμαστή ουσία που φέρει φως). 'Ομως, σε καμιά περίπτωση το φως αυτό δεν είναι τόσο λαμπρό, όσο απεικονίζεται στον περίφημο πίνακα του Wright.
Οι αλχημιστές συνήθιζαν να κρατούν ως επτασφράγιστα μυστικά τις λεπτομέρειες
των τεχνικών τους και να κρατούν σημειώσεις χρησιμοποιώντας "κρυπτογραφικά" σύμβολα. Αυτό
είχε ως αποτέλεσμα να ταυτιστούν με μυστικιστικές ομάδες και συντεχνίες με
"ύποπτους σκοπούς". Αλλά και οι ίδιοι οι αλχημιστές, τις περισσότερες φορές
σκόπιμα και για λόγους εντυπωσιασμού και βιοπορισμού, δεν επεδίωξαν να
διαχωρίσουν την "τέχνη" τους από το υπερφυσικό, το μαγικό και τη
δεισιδαιμονία και άφηναν να εννοηθεί ότι διατηρούσαν επαφές με δαίμονες.
 |
 |
 |
|
Αριστερά-μέσον: Δύο από τις άφθονες ζωγραφικές απεικονίσεις αλχημιστών και των εργαστηρίων. Δεξιά: Ο δρόμος των αλχημιστών ή το χρυσό σοκάκι (Zlata Ulicka, Golden Lane). Ένας στενός δρόμος με μικρά σπιτάκια-εργαστήρια χρυσοχόων, που βρίσκονται μέσα στο κάστρο της Πράγας. Ο θρύλος αναφέρει ότι εκεί ζούσαν και αλχημιστές (στην πραγματικότητα αυτοί βρίσκονταν σε άλλα καλύτερα φυλασσόμενα μέρη του κάστρου). Οι ηγεμόνες της Βοημίας (σημερινής Τσεχίας) κρατούσαν χρυσοχόους και αλχημιστές σε μια κατάσταση ημιαιχμαλωσίας και συνεχούς επιτήρησης. |
||
 Οι αλχημιστές
υπέστησαν πολλούς διωγμούς ανά τους αιώνες (συχνότατα δικαιολογημένους) και
η εξάσκηση της αλχημιστικής τέχνης
πολλές φορές απαγορεύτηκε από θεσμικά πρόσωπα όπως ο Πάπας Ιωάννης XXII
(1317) ή ο Ερρίκος ο IV της Αγγλίας (1403). Κάποιες αλχημιστικές
αναζητήσεις και πρακτικές είχαν απαγορευθεί στην Αγγλία (με απειλές δημόσιας
εκτέλεσης). Οι 'Αγγλοι μονάρχες δεν έβλεπαν με καλό μάτι την αναζήτηση της
φιλοσοφικής λίθου. Αν οι αλχημιστές έβρισκαν μέθοδο να μετατρέπουν φθηνά
μέταλλα σε χρυσό, τότε όλος ο χρυσός, που είχε σωρευθεί στα βασιλικά
θησαυροφυλάκια αυτόματα θα έχανε την αξία του. Από την άλλη μεριά, ο βασιλέας της Πρωσίας
Frederich I (1657-1713) είχε διατάξει την εκτέλεση
αλχημιστών, οι οποίοι παρά τις υποσχέσεις τους δεν κατάφεραν να μετατρέψουν κοινά
μέταλλα σε χρυσό.
Οι αλχημιστές
υπέστησαν πολλούς διωγμούς ανά τους αιώνες (συχνότατα δικαιολογημένους) και
η εξάσκηση της αλχημιστικής τέχνης
πολλές φορές απαγορεύτηκε από θεσμικά πρόσωπα όπως ο Πάπας Ιωάννης XXII
(1317) ή ο Ερρίκος ο IV της Αγγλίας (1403). Κάποιες αλχημιστικές
αναζητήσεις και πρακτικές είχαν απαγορευθεί στην Αγγλία (με απειλές δημόσιας
εκτέλεσης). Οι 'Αγγλοι μονάρχες δεν έβλεπαν με καλό μάτι την αναζήτηση της
φιλοσοφικής λίθου. Αν οι αλχημιστές έβρισκαν μέθοδο να μετατρέπουν φθηνά
μέταλλα σε χρυσό, τότε όλος ο χρυσός, που είχε σωρευθεί στα βασιλικά
θησαυροφυλάκια αυτόματα θα έχανε την αξία του. Από την άλλη μεριά, ο βασιλέας της Πρωσίας
Frederich I (1657-1713) είχε διατάξει την εκτέλεση
αλχημιστών, οι οποίοι παρά τις υποσχέσεις τους δεν κατάφεραν να μετατρέψουν κοινά
μέταλλα σε χρυσό.
Οι αλχημιστές αποτυπώνονταν σε έργα ζωγραφικής ή περιγράφονταν σε κείμενα ως άνθρωποι μυστηριώδεις και αναξιόπιστοι. Δεν ήταν λίγες οι φορές που Ευρωπαίοι ηγεμόνες πλήρωναν αδρά αλχημιστές για να τους εξασφαλίσουν "φθηνό" χρυσό ή ελιξίρια μακροζωίας. Αναφέρονται κωμικοτραγικές περιπτώσεις αλχημιστών-απατεώνων οι οποίοι ζητούσαν ποσότητες γνήσιου χρυσού από τους ηγεμόνες-"προστάτες" τους για να τον χρησιμοποιήσουν ως "προζύμι" στα πειράματά τους και τελικά εξαφανίζονταν με τον χρυσό αυτό.
Μετά τις σημαντικές επιστημονικές ανακαλύψεις της Χημείας από τον 18ο αιώνα και μετά, η μεταστοιχείωση με καθαρά χημικά μέσα έχει αποκλεισθεί οριστικά, όπως επίσης και η ύπαρξη της φιλοσοφικής λίθου. Ωστόσο, ακόμη και σήμερα γίνεται μερική χρήση αλχημιστικών θεωριών, σε θεραπευτικές πρακτικές όπως είναι η ομοιοπαθητική, η αρωματοθεραπεία και η κρυσταλλοθεραπεία.
Μεταξύ των πιο διάσημων αλχημιστών όλων των εποχών (πέραν από τους προαναφερθέντες Geber, Αβικένα και Αβερρόη) θεωρούνται οι: Wei Boyang (Κίνα), που έκανε την πρώτη γραπτή αναφορά για την πυρίτιδα (142 μ.Χ.), ο Ζώσιμος ο Πανοπολίτης ('Ελληνας ή Αιγύπτιος, 4ος-5ος αιώνας μ.Χ.), ο Muhammad ibn Zakariya al-Razi (Περσία, 865-925 μ.Χ.), διάσημος φαρμακοποιός και γιατρός της εποχής του, ο Nagarjuna (Ινδία, 10ος αιώνας μ.Χ.), διάσημος μεταλλουργός (συνέγραψε πραγματεία για τον υδράργυρο).
Διάσημοι δυτικοευρωπαίοι αλχημιστές ήταν ο 'Αγγλος Roger Bacon (1214-1294) γνωστός και ως "Doctor Mirabilis" (: ο υπέροχος δάσκαλος), ο Βαυαρός Albertus Magnus, (1193/1206-1280),ο Γάλλος Nicolas Flamel (1330-1418) και ο Ελβετός Θεόφραστος Παράκελσος (Theophrastus Bombastus von Hohenheim, 1493-1541).
O Φραγκισκανός μοναχός Roger Bacon (Ρογήρος Βάκων) της Οξφόρδης υπήρξε ο πρώτος "πραγματικός" αλχημιστής της Μεσαιωνικής Ευρώπης. Ο Bacon θεωρούσε ότι μόνο με την παρατήρηση και το πείραμα μπορεί να αποκτήσει κανείς τη γνώση. Ο Bacon είναι ο πρώτος Ευρωπαίος που περιγράφει σε κείμενο του τη σύνθεση της πυρίτιδας, που πιθανώς γνώρισε μετά από μια επίδειξη κινεζικών πυροτεχνημάτων.
Ο Δομινικανός μοναχός και επίσκοπος Albertus Magnus πρέσβευε την άποψη της ειρηνικής "συνύπαρξης" αλχημείας και θρησκείας. Στο έργο του "De mineralibus" αναφέρεται στη "δύναμη" των λίθων. Στον Magnus αποδίδεται η ανακάλυψη του αρσενικού και επίσης αναφέρονται πειραματισμοί του με φωτοευαίσθητες ουσίες, όπως ο νιτρικός άργυρος.
 |
 |
 |
 |
| Roger Bacon (1214-1294), 'Αγγλος |
Albertus Magnus (1193/1206-1280), Βαυαρός |
Nicolas Flamel (1330-1418), Γάλλος |
Paracelsus (1493-1541), Ελβετός |
Ο γραφέας, αλλά και συλλέκτης και έμπορος χειρογράφων Nicolas Flamel, από κείμενά του που βρέθηκαν, απέκτησε μεταθανάτια φήμη έξοχου αλχημιστή που ανακάλυψε τη φιλοσοφική λίθο και το ελιξίριο της ζωής. Ωστόσο, πιστεύεται ότι όλα αυτά ήταν δημιούργημα μετέπειτα εκδοτών αλχημιστικών κειμένων, που ήθελαν να προσδώσουν κάποιο κύρος στις "αρχαίες πηγές" τους.
Ο Παράκελσος θεωρείται ως ένας από τους μεγαλύτερους αλχημιστές, αστρολόγους, και αποκρυφιστές όλων των εποχών. Ωστόσο, ήταν και από τους πρώτους αλχημιστές που πίστεψαν ότι η αναζήτηση της φιλοσοφικής λίθου για την παρασκευή χρυσού ήταν ματαιοπονία και ότι οι αλχημιστές θα έπρεπε να στρέψουν την έρευνά τους σε πιο χρήσιμες οδούς και κυρίως στην αναζήτηση φαρμάκων. Ο Παράκελσος υπύρξε ο πρώτος ο οποίος δίδαξε ότι η ζωή η ίδια δεν είναι παρά μια σειρά χημικών διεργασιών και ότι κάθε αρρώστια στην ουσία είναι μια χημική δυσλειτουργία κάτι που δεν απέχει πολύ από την πραγματικότητα.
Ο Παράκελσος θεωρείται ως ο "πατέρας" της τοξικολογίας και είχε διατυπώσει την περίφημη φράση "η δόση κάνει το δηλητήριο" (Sola dosis facit venemum). Το 1536, εξέδωσε το Die grosse Wundartzney (το μεγάλο βιβλίο της Χειρουργικής), ενώ ως σημαντικότερο έργο του θεωρείται το Philosophia sagax (υπάρχει και με τον τίτλο Astronomia magna, που είναι γραμμένο στα γερμανικά).
Μετά τον θάνατο του Παράκελσου, το επιστημονικό έργο του άρχισε να αναγνωρίζεται και να εκτιμάται από πολλούς ιατρούς της Γερμανίας και της Γαλλίας, οι οποίοι του προσέδωσαν την προσωνυμία του "Λούθηρου της Ιατρικής". Αντίθετα, οι εχθροί του που δημιούργησε αρνούμενος να δεχθεί τις αντιλήψεις των ιατρών της εποχής του, τον αποκαλούσαν "φιλόσοφον ά-λογον" (χωρίς λογική) και τα ιατρικά του συγγράμματα ως προϊόντα διανοητικής ανισορροπίας.

Γραμματόσημα διάφορων χωρών με απεικονίσεις του Παρακέλσου. Από τους πρώτους αλχημιστές που στράφηκε στην παρασκευή φαρμάκων και όχι στη μάταιη αναζήτηση της φιλοσοφικής λίθου.
Πηγές από το Διαδίκτυο: (1) "Alchemy" (Wikipedia). (2) "The Alchemy web site on Levity.com". (3) "The Alchemy Web Site" (άφθονο υλικό για την αλχημεία και τους αλχημιστές). (4) "History of Alchemy".
|
|
|
|
|
|
Αλχημιστικές συσκευές και όργανα


Συλλογές τυπικών αλχημιστικών συμβόλων
|
|
|
|
|
Ο μεγαλοφυής Ισαάκ Νεύτων (1642-1727), γνωστός στους πάντες από τη θεμελιώδη προσφορά του στη Φυσική και στα Μαθηματικά, αν και ασχολήθηκε και με τη Χημεία, για το έργο του αυτό δεν είναι γνωστά πολλά πράγματα. Αναφέρεται ότι μια τυχαία πυρκαγιά στο εργαστήριό του, την οποία προκάλεσε ο σκύλος του, κατέστρεψε ό,τι είχε καταγράψει. Μπορούμε να υποθέσουμε ότι αν η συμβολή του Νεύτωνα στη Χημεία ήταν αντίστοιχη με τη συμβολή του στη Φυσική και στα Μαθηματικά, τότε αυτό το φημολογούμενο περιστατικό θα πρέπει να κόστισε πολύ στη Χημεία. |
||
 |
 |
|
Οι θεμελιωτές της σύγχρονης Χημείας: Robert Boyle (1627-1691) και Antoine Lavoisier (1743-1794) |
|
11. Η Χημεία κατά τον 17ο και 18ο Αιώνα
Η ιστορία της Χημείας με τους αλχημιστές είχε φτάσει στα όρια μιας ψευδο-επιστήμης με πολλές δεισιδαιμονίες, παρανοήσεις και τυφλά πειράματα για χημικές μετατροπές που δεν έδιναν αποτελέσματα ή έδιναν, αλλά δεν ήταν τα επιζητούμενα και συχνά αγνοούνταν. Θα πρέπει να σημειωθεί ότι ο διάσημος Ισαάκ Νεύτων (1642-1727), είχε ασχοληθεί με την αλχημεία, αλλά η καταγραφή (από τον ίδιο) των ανακαλύψεών του χάθηκε μετά από μια πυρκαγιά στο εργαστήριό του.
Ακόμη αναφέρεται πως ο Νεύτων είχε υποστεί νευρική κατάρρευση κατά τις αλχημιστικές του αναζητήσεις και αυτό αποδίδεται είτε στην ίδια τη φύση των ψυχολογικών μεταπτώσεων που προκαλούσαν "αλχημιστικού" τύπου έρευνες είτε σε χημική δηλητηρίασή του από ενώσεις βαρέων μετάλλων.
|
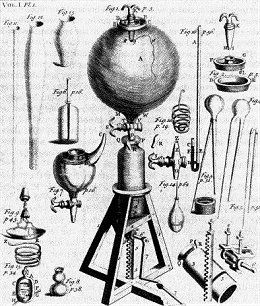
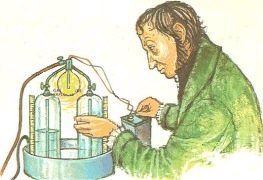
Η πρώτη αεραντλία του Robert Boyle όπως εμφανίζεται σε γκραβούρα στο "New Experiments Physico-Mechanical" (1660) [πηγή]. |
Οι πρωτοπόροι και "πατέρες" της πραγματικής επιστήμης της Χημείας, με πραγματικά πειράματα, παρατήρηση, λεπτομερή καταγραφή μετρήσεων, αλλά και με έλεγχο της ακρίβειας των μετρήσεων, θεωρούνται ο Robert Boyle (1627-1691) στην Αγγλία και ο Antoine Lavoisier (1743-1794) στη Γαλλία.
Η σύγχρονη λέξη Χημεία εδραιώνεται τον 17ο αιώνα με το έργο του Robert Boyle, που θεωρείται ως ο τελευταίος των αλχημιστών και συγχρόνως ο πρώτος των χημικών, στο βιβλίο που εξέδωσε το 1661 "Ο Σκεπτικιστής Χυμικός" (The Skeptical Chymist), που έγινε βασικό σύγγραμμα-οδηγός για τους χημικούς που ακολούθησαν. Το πλήρες βιβλίο είναι διαθέσιμο στο διαδίκτυο από εδώ (βιβλιοθήκη του Πανεπιστημίου της Πενσυλβάνιας).
Ο Robert Boyle ήταν κατά τον 17ο αιώνα ένας φυσικός φιλόσοφος (όπως αποκαλούνταν οι επιστήμονες την εποχή εκείνη) με γνώσεις φυσικής, χημείας και θεολογίας.
Αν και επικρατούσε σε όλους τους πειραματιστές της εποχής εκείνης μια μηχανοκρατική αντίληψη, ο Robert Boyle προχώρησε περισσότερο από οποιονδήποτε χημικό της γενιάς του, αμφισβητώντας τη δομή της επικρατούσας χημικής θεωρίας. Ο μεγάλος αυτός ερευνητής χρησιμοποίησε χημικές μεθόδους για να αποδείξει ότι διαφορετικά σώματα διασπώνται σε διαφορετικές ουσίες. Ο Robert Boyle δεν ξέφυγε πολύ από τις επικρατούσες αντιλήψεις (δηλ. την πεποίθηση ότι υπήρχαν "άτομα" φωτιάς) που σχετίζονταν με την καύση και την αναπνοή των ζώων.
Μετά από πολλές περιηγήσεις σε διάφορες χώρες, ο Boyle κατέληξε στην Οξφόρδη το 1667, όπου εφηύρε την αντλία αερίων. Με την αντλία αυτή έκανε πειράματα σε κενό και διατύπωσε τους νόμους των αερίων, την περίφημη σχέση PV = σταθερά, υπό σταθερή θερμοκρασία, μια κοινή γνώση σήμερα, σημαντικό όμως εύρημα για εκείνη την εποχή.
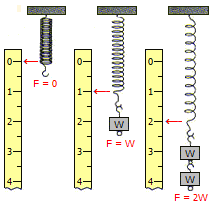
Ο Robert Boyle συνεργάσθηκε με τους πιο γνωστούς φυσικούς-φιλόσοφους της Οξφόρδης εκείνης της εποχής, τον Robert Hooke (1635-1703) και τον John Mayow (1641-1679). Ο Hooke ήταν ένας "πανεπιστήμονας" (φυσικός, χημικός, βιολόγος, αστρονόμος, μηχανικός, αρχιτέκτονας), έμεινε γνωστός στην επιστήμη ως "πατέρας της μικροσκοπίας", αλλά και από τον ομώνυμο νόμο της ελαστικότητας. Αυτοί οι δύο ερευνητές πραγματοποιούσαν μελέτες, ο Hooke στα προϊόντα καύσης ενός κεριού. Ο Mayow μαζί με το κερί έκλεινε στο δοχείο και ένα πειραματόζωο, το οποίο πάντοτε πέθαινε όταν έσβηνε το κερί. Και στις δύο περιπτώσεις τα αποτελέσματα οδηγούσαν στο συμπέρασμα ότι για να διατηρηθεί τόσο η καύση, όσο και η ζωή σε έναν κλειστό χώρο, ήταν απαραίτητη η συνεχής παροχή αέρα.
Ο Mayow ονόμασε την ουσία που συντηρούσε την καύση νιτρο-αερώδες πνεύμα (spiritus nitro-aereus), επειδή (σωστά) τη συσχέτισε με κάποια ή κάποιες ουσίες, που περιέχει το "νίτρο" (KNO3). Ο Mayow θεωρούσε ότι το νιτρο-αερώδες πνεύμα είχε σχέση με τους σεισμούς, τους κεραυνούς και την κατάψυξη. Χρειάστηκαν άλλα 100 χρόνια για να ανακαλυφθεί το οξυγόνο από τον Lavoisier και να γίνει αντιληπτό ότι αυτό το αέριο τροφοδοτούσε την καύση και τη ζωή.
|
|
|
|
|
|
| O Johannes (John) Mayow (1641-1679) και τα σκεύη που χρησιμοποιούσε για τα περίφημα πειράματά του πάνω στην αναπνοή των ζώων. | Ο Robert Hooke (1635-1703) είναι γνωστός από τον ομώνυμο νόμο του σύμφωνα με τον οποίο "η επιμήκυνση ενός ελατηρίου είναι ανάλογη της δύναμης που ασκείται στο ελατήριο". O Hook υπήρξε και ο εφευρέτης μικροσκοπίου. 'Ισως δεν είναι ευρύτερα γνωστό ότι είναι ο πρώτος που παρατήρησε τα κύτταρα και σ' αυτόν οφείλεται η ονομασία του κυττάρου στην Αγγλική ως cell. Με τον όρο cell (κελί) θέλησε να παρομοιάσει τα κύτταρα με τα κελιά των μοναχών. | |||
 |
|
|
|
Οι θεμελιωτές της φλογιστικής θεωρίας: Johann Joachim Becher (1635-1682) και Georg Ernst Stahl (1660-1734). |
||
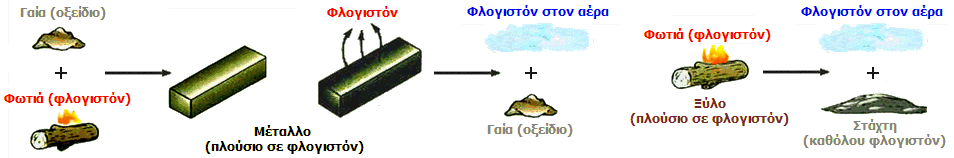
11.1. Φλογιστική Θεωρία. Το 1667 ο Γερμανός αλχημιστής Johann Joachim Becher (1635-1682) σε δημοσίευσή του ανέφερε τις πρώτες ιδέες του που αργότερα θα εξελίσσονταν στη φλογιστική θεωρία. Ο Becher "διέγραψε" τη φωτιά και τον αέρα από το κλασικό σύστημα των τεσσάρων στοιχείων και τα αντικατέστησε από τρεις μορφές "γης": την υαλώδη γη (terra lapidea), την υδραργυρική ή ρευστή γη (terra mercurialis, terra fluida) και την ελαιώδη γη (terra pinguis). Οι τρεις αυτές μορφές γης αντιστοιχούσαν στο αλάτι, τον υδράργυρο και το θείο του Παράκελσου. Η υαλώδης γη παραμένει στα υπολείμματα της καύσης (calx) ενός σώματος, η υδραργυρική γη δίνει τη μεταλλική στιλπνότητα, ενώ η ελαιώδης γη, που βρίσκεται κυρίως στα ζωικά και φυτικά σώματα, καθιστούσε τα σώματα καύσιμα και απελευθερωνόταν κατά την καύση τους.
Ο μαθητής του Becher Georg Ernst Stahl (1660-1734), καθηγητής της Χημείας και της Ιατρικής στο Πανεπιστήμιο του Halle (σήμερα Martin Luther University of Halle-Wittenberg) πρότεινε μια παραλλαγή της θεωρίας του Becher και μετονόμασε την ελαιώδη γη σε φλογιστόν (phlogiston). Tο φλογιστόν βρίσκεται σε κάθε υλικό που μπορεί να καεί και χάνεται στον αέρα εν μέρει ή συνολικά κατά την καύση της ουσίας. Μόνο ό,τι απομείνει μετά την καύση (calx) αποτελεί την πραγματική φύση της ουσίας.
Η αντίληψη ότι η φλόγα απομακρύνει κάτι από το καιόμενο σώμα υπήρχε ήδη από την αρχαιότητα. Η αντίληψη αυτή συναντάται στην αριστοτελική θεωρία των τεσσάρων στοιχείων "γη, ύδωρ, πυρ και αήρ", αλλά και στα έργα του Παράκελσου για τις δύο εκπνοές της Γης. Το καθαρό συμπέρασμα ήταν ότι ό,τι καίγεται περιέχει την ουσία "φλογιστόν", το οποίο αποβάλλει κατά την καύση. 'Ετσι ίσχυαν "αντιδράσεις" όπως:
ξύλο
![]() στάχτη + φλογιστόν, σίδηρος
στάχτη + φλογιστόν, σίδηρος
![]() σκουριά + φλογιστόν,
σκουριά + φλογιστόν,
κάρβουνο
![]() φλογιστόν, θειάφι
φλογιστόν, θειάφι
![]() στάχτη (αεριώδης) + φλογιστόν
στάχτη (αεριώδης) + φλογιστόν
Ιδιαίτερα πλούσιος σε φλογιστό ήταν ο άνθρακας και για το λόγο αυτό, κατά τη θέρμανσή του με οξείδια μετάλλων, δηλαδή μέταλλα που είχαν χάσει το φλογιστόν τους, τα επανέφερε στη μεταλλική κατάσταση προσφέροντάς τους το δικό του φλογιστό.
'Οταν διαπιστώθηκε ότι για να υπάρξει καύση ήταν απαραίτητη και η παρουσία αέρα και ότι από αυτόν ένα μέρος ουσιαστικά δεν χρησιμοποιείται για τις καύσεις, εισήχθησαν οι έννοιες του φλογιστικοποιημένου (phlogistated), που στην ουσία ήταν το CO2, και του αποφλογιστικοποιημένου (dephlogistated) αέρα, που στην ουσία ήταν το Ο2, καθώς και του μεφιτικού αέρα (mephitic, από το λατινικό mephitis: τοξικός, δύσοσμος), που στην ουσία ήταν το Ν2. Οπότε ήταν:
ξύλο + κοινός αέρας
![]() στάχτη + φλογιστικοποιημένος αέρας
στάχτη + φλογιστικοποιημένος αέρας
και κοινός αέρας = μεφιτικός αέρας + αποφλογιστικοποιημένος αέρας, οπότε:
φλογιστικοποιημένος αέρας = αποφλογιστικοποιημένος αέρας + φλογιστόν
 |
 |
 |
|
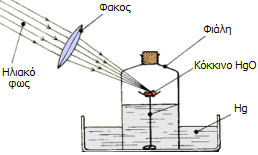
Αριστερά: Ο διάσημος 'Αγγλος φυσιοδίφης, θεολόγος, ιερέας και χημικός Joseph Pristley (1733-1804). Ο πρώτος που απομόνωσε το οξυγόνο, αν και δεν το αναγνώρισε ως ξεχωριστό στοιχείο, επηρεασμένος από τη φλογιστική θεωρία της οποίας υπήρξε ένθερμος οπαδός. Μέσον: Ο Pristley σε γελοιογραφία της εποχής διακωμωδούμενος ως "Dr Phlogiston" από πολιτικούς αντιπάλους του [πηγή]. Δεξιά: Τα σκεύη που χρησιμοποίησε στις μελέτες πάνω στα διάφορα "είδη" αέρα. |
||
Η φλογιστική θεωρία επικράτησε ουσιαστικά σε όλη τη διάρκεια του 18ου αιώνα, αν και προς το τέλος του αιώνα άρχισαν να εμφανίζονται κάποιες ασυνέπειες στη δομή της. Για παράδειγμα, είχαν ήδη διαπιστώσει ότι ο "αποφλογιστικοποιημένος" υδράργυρος, δηλαδή το οξείδιο του υδραργύρου, μπορούσε με απλή θέρμανση να ξαναδώσει υδράργυρο χωρίς κάποια "πηγή φλογιστού", όπως π.χ. άνθρακα, που χρειαζόταν για να ληφθούν άλλα μέταλλα από τα οξείδιά τους.
Ακόμη, είχε πλέον διαπιστωθεί ότι η καύση των μετάλλων στον αέρα, οδηγούσε σε προϊόντα με μεγαλύτερο βάρος, σε αντίθεση με ό,τι συνέβαινε π.χ. με το ξύλο. Αυτό οδήγησε πολλούς να πιστεύουν ότι το φλογιστόν, που "έχαναν" κατά την καύση μπορεί για τα μέταλλα να είχε και αρνητικό βάρος. 'Αλλωστε αυτό συμβαδίζει και με το γεγονός ότι ο θερμός και γεμάτος φλογιστόν αέρας, ο οποίος παράγεται κατά τις καύσεις, κινείται προς τα πάνω (!). 'Ολα αυτά άρχισαν να δημιουργούν σοβαρά "ρήγματα" στη θεωρία του φλογιστού.
Θα πρέπει εδώ να τονιστεί ότι οι οπαδοί της θεωρίας του φλογιστού δεν ήταν παραδοξολόγοι και ευφάνταστοι αλχημιστές, ούτε τσαρλατάνοι. Οι περισσότεροι ήταν σοβαροί επιστήμονες, οι οποίοι προσπαθούσαν να απαντήσουν σε βασικές χημικές ερωτήσεις με την προσεκτική εκτέλεση πειραμάτων και τη λήψη σχολαστικών μετρήσεων, αξιοποιώντας στον μέγιστο δυνατό βαθμό τις περιορισμένες έως και ανύπαρκτες γνώσεις της εποχής ως προς τη δομή της ύλης.
Μεταξύ των πλέον διάσημων και ένθερμων υποστηρικτών της θεωρίας του φλογιστού και μέχρι τέλους της ζωής του ήταν ο διάσημος Joseph Pristley (1733-1804), ο οποίος υπήρξε εξαιρετικά ισχυρογνώμονας, δύσκολος στις σχέσεις του, ιδιότροπος και ακραίος στις πολιτικές πεποιθήσεις του, εξαιτίας των οποίων είχε δημιουργήσει πολλούς εχθρούς. Ο Pristley εξακολούθησε να υπερασπίζεται τη φλογιστική θεωρία με πείσμα, ακόμη και όταν οι "αντι-φλογιστές" (με επικεφαλής τον Lavoisier) είχαν αρχίσει πλέον να επικρατούν στην επιστημονική κοινότητα της εποχής.
 |
|
|
|
Ο Σκωτσέζος χημικός Joseph Black (1728-1799) εισήγαγε τους ζυγούς ακριβείας (αναλυτικούς ζυγούς) στα χημικά εργαστήρια. |
||
Θα πρέπει να αναγνωρίσουμε ότι η φλογιστική θεωρία, όσο και αν για τα σημερινά
δεδομένα μας φαίνεται εξαιρετικά παράδοξη, σε κάποιο βαθμό είχε πλησιάσει την
αλήθεια. Το φλογιστόν στην ουσία αντιπροσώπευε την "τάση" ή τη "δίψα" μιας
ουσίας να προσλάβει οξυγόνο. 'Ετσι,
η
αντίδραση μιας ουσίας με το οξυγόνο, αντί να γραφεί συμβατικά ως: Α + [Ο]
![]() Β, θα μπορούσε να γραφεί και ως: Α
Β, θα μπορούσε να γραφεί και ως: Α
![]() Β + [-Ο]. Το φλογιστόν αντιπροσώπευε ακριβώς αυτό το "αρνητικό" οξυγόνο ή "αντι-οξυγόνο".
Β + [-Ο]. Το φλογιστόν αντιπροσώπευε ακριβώς αυτό το "αρνητικό" οξυγόνο ή "αντι-οξυγόνο".
11.2. Μετρήσεις Ακριβείας. Από τις αρχές του 18ου αιώνα οι ερευνητές άρχισαν να γίνονται πιο σχολαστικοί στα πειράματά τους και άρχισαν πλέον να κάνουν συστηματική χρήση του ζυγού. Την αρχή έκανε ο ο Σκωτσέζος χημικός Joseph Black (1728-1799), ο οποίος θεωρείται ως ο εφευρέτης του αναλυτικού ζυγού και άρχισε να περιγράφει τα πειράματά του παρουσιάζοντας ακριβείς ποσοτικές σχέσεις. Αλλά ο Antoine-Laurent Lavoisier (1743-1794) ήταν αυτός που κατέστησε την ακριβή ζύγιση αναπόσπαστο μέρος κάθε προσεκτικά σχεδιασμένου χημικού πειράματος και ο Lavoisier ήταν αυτός που επέφερε το τελειωτικό χτύπημα στους γρίφους, στις παραδοξότητες και στους μυστικισμούς της αλχημιστικής αντίληψης.
|
Ο Antoine Lavoisier και η σύζυγός του Marie-Anne (Πίνακας του Jacques-Louis David, 1788). Ο Lavoisier θεμελίωσε τη σύγχρονη Χημεία. Μεταξύ πολλών άλλων, απέδειξε με σχολαστικά πειράματα και διατύπωσε τον βασικό νόμο της Χημείας για τη διατήρηση της μάζας. 'Ομως καρατομήθηκε, αφού "Η Δημοκρατία δεν χρειαζόταν ούτε επιστήμονες, ούτε χημικούς". |
Ο Lavoisier σε ηλικία 26 ετών έγινε γνωστός όταν κατέρριψε τη μέχρι τότε επικρατούσα θεωρία ότι το νερό μετατρέπεται σε "γη" κατά την επαναλαμβανόμενη απόσταξη. Για 100 ημέρες έβραζε νερό και μετέφερε το απόσταγμα που συνέλεγε, ξανά στον βραστήρα, έτσι ώστε να μην υπάρχει κάποια απώλεια. Ζυγίζοντας την αποστακτική συσκευή με το νερό πριν και μετά την όλη διαδικασία, όπως και το στερεό υπόλειμμα που είχε μαζευτεί στην αποστακτική συσκευή, έδειξε ότι το στερεό αυτό προϊόν προερχόταν από τα γυάλινα σκεύη και όχι από το νερό. Ο Lavoisier υπήρξε ο πρώτος επιστήμονας που εισήγαγε την ζύγιση ακριβείας στην επιστήμη της Χημείας.
Το 1772, ο Lavoisier άρχισε να εξετάζει τον ρόλο του αέρα στην καύση. Με καύση διάφορων υλικών (P, S, Pb) σε κλειστά δοχεία και προσεκτικές ζυγίσεις (η ακρίβεια ζύγισης που είχε πετύχει ήταν 0,5 mg) διατύπωσε τη σωστή άποψη ότι το υλικό που καίγεται δεν αποβάλλει φλογιστόν, αλλά ενώνεται με ένα μέρος του αέρα, δηλαδή οξειδώνεται δεσμεύοντας το οξυγόνο.
Αργότερα, ο Lavoisier κατέληξε στο συμπέρασμα ότι ο αέρας ήταν μίγμα αερίων, όπου το 20% ήταν ένα αέριο, που το ονόμασε οξυγόνο (oxygenium), χρήσιμο στην καύση, ενώ το υπόλοιπο ήταν ένα αέριο που δεν μπορούσε να διατηρήσει την καύση. Η ονομασία που του έδωσε οφειλόταν στην εσφαλμένη αντίληψη της εποχής, ότι αποτελεί απαραίτητο συστατικό όλων των οξέων, δηλαδή ότι είναι το στοιχείο που "παράγει οξέα".
 |
|
|
Διεξαγωγή πειράματος στο εργαστήριο του Lavoisier πάνω στην ανθρώπινη αναπνοή (σκίτσο της Marie-Anne Lavoisier, που φαίνεται δεξιά να κρατά σημειώσεις). O Lavoisier, χάρις στη μεγάλη περιουσία του, διέθετε το πλέον εξοπλισμένο χημικό εργαστήριο εκείνης της εποχής. |
Ο Lavoisier υπήρξε εισηγητής και ένθερμος υποστηρικτής της αντι-φλογιστικής θεωρίας. Το 1777, παρουσίασε τη θεωρία του περί της καύσης των σωμάτων (Le mémoire sur la combustion: Mémoires del' Académie Royale des Sciences, 1777, pp. 592-600) σύμφωνα με την οποία η καύση δεν ήταν παρά η ένωση των σωμάτων με το οξυγόνο. Αυτή η θεωρία του Lavoisier ήταν η αρχή του τέλους της φλογιστικής θεωρίας.
Σύντομα, το φλογιστόν δεν είχε πλέον θέση στη θεωρία και σταδιακά τέθηκε στο περιθώριο, παρά το ότι μερικοί αξιόλογοι ερευνητές της εποχής, όπως ο Pristley, συνέχισαν να το θεωρούν θεμέλιο της χημικής θεωρίας. Η φλογιστική θεωρία, παρά τις αντιφάσεις της, διατηρήθηκε για λίγα ακόμη χρόνια διότι εξυπηρετούσε κυρίως ιδεολογικές αντιλήψεις μερικών γνωστών επιστημόνων της εποχής.
Ο Lavoisier, μετά από προσεκτικές μετρήσεις διαπίστωσε ότι δεν υπεισέρχεται κάποια απώλεια της μάζας μετά από μια χημική αντίδραση και έτσι διατύπωσε πρώτος τον βασικό νόμο της Χημείας, τον νόμο διατήρησης της μάζας.
Το 1787, ο Lavoisier με το βιβλίο του Méthode de Nomenclature Chimique καθιέρωσε ένα μεθοδικό και συστηματικό τρόπο ονοματοδοσίας των χημικών στοιχείων. Το 1789 δημοσίευσε το πρώτο βασικό εγχειρίδιο Χημείας το Traité Elémentaire de Chimie.
Ο Lavoisier, αν και ενεργός υποστηρικτής της Γαλλικής επανάστασης και παρά τις συμβουλές και τις υπηρεσίες σε οικονομικά θέματα που είχε προσφέρει στις επαναστατικές κυβερνήσεις, αφενός μεν λόγω της αριστοκρατικής του καταγωγής, αφετέρου λόγω της άτυχης επιλογής του να ασχοληθεί επαγγελματικά με μια ιδιωτική φοροεισπρακτική εταιρεία, συνελήφθη και καταδικάστηκε σε θάνατο κατά τα χρόνια της τρομοκρατίας του Ροβεσπιέρου. 'Ισως, η μοίρα του Lavoisier να είχε σφραγισθεί από κάποια χρόνια πριν, όταν απέρριψε ως απαράδεκτη μια "επιστημονική" εργασία του Jean-Paul Marat, στερώντας του έτσι την περιζήτητη θέση μέλους της Γαλλικής Ακαδημίας των Επιστημών. Ο Marat υπήρξε ένας από τους φανατικότερους ηγέτες της Γαλλικής Επανάστασης κατά την περίοδο της τρομοκρατίας, ο οποίος όμως δολοφονήθηκε στο λουτρό του από την Charlotte Corday το 1793, έναν χρόνο πριν από την εκτέλεση του Lavoisier.
'Οταν ζητήθηκε από το δικαστήριο να χαρίσει τη ζωή στον Lavoisier για να συνεχίσει τα πειράματά του, ο δικαστής απέρριψε το αίτημα με την ιστορική πλέον φράση: "Η Δημοκρατία δεν χρειάζεται ούτε επιστήμονες, ούτε χημικούς". Στις 8 Μαΐου του 1794, λίγες ώρες μετά την καταδικαστική απόφαση, ο Lavoisier καρατομήθηκε μαζί με άλλους 27 καταδικασμένους ανθρώπους. Το σώμα του ανθρώπου που θεμελίωσε τη Χημεία ρίχτηκε σε έναν κοινό τάφο. Ο μαθηματικός Lagrange σχολιάζοντας την είδηση της εκτέλεσης του Lavoisier είπε: "χρειάσθηκε μια στιγμή για να κοπεί αυτό το σπάνιο κεφάλι, αλλά και εκατό χρόνια να περάσουν δεν θα γεννηθεί άλλο αντάξιό του".
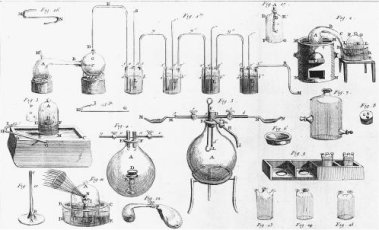 |
 |
 |
 |
|
Όργανα του εργαστηρίου του Antoine Lavoiser. O Lavoisier, χάρις στη μεγάλη περιουσία που διέθετε, είχε στη διάθεσή του το πληρέστερα εξοπλισμένο χημικό εργαστήριο της εποχής του. |
|||
11.3. Ανακάλυψη Αερίων. Σημαντικό στάδιο εξέλιξης της επιστήμης της Χημείας αποτέλεσαν οι πειραματικές προσπάθειες για την ανακάλυψη αερίων και της σύστασης του αέρα. Από το 1624 ο Φλαμανδός ιατρός Jan Baptist van Helmont (1579-1644) διαπίστωσε ότι υπάρχουν διαφορετικά αέρια με διαφορετικές ιδιότητες. Ο van Helmont ανακάλυψε το διοξείδιο του άνθρακα (CO2), ως προϊόν της καύσης ξύλου και άλλων οργανικών ενώσεων και αρχικά το ονόμασε ξυλαέριο. Το διοξείδιο του άνθρακα ονομάσθηκε ακόμη δεσμευμένος ή σταθεροποιημένος αέρας (fixed air), επειδή μπορούσε να δεσμευτεί από την άσβεστο προς ανθρακικό ασβέστιο, όπως επίσης και φλογιστικοποιημένος αέρας (phlogisticated air), ως αποτέλεσμα της απομάκρυνσης του φλογιστού από καύσιμα υλικά.
Ο van Helmont ήταν εκείνος που εισήγαγε τον όρο-λέξη gas στο επιστημονικό λεξιλόγιο για την περιγραφή των διαφόρων "ειδών" αερίων ή "πνευμάτων". Συγκεκριμένα, στις σημειώσεις που κρατούσε στη λατινική γλώσσα o van Helmont είχε γράψει: "Hunc spiritum, incognitum hactenus, novo nomine gas voco. In nominis egestate, halitum illud gas vocavi, non longe a chao veterum" (: Αυτό το πνεύμα, το μέχρι στιγμής άγνωστο, το ονομάζω με ένα νέο όνομα, gas. Ελλείψει άλλου ονόματος, αυτή την αναθυμίαση την ονόμασα gas, που δεν διαφέρει και πολύ από το χάος των αρχαίων). 'Ετσι, η κοινή αυτή πλέον λέξη σε πολλές γλώσσες (gas: αγγλικά, γερμανικά, ισπανικά, ιταλικά, gaz: γαλλικά, газа: ρωσικά), έχει Ελληνική ρίζα και προέρχεται από τη λέξη χάος.
 |
 |
Πειραματική διάταξη που χρησιμοποίησε ο Pristley για την παρασκευή οξυγόνου με θέρμανση οξειδίου του υδραργύρου |
|
Το οξείδιο του υδραργύρου υπήρξε μια από τις χημικές ουσίες-"κλειδιά" στην εξέλιξη της χημείας. Στις φωτογραφίες δείχνονται δύο αλλοτροπικές μορφές τους: Η κίτρινη (καθιζάνει με επίδραση βάσεων σε διαλύματα αλάτων του Hg(II)). Η κόκκινη παρασκευάζεται με θέρμανση του Hg στον αέρα. |
||
Τα πειράματά του van Helmont βοήθησαν τον Joseph Black και αργότερα τον Lavoisier να προτείνουν ότι ο ατμοσφαιρικός αέρας δεν είναι ένα αέριο, αλλά είναι μίγμα αερίων. Η πρόταση αυτή ήταν πολύ τολμηρή για την εποχή της, αφού βρισκόταν σε αντίθεση με την αριστοτέλεια αντίληψη, ότι ο αέρας δεν είναι μίγμα, αλλά είναι ένα από τα τέσσερα στοιχεία (γη, πυρ, αέρας, νερό).
Ο Joseph Pristley (1733-1804) παρασκεύασε, απομόνωσε και χαρακτήρισε πολλούς "αέρες", όπως: Τον νιτρώδη αέρα (nitrous air, δηλ. το NO), τον ατμό του πνεύματος του άλατος ή όξινο αέρα (vapor of spirit of salt, acid air, δηλ. το HCl), τον αλκαλικό αέρα (alkaline air, δηλ. την ΝΗ3), τον αποφλογιστικοποιημένο νιτρώδη αέρα (dephlogisticated nitrous air, δηλ. το N2O) και κυρίως τον αποφλογιστικοποιημένο αέρα (dephlogisticated air, δηλ. το Ο2). Το 1774 πραγματοποίησε το πλέον γνωστό πείραματα. Χρησιμοποιώντας ένα συγκεντρωτικό φακό θέρμανε μια ποσότητα οξειδίου υδραργύρου (διασπάται στους 350ºC προς υδράργυρο και οξυγόνο) σε ένα κλειστό δοχείο και απομόνωσε το παραγόμενο οξυγόνο, ωστόσο δεν αναγνώρισε τη στοιχειακή φύση του ως φανατικός οπαδός της φλογιστικής θεωρίας.
Το 1772, ο Pristley πρώτος παρασκεύασε το "αεριούχο νερό", δηλαδή ένα υπέρκορο διάλυμα διοξειδίου του άνθρακα (CO2) σε νερό και πρώτος διαπίστωσε την ευχάριστη και δροσιστική γεύση του. Επίσης, υπήρξε ο πρώτος ο οποίος διαπίστωσε την ικανότητα των φυτών να "φρεσκάρουν" τον αέρα που προκύπτει με καύση οργανικού υλικού, αέρα ο οποίος δεν μπορούσε πλέον να διατηρήσει τη ζωή, δηλαδή ανακάλυψε την ικανότητα των φυτών να μετατρέπουν το διοξείδιο του άνθρακα σε οξυγόνο.
Το υδρογόνο (H2) ανακαλύφθηκε αρχικά από τον Robert Boyle, αλλά μελετήθηκε συστηματικά από τον 'Αγγλο Henry Cavendish (1731-1810) που το αποκάλεσε εύφλεκτο αέρα και κάποια εποχή ταυτίστηκε με το φλογιστόν. Ο Cavendish, επινόησε μέθοδο παραγωγής και αποθήκευσης υδρογόνου πάνω από υδράργυρο και επίσης έδειξε ότι το νερό είναι το προϊόν της εκρηκτικής αντίδρασης μεταξύ υδρογόνου και το οξυγόνου. Υπήρξε ο πρώτος που εξέτασε σχολαστικά τη σύνθεση του αέρα και κατέληξε στο συμπέρασμα ότι "ο αέρας αποτελείται κατά ένα μέρος από αποφλογιστικοποιημένο αέρα [εννοώντας το οξυγόνο] και κατά τέσσερα μέρη από φλογιστικοποιημένο αέρα [εννοώντας το άζωτο]" (1785). Ακόμη, παρατήρησε ότι μετά τη δέσμευση του οξυγόνου και του αζώτου, παρέμενε ελεύθερο το 1/120 του αρχικού όγκου αέρα. Την παρατήρηση αυτή αξιοποίησαν οι Rayleigh και Ramsay μετά από 100 χρόνια για να ανακαλύψουν αρχικά το αργόν και στη συνέχεια τα υπόλοιπα ευγενή αέρια (βλ. παρακάτω).
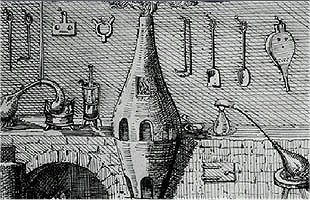 Το "ταπεινό" εργαστήριο του Scheele και κάποια από τα σκεύη που χρησιμοποιούσε στα πειράματά του [πηγή]. |
|
Ο Σουηδός φαρμακοποιός Carl Wilhelm Scheele (1742-1786) προσδιόρισε ότι ο αέρας ήταν μίγμα δύο αερίων, από τα οποία μόνο το ένα μπορούσε να συντηρήσει την καύση. Το1772, ο Scheele πρώτος παρασκεύασε καθαρό οξυγόνο με θερμική διάσπαση του οξειδίου του υδραργύρου και νιτρικών αλάτων, αλλά δεν το αναγνώρισε ως ξεχωριστό στοιχείο αν και του έδωσε το όνομα πύρινος αέρας (fire air). Αν και o Scheele απομόνωσε το οξυγόνο δύο χρόνια πριν από τον Pristley και αρκετά πριν από τον Lavoisier, η ανακάλυψη του οξυγόνου συνήθως αποδίδεται στον Pristley, επειδή προηγήθηκε στη δημοσίευση των πειραματικών αποτελεσμάτων.
Αργότερα, ο Scheele παρασκεύασε και μελέτησε το υδροφθόριο (HF), το υδρόθειο (H2S), το υδροκυάνιο (HCN), την αμμωνία (NH3), το διοξείδιο του θείου (SO2) και το υδροχλώριο (HCl). Το 1774, με αντίδραση πυρολουσίτη (MnO2) με υδροχλωρικό οξύ παρήγαγε και απομόνωσε για πρώτη φορά το κιτρινοπράσινο αέριο χλώριο (Cl2), το οποίο ονόμασε αποφλογιστικοποιημένο μουριατικό οξύ (μουριατικό οξύ: υδροχλωρικό οξύ), που εσφαλμένα πίστευε πως επρόκειτο για ένωση του οξυγόνου. Πρώτος μάλιστα διαπίστωσε τις λευκαντικές ιδιότητας του χλωρίου.
Η συνεισφορά του Scheele στη Χημεία υπήρξε μεγάλη. Πέραν από την ανακάλυψη του οξυγόνου και του χλωρίου, ανακάλυψε ακόμη τα στοιχεία βάριο (1774), μαγγάνιο (1774), μολυβδαίνιο (1778) και βολφράμιο (1781). Θα πρέπει να σημειωθεί ότι ο Scheele δεν σπούδασε ποτέ κάποια επιστήμη, αλλά ξεκίνησε σαν βοηθός φαρμακοποιού από την ηλικία των 15 ετών.
Παρά το ότι ο Scheele δεν είχε στη διάθεσή του τα εξελιγμένα και πανάκριβα χημικά όργανα που διέθετε ο Lavoisier, με τη δουλειά του συνεισέφερε στην κατάρριψη της φλογιστικής θεωρίας χωρίς ο ίδιος να καταφερθεί ποτέ κατά της θεωρίας αυτής. Ο θάνατός του σε σχετικά μικρή ηλικία (44 ετών) υπήρξε αποτέλεσμα της συνεχούς ενασχόλησής του με τοξικές ενώσεις βαρέων μετάλλων (μολύβδου, υδραργύρου), η επικινδυνότητα των οποίων δεν είχε ακόμη εκτιμηθεί σωστά. Αξίζει να σημειωθεί ότι ο δύστυχος Scheele θεωρούσε επιστημονικό καθήκον του να περιγράψει με ακρίβεια τη γεύση και την οσμή κάθε ουσίας που εξέταζε.
Το άζωτο ανακαλύφθηκε αργότερα από τον μαθητή του Black, Daniel Rutherford (1749-1819), ο οποίος παρατήρησε ότι μετά από μια καύση σε κλειστό δοχείο, παραμένει ένα άγνωστο αέριο που δεν μπορούσε να συντηρήσει την καύση, αλλά και τη ζωή οργανισμών (α+ζωή). Το αέριο αυτό το ονόμασε "βλαβερό αέρα" (mephitic air) ή "φλογιστικοποιημένο αέρα".
 |
 |
 |
 |
|
(1579-1644) |
(1731-1810) |
(1742-1786) |
(1749-1819) |
Οι ανακαλύψεις αυτές ήταν εξαιρετικής σημασίας για την εποχή τους. Παρά τις δυσκολίες να κατανοήσουν τη φύση των στοιχείων και τις διαφορές μεταξύ των χημικών ενώσων και των μιγμάτων τους, οι πειραματιστές της εποχής εκείνης έκαναν μεγάλες προόδους στην κατανόηση των βασικών αρχών της Χημείας. 'Ηταν μια εποχή κατά την οποία επικρατούσε πλήθος εσφαλμένων θεωριών λόγω της ιδεαλιστικής αντίληψης των πραγμάτων και του θρησκευτικού δογματισμού. Χρειαζόταν ένας Lavoisier, οι κορυφαίες ανακαλύψεις του οποίου καθιέρωσαν τη Χημεία ως θετική επιστήμη και διέλυσαν πολλούς "επιστημονικούς μύθους".
Πηγές από το διαδίκτυο: (1) "Phlogiston Theory" (Jim Loy, 1996). (2) "Considerations on the Doctrine of Phlogiston and the Decomposition of Water" (Joseph Priestly, 1796). (3) "Death of Lavoisier" (John H. Lienhard).

Σύμβολα χημικών ουσιών που χρησιμοποιούσε ο Scheele στα χειρόγραφά του (περισσότερα)
 |
 |
 |
 |
 |
|
(1754-1806) |
(1748-1822) |
(1766-1844) |
(1776-1856) |
(1779-1848) |
 |
 |
 |
|
Αριστερά - κέντρο: 'Ατομα και μόρια όπως απεικονίζονται στο σύγγραμμα του Dalton "A New System of Chemical Philosophy" (1808) (αποσπάσματα). Δεξιά: Το ιστορικό σύγγραμμα του Berzelius (1808), όπου για πρώτη φορά εμφανίζονται πολλά από τα σημερινά σύμβολα των χημικών στοιχείων. |
||
12. 18ος - 19ος αιώνας: Ατομική Θεωρία και Περιοδικός Πίνακας
Στις αρχές του 18ου αιώνα άρχισε να διαμορφώνεται η πεποίθηση μεταξύ των χημικών της εποχής εκείνης ότι οι χημικές ενώσεις έχουν συγκεκριμένη σύνθεση και ότι αποτελούνται από συγκεκριμένα στοιχεία και σε σταθερές αναλογίες μεταξύ τους ("νόμος καθορισμένων αναλογιών"). Ο κύριος υποστηρικτής αυτής της ιδέας υπήρξε ο Γάλλος χημικός Joseph Louis Proust (1754-1806).
Το 1797, ο Γάλλος χημικός Claude Louis Berthollet (1748-1822), απέρριψε τον νόμο των καθορισμένων αναλογιών, θεωρώντας ότι η αναλογία των στοιχείων σε μια ένωση καθορίζεται από την αναλογία υπό την οποία λαμβάνονται τα αντιδρώντα. Η άρνηση του Berthollet (ο οποίος βρισκόταν σε μόνιμη επιστημονική διαμάχη με τον Proust), η γνώμη του οποίου μέτραγε πολύ στην επιστημονική κοινότητα, καθυστέρησε την αποδοχή της ορθής θεωρίας του Proust.
|
|
|
|
Νόμος του Avogadro: "ίσοι όγκοι αερίων, κάτω από την ίδια πίεση και θερμοκρασία, περιέχουν ίσο αριθμό μορίων" |
Ο Amedeo Avogardo (1776-1856)πειραματιζόμενος με αντιδρώντα αέρια [πηγή]. |
Το θέμα ξεκαθάρισε σε μεγάλο βαθμό το 1808 με τη διατύπωση της ατομικής θεωρίας του 'Αγγλου χημικού (αλλά και φυσικού, μαθηματικού και μετεωρολόγου) John Dalton (1766-1844). Ο Dalton υποστήριξε ότι τα στοιχεία αποτελούνται από μικροσκοπικά, άτμητα και άφθαρτα σωματίδια, συνδυασμοί των οποίων δημιουργούν τις διάφορες ουσίες. Στο κάθε στοιχείο ο Dalton είχε αποδώσει ένα σύμβολο.
Η θεωρία του Dalton, στην ουσία της, βασίζεται στην ιδέα της ατομικής θεωρίας του Δημόκριτου, και είχε σημαντική επίδραση στην εξέλιξη της Χημείας, αφού άρχισαν πλέον να αποδίδονται συγκεκριμένες ατομικές μάζες (παλιότερα: ατομικά βάρη) στα διάφορα στοιχεία. 'Ολα αυτά περιγράφονται στο διάσημο βιβλίο του Dalton Νέο Σύστημα της Χημικής Φιλοσοφίας (A New System of Chemical Philosophy).
Τιμητικά, το όνομα του Dalton διατηρείται στις μονάδες μοριακής μάζας κυρίως μεγαλομοριακών ενώσεων, π.χ. η πρωτεΐνη αιμοσφαιρίνη Α αναφέρεται ότι έχει μοριακή μάζα 68 kilodalton (kDa). Αυτό που ίσως είναι λιγότερο γνωστό για τον Dalton, είναι οι μελέτες του πάνω στην ασθένεια της αχρωματοψίας, από έναν τύπο της οποίας έπασχε και ο ίδιος. Η ασθένεια αυτή προς τιμήν του ονομάστηκε δαλτωνισμός.
Κατά τον 19ο αιώνα παρατηρήθηκε σε έντονο βαθμό το εξής: Διάσημοι χημικοί, που προσέφεραν πολλά στη Χημεία, παρέμεναν δογματικά προσκολλημένοι σε παλιές θεωρίες και πολεμούσαν σφοδρότατα κάθε είδους "νεωτερισμό", σε κάποιο βαθμό δικαιολογημένα αφού δεν ήταν και λίγες οι ανοησίες που είχαν διατυπωθεί. Συχνά μάλιστα συνέβαινε προς το τέλος της σταδιοδρομίας τους αλλά και της ίδιας τους της ζωής, να βλέπουν θεωρίες που υπερασπίστηκαν με πάθος, να καταρρίπτονται και μάλιστα από μαθητές τους των οποίων συχνά αμφισβητούσαν την επιστημοσύνη.
Κατά τη διάρκεια του 19ου αιώνα οι χημικοί είχαν χωρισθεί σε δύο αντίπαλα στρατόπεδα γύρω από την ατομική θεωρία. Ο διάσημος Ιταλός χημικός Amedeo Avogardo (1776-1856) και ο Αυστριακός φυσικός Ludwig Edward Boltzmann (1844-1906) υπήρξαν ένθερμοι υποστηρικτές της ατομικής θεωρίας και συνεισέφεραν σε αυτήν με ανακαλύψεις στον τομέα των αερίων. Εναντίον της θεωρίας ήταν οι χημικοί Wilhelm Ostwald και Ernst Mach. O Avogadro πρότεινε τον διάσημο νόμο που φέρει το όνομά του, ότι "ίσοι όγκοι αερίων, κάτω από την ίδια πίεση και θερμοκρασία, περιέχουν ίσο αριθμό μορίων".
 |
 |
|
Ludwig Edward Boltzmann (1844-1906). Οι μελέτες του Boltzmann γεφύρωσαν τον μικρόκοσμο των ατόμων και των μορίων με τις μακροσκοπικές ιδιότητές τους, όπως η θερμοκρασία. Οι θεωρίες του βοήθησαν στην πρόβλεψη της επίδρασης της θερμοκρασίας στην ταχύτητα των χημικών αντιδράσεων. |
|
Το 1909, προς τιμήν του Avogadro προτάθηκε από τον Γάλλο φυσικό Jean Perrin και ονομάσθηκε σταθερά ή αριθμός Avogadro (NA), ο αριθμός των μορίων που περιέχονται σε ένα γραμμομόριο μιας χημικής ένωσης. Η πρώτη σχετικώς ακριβής τιμή του αριθμού Avogadro υπολογίσθηκε μετά τον πειραματικό προσδιορισμό του φορτίου του ηλεκτρονίου από τον Αμερικάνο φυσικό Robert Millikan το 1910, με βάση τη σχέση: (Σταθερά Faraday) = (Αριθμός Avogadro) x (Φορτίο ηλεκτρονίου).
Το 1808, ο διάσημος Σουηδός χημικός Jöns Jakob Berzelius (1779-1848) στο βιβλίο του Lãrbok I Kemien, πρότεινε τα σημερινά χημικά σύμβολα των στοιχείων (όσων είχαν μέχρι τότε βρεθεί) σε αντικατάσταση των γεωμετρικών συμβόλων, που χρησιμοποιούσε o Dalton. Ακόμη, καθιέρωσε τον σημερινό τρόπο αναγραφής των χημικών αντιδράσεων (μια μικρή διαφορά ήταν ότι ο αριθμός των ατόμων ενός στοιχείου σε ένα μόριο γραφόταν ως άνω δείκτης και όχι ως κάτω δείκτης), καθώς και την έννοια των ατομικών βαρών των στοιχείων.
Ο Berzelius θεωρούσε ότι όλες οι χημικές ενώσεις αποτελούνται από δύο ομάδες ατόμων με αντίθετα σθένη και προσπάθησε να προσδιορίσει τους χημικούς τύπους των σύνθετων σωμάτων καθώς και τα ατομικά βάρη των στοιχείων. Επίσης, ανακάλυψε και μελέτησε αρκετά χημικά στοιχεία όπως τα: δημήτριο (1803), λίθιο, σελήνιο (1817), πυρίτιο (1824), ταντάλιο (1825), θόριο (1828), ζιρκόνιο (1829), βανάδιο (1830).
Ο Berzelius ήταν αυτός που καθιέρωσε στη Χημεία όρους με ελληνικές ρίζες, που περιγράφουν βασικά χημικά φαινόμενα όπως, π.χ. η κατάλυση, ο πολυμερισμός, ο ισομερισμός και αλλοτροπισμός. Η προσφορά του Berzelius στη Χημεία υπήρξε τεράστια, παρά το γεγονός ότι προς το τέλος της ζωής του είδε πολλές από τις θεωρίες, τις οποίες υποστήριζε με φανατισμό, να καταρρίπτονται από τη νεότερη γενιά χημικών, πολλούς από τους οποίους περιφρονούσε. 'Οπως ο Pristley υπήρξε μέχρι τέλους φανατικός οπαδός της φλογιστικής θεωρίας, έτσι και ο Berzelius υπήρξε φανατικός οπαδός της βιταλιστικής θεωρίας, σύμφωνα με την οι οποία οργανικές ενώσεις μπορούσαν να παραχθούν μόνο με τη μεσολάβηση ζώντων οργανισμών.
Για αρκετές δεκαετίες η ανακάλυψη νέων στοιχείων υπήρξε ένα σημαντικό γεγονός στη Χημεία και ο αριθμός των χημικών στοιχείων αυξάνονταν, με μέσο ρυθμό ενός στοιχείου για κάθε έτος κατά την περίοδο 1840-1870. Καθώς οι φυσικές και οι χημικές ιδιότητες των στοιχείων άρχισαν να γίνονται γνωστά, ορισμένοι χημικοί άρχισαν να παρατηρούν κάποιες ομοιότητές τους κατά ομάδες, όπως και κάποια "περιοδικότητα" στις ιδιότητές, όταν τα στοιχεία εξετάζονταν κατά σειρά αυξανόμενης ατομικής μάζας. 'Οπως είναι γνωστό, εκείνη την εποχή δεν υπήρχε η παραμικρή ιδέα για την ηλεκτρονιακή δομή των ατόμων.
 |
 |
 |
 |
| Robert Bunsen (1811-1899) | Gustav Kirchhoff (1824-1887) | Μια από τις αρχικές μορφές φασματοσκόπιου, εφεύρεση των Bunsen και Kirchhoff (1859) |
Τυπικά φάσματα εκπομπής διαφόρων στοιχείων, όπως φαίνονται στο φασματοσκόπιο των Bunsen και Kirchhoff. |
Το 1864, ο Γερμανός Lothar Meyer (1830-1895) ήταν ο πρώτος που ασχολήθηκε με την κατάταξη των στοιχείων σε μια πρωταρχική μορφή "περιοδικού πίνακα", αλλά υπήρχαν και σημαντικά κενά σε πολλά σημεία του. Πέντε χρόνια αργότερα, το 1869, με το θέμα της περιοδικότητας των ιδιοτήτων των χημικών στοιχείων ασχολήθηκε ο Ρώσος χημικός Dmitri Mendeleev (1834-1907).
|
Τα δύο δραστικότατα και εύτηκτα μέταλλα της ομάδας των αλκαλίων, το ασημόχρωμο ρουβίδιο (Rb) και το ελαφρά χρυσόχρωμο καίσιο (Cs) είναι τα πρώτα στοιχεία που ανακαλύφθηκαν με φασματοσκοπικά μέσα. |
Τόσο ο Meyer, όσο και ο Mendeleev είχαν σπουδάσει υπό τον διάσημο χημικό Robert Bunsen (1811-1899). Θα πρέπει εδώ να σημειωθεί ότι ο Bunsen μαζί με τον επίσης διάσημο φυσικό Gustav Kirchhoff (1824-1887), θεωρούνται οι θεμελιωτές της φασματοσκοπίας, μέσω της οποίας ανακάλυψαν δύο ακόμη στοιχεία: το 1860 το καίσιο (Cs) και το 1861 το ρουβίδιο (Rb), που κάλυψαν δυο κενές θέσεις της 1ης ομάδας του περιοδικού πίνακα (ομάδα αλκαλίων). Το όνομά τους το οφείλουν στο χρώμα των πλέον έντονων φασματικών γραμμών εκπομπής (λατινικά, caesius: γαλάζιος, rubidus: ερυθρός).
To 1869, ο Mendeleev, αφού μελέτησε συστηματικά (τότε ήταν πλέον γνωστά 63 στοιχεία) τον πίνακα του Meyer, δημοσίευσε την κλασική εργασία του με τίτλο "Επί της σχέσης των ιδιοτήτων και των ατομικών βαρών των στοιχείων" (On the Relation of Properties to the Atomic Weights of Elements) και άρχισε να συγκεντρώνει πληροφορίες για τα κενά. Εξετάζοντας την περιοδικότητα διάφορων φυσικών και χημικών ιδιοτήτων των στοιχείων, δεν δίστασε να ισχυρισθεί ότι υπάρχουν χημικά στοιχεία τα οποία δεν είχαν ακόμη ανακαλυφθεί και μάλιστα ήταν σε θέση να προβλέψει τις φυσικές και χημικές ιδιότητες των στοιχείων αυτών, όπως και ορισμένων ενώσεών τους. 'Ετσι, π.χ. τα στοιχεία που βρίσκονταν στον πίνακά του κάτω από το βόριο, το αργίλιο και το πυρίτιο, δεν είχαν ακόμη ανακαλυφθεί. Μάλιστα τους είχε δώσει τα "προσωρινά" ονόματα: εκα-βόριο, εκα-αργίλιο και εκα-πυρίτιο και κατάφερε να προβλέψει με αξιόλογη ακρίβεια τις φυσικές και χημικές ιδιότητές τους, όπως και των οξειδίων τους και των χλωριούχων ενώσεών τους. Με τα προθήματα eka-, dvi- και tri- (στα σανσκριτικά: ένα, δύο, τρία) δήλωνε τον αριθμό θέσεων κάτω από το στοιχείο που ακολουθεί (π.χ. εκα-πυρίτιο: το στοιχείο που βρίσκεται μία θέση κάτω από το πυρίτιο). 'Οταν αργότερα ανακαλύφθηκαν τα στοιχεία αυτά (σκάνδιο, γάλλιο και γερμάνιο), οι προβλέψεις του Mendeleev αποδείχθηκαν εξαιρετικά ακριβείς. Αυτές ακριβώς οι προβλέψεις ξεχώρισαν τον Mendeleev απ' όσους ασχολήθηκαν με το θέμα αυτό και κατέστησαν το όνομά του συνώνυμο με τον περιοδικό πίνακα.
Για να εκτιμηθεί το μέγεθος του επιτεύγματος της σχεδίασης του πρώτου περιοδικού πίνακα, θα πρέπει να ληφθεί υπόψη το γεγονός ότι την εποχή εκείνη οι επιστήμονες είχαν πλήρη άγνοια ως προς τη δομή των ατόμων και ως προς την ύπαρξη των ηλεκτρονίων και φυσικά αγνοούσαν την έννοια του ατομικού αριθμού, που καθιερώθηκε 50 χρόνια αργότερα.
Οι Mendeleev και Meyer βραβεύθηκαν ισάξια για το επιστημονικό αυτό επίτευγμα από τη Royal Society της Μ. Βρετανίας (το 1883) με το τιμητικό για εκείνη την εποχή Davy Medal. Ο Mendeleev τιμήθηκε επίσης το 1955, όταν το ραδιενεργό στοιχείο με ατομικό αριθμό 101 ονομάστηκε Μενδελέβιο (Mendelevium, Md).
 |
 |
 |
| Lothar Meyer (1830-1895) | Dmitri Mendeleev (1834-1907) | Οι 5 πρώτες περίοδοι του Περιοδικού Πίνακα του Mendeleev (με αστερίσκο σημειώνονται οι κενές θέσεις στοιχείων των οποίων προέβλεψε τις ιδιότητες) |

Λίγα από τα πολλά γραμματόσημα που εκδόθηκαν προς τιμήν του Mendeleev.
 |
 |
|
| Γερμανικό γραμματόσημο που εκδόθηκε κατά την εκατοστή επέτειο του θανάτου του Friedrich Wöhler. |
(1800-1882) |
13. Οργανική Χημεία και ο Βιταλισμός
Μετά την επικράτηση της ατομικής θεωρίας και των ποσοτικών σχέσεων που συνέδεαν τα χημικά στοιχεία στις διάφορες ενώσεις τους, η Χημεία έγινε επιστημονικός κλάδος με πειραματικά τεκμηριωμένο περιεχόμενο. Παρ' όλα αυτά ακόμη και μέχρι σχεδόν τα μέσα του 19ου αιώνα επικρατούσαν ακόμη κάποιες "βιταλιστικές" απόψεις, που είχαν τις βάσεις τους σε αριστοτελικές θεωρίες περί ζωής. Μέχρι το 1828 υπήρχε η γενική "μεταφυσική" πεποίθηση ότι δεν είναι δυνατή η παρασκευή οργανικών ουσιών στο εργαστήριο. Για την παρασκευή τους πίστευαν πως χρειαζόταν μια ζωική δύναμη (vis vitalis), μια δύναμη ακαθόριστης προέλευσης και φύσης που έδινε "ψυχή" στα οργανικά σώματα.
Παράλληλα, αρκετά διαδεδομένη ήταν και η θεωρία της αυτόματης γένεσης ή αβιογένεσης (spontaneous generation, abiogenesis), σύμφωνα με την οποία οι ζωντανοί οργανισμοί μπορούν να γεννηθούν από ανόργανη ύλη (χώμα, λάσπη, φυτική ύλη) με "θεϊκή παρέμβαση". 'Ολα αυτά ήταν αποτέλεσμα εσφαλμένης ερμηνείας της εμφάνισης μικροοργανισμών και υδρόβιων μικρών οργανισμών (σκουλήκια, σκαθάρια, κ.λπ.) στις λάσπες αγρών, όπως και κατά τη σήψη φυτικής και ζωικής ύλης.
Οι οργανικές ενώσεις που είχαν απομονωθεί από διάφορα φυσικά προϊόντα ή μετά από φυσικές διεργασίες, όπως π.χ. η αιθανόλη, το οξικό οξύ, η ακετόνη, διάφορα σάκχαρα, ήταν άφθονες. Ο μοριακός τύπος πολλών από τις ενώσεις αυτές ήταν σε γενικές γραμμές γνωστός, ωστόσο το δόγμα της ζωικής δύναμης εκ των προτέρων απέτρεπε κάθε απόπειρα σύνθεσής τους. Είναι προφανές μια θεωρία αυτού του είδους από μόνη της αποτελούσε εμπόδιο στην ανάπτυξη της Οργανικής Χημείας.
Το 1828, ο νεαρός Γερμανός χημικός Friedrich Wöhler διαπίστωσε ότι μπορούσε να παρασκευάσει στο εργαστήριο μια οργανική ένωση. Αυτό το πέτυχε τυχαία, όταν με θέρμανση κυανικού αμμωνίου (NH4NCO) παρασκεύασε την ουρία (H2NCONH2), η οποία είναι οργανική ένωση που παράγεται σε αφθονία από ζώντες οργανισμούς. Η αλληλουχία των αντιδράσεων που χρησιμοποίησε ο Wöhler ήταν:
|
Marcellin Berthelot (1827-1907). Συνέθεσε πλήθος οργανικών ενώσεων δίνοντας τη χαριστική βολή στη θεωρία του βιταλισμού. |
AgΝCΟ
+ NH4Cl
![]() AgCl + NH4NCO NH4NCO
AgCl + NH4NCO NH4NCO
![]() H2NCONH2.
H2NCONH2.
Είναι χαρακτηριστικό αυτό το απόσπασμα από το "θριαμβευτικό" γράμμα που έστειλε στον σεβαστό καθηγητή του Berzelius, ο οποίος υπήρξε ένθερμος οπαδός του βιταλισμού: "Πρέπει να σας πω ότι μπορώ να παρασκευάσω ουρία χωρίς να χρειαστώ νεφρά, ούτε άνθρωπο, ούτε σκύλο. Το κυανικό αμμώνιο είναι η ουρία!".
Ακολούθησαν βέβαια αντιδράσεις από τον Berzelius και άλλους υποστηρικτές του βιταλισμού και αιτιάσεις του τύπου "η ουρία βρίσκεται στο μεταίχμιο μεταξύ οργανικών και ανόργανων ενώσεων" ή ότι το κυανικό αμμώνιο είναι περισσότερο μια οργανική ένωση, παρά ανόργανη, αφού παρασκευάζεται με οξείδωση των κυανιούχων, που και αυτά είναι προϊόν επεξεργασίας υλικών του ζωικού κόσμου (κέρατα, οπλές ζώων). Ωστόσο, το ρήγμα στη βιταλιστική θεωρία είχε ήδη επέλθει. Μια ακόμη εσφαλμένη θεωρία "τροχοπέδη" στην εξέλιξη της επιστήμης της Χημείας καταρρίφθηκε. Αφού παρασκευάσθηκε η ουρία, γιατί όχι και οποιαδήποτε άλλη οργανική ένωση; 'Ετσι, το έτος 1828 θεωρείται πλέον το έτος έναρξης της Οργανικής Σύνθεσης. Στις μέρες μας, ο "παραδοσιακός" διαχωρισμός της Χημείας σε Ανόργανη και Οργανική εξακολουθεί να υφίσταται, αλλά καθαρά και μόνο για λόγους συστηματικότερης εκπαίδευσης μαθητών και φοιτητών στην επιστήμη της Χημείας.
Τη χαριστική βολή στη θεωρία του βιταλισμού έδωσε ο διάσημος Γάλλος οργανικός χημικός και πολιτικός Marcellin Berthelot (1827-1907), ο οποίος συνέθεσε μεγάλο αριθμό οργανικών ενώσεων, όπως υδρογονάνθρακες, λιπαρά οξέα, υδατάνθρακες κ.α., ξεκινώντας από ανόργανες πρώτες ύλες. Το 1860, ο Berthelot ανακάλυψε εκ νέου το ακετυλένιο (C2H2) στο οποίο έδωσε και το όνομα αυτό. Το ακετυλένιο είχε αναφερθεί για πρώτη φορά από τον Davy το 1836, ο οποίος το είχε ονομάσει "ενανθρακωμένο υδρογόνο (carburated hydrogen). Ο Berthelot συνέθεσε το ακετυλένιο με απευθείας ένωση του υδρογόνου με άνθρακα με διαβίβαση υδρογόνου μέσω ηλεκτρικού τόξου άνθρακα (βολταϊκού τόξου). Το ακετυλένιο παραδοσιακά θεωρείται ως "συνδετικός κρίκος" ανόργανου και οργανικού κόσμου, αφού αποτελεί την πρώτη ύλη από την οποία μπορεί να πραγματοποιηθεί η σύνθεση πλήθους οργανικών ενώσεων.
Ο Berthelot ασχολήθηκε επίσης με την ιστορία της Χημείας. Το 1869, με αφορμή μια επίσκεψή του στην Αίγυπτο με την ευκαιρία των εγκαινίων της διώρυγας του Σουέζ και χάρις στις γνώσεις του στην Ελληνική γλώσσα μελέτησε και μετέφρασε πολλά αδημοσίευτα αλχημιστικά χειρόγραφα.
 |
 |
 |
|
Αριστερά: Ο Jean Louis Pasteur (1822-1895) πειραματιζόμενος με τις περίφημες φιάλες" με λαιμό κύκνου" χάρις στις οποίες κατέρριψε τη θεωρία της "αυτόματης γέννησης". Μέσον: Ο Pasteur έβρασε τον ζωμό σε μια φιάλη και στη συνέχεια έδωσε στο λαιμό το σχήμα S ("λαιμός κύκνου") με τη βοήθεια φλόγας. Αυτό αποτρέπει την εισαγωγή μικροοργανισμών του αέρα στη φιάλη, αλλά επιτρέπει τη μερική ανταλλαγή αέρα. 'Οταν ο "λαιμός κύκνου" έσπαζε, άρχιζε η ανάπτυξη μικροοργανισμών. Το θόλωμα στο ζωμό είναι ένδειξη ανάπτυξης μικροοργανισμών στον αρχικά διαυγή ζωμό κρέατος (περισσότερα). Δεξιά: Οι δύο κατοπτρικές μορφές κρυστάλλων του μικτού άλατος του D,L-τρυγικού οξέος ("ρακεμικού οξέος") με αμμώνιο και νάτριο, που διαχώρισε ο Pasteur με το χέρι και με απλή οπτική παρατήρηση (περισσότερα εδώ και εδώ). |
||
Το επόμενο σημαντικό θέμα που αντιμετωπίστηκε ήταν το θέμα της αυτόματης γένεσης των ζωντανών ειδών. Το θέμα αυτό είχε επηρεάσει αρνητικά την πρόοδο της βιοχημείας και της βιολογίας αλλά και άλλων επιστημών. Μάλιστα είχε επηρεάσει επιστήμονες και ιδεαλιστές φιλόσοφους (όπως ο Καντ, ο Χέγκελ) που είχαν συμβάλλει με σπουδαίες ανακαλύψεις. Τελικά, το θέμα έγινε τόσο σημαντικό, ώστε η Γαλλική 'Ακαδημία Επιστημών προκήρυξε βραβείο για τον επιστήμονα που θα κατόρθωνε με τεκμηριωμένα πειράματα να δείξει τι ακριβώς ισχύει.
Το βραβείο κέρδισε ο Γάλλος χημικός-μικροβιολόγος Jean Louis Pasteur (1822-1895) με τα απλά και ευφυή πειράματα που διεξήγαγε κατά το 1862-63. Ο Pasteur έδειξε ότι ζωμός κρέατος, που έχει βραστεί καλά και έχει προφυλαχθεί από μικροοργανισμούς του αέρα (χάρις σε φιάλες ειδικής κατασκευής που απέκλειαν την είσοδο αέρα) ήταν αδύνατο να αναπτυχθούν μικρόβια και άλλοι μικροοργανισμοί και μπορούσε ο ζωμός να μείνει αναλλοίωτος (και μάλιστα, όπως αποδείχθηκε, για χρόνια). Με αυτό το απλό πείραμα, που έμεινε στην ιστορία της Επιστήμης ως το πείραμα με τη φιάλη με "λαιμό κύκνου" ("swan neck" flask experiment), ο Pasteur έδειξε ότι αυτόματη γένεση ζωής δεν υπάρχει, κλείνοντας δια παντός ένα ακόμη θέμα που ενέπλεκε την επιστήμη με παραδοξολογίες μυστικιστικού χαρακτήρα.
Το 1848, είχε προηγηθεί η επίλυση ενός άλλου χημικού προβλήματος από τον Pasteur, όταν ήταν ακόμη μεταπτυχιακός φοιτητής. Είχε διαπιστωθεί ότι τρυγικό οξύ που λαμβανόταν από φυσικά προϊόντα (το L(+)-τρυγικό οξύ) είχε επακριβώς τις ίδιες χημικές ιδιότητες με το συνθετικά παρασκευαζόμενο τρυγικό οξύ και το "παρατρυγικό οξύ" ή "σταφυλικό" ή "ρακεμικό" (racemic) οξύ (το DL-τρυγικό οξύ), το οποίο μπορούσε να ληφθεί επίσης -κάτω υπό ορισμένες συνθήκες- και ως φυσικό προϊόν κατά τη ζύμωση του γλεύκους. Ωστόσο, το πρώτο έστρεφε το επίπεδο πόλωσης φωτός σε αντίθεση με το δεύτερο, που εμφανιζόταν ως "οπτικώς ανενεργό". Να σημειωθεί εδώ ότι το επίθετο "ρακεμικό" επεκτάθηκε αργότερα σε κάθε ισομοριακό μίγμα οπτικών αντιπόδων μιας ένωσης, αρχικά όμως αφορούσε το οπτικώς ανενεργό τρυγικό οξύ, δηλ. το DL-τρυγικό οξύ.

Λίγα από τα πολλά γραμματόσημα που εκδόθηκαν προς τιμήν του Louis Pasteur.
O Pasteur, εξοπλισμένος με ένα μεγεθυντικό φακό, ένα τσιμπιδάκι και με μεγάλη υπομονή, κατάφερε να διαχωρίσει κρυστάλλους του μικτού άλατος του DL-τρυγικού οξέος με αμμώνιο και νάτριο, το οποίο εμφανιζόταν ως οπτικώς ανενεργό, σε δύο "σωρούς", ανάλογα με τη μορφή τους (η μία κατοπτρική της άλλης). Στη συνέχεια, διαπίστωσε ότι διαλύματα ίσης συγκέντρωσης των δύο διαφορετικών κρυστάλλων είχαν ακριβώς αντίθετες στροφικές ικανότητες, ενώ ισομοριακό μίγμα τους δεν παρουσίαζε στροφική ικανότητα. 'Ετσι, ο Pasteur έδειξε ότι το ρακεμικό οξύ αποτελείται από δύο "οπτικούς αντίποδες", γεγονός το οποί υπήρξε η πρώτη απόδειξη ύπαρξης εναντιομερών (χειρόμορφων) ενώσεων. Να σημειωθεί ότι τότε απολύτως τίποτα δεν ήταν γνωστό για τη στερεοχημεία των ενώσεων του άνθρακα, την τετραεδρική διάταξη των δεσμών του και φυσικά για τα D-, L- ή DL-ισομερή.
Ο Pasteur στάθηκε τυχερός
διότι ειδικά το μικτό άλας του DL-τρυγικού οξέος που χρησιμοποίησε, είναι μια από τις λίγες ρακεμικές ουσίες
οι οποίες
μπορούν να διαχωριστούν αυθόρμητα σε οπτικούς αντίποδες κατά την κρυστάλλωση. Επίσης
υπήρξε τυχερός διότι διεξήγαγε τα πειράματά του στο ψυχρό Παρίσι, αφού ο διαχωρισμός του
άλατος στις δύο εναντιομερείς κρυσταλλικές μορφές συμβαίνει σε θερμοκρασίες
κάτω από τους 26ºC. Ωστόσο, όπως είχε πει ο ίδιος: "Στον χώρο των παρατηρήσεων, η τύχη ευνοεί τα προετοιμασμένα μυαλά"
(Dans les champs
de l'
 |
 |
|
Το κανονικό τετράεδρο των απλών δεσμών του άνθρακα (μόριο μεθανίου). Δεξιά δείχνεται μια ομάδα από τα τετράεδρα από χαρτόνι, που χρησιμοποιούσε ο ίδιος ο van't Hoff. |
|
14. Οργανική Χημεία, Χημικοί Δεσμοί του 'Ανθρακα και Οργανικές Ενώσεις
Η Οργανική Χημεία έχει ως αντικείμενο μελέτης τις ενώσεις του άνθρακα. Ο άνθρακας παρουσιάζει κάποιες ξεχωριστές ιδιότητες σε σχέση με τα άλλα στοιχεία. Είναι το μοναδικό στοιχείο του οποίου τα άτομα μπορούν να σχηματίσουν δεσμούς μεταξύ τους δημιουργώντας επιμήκεις ανθρακικές αλυσίδες και δακτυλίους. Ο άνθρακας έχει τη δυνατότητα να σχηματίζει μια τεράστια ποικιλία χημικών ενώσεων, από το απλό μεθάνιο μέχρι τις πρωτεΐνες και τα νουκλεϊνικά οξέα με μοριακά μάζες της τάξης μερικών εκατομμυρίων. Αυτός είναι και ο λόγος που οι οργανικές ενώσεις είναι τα κύρια συστατικά μόρια των ζωντανών οργανισμών. Αλλά και η βιομηχανική επανάσταση δημιούργησε μεγάλο αριθμό χημικών βιομηχανιών με βάση τις οργανικές ενώσεις για φάρμακα, χρώματα, πολυμερή, φυτοφάρμακα, και βιοχημικά αντιδραστήρια.
Από τα μέσα του 19ου αιώνα άρχισε η ραγδαία ανάπτυξη της Οργανική Χημείας. Οι επιστήμονες άρχισαν να ενδιαφέρονται για τις δυνάμεις και τους δεσμούς που συγκρατούν τα άτομα άνθρακα μεταξύ τους και σχηματίζουν αυτήν την τεράστια ποικιλία ενώσεων. Το 1858, ο Γερμανός χημικός August Kekulé (1829-1896) και ο Σκότος χημικός Archibald Couper (1831-1892), ανεξάρτητα ο ένας από τον άλλο, διατυπώνουν τις απόψεις τους για τις "τέσσερις μονάδες συγγένειας" ή δεσμούς του κάθε ατόμου άνθρακα. Η τετρασθένεια του άνθρακα ήταν δεδομένη και οι ενώσεις του σταθερές. Το 1865, ο Kekulé εισηγήθηκε ότι οι ανθρακικές αλυσίδες μπορούν να σχηματίσουν δακτυλίους με αναδίπλωση των δεσμών, ιδέα που ήταν αρκετά προχωρημένη για την εποχή του
Η θεωρία Kekulé για το τετρασθενές του άνθρακα ολοκληρώθηκε αργότερα με την παρέμβαση του Ολλανδού χημικού Jacobus van't Hoff (1852-1911, Nobel Χημείας του 1901) και του Joseph Le Bel (1847-1930), που επιβεβαίωναν ότι ο άνθρακας συνδέεται με άλλα τέσσερα άτομα τοποθετημένα στις 4 γωνίες ενός κανονικού τετραέδρου, με το άτομο του άνθρακα στο κέντρο του. Η πυραμιδική διάταξη φαίνεται ξεκάθαρα στην απλούστερη δυνατή περίπτωση, το μόριο μεθανίου (CH4).
Αρκετά, αργότερα οι χημικοί με μεγάλο αριθμό δεδομένων κατέληξαν οι 4 δεσμοί είναι ισοδύναμοι και σχηματίζονται με "ανάμιξη" ενός τροχιακού s και τριών τροχιακών p (υβριδισμός sp3). Ο υβριδισμός βοηθάει στον σχηματισμό 4 ισοδύναμων μοριακών τροχιακών τετραεδρικής διευθέτησης.
 |
 |
 |
|
Michael Faraday (1791-1867). Το 1825 ανακοίνωσε την ανακάλυψη του βενζολίου. |
August Kekulé (1829-1896). Το 1865 πρότεινε τη χημική δομή του βενζολίου |
Η δομή του βενζολίου που προτάθηκε από τον Kekulé. |
Η σημαντικότερη συμβολή του August Kekulé στην Οργανική Χημεία υπήρξε η θεωρία του για τη δομή του βενζολίου το 1865. Το βενζόλιο είχε απομονωθεί πριν περίπου 40 χρόνια από τον Michael Faraday (1791-1867) από ένα είδος φωταερίου ("το φορητό αέριο", προϊόν θερμικής διάσπασης ιχθυελαίων) που χρησιμοποιούσαν στη Μ. Βρετανία από τις αρχές του 19ου αιώνα. Ο Faraday υπήρξε διάσημος 'Αγγλος φυσικός και χημικός, που έγινε γνωστός για τις ανακαλύψεις στο πεδίου του ηλεκτρομαγνητισμού και της ηλεκτροχημείας.
Από τα μέσα του 19ου αιώνα ήταν γνωστό ότι το βενζόλιο είχε τον μοριακό τύπο C6H6 και παρά την εμφανέστατη "ακορεστότητά" του, παρουσιαζόταν ως μια εξαιρετικά σταθερή ένωση με σημαντικές διαφοροποιήσεις ως προς τη χημική του συμπεριφορά, σε σχέση με άλλες γνωστές ακόρεστες οργανικές ενώσεις. Οι ιδιαιτερότητες αυτές αναφέρονται ως αρωματικότητα ή αρωματικός χαρακτήρας.
Το 1865, ο Kekulé διατύπωσε την άποψη ότι το βενζόλιο αποτελείται από ένα εξαμελή δακτύλιο ανθράκων με τρεις διπλούς δεσμούς. Η ερμηνεία του ήταν ότι τρεις διπλοί δεσμοί "ταλαντώνονται" ταχύτατα μεταξύ δύο θέσεων. Η δομή αυτή γνώρισε την εποχή εκείνη πολλές επικρίσεις. Παρ' όλο που ερμήνευε ικανοποιητικά τον αριθμό των δισ-υποκατεστημένων βενζολίων, δεν μπορούσε να ερμηνεύσει την ελάχιστη δραστικότητα του βενζολίου σε σχέση με εκείνη των άλλων αλκενίων και ακόρεστων ενώσεων. Η ασυνήθιστη σταθερότητα του βενζολίου αποτέλεσε δυσεπίλυτο αίνιγμα για τους χημικούς της εποχής εκείνης.
Την απάντηση στο ερώτημα αυτό έδωσε αρκετά αργότερα η θεωρία του συντονισμού (ή μεσομέρειας), σύμφωνα με την οποία το βενζόλιο μπορεί να περιγραφεί ως ένα υβρίδιο δύο ισοδύναμων δομών, στις οποίες κάθε σύνδεση C-C αντιστοιχεί κατά μέσο όρο σε 1,5 δεσμό, δηλαδή σε μια ενδιάμεση κατάσταση μεταξύ απλού και διπλού δεσμού. Οι δομές συντονισμού διαφέρουν μόνο ως προς τις θέσεις των ηλεκτρονίων τους. Η πραγματική δομή βρίσκεται ανάμεσα στις δύο ακραίες εκδοχές.
Τελικά, η θεωρία του Kekulé για τη δομή του βενζολίου επικράτησε και οδήγησε στην υιοθέτηση ανάλογων τύπων για όλες τις αρωματικές ενώσεις. Το 1890, η "Εταιρεία των Γερμανών Χημικών" οργάνωσε ειδική τελετή, με το όνομα Benzolfest (: εορταστικές εκδηλώσεις για το βενζόλιο), για να τιμήσει τον Kekulé με την ευκαιρία της 25ης επετείου από τη δημοσίευση του πρώτου άρθρου του που πρότεινε τη δομή του βενζολίου. Στην ομιλία του, ο Kekulé αναφέρθηκε στο περίφημο "όνειρό" του (για τον "ουροβόρο όφι", πανάρχαιο αλχημιστικό σύμβολο του σύμπαντος), από το οποίο εμπνεύστηκε τη δομή του βενζολίου. Το όνειρο αυτό είναι ίσως ένα από τα ωραιότερα "παραμύθια" της χημείας (βλ. Χημική ένωση του μήνα: Βενζόλιο).
 |
 |
 |
 |
 |
|
Γραμματόσημα που εκδόθηκαν προς τιμήν του Kekulé. Ο ίδιος και το περίφημο "όνειρό του" υπήρξαν θέματα πολλών χιουμοριστικών σκίτσων. |
||||
15. Εξελίξεις στη Χημεία κατά τον 19ο αιώνα
Η Χημεία απαλλαγμένη πλέον από παραδοξολογίες του παρελθόντος, από τα μέσα του 19ου αιώνα και μετά είναι πλέον μια καθιερωμένη και κοινωνικά αποδεκτή επιστήμη, αλλά συγχρόνως και ένα "παρθένο" έδαφος, το οποίο η ανθρώπινη διανόηση είναι πλέον έτοιμη να γονιμοποιήσει. Εμφανίζεται πλέον πλήθος λαμπρών επιστημόνων, ενδεχομένως με κάποιες προκαταλήψεις από διδασκαλίες και παραδοχές του παρελθόντος, αλλά αποκλειστικά επιστημονικού και μόνο χαρακτήρα, όπως και με νέες έξοχες ιδέες που χρειάζεται κάποιος αγώνας για να έρθουν στο προσκήνιο και να γίνουν αποδεκτές. Οι ανταγωνισμοί και οι αγώνες για την "προτεραιότητα" ιδεών είναι αναπόφευκτοι και συγχρόνως αποδοτικοί.
 |
 |
 |
 |
| Ο 'Αγγλος χημικός Humphry Davy (1778-1829) μπορεί να θεωρηθεί ως ο πρώτος που εισήγαγε τον ηλεκτρισμό στη Χημεία. Πραγματοποίησε την πρώτη απομόνωση των δραστικών μετάλλων των αλκαλίων (Na, K) και των γαιαλκαλίων (Mg, Ca, Sr, Ba) με ηλεκτρόλυση τηγμένων αλάτων τους. | Αριστερά: Ηλεκτρική στήλη της εποχής του Davy αποτελούμενη από επάλληλους δίσκους Cu και Zn χωριζόμενους με χαρτόνι με διάλυμα άλατος. Δεξιά: κομμάτια νατρίου σε υγρή παραφίνη. | ||
 |
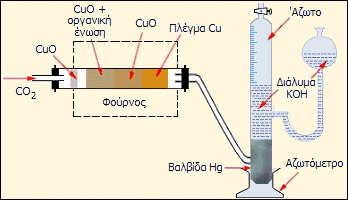 |
|
(1800-1884) |
Διάταξη προσδιορισμού αζώτου σε οργανικές ενώσεις με τη μέθοδο Duma. Χρησιμοποιήθηκε ευρύτατα για τον προσδιορισμό του αζώτου σε πλήθος αζωτούχων οργανικών ενώσεων κατά τον 19ο αιώνα. |
Ο 'Αγγλος χημικός Humphry Davy (1778-1829) ασχολήθηκε με τα αέρια και τις επιπτώσεις τους στην υγεία του ανθρώπου εργαζόμενος ως βοηθός στο περίφημο Pneumatic Institute στο Bristol. Μάλιστα, το 1799 παραλίγο να πεθάνει όταν δοκίμασε να εισπνεύσει μονοξείδιο του άνθρακα.
Ο Davy, έγινε περισσότερο γνωστός λίγα χρόνια αργότερα, για τη χρησιμοποίηση του ηλεκτρισμού για την ηλεκτρολυτική παρασκευή μετάλλων των αλκαλίων και γαιαλκαλίων με ηλεκτρόλυση τηγμάτων των αλάτων τους, που λόγω της μεγάλης δραστικότητάς τους δεν ήταν δυνατόν να απομονωθούν με καθαρά χημικές μεθόδους. 'Ετσι, το 1807 απομόνωσε πρώτα το κάλιο και στη συνέχεια το νάτριο, ενώ το 1808 απομόνωσε σε μεταλλική κατάσταση τα τέσσερα γαιαλκάλια: μαγνήσιο, ασβέστιο, στρόντιο και βάριο.
Ο Γάλλος Jean Baptiste Dumas (1800-1884) καθιερώνει ως μονάδα την ατομική μάζα του υδρογόνου, προσδιορίζει τις ατομικές μάζες του άνθρακα και του οξυγόνου και άλλων στοιχείων (συνολικά 30) και αναπτύσσει μέθοδο προσδιορισμού του αζώτου σε οργανικές ενώσεις.
Η Οργανική Χημεία επεκτάθηκε με ταχύτατο ρυθμό κατά τον 19ο και 20ο αιώνα με σημαντικό αριθμό νέων ανακαλύψεων και πειραματικών τεχνικών. Στην άνθιση της Οργανικής Χημείας συνέβαλε μια σειρά από έξοχους οργανικούς χημικούς που βελτίωσαν τις μέχρι τότε εργαστηριακές συσκευές, όπως ο Γερμανός Justus von Liebig (1803-1873) που συνεισέφερε πολλά στον τομέα του προσδιορισμού της στοιχειακής σύνθεσης των οργανικών ενώσεων.
Ο Γάλλος (Αλσατός) Charles Adolphe Wurtz (1817-1884) συνεισφέρει πολλά στην ανόργανη και στην οργανική σύνθεση και μένει στην ιστορία της Οργανικής Χημείας γνωστός χάρις στην ομώνυμη αντίδραση παρασκευής υδρογονανθράκων με την αντίδραση αλκυλαλογονιδίων με το μεταλλικό νάτριο.
 |
|
|
|
(1803-1873) |
Το διάσημο σκεύος Kaliapparat, που επινόησε ο Liebig για τη δέσμευση του CO2 κατά τον στοιχειακό προσδιορισμό άνθρακα σε οργανικές ενώσεις. |
|
Ο 'Αγγλος Edward Frankland (1825-1899), στην προσπάθειά του να απομονώσει οργανικές ρίζες (αλκύλια) αναφέρει το 1848 την πρώτη σύνθεση οργανομεταλλικής ένωσης (δηλ. ένωσης με απ' ευθείας δεσμό άνθρακα-μετάλλου), του διαιθυλο-ψευδαργύρου και αναγνωρίζει τις δυνατότητες εφαρμογής των οργανομεταλλικών ενώσεων αυτών στην οργανική σύνθεση, δυνατότητας που αργότερα φέρει στα όρια της τελειότητας ο Victor Grignard. Δικαιολογημένα ο Frankland θεωρείται ως ο "πατέρας της Οργανομεταλλικής Χημείας".
Σταθμός στην εφαρμοσμένη οργανική σύνθεση υπήρξε και το έτος 1856. Ο μόλις 18-χρονος τότε 'Αγγλος φοιτητής της Χημείας William Henry Perkin (1838-1907) στην προσπάθειά του να συνθέσει την περιζήτητη τότε κινίνη, οξείδωσε με διάλυμα διχρωμικού καλίου σε θειικό οξύ μίγμα διάφορων αρωματικών αμινών (ανιλίνες, τολουιδίνες). Διαπίστωσε ότι προέκυψε ένα σκουρόχρωμο πισσώδες προϊόν, που του λέρωσε τα γυάλινα σκεύη που χρησιμοποιούσε. Ο Perkin, προσπαθώντας να καθαρίσει τα σκεύη με αλκοόλη, παρέλαβε ένα σκούρο μωβ διάλυμα που μπορούσε εύκολα και ανεξίτηλα να βάψει μωβ μεταξωτά και άλλα υφάσματα.
 |
 |
|
William Henry Perkin (1838-1907) |
Παλαιό φιαλίδιο με στερεή μωβεΐνη και φόρεμα βαμμένο με το χρώμα αυτό. |
Αυτό το τυχαία παρασκευασμένο προϊόν υπήρξε το πρώτο συνθετικό οργανικό χρώμα, η μωβεΐνη (ή ιώδες της ανιλίνης). Αυτή ήταν η αρχή της βιομηχανικής σύνθεσης οργανικών χρωμάτων που έμελλε να οδηγήσει σε βιομηχανίες χρωμάτων-κολοσσούς. 50 χρόνια μετά την "κατά λάθος" σύνθεση της μωβεΐνης, ήδη είχαν παρασκευασθεί 2000 συνθετικές χρωστικές ύλες (βλ. Χημική ένωση του μήνα: Κινίνη).
Κατά το διάστημα 1864-1867, οι Νορβηγοί χημικοί Cato Maximilian Guldberg (1836-1902) και Peter Waage (1833-1900) διατυπώνουν τον θεμελιώδη νόμο της χημικής κινητικής ευρύτερα γνωστό ως νόμο δράσης των μαζών, με τον οποίο συσχετίζεται η ταχύτητα των χημικών αντιδράσεων με τις συγκεντρώσεις των ενώσεων που συμμετέχουν στην αντίδραση.
Πολλοί υπήρξαν οι πρωτεργάτες πάνω στο νέο πεδίο της Χημείας, τη Φυσικοχημεία που ερμηνεύει χημικά φαινόμενα με καθιερωμένες γνώσεις από τη Φυσική και κυρίως από τη Θερμοδυναμική.
Ο Αμερικανός χημικός, φυσικός και μαθηματικός Josiah Willard Gibbs (1839-1903) θεωρείται ο θεμελιωτής της Χημικής Θερμοδυναμικής. Ο Γάλλος Henri Louis Le Chatêlier (1850-1936) διατυπώνει περί τα τέλη του 19ου αιώνα την περίφημη αρχή του που διέπει κάθε χημική ισορροπία: "Εάν ένα χημικό σύστημα βρίσκεται σε ισορροπία, θα αντιδράσει σε κάθε αλλαγή συγκέντρωσης, θερμοκρασίας ή πίεσης κατά τρόπο που να ελαχιστοποιεί την αλλαγή αυτή".
Ο Ολλανδός οργανικός χημικός και φυσικοχημικός Jacobus Henricus van't Hoff (1852-1911) συνεισέφερε πολλά σε θέματα χημικής κινητικής και ισορροπίας. Το 1874 δημοσίευσε το βιβλίο με τίτλο "La chimie dans l' éspace" (η Χημεία στον χώρο), το οποίο θεωρείται η απαρχή της στερεοχημείας και όπου θεμελιώνεται η τετραεδρική δομή των κορεσμένων ενώσεων του άνθρακα, αν και αρχικά υπήρξε αντικείμενο σφοδρών επικρίσεων. Ο van't Hoff υπήρξε ο πρώτος επιστήμονας που τιμήθηκε το 1901 με το Nobel Χημείας για τις εργασίες σε θέματα χημικής δυναμικής και της ωσμωτικής πίεσης σε διαλύματα.
Στις αρχές του 20ου αιώνα, ο Γερμανός (από τη Λιθουανία) Wilhelm Ostwald (1853-1932) διατυπώνει τις θεωρίες του πάνω στη χημική ισορροπία, στη χημική κινητική και στην κατάλυση και για το έργο του αυτό τιμήθηκε με το Nobel Χημείας του 1909.
|
(1817-1884) |
(1825-1899) |
(1836-1902) |
(1833-1900) |
(1850-1936) |
Το 1884, ο Σουηδός Svante August Arrhenius (1859-1927), στη διδακτορική διατριβή που υπέβαλε στο Πανεπιστήμιο της Uppsala, διατυπώνει τη θεωρία του για την ηλεκτρολυτική διάσταση, τον ιοντισμό και την ύπαρξη ιόντων. Η ιδέα του 25χρονου Arrhenius υπήρξε τόσο ριζοσπαστική για εκείνη την εποχή, που μόλις και έγινε δεκτή η διατριβή του από την εξεταστική επιτροπή και μάλιστα με τον χαμηλότερο δυνατό βαθμό! Σήμερα, η ηλεκτρολυτική διάσταση π.χ. των αλάτων, σε διαλύματά τους αποτελεί κοινή γνώση, τότε όμως η ιδέα αυτή θεωρήθηκε εξωφρενική και πολεμήθηκε σφοδρότατα. Με βάση τη θεωρία της ηλεκτρολυτικής διάστασης, ο Arrhenius δίνει τον πρώτο σύγχρονο ορισμό των οξέων και των βάσεων, θεωρώντας ως οξέα τις ενώσεις που διαλυόμενες στο νερό παρέχουν κατιόντα υδρογόνου, ενώ ως βάσεις τις ενώσεις που διαλυόμενες στο νερό παρέχουν ανιόντα υδροξυλίου.
Ο Arrhenius βρήκε ένθερμο υποστηρικτή της θεωρίας του στο πρόσωπο του Wilhelm Ostwald (1853-1932) και αργότερα τιμήθηκε για αυτήν με το Nobel Χημείας του 1903. Τη θεωρία του Arrhenius υποστήριξε και ο Jacobus Henricus van't Hoff (1852-1911), ο οποίος μάλιστα το 1889 απέδειξε πειραματικά την ορθότητα της θεωρίας της διάστασης των ηλεκτρολυτών. O van't Hoff υπήρξε ο επιστήμονας που τιμήθηκε με πρώτο βραβείο Nobel Χημείας, το 1901 για την ανακάλυψη των νόμων που διέπουν τη δυναμική και την ωσμωτική πίεση διαλυμάτων χημικών ουσιών.
 |
 |
 |
 |
 |
|
(1839-1903) |
van't Hoff (1852-1911) |
(1853-1932) |
(1859-1927) |
(1864-1941) |
Εκτός από τη θεωρία της ηλεκτρολυτικής διάστασης, ο Arrhenius είναι ο πρώτος (το 1889) ο οποίος συνέδεσε μαθηματικά την ταχύτητα μιας χημικής αντίδρασης με τη θερμοκρασία, μέσω της ομώνυμης εξίσωσης. Να σημειωθεί ότι η εξίσωση αυτή είχε διατυπωθεί λίγα χρόνια πριν από τον van't Hoff, αλλά ο Arrhenius ήταν εκείνος που την απέδειξε θεωρητικά. Αυτό που ίσως δεν είναι ευρύτερα γνωστό για τον Arrhenius είναι το ότι πρώτος, ήδη από 1896, είχε προβλέψει ότι η καύση ορυκτών καυσίμων και η εξαιτίας της αύξηση του ατμοσφαιρικού CO2 θα οδηγήσει αναπόφευκτα στο φαινόμενο της υπερθέρμανσης της ατμόσφαιρας του πλανήτη. Μάλιστα, είχε υπολογίσει ότι διπλασιασμός της περιεκτικότητας της ατμόσφαιρας σε CO2 θα προκαλούσε αύξηση της μέσης θερμοκρασίας της ατμόσφαιρας κατά 5ºC.
Ο Γερμανός φυσικοχημικός Walter Nernst (1864-1941), τιμήθηκε με το Nobel Χημείας του 1920 για τη θεωρία του πάνω στον 3ο θερμοδυναμικό νόμο (η εντροπία του τέλειου κρυστάλλου τείνει προς το μηδέν, όσο η θερμοκρασία του τείνει προς το απόλυτο μηδέν). Συνεισέφερε πολλά στη Φυσικοχημεία και είναι γενικότερα γνωστός για την περίφημη εξίσωσή του, που είναι η βασική εξίσωση σε θέματα οξειδοαναγωγής και γενικότερα στον χώρο της Ηλεκτροχημείας.
 |
 |
 |
|
John William Strutt, Λόρδος Rayleigh (1842-1919) |
(1852-1916) |
Σωλήνες ηλεκτρικής εκκένωσης με διάφορα ευγενή αέρια. |
Το 1896, ο 'Αγγλος φυσικός John William Strutt, Λόρδος Rayleigh (1842-1919) και ο Σκότος χημικός William Ramsay (1852-1916), διαπίστωσαν μια μικρή διαφορά στην πυκνότητα μεταξύ του αζώτου που λαμβάνεται με χημικές μεθόδους, σε σχέση με την πυκνότητα του αζώτου που λαμβάνεται από τον αέρα (μετά την απομάκρυνση του οξυγόνου και του διοξειδίου του άνθρακα). Το πρώτο ήταν μόλις κατά 0,5% ειδικώς ελαφρότερο από το δεύτερο. Με προσεκτικές μετρήσεις διαπίστωσαν ότι αυτή η μικρή διαφορά δεν ήταν κάτι το τυχαίο, αλλά εμφανιζόταν συστηματικά. Κατάλαβαν ότι η διαφορά αυτή οφειλόταν σε κάποιο άλλο συστατικό της ατμόσφαιρας, γεγονός που τους οδήγησε στην ανακάλυψη του αέριου στοιχείου αργόν.
Τα επόμενα 4-5 χρόνια ο Ramsey ανακάλυψε και τα υπόλοιπα ευγενή αέρια, δηλ. το νέον, το κρυπτόν, το ξένον, όπως και το ελαφρύτερο απ' όλα, το ήλιο, που ήταν ήδη γνωστή η παρουσία του στον ήλιο από φασματοσκοπικά δεδομένα. Ο Ramsey διαπίστωσε ότι τα αέρια αυτά ήταν χημικώς αδρανή και τα ονόμασε ευγενή αέρια. Αρκετά αργότερα, το 1910, απομόνωσε και το σχετικά βραχύβιο ραδιενεργό ευγενές αέριο, το ραδόνιο. O Rayleigh τιμήθηκε με το Nobel Φυσικής του 1904 για τις μελέτες του πάνω στην πυκνότητα των αερίων και την ανακάλυψη του αργού. Με το Nobel Χημείας του ίδιου έτους τιμήθηκε ο Ramsey για την ανακάλυψη των ευγενών αερίων και την κατάταξή τους στον περιοδικό πίνακα.
Περίπου 60 χρόνια αργότερα διαπιστώθηκε ότι τα ευγενή αέρια δεν είναι και τόσο "ευγενή", όταν ο 'Αγγλος χημικός Neil Bartlett (1932-2008) διαπίστωσε ότι σχετικά εύκολα μπορούσαν να παρασκευαστούν φθοριούχες ενώσεις του ξένου. Σήμερα, είναι πλέον γνωστές ανάλογες ενώσεις του ραδονίου (σταθερότερες, αλλά βραχύβιες λόγω της ραδιενεργού διάσπασης του ραδονίου) και του κρυπτού (εξαιρετικά ασταθείς).
Ο Γερμανός χημικός Hermann Emil Fischer (1852-1919), τιμήθηκε με το Nobel Χημείας του 1902 για τη μεγάλη συνεισφορά στη χημεία των αμινοξέων, των πεπτιδίων και των πρωτεϊνών. Υπήρξε ο πρώτος που αναγνώρισε τη φύση του πεπτιδικού δεσμού, όπως και ο πρώτος που συνέθεσε πεπτίδια, φθάνοντας μέχρι και 18-πεπτίδιο, ένωση που έμοιαζε πλέον στις ιδιότητές της με πρωτεΐνη.
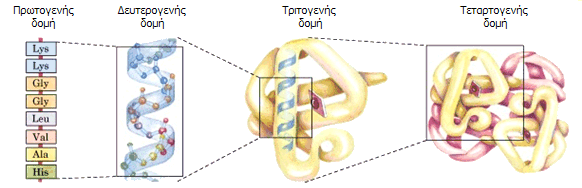 |
 |
|
| Η χημεία των αμινοξέων, πεπτιδίων και των πρωτεϊνών ξεκίνησε με τις ερευνητικές εργασίες του Hermann Emil Fischer |
(1852-1919) |
16. Συμβολή της Φυσικής στη Χημεία: Η Φύση των Ατόμων και του Χημικού Δεσμού
Κατά τα τέλη του 19ου αιώνα τα πράγματα είχαν φτάσει σε σημείο που δεν επαρκούσαν πλέον οι απλές παρατηρήσεις και οι στοιχειομετρικοί υπολογισμοί για να δώσουν την απάντηση στο θεμελιώδες ερώτημα: Πώς και γιατί συνδέονται τα άτομα μεταξύ τους και σχηματίζουν τις ενώσεις. 'Επρεπε να διευκρινιστεί πρώτα απ' όλα η φύση του ίδιου του ατόμου και η επιστήμη της Φυσικής είχε πλέον τα κατάλληλα εργαλεία και τους ανθρώπους που θα έδιναν τις απαντήσεις αυτές. Οι ανακαλύψεις στο θέμα αυτό άρχισαν να έρχονται με ραγδαίο ρυθμό.
 |
|
|
 |
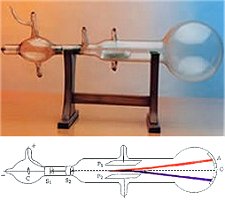 |
|
Antoine Henri Becquerel (1852-1908) |
Αμαύρωση φωτογραφικού φιλμ από τη ραδιενέργεια άλατος ουρανίου. Το περίγραμμα ενός χάλκινου σταυρού έδειξε ότι ορισμένα υλικά ήταν "αδιαφανή" ως προς την ακτινοβολία αυτή (περισσότερα). |
Joseph John Thomson (1856-1940) | Ο σωλήνας Crookes με τον οποίο ο Thomson πραγματοποίησε τα πειράματά του (περισσότερα). |
Η αρχή έγινε το 1896 με την ανακάλυψη της φυσικής ραδιενέργειας από τον Γάλλο φυσικό Antoine Henri Becquerel (1852-1908). Τυχαία ο Becquerel διαπίστωσε ότι ενώσεις του ουρανίου προκαλούσαν αμαύρωση σε προστατευμένα από το φως φωτογραφικά φιλμ. 'Ηταν ήδη γνωστό ότι αντίστοιχο φαινόμενο μπορούσαν να προκαλέσουν μόνο οι ακτίνες Χ, οι οποίες είχαν ανακαλυφθεί μόλις ένα χρόνο πριν από τον Γερμανό φυσικό Wilhelm Conrad Roentgen (1845-1923). Το ότι το ορυκτό του ουρανίου πισουρανίτης (pitchblende), (UO2+προσμίξεις) εξέπεμπε τέσσερις φορές εντονότερη ραδιενέργεια απ' όσο το καθαρό οξείδιο του ουρανίου (UO2), καθιστούσε προφανές το γεγονός ότι κάποιο ή κάποια άλλα στοιχεία θα έπρεπε να βρίσκονται στο ορυκτό, τα οποία θα έπρεπε να είναι κατά πολύ περισσότερο ραδιενεργά από το ίδιο το ουράνιο. Τα ραδιενεργά αυτά στοιχεία απομόνωσε λίγα χρόνια αργότερα η συνεργάτρια του Becquerel, η Marie Curie. Για την ανακάλυψη της ραδιενέργειας, o Becquerel τιμήθηκε (μαζί με την Curie) με το Nobel Φυσικής του 1903.

(1871-1937) |

(1882-1945) |

(1889-1970) |
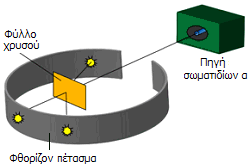 Η εκτροπή ενός πολύ μικρού ποσοστού των α-σωματιδίων που προσπίπτουν σε ένα λεπτότατο φύλλο χρυσού (πάχους 0,4 μm), αποδεικνύει την παρουσία σημείων "πυκνού" θετικού φορτίου στο φύλλο, δηλαδή των πυρήνων των ατόμων χρυσού (περισσότερα). |
Το 1897, ακολούθησε η ανακάλυψη του ηλεκτρονίου από τον 'Αγγλο φυσικό Joseph John Thomson (1856-1940), ως αποτέλεσμα των πειραμάτων που πραγματοποιούσε πάνω στην επίδραση του ηλεκτρικού πεδίου πάνω στις "καθοδικές ακτίνες" ενός σωλήνα Crookes. Η ανακάλυψη των ηλεκτρονίων προηγήθηκε περίπου 12 χρόνια της ανακάλυψης του πυρήνα. Ο Thomson (γνωστός στην επιστημονική κοινότητα ως "Τζέι-Τζέι") τιμήθηκε για την ανακάλυψη αυτή με το Nobel Φυσικής του 1906. Οι ανακαλύψεις αυτές άρχισαν να αναδεικνύουν τη στενή συγγένεια μεταξύ των επιστημών της Φυσικής και της Χημείας.
Θα πρέπει να σημειωθεί ότι η ονομασία "ηλεκτρόνιο" είχε προηγηθεί λίγα χρόνια πριν από την ίδια την ανακάλυψή του και οφείλεται στον Ιρλανδό φυσικό George Johnstone Stoney (1826-1911). Ο Stoney, μελετώντας το φαινόμενο της ηλεκτρόλυσης είχε ήδη υποθέσει την ύπαρξη μιας "απλής και καθορισμένης ποσότητας ηλεκτρισμού", που ισοδυναμεί στο ηλεκτρικό φορτίο ενός μονοφορτισμένου ιόντος. Το 1894, για την περιγραφή αυτού του στοιχειώδους φορτίου χρησιμοποίησε για πρώτη φορά τον όρο "ηλεκτρόνιο".
|
Γραμματόσημο της Νέας Ζηλανδίας προς τιμήν του Ernst Rutherford με αναπαράσταση του διάσημου πειράματός του, με το οποίου αποδείχτηκε η ύπαρξη θετικώς φορτισμένου πυρήνα στα άτομα. |
Η Γαλλίδα (Πολωνικής καταγωγής) φυσικός και χημικός Marie Skłodowska Curie (1867-1934) υπήρξε η πρώτη γυναίκα που τιμήθηκε με το βραβείο Nobel. Είναι επίσης η μόνη γυναίκα που τιμήθηκε με δύο Nobel. Τo 1903, η Curie μοιράστηκε το Nobel Φυσικής με τον σύζυγό της Pierre Curie (1859-1906) και τον Henry Becquerel για την ανακάλυψη του φαινομένου της ραδιενέργειας, ενώ το 1911 τιμήθηκε με το Nobel Χημείας για την ανακάλυψη των στοιχείων ράδιο και πολώνιο. Στο πρόσωπο της Κιουρί αποδείχθηκε η άρρηκτη συγγένεια Φυσικής και Χημείας. Η Curie τιμήθηκε επίσης όταν το ραδιενεργό στοιχείο με ατομικό αριθμό 96 ονομάστηκε Κιούριο (Curium, Cm) το 1944.
 |
 |
 |
|
(1868-1953) |
(1887-1915) |
(1885-1962) |
Δυστυχώς, οι δυσμενείς επιπτώσεις της ραδιενέργειας στην υγεία του ανθρώπου ήταν άγνωστες και η Curie είχε πραγματοποιήσει πλήθος πειραμάτων και μετρήσεων με ραδιενεργές ουσίες. Ο θάνατός της από λευχαιμία το 1934 ήταν αποτέλεσμα της ραδιενέργειας. Είναι χαρακτηριστικό το ότι σήμερα για την εξέταση των εργαστηριακών ημερολόγιων και των χειρογράφων σημειώσεων της Curie επιβάλλονται μέτρα ακτινοπροστασίας λόγω της μόλυνσής τους με ίχνη ενώσεων του ραδίου.
Το 1907, τιμήθηκε με το Nobel Φυσικής ο Νεοζηλανδός Ernst Rutherford (1871-1937) για την ανακάλυψη της διάσπασης των ραδιενεργών στοιχείων και ο οποίος θεωρείται σήμερα ο πατέρας της Πυρηνικής Φυσικής. 'Ετσι, η ουσιαστική φύση του ατόμου αποκαλύφθηκε από τα πειράματα των Thomson και Rutherford. Ο Rutherford τιμήθηκε επίσης όταν το ραδιενεργό στοιχείο με ατομικό αριθμό 104 ονομάστηκε Ραδερφόρντιο (Rutherfordium, Rf).
Το 1909, ο Αμερικανός φυσικός Robert Millikan (1868-1953), με το περίφημο πείραμα της "αιωρούμενης σταγόνας λαδιού", υπολογίζει με εξαιρετική ακρίβεια το ηλεκτρικό φορτίο του ηλεκτρονίου. Η τιμή που έδωσε ο Millikan ήταν μόλις 0,6% μικρότερη από τη σημερινή αποδεκτή τιμή (qe = 1,602176 x 10-19 C).
Το 1911, ο Αγγλο-Νεοζηλανδός χημικός και φυσικός Ernest Rutherford (1871-1937), ο Γερμανός φυσικός Hans Geiger (1882-1945), γνωστός από τον ανιχνευτή ραδιενέργειας που φέρει το όνομά του, και ο Αγγλο-Νεοζηλανδός φυσικός Ernest Marsden (1889-1970) ανακοινώνουν τα αποτελέσματα των πειραμάτων τους (το περίφημο πείραμα με το "φύλλο χρυσού") και επιβεβαιώνουν το ατομικό μοντέλο των ατόμων, με τον θετικά φορτισμένο μικροσκοπικό πυρήνα, ο οποίος περιβάλλεται από το αρνητικά φορτισμένο ηλεκτρονιακό νέφος.
Η ανακάλυψη της ύπαρξης πυρήνα στα άτομα κατέρριψε το λεγόμενο μοντέλο του σταφιδόψωμου (plum pudding) που προτάθηκε αρχικά από τον J. J. Thomson, σύμφωνα με το οποίο το άτομο ήταν μια θετικά φορτισμένη σφαίρα μέσα στην οποία κινούνταν τα αρνητικώς φορτισμένα ηλεκτρόνια. Τα άτομα πλέον άρχισαν να αποκτούν μορφή.
|
Τα στοιχεία ρήνιο (Re) και άφνιο (Hf) είναι τα δύο τελευταία σταθερά χημικά στοιχεία που απομονώθηκαν το 1925. Θεωρούνται ως "στρατηγικά μέταλλα" λόγω των ειδικών τεχνολογικών εφαρμογών τους (καταλύτες, πυρηνικοί αντιδραστήρες, δύστηκτα κράματα ειδικών χρήσεων). |
Το 1913, ο νέος 'Αγγλος φυσικός Henry Moseley (1887-1915), εξετάζοντας τα φάσματα των ακτίνων Χ, που λάμβανε χρησιμοποιώντας διάφορα μεταλλικά στοιχεία ως στόχους, διαπίστωσε τη συστηματική μαθηματική σχέση μεταξύ του μήκους κύματος των ακτίνων Χ και ενός νέου χαρακτηριστικού του κάθε στοιχείου, του ατομικού αριθμού. 'Ετσι, έγινε γνωστό ότι κάθε στοιχείο, εκτός από την ατομική μάζα, χαρακτηρίζεται και από τον ατομικό αριθμό. Ακόμη, αποδείχθηκε ότι η κατάταξη των στοιχείων στον Περιοδικό Πίνακα θα έπρεπε να γίνεται κατά σειρά ατομικού αριθμού και όχι της ατομικής μάζας.
Η κατάταξη των στοιχείων με βάση τον ατομικό αριθμό ήρε τις ονομαζόμενες "ανωμαλίες των ατομικών μαζών", κατά τις οποίες η σειρά ατομικών μαζών δεν συνέπιπταν με τη σειρά ατομικών αριθμών (περιπτώσεις ζευγών: Ar-K, Co-Ni και Te-I). Επιπλέον, ο νέος τρόπος κατάταξης διευκόλυνε και τον εντοπισμό των "κενών θέσεων" του Περιοδικού Πίνακα. Ίσως σήμερα να φαίνεται παράδοξο το ότι ένα τόσο βασικό χαρακτηριστικό κάθε χημικού στοιχείου ανακαλύφθηκε με τόση καθυστέρηση.
Με βάση τις κενές θέσεις στον Περιοδικό Πίνακα, ο Moseley προέβλεψε την ύπαρξη των στοιχείων άφνιο και ρήνιο, τα τελευταία σταθερά (μη ραδιενεργά) στοιχεία που απομόνωσαν οι χημικοί. Τα δύο αυτά μεταλλικά στοιχεία απομονώθηκαν με ιδιαίτερες δυσκολίες λίγα χρόνια αργότερα (1922-25). Το άφνιο απομονώθηκε δύσκολα λόγω της μεγάλης δυσκολίας διαχωρισμού του από το ζιρκόνιο, το οποίο συνοδεύει στα ορυκτά του σε μικρό ποσοστό, 1-3% (1922, Dirk Coster και Georg von Hevesy), ενώ το ρήνιο απομονώθηκε δύσκολα λόγω των ελάχιστων ποσοτήτων του σε διάφορα ορυκτά, με μέση περιεκτικότητα ρηνίου στον γήινο φλοιό: 1 μέρος στο 1 δισεκατομμύριο (Walter Noddack, Ida Tacke και Otto Berg).
Το 1915, ο Moseley σε ηλικία μόλις 27 ετών, διέκοψε τις έρευνές του για να καταταγεί στον Βρετανικό στρατό. Λίγους μήνες αργότερα χάνει τη ζωή του πολεμώντας στη μάχη της Καλλίπολης κατά τον 1ο Παγκόσμιο Πόλεμο. Ο θάνατος στέρησε από τον ίδιο ένα βέβαιο Nobel και την επιστήμη από έναν εξαιρετικό επιστήμονα. Το γεγονός αυτό υπήρξε αφορμή να περάσει νόμος στη Βρετανία (και στη συνέχεια σε πολλά άλλα κράτη) που εξαιρούσε νέους λαμπρούς επιστήμονες από τη μάχιμη στρατιωτική υπηρεσία.
Τέλος, ο Δανός φυσικός Niels Bohr (1885-1962) για τη δομή των ατόμων έκανε ένα ακόμη σημαντικό βήμα ερμηνεύοντας τις γραμμές που παρουσιάζονται στο φάσμα εκπομπής του υδρογόνου και εισάγοντας την έννοια της τροχιάς των ηλεκτρονίων. Ο Bohr τιμήθηκε επίσης όταν το ραδιενεργό στοιχείο με ατομικό αριθμό 107 ονομάστηκε Μπόριο (Bohrium, Bh).
 |
 |
 |
 |
|
Φωτογραφίες της Marie Skłodowska Curie (1867-1934): 1η, 2η στο εργαστήριό της. 3η: Η Marie Curie και ο σύζυγός της, ο φυσικός Pierre Curie (1859-1906). 4η: Η Marie Curie και η κόρη της Irène Joliot-Curie (1897-1956), που με τον σύζυγό της Frederic Joliot-Curie (1900-1958) τιμήθηκαν με το Nobel Χημείας του 1935 για τις έρευνές τους στην τεχνητή ραδιενέργεια. |
|||

Λίγα από τα πολλά γραμματόσημα που εκδόθηκαν προς τιμήν της Marie Curie.
Πηγές από το Διαδίκτυο: (1) "Fixing the broken Periodic Table for the world of Chemistry". (2) "On a New, Strongly Radio-active Substance Contained in Pitchblende" (P. Curie, Mme. P. Curie and G. Bemont, Comptes rendus de l'Acadιmie des Sciences, Paris, 1898 (26 December), vol. 127, pp. 1215-1217.) (3) "Radium and Radioactivity" (Marie Skłodowska Curie, Century Magazine (January 1904), pp. 461-466). (4) Αυτοβιογραφία της Marie Curie.
 |
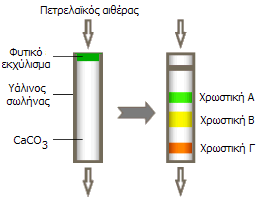 |
|
Mikhail Semyonovich Tsvet (1872-1919) |
Σχηματική αναπαράσταση του πρώτου χρωματογραφικού διαχωρισμού του Tsvet |
17. Σταθμοί στην Εξέλιξη της Χημείας κατά τον 20ο αιώνα
Ο 20ος αιώνας χαρακτηρίζεται από ραγδαία πορεία ανακαλύψεων τόσο για εφαρμογές στη χημική βιομηχανία, όσο και για το θεωρητικό υπόβαθρο της Χημείας. Την ίδια περίοδο ξεκινάει μία εκπληκτική πορεία ανακαλύψεων της κβαντικής χημείας, των νέων και ευαίσθητων αναλυτικών τεχνικών, της σύνθεσης πολύπλοκων οργανικών ενώσεων και πολυμερών που διαδραματίζουν σημαντική πρόοδο για τη Χημεία.
Οι σημαντικότερες ανακαλύψεις στον τομέα της Χημείας και ορισμένες εμβληματικές ανακαλύψεις της φυσικής και της βιοχημείας παρατίθενται στη συνέχεια κατά χρονολογική σειρά:
17.1. Περίοδος 1900-1915
Το 1900, ο Γάλλος χημικός François Auguste Victor Grignard (1871-1932) ανακοινώνει σειρά μεθόδων οργανικής σύνθεσης με τη βοήθεια οργανομαγνησιακών ενώσεων, που αποδείχθηκαν πολύ πιο εύχρηστες και ασφαλείς σε σχέση με άλλες δραστικές οργανομεταλλικές ενώσεις. Ο Grignard τιμήθηκε με το Nobel Χημείας του 1912.
Το 1903, ο Ρώσος βοτανολόγος Mikhail Semyonovich Tsvet (1872-1919), εξετάζοντας τις φυτικές χρωστικές ουσίες, ανακαλύπτει τη χρωματογραφία, μια εξαιρετικά χρήσιμη τεχνική τόσο για τον διαχωρισμό και ανάλυση πολύπλοκων χημικών μιγμάτων, όσο και για τον καθαρισμό χημικών ενώσεων.
Το 1905, οι Γερμανοί χημικοί Fritz Haber (1868-1934) and Carl Bosch (1874-1940) αναπτύσσουν βιομηχανική μέθοδο παρασκευής αμμωνίας από το ατμοσφαιρικό άζωτο και υδρογόνο, το οποίο αρχικά το παρήγαγαν με ηλεκτρόλυση του ύδατος, στη συνέχεια όμως σχεδόν αποκλειστικά από το φυσικό αέριο (αντίδραση μεθανίου με υδρατμούς, αντίδραση γνωστή ως "αναμόρφωση μεθανίου με ατμό", βλ. Χημική ένωση του μήνα: Μεθανόλη).
 |
 |
 |
 |
|
(1868-1934) |
(1874-1940) |
Αριστερά: Τμήμα του εργοστασιακού συγκροτήματος BASF (Badische Anilin und Soda Fabrik ). Το συγκρότημα άνοιξε το 1913, ένα χρόνο πριν από την έναρξη του 1ου Παγκόσμιου Πόλεμου για την παραγωγή αμμωνίας με τη μέθοδο Haber-Bosch, αλλά αμέσως επεκτάθηκε με μονάδες παραγωγής νιτρικού οξέος για την παρασκευή εκρηκτικών. Δεξιά: Χαλύβδινος αντιδραστήρας παραγωγής αμμωνίας. | |
Η μέθοδος παρασκευής αμμωνίας με δέσμευση του ατμοσφαιρικού αζώτου, γνωστή πλέον ως μέθοδος Haber-Bosch, έπαιξε ακρογωνιαίο ρόλο στην ανάπτυξη της χημικής βιομηχανίας και των λιπασμάτων για τη γεωργία, αλλά και των εκρηκτικών υλών, αφού με οξείδωση της αμμωνίας ήταν πλέον εύκολη η παρασκευή νιτρικού οξέος. Θα πρέπει να σημειωθεί ότι πριν την ανάπτυξη της μεθόδου ουσιαστικά η μοναδική πηγή νιτρικών ήταν η έρημος Atacama της Χιλής. Εκτιμάται πως αν δεν είχε ανακαλυφθεί η μέθοδος, ο Α' Παγκόσμιος Πόλεμος δεν θα διαρκούσε περισσότερο από ένα ή δύο χρόνια, αφού η τροφοδοσία της Γερμανίας με νιτρικά άλατα από τη Χιλή είχε αποκοπεί. Ο Haber τιμήθηκε με το Nobel Χημείας το 1918 και ο Bosch το 1931.
 |
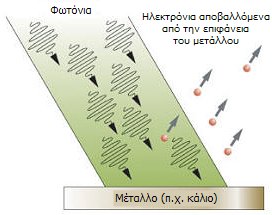 |
|
Το φωτοηλεκτρονικό φαινόμενο ερμηνεύεται με την αποδοχή της σωματιδιακής φύσης του φωτός. |
|
Το 1905, ο μεγαλοφυής Γερμανός φυσικός Albert Einstein (1879-1955), θεμελιωτής της σύγχρονης Φυσικής, ερμηνεύει το φωτοηλεκτρικό φαινόμενο, δηλαδή την απόσπαση ηλεκτρονίων από την επιφάνεια μετάλλων (ιδιαίτερα έντονη στην περίπτωση των αλκαλίων), όταν αυτά δέχονται οπτική ακτινοβολία. Ο Einstein το ερμήνευσε κάνοντας δεκτή τη σωματιδιακή φύση του φωτός.
Η λογική της σύνδεσης του φωτοηλεκτρονικού φαινομένου με τη σωματιδιακή φύση του φωτός είναι απλή: Είναι αδύνατον η ενέργεια της οπτικής ακτινοβολίας "απλωμένη" (ως απλό κύμα) σε όλη τη φωτοευαίσθητη επιφάνεια ενός μετάλλου να επαρκεί, ώστε να επιτευχθεί η απόσπαση ηλεκτρονίου από τα επιμέρους άτομα, αφού η ενέργεια που δέχεται το κάθε άτομο είναι αναλογικά ελάχιστη. Αντίθετα, εάν η ενέργεια της ακτινοβολίας προσπίπτει στην επιφάνεια σε μορφή "ενεργειακών πακέτων-βομβών", η απόσπαση αυτή καθίσταται ενεργειακά εφικτή για κάθε άτομο μετάλλου, που δέχεται "βομβαρδισμό" από ένα ενεργειακό πακέτο, δηλ. το φωτόνιο. Επιπλέον, η ενέργεια του αποσπώμενου ηλεκτρονίου εξαρτάται από τη συχνότητα της ακτινοβολίας και όχι από την έντασή της, η οποία επηρεάζει μόνο τον αριθμό των αποσπώμενων ηλεκτρονίων ανά μονάδα χρόνου.
Για το έργο του αυτό, ο Einstein τιμήθηκε με το Nobel Φυσικής του 1921. Ο Einstein τιμήθηκε επίσης όταν το ραδιενεργό στοιχείο με ατομικό αριθμό 99 ονομάστηκε Αϊνσταΐνιο (Einsteinium, Es).
Το 1907, ο Βέλγος χημικός Leo Hendrik Baekeland (1863-1944) ανακαλύπτει τον βακελίτη, πολυμερές προϊόν αντίδρασης φορμαλδεΰδης και φαινόλης, το πρώτο εμπορικά διαθέσιμο πλαστικό. Οι εξαιρετικές μηχανικές και μονωτικές δυνατότητες του βακελίτη, τον έκαναν ένα πολύτιμο υλικό ειδικά για τη βιομηχανία ηλεκτρικών και ηλεκτρονικών ειδών, αλλά και πλήθους άλλων προϊόντων. Τα πολυμερή παύουν να θεωρούνται μόνο ενοχλητικά παραπροϊόντα της οργανικής σύνθεσης, αλλά οι χημικοί αρχίζουν να τα βλέπουν ως μια νέα τάξη χημικών προϊόντων που μπορούν να αποκτήσουν πολύτιμές ιδιότητες και να βρουν πλήθος εφαρμογών. 'Εναρξη της Χημείας των Πολυμερών.
Το 1909, ο Δανός χημικός Søren Peder Lauritz Sørensen (1868-1939) προτείνει την έννοια του pH για τον χαρακτηρισμό της οξύτητας διαλυμάτων, όπως και δύο μεθόδους μέτρησής του: με τη βοήθεια έγχρωμων δεικτών και με ηλεκτροχημικά μέσα.
 |
 |
 |
 |
 |
 |
|
(1871-1932) |
Leo Hendrik Baekeland (1863-1944) |
(1862-1942) |
William Lawrence Bragg (1890-1971) |
(1884-1966) |
(1877-1956) |
 |
 |
 |
|
Ο Βέλγος χημικός Leo Hendrik Baekeland (1863-1944) (αριστερά: σε εξώφυλλο του περιοδικού TIME του 1925), παρασκεύασε το 1907 τον βακελίτη, το πρώτο συνθετικό πολυμερές (προϊόν συμπύκνωσης φαινόλης - φορμαλδεΰδης). Ο βακελίτης υπήρξε ένα ιδιαίτερα επιτυχημένο βιομηχανικό προϊόν, που άρχισε να παρασκευάζεται μεγάλη κλίμακα και βρήκε πλήθος εφαρμογών. |
||
Το 1912, ο Βρετανός φυσικός και χημικός William Henry Bragg (1862-1942) και ο γιος του φυσικός William Lawrence Bragg (1890-1971) παρουσιάζουν την κρυσταλλογραφία ακτίνων-Χ, ένα σπουδαίο εργαλείο για τον προσδιορισμό της δομής κρυσταλλικών χημικών ενώσεων και διατυπώνουν τον περίφημο νόμο του Bragg (διάθλαση ακτίνων Χ από τους κρυστάλλους) πάνω στον οποίο βασίζεται η πανίσχυρη αυτή τεχνική. Για την εργασία τους τιμήθηκαν με το Nobel Φυσικής του 1915.
Την ίδια χρονιά, ο Ολλανδός φυσικοχημικός Peter Debye (1884-1966) ανακοινώνει τη θεωρία του για το μοριακό δίπολο και τη διπολική ροπή, για να περιγράψει την κατανομή των ηλεκτρικών φορτίων σε ασύμμετρα μόρια, που ευνοεί ορισμένες διπολικές έλξεις και διαμοριακές δυνάμεις, όπως ο δεσμός υδρογόνου. Προς τιμήν του, η διπολική ροπή ενός μορίου εκφράζεται σε μονάδες debye (D). O Debye τιμήθηκε με το Nobel Χημείας του 1936 για τις μελέτες του στις μοριακές δομές.
Το 1913, ο 'Αγγλος ραδιοχημικός Frederick Soddy (1877-1956) εξετάζοντας τα προϊόντα διάσπασης του ουρανίου προτείνει την ιδέα ότι ένα ραδιενεργό στοιχείο μπορεί να έχει περισσότερες από μία ατομικές μάζες και πρότεινε τον όρο "ισότοπο". Ισότοπα βέβαια έχουν και τα μη ραδιενεργά στοιχεία. Ο Soddy τιμήθηκε με το Nobel Χημείας του 1921.
Την ίδια χρονιά, ο 'Αγγλος φυσικός Joseph John Thomson (1856-1940) (γνωστότερος ως "J-J Thomson") εφαρμόζει τις γενικές θεωρίες περί θετικά φορτισμένων σωματιδίων που προκύπτουν από τον βομβαρδισμό με ταχύτατα ηλεκτρόνια και μπορούν να διαχωριστούν με βάση τον λόγο μάζας προς φορτίο (m/z). Τα πειράματά του οδήγησαν στην ανακάλυψη της φασματομετρίας μαζών. Ο Thomson τιμήθηκε με το Nobel Φυσικής του 1906 για τις εργασίες πάνω στην αγωγιμότητα των αερίων.
 |
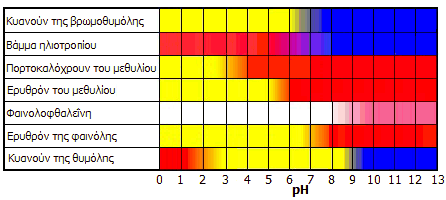 |
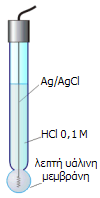 |
 |
|
O Δανός Søren Sørensen (1868-1939) πρότεινε το 1909 την κλίμακα pH για τον χαρακτηρισμό της οξύτητας υδατικών διαλυμάτων. Ο προσδιορισμός του pH (στην περίπτωση άχρωμων διαλυμάτων) μπορεί να πραγματοποιηθεί με περιορισμένη ακρίβεια με τη βοήθεια οξεοβασικών δεικτών ή (ακριβέστερα) με ηλεκτροχημικές μετρήσεις. Σήμερα πραγματοποιείται σχεδόν αποκλειστικά ποτενσιομετρικά με τη βοήθεια του ονομαζόμενου "ηλεκτροδίου υάλου" και πεχαμέτρου. |
|||
17.2. Περίοδος 1916-1935
Το 1923, δύο χημικοί ανεξάρτητα ο ένας από τον άλλο, ο Δανός Johannes Nicolaus Brønsted (1879-1947) και o Βρετανός Thomas Martin Lowry (1874-1936) διατυπώνουν μια νέα θεωρία για τη φύση των οξέων και των βάσεων, η οποία συμπληρώνει και γενικεύει τη θεωρία του Arrhenius. Σύμφωνα με τους Brønsted και Lowry, οξύ και βάση είναι κάθε δότης και δέκτης κατιόντων υδρογόνου, αντίστοιχα, ενώ σε κάθε οξύ αντιστοιχεί μια συζυγής βάση και αντιστρόφως.
Κατά την περίοδο 1916-1923 ο Αμερικανός χημικός Gilbert N. Lewis (1875-1946) δημοσιεύει το πρωτοποριακό βιβλίο του "Το 'Ατομο και το Μόριο" (The Atom and the Molecule), που θέτει τα θεμέλια για τη θεωρία του χημικού δεσμού, ενώ το 1923 με τον Merle Randall (1888-1950) δημοσιεύουν το βιβλίο τους "Θερμοδυναμική και η Ελεύθερη Ενέργεια των Χημικών Ενώσεων" (Thermodynamics and the Free Energy of Chemical Substances), που αποτελεί το πρώτο κλασικό βιβλίο Χημική Θερμοδυναμικής.
Το 1923 ο Lewis αναπτύσσει τη γενικευμένη θεωρία περί οξέων και βάσεων με βάση την ηλεκτρονιακή δομή των χημικών ενώσεων. Ο Lewis ορίζει τα οξέα και τις βάσεις ως δέκτες και δότες ζεύγους ηλεκτρονίων, αντιστοίχως. Ο ορισμός αυτός υπερκαλύπτει τον πρώιμο ορισμό των οξέων και βάσεων του Arrhenius, όπως και τον ορισμό των Brønsted και Lowry. Οξύ πλέον μπορεί να είναι και ουσία που δεν περιέχει καν υδρογόνο, όπως π.χ. οι ενώσεις BF3 και AlCl3. Το 1926, ο επιστημονικός κόσμος έχει πλέον αποδεχθεί τη σωματιδιακή φύση του φωτός και ο Lewis μαζί με τον φυσικό Frithiof Wolfers προτείνουν το όνομα φωτόνιο (photon) για το στοιχειώδες σωματίδιο ηλεκτρομαγνητικής ενέργειας.
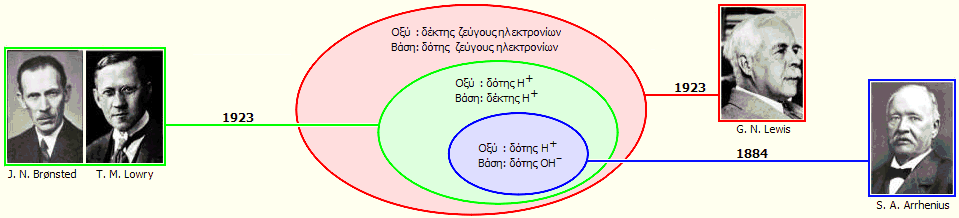
|
Εξέλιξη των θεωριών περί οξέων και βάσεων: Κάθε νεότερη θεωρία γενίκευε την προηγούμενη: Κατά τον Arrhenious (1884) τα οξέα είναι δότες υδρογονοκατιόντων και οι βάσεις είναι δότες υδροξυλίων. Κατά τους Brønsted και Lowry (1923) τα οξέα είναι δότες υδρογονοκατιόντων και οι βάσεις δέκτες υδρογονοκατιόντων. Κατά τον Lewis (1923) οξέα είναι οι δέκτες ζεύγους ηλεκτρονίων και οι βάσεις δότες ζεύγους ηλεκτρονίων (1924), οπότε καταργείται το υδρογονοκατιόν ως απαραίτητο σωματίδιο στις οξεοβασικές ισορροπίες. |
 |
 |
 |
 |
 |
 |
|
(1875-1946) |
(1892-1987) |
(1887-1961) |
(1900-1954) |
(1896-1937) |
(1896-1980) |
Οι Irving Langmuir (1881-1957), Nobel Χημείας του 1932, και ο διάσημος Αμερικανός χημικός Linus Pauling (1901-1994), Nobel Χημείας του 1954 και Nobel Ειρήνης του 1962, προώθησαν τις ηλεκτρονιακές θεωρίες για τους χημικούς δεσμούς, το σθένος των στοιχείων και τα μοριακά τροχιακά.
Η περίοδος 1924-1926 είναι ιδιαίτερα σημαντική για την Κβαντική Φυσική και Χημεία. Ο νεαρός Γάλλος φυσικός Louis de Broglie (1892-1987), Nobel Φυσικής του 1929, προτείνει την επαναστατική άποψη για την εποχή εκείνη, περί της κυματικής φύσης του ηλεκτρονίου, και αναπτύσσει την αντίληψη της δυαδική φύσης της ακτινοβολίας. Αργότερα, ο Αυστριακός Erwin Schrödinger (1887-1961) προτείνει την περίφημη εξίσωσή του, που αποτελεί τη μαθηματική θεμελίωση για την κυματική φύση της ατομικής δομής της ύλης. Ο Schrödinger τιμήθηκε με το Nobel Φυσικής του 1933.
Το 1927, οι Γερμανοί θεωρητικοί φυσικοί Fritz London (1900-1954) and Walter Heitler (1904-1981) εφαρμόζουν τις αρχές της νεοδιατυπωθείσας θεωρίας της κβαντομηχανικής για να ερμηνεύσουν τον ομοιοπολικό δεσμό στο μόριο του υδρογόνου, όπως και τις ενδομοριακές και διαμοριακές δυνάμεις (δυνάμεις London). Με τον τρόπο αυτό εγκαινιάσθηκε η γέννηση της Κβαντικής Χημείας.
|
(1883-1981) |
Η πρώτη ένδειξη ύπαρξης του δευτερίου: Αριστερά από μια έντονη φασματική γραμμή Balmer του Η (πρώτιο)διακρίνεται η ασθενής γραμμή (πάνω από το βέλος) της αντίστοιχης γραμμής του D (δευτέριο) σε δείγμα φυσικού υδρογόνου εμπλουτισμένου σε D. Το δείγμα αυτό προέκυψε μετά από βραδεία εξάτμιση του υγροποιημένου αερίου που ως αποτέλεσμα είχε τον εμπλουτισμό του σε D. (βλ. Χημική 'Ενωση του μήνα: Βαρύ ύδωρ). |
Το 1930, ο Linus Pauling (1901-1994) σε μια επιπλέον μεγάλη του συνεισφορά στη Χημεία προτείνει τους βασικούς κανόνες για τη χρήση της κρυσταλλογραφίας ακτίνων Χ στη μελέτη των χημικών δομών.
Το 1930, ο Αμερικανός χημικός της πολυεθνικής εταιρείας DuPont, ο Wallace Carothers (1896-1937) ανακαλύπτει το νάϋλον (nylon), το πολυμερές που έφερε επαναστατικές αλλαγές στα χημικά συνθετικά υλικά και υπήρξε το εμπορικώς επιτυχέστερο προϊόν της χημικής βιομηχανίας.
Το 1931, ο Γερμανός φυσικοχημικός Erich Hückel (1896-1980) προτείνει τον κανόνα Hückel (4n+2), με τον οποίο προβλέπεται πότε ένα μονοκυκλικό, επίπεδο και με συζυγιακούς δεσμούς μόριο (με ένα τροχιακό p σε κάθε άτομο) έχει αρωματικό χαρακτήρα.
Το 1931, ο Αμερικανός χημικός Harold Clayton Urey (1883-1981) ανακαλύπτει το δευτέριο (deuterium, D), εξετάζοντας φασματοσκοπικά το συμπύκνωμα που προκύπτει κατά τη βραδεία εξάτμιση του υγρού υδρογόνου. Για την ανακάλυψη αυτή o Urey τιμήθηκε με το Nobel Χημείας του 1934. Η παρασκευή και η χρήση πλήθους δευτεριωμένων ενώσεων συνέβαλε αποφασιστικά στην κατανόηση των μηχανισμών πλήθους χημικών αντιδράσεων (βλ. Χημική 'Ενωση του μήνα: Βαρύ ύδωρ).
Το 1932, ο 'Αγγλος φυσικός James Chadwick (1891-1974) ανακαλύπτει το νετρόνιο. Για την ανακάλυψη αυτή ο Chadwick τιμήθηκε με το Nobel Φυσικής του 1935. Με την ανακάλυψη αυτή ολοκληρώνεται πλέον η γνώση της βασική δομής των ατόμων. Θα πρέπει να σημειωθεί ότι η υπόθεση της ύπαρξης ενός ουδέτερου σωματιδίου στον πυρήνα των ατόμων είχε ήδη διατυπωθεί από τον Ernst Rutherford, ήδη από το 1920, για να ερμηνεύσει τη διαφορά μεταξύ ατομικής μάζας και ατομικού αριθμού ενός στοιχείου.
Κατά την περίοδο 1932-1934 οι χημικοί Linus Pauling και Robert Mulliken (1896-1986, Nobel Χημείας του 1966) παρουσιάζουν μια ποσοτική θεώρηση της ηλεκτροαρνητικότητας των στοιχείων και διατυπώνουν μια κλίμακα ηλεκτροαρνητικότητας που φέρει το όνομά τους.

Κύριοι χρονικοί σταθμοί στη διευκρίνιση της βασικής δομής των ατόμων και της συσχέτισής της με τις χημικές και φυσικές ιδιότητες των αντίστοιχων στοιχείων.
17.3. Περίοδος 1936-1960
Το 1937 υπήρξε μια ιδιαίτερα αποδοτική χρονιά για την πετροχημική βιομηχανία. Ο Γάλλος χημικός μηχανικός Eugene Houdry (1892-1962) αναπτύσσει με επιτυχία μέθοδο κλασματικής καταλυτικής απόσταξης (διύλιση πετρελαίου, καταλυτική πυρόλυση). Οι τεχνική αυτή οδηγεί στη ραγδαία ανάπτυξη της πετροχημικής βιομηχανίας πετρελαίου και στην παρασκευή υψηλής ποιότητας καυσίμων για τροχοφόρα.
Το 1939, ο διάσημος Αμερικανός χημικός Linus Pauling (1901-1994) δημοσιεύει το πρωτοποριακό βιβλίο "Η Φύση του Χημικού Δεσμού" (The Nature of the Chemical Bond). Είναι ένα από τα σημαντικότερα συγγράμματα Χημείας, τόσο για τη φύση του ομοιοπολικού χημικού δεσμού, όσο και για τη θεωρία της υβριδοποίησης τροχιακών και τη θεωρία του συντονισμού, μέσω της ηλεκτραρνητικότητας των στοιχείων.
Το 1941, ο Αμερικανός χημικός Glenn T. Seaborg (1912-1999) με τη μέθοδο της δέσμευσης νετρονίων σε πυρηνικές αντιδράσεις κατάφερε να δημιουργήσει και να απομονώσει 9 στοιχεία που ανήκουν στα υπερουράνια στοιχεία, όπως και δεκάδες ισοτόπων. Το 1940 το πλουτώνιο (Pu) και στο διάστημα 1944-1958 το αμερίκιο (Am), το κιούριο (Cm), το μπερκέλιο (Bk), το καλιφόρνιο (Cf), το αϊνσταΐνιο (Es), το φέρμιο (Fm), το μεντελέβιο (Md) και το νομπέλιο (No).
 |
 |
 |
 |
 |
|
(1912-1999) |
Edwin Mattison McMillan (1907-1991) |
Ποσότητα διοξειδίου του ποσειδωνίου (NpO2), υπερουράνιου στοιχείου, ενός από τα λίγα που παράγονται σε σχετικά μεγάλες ποσότητες (kg). |
Η πρώτη ορατή ποσότητα ένωσης του αμερικίου (λίγα μg Am(OH)3). |
Ένα υπερουράνιο στοιχείο στο σπίτι: Μικροποσότητες (0,1-0,2 mg) οξειδίου του αμερικίου AmO2 (Am-241) χρησιμοποιείται ως πηγή ακτίνων α σε πολλούς κοινούς ανιχνευτές καπνού οικιακής χρήσης . |
Ο Seaborg υπήρξε ισχυρή επιστημονική φυσιογνωμία με τις πολυάριθμες ανακαλύψεις του στον τομέα των πυρηνικών καυσίμων και επιστημονικός σύμβουλος πολλών Αμερικανών προέδρων. Για την ανακάλυψη των υπερουράνιων στοιχείων και τη μελέτη της χημείας τους ο Seaborg τιμήθηκε με Nobel Χημείας του 1935, το οποίο μοιράσθηκε με τον Αμερικανό φυσικό Edwin Mattison McMillan (1907-1991). Ο Seaborg τιμήθηκε επίσης όταν το ραδιενεργό στοιχείο με ατομικό αριθμό 106 ονομάστηκε Σιμπόργκιο (Seaborgium, Sg). Στο διαδίκτυο υπάρχει μια ωραία συλλογή άρθρων του Seaborg σχετικών με την ανακάλυψη και απομόνωση των υπερουράνιων στοιχείων.
Κατά τη διετία 1945-1946, o Ελβετός φυσικός Felix Bloch (1905-1983) και ο Αμερικανός φυσικός Edward Mills Purcell (1912-1997) ανακαλύπτουν τον Πυρηνικό Μαγνητικό Συντονισμό (Nuclear Magnetic Resonance, NMR), μια σημαντικότατη φασματοσκοπική τεχνική που αποτελεί σήμερα το κυριότερο εργαλείο που διαθέτουν οι χημικοί για τον προσδιορισμό της δομής οργανικών (κυρίως) ενώσεων. Οι Bloch και Purcell τιμήθηκαν για την ανακάλυψή τους με το Nobel Φυσικής του 1952. Το 1954, ο Bloch υπήρξε ο πρώτος Γενικός Διευθυντής του Κέντρου Πυρηνικών Μελετών και Ερευνών (CERN) στη Γενεύη.
 |
 |
 |
 |
|
(1905-1983) |
(1912-1997) |
'Ενα από τα πρώτα συστήματα NMR (συνεχούς κύματος, 40 MHz) του 1961 |
Σύγχρονο σύστημα NMR (800 MHz) που χρησιμοποιείται σε δομικές μελέτες πρωτεϊνών |
Το 1951, ο Linus Pauling (1901-1994) εξέτασε τη δυνατότητα χρήσης της φασματοσκοπίας των ακτίνων Χ για τον προσδιορισμό της δομής των πρωτεϊνών στον χώρο. Η δυνατότητα προσδιορισμού της δομής των πρωτεϊνών υπήρξε ανακάλυψη πρωταρχικής σημασίας για την κατανόηση της δράσης των ενζύμων και του ρόλου τους στα βιολογικά συστήματα. Για αυτήν την πρωτοποριακή έρευνα τιμήθηκε με το Nobel Χημείας του 1954.
|
|
|
|
(1901-1994) |
Για την επιστημονική πολυπραγμοσύνη του Pauling και την εν γένει προσφορά του στην Επιστήμη και την Ανθρωπότητα, μπορεί να αναζητηθεί άφθονο υλικό στο διαδίκτυο, όπως ο ιστότοπος αυτός. |
Θα πρέπει να σημειωθεί ότι η επιστημονική κοινότητα "όφειλε" στον Pauling το Nobel για δεκαετίες. Ενώ εμφανιζόταν συνεχώς ως υποψήφιος για το βραβείο, έβλεπε νεότερούς του επιστήμονες, να βραβεύονται ακόμη και για μικρότερης σημασίας επιστημονικά επιτεύγματα. Ουσιαστικά, το Nobel που έλαβε τελικά το 1954 δεν αφορούσε αυτή τη συγκεκριμένη ερευνητική ανακάλυψη, αλλά επιβράβευε μια ολόκληρη ζωή συνεχούς προσφοράς στην Επιστήμη της Χημείας σε πολλούς τομείς.
Ο Pauling υπήρξε ο μόνος επιστήμονας που τιμήθηκε με δεύτερο Nobel, που δεν είχε σχέση με τις Φυσικές Επιστήμες. Το 1963 τιμήθηκε με το Nobel Ειρήνης για την επιτυχή εκστρατεία του για την κατάργηση των πυρηνικών δοκιμών στην ατμόσφαιρα. Ο φιλειρηνικός ακτιβισμός του Pauling του είχε στοιχίσει τη στέρηση του διαβατηρίου του από το Υπουργείο Εξωτερικών των ΗΠΑ (1952). Βέβαια, το διαβατήριο του επεστράφη λίγο αργότερα, όταν χρειάστηκε να μεταβεί στη Σουηδία για την παραλαβή του πρώτου του βραβείου Nobel.
Το 1944, ο Αμερικανός χημικός Robert Burns Woodward (1917-1979) με τον συνεργάτη του William von Eggers Doering (1917-2011) ανακοίνωσαν τη σύνθεση της κινίνης, γεγονός που για εκείνη την εποχή ήταν μεγάλο επίτευγμα οργανικής σύνθεσης. Τη δεκαετία του 1940, στο εργαστήριο του Woodward συνέθεσαν σημαντικές οργανικές ενώσεις, όπως η χοληστερόλη, η κορτιζόνη, η στρυχνίνη, το λυσεργικό οξύ, η ρεσερπίνη και άλλα φυσικά προϊόντα με αρκετά πολύπλοκη μοριακή δομή. Στην αρχή της δεκαετίας του 1960 ο Woodward και συνεργάτες συνέθεσαν με πολυάριθμα στάδια το εξαιρετικά πολύπλοκο μόριο της Βιταμίνης Β12. Ο Woodward τιμήθηκε για το πολύπλευρο συνθετικό του έργο με το Nobel Χημείας του 1965.
Το 1952 ο Robert Burns Woodward (1917-1979), ο 'Αγγλος χημικός Geoffrey Wilkinson (1921-1996) και ο Γερμανός χημικός Ernst Otto Fischer (1918-2007) διευκρίνισαν τη δομή του φερροκενίου και καθιέρωσαν την Οργανομεταλλική Χημεία ως ιδιαίτερο κλάδο της Χημείας. Οι Geoffrey Wilkinson και Ernst Otto Fischer τιμήθηκαν το 1973 με το Nobel Χημείας για τις ανακαλύψεις τους, που συνέβαλαν στην αλματώδη ανάπτυξη της Οργανομεταλλικής Χημείας.
|
Robert Burns Woodward (1917-1979) |
(1921-1996) |
(1918-2007) |
|
 |
| Η σύνθεση και στη συνέχεια η διευκρίνιση της δομής του φερροκενίου (η πρώτη γνωστή ένωση "σάντουιτς") κατά τη δεκαετία του 1950, έδωσε σημαντική ώθηση στο πεδίο της Οργανομεταλλικής Χημείας (βλ. Χημική ένωση του μήνα: φερροκένιο). | ||||
Το 1953 υπήρξε μια ιδιαίτερα σημαντική χρονιά για την επιστήμη. Οι Αμερικάνος βιολόγος James Watson (1928), ο 'Αγγλος βιοφυσικός Francis Crick (1916-2004), ο Νεοζηλανδός βιολόγος Maurice Wilkins (1916-2004) και η Αγγλίδα βιοφυσικός και χημικός Rosalind Franklin (1920-1958) με την τριπλή δημοσίευση των ερευνητικών τους εργασιών στο περιοδικό Nature (βλ. συλλογή αυτών των πρωτοποριακών δημοσιεύσεων) πρότειναν τη δομή της διπλής έλικας για το μόριο του DNA (δυο αλληλοσυγκρατούμενοι πολυνουκλεοτιδικοί κλώνοι). Η ανακάλυψη αυτή θεωρήθηκε εξαιρετικά σημαντική για την κατανόηση της κληρονομικότητας. 'Ετσι, έγινε κατανοητό πλέον ότι οι γενετικές πληροφορίες ενός οργανισμού αποθηκεύονται στην αλυσίδα του μορίου DNA, υπό τη μορφή της αλληλουχίας των δεοξυριβονουκλεοτιδίων. Αυτό ονομάσθηκε "κεντρικό δόγμα της μοριακής γενετικής". Οι Watson, Crick και Wilkins τιμήθηκαν με το Nobel Ιατρικής και Φυσιολογίας του 1963. Δυστυχώς, ο πρόωρος θάνατος της Franklin στέρησε την ίδια από μια ανάλογη τιμή και την Επιστήμη από μια πανάξια λειτουργό της.
|
|
|
|
 |
 |
|
|
(1928) |
(1916-2004) |
(1916-2004) |
(1920-1958) |
Τμήμα μορίου DNA και η περίφημη "φωτογραφία 51": Περιθλασίγραμμα ακτίνων Χ ίνας DNA, που ελήφθη από τη Franklin και απεκάλυπτε τη χαρακτηριστική διπλή έλικα και άλλα δομικά στοιχεία του μορίου του DNA (βλ. "ανατομία της φωτογραφίας 51"). |
|
Το 1953, ο Αμερικανός χημικός και βιολόγος Stanley Miller (1930-2007) και Harold Clayton Urey (που είχε ανακαλύψει το δευτέριο) στο Πανεπιστήμιο του Σικάγου έκαναν ένα πρωτοποριακό πείραμα για τη σύνθεση οργανικών ενώσεων σε προβιοτικές συνθήκες. Ο βομβαρδισμός με ηλεκτρικές εκκενώσεις μίγματος αερίων CH4, NH3, H2 και υδρατμών, δηλ. σε συνθήκες που προσομοίαζαν εκείνες της αρχέγονης ατμόσφαιρας της Γης, έδωσε έναν "ζωμό" που περιείχε μια ποικιλία αμινοξέων και άλλων οργανικών ουσιών, πρόδρομων ενώσεων μορίων βιολογικής σημασίας (πρωτεϊνών, DNA). Το πείραμα των Miller-Urey περιγράφεται στις εισαγωγικές σελίδες σχεδόν κάθε βιβλίου Βιοχημείας και αποτέλεσε ένα σημαντικό βήμα στην αναζήτηση μιας τεκμηριωμένης θεωρίας ως προς την προέλευση της ζωής στον πλανήτη Γη πριν από 3,5-4 δισεκατομμύρια χρόνια.
 |
 |
 |
 |
|
| O Stanley Miller (1930-2007) και η περίφημη πειραματική διάταξη προσομοίωσης της αρχέγονης ατμόσφαιρας της Γης. | Ο Frederick Sanger (1918) και το μόριο της ινσουλίνης στο οποίο προσδιόρισε την αλληλουχία των αμινοξέων. | |||
Κατά την περίοδο 1951-1953 ο 'Αγγλος βιοχημικός Frederick Sanger (1918) βρήκε τρόπο προσδιορισμού της αλληλουχίας των αμινοξέων της ινσουλίνης (βλ. Χημική ένωση του μήνα: Ινσουλίνη), που αποτελείται από δύο πεπτιδικές αλυσίδες συνδεόμενες με δύο δισουλφιδικές γέφυρες. Ο Sanger τιμήθηκε για την ανακάλυψή του αυτή με το Nobel Χημείας του 1958. Το 1980 ο Sanger μαζί με τον Αμερικανό βιοχημικό, φυσικό και μοριακό βιολόγο Walter Gilbert (1932) μοιράσθηκαν το Nobel Χημείας για τη συμβολή τους στον προσδιορισμό της ακολουθίας των νουκλεϊνικών βάσεων στα νουκλεϊνικά οξέα (DNA), ενώ το άλλο μισό του βραβείου απονεμήθηκε στον Paul Berg (1926) για τις βασικές βιοχημικές έρευνες στον τομέα των νουκλεϊνικών οξέων και ιδιαίτερα του ανασυνδυασμένου DNA.
 |
 |
 |
|
(1898-1973) |
(1903-1979) |
Με τους καταλύτες Ziegler-Natta (εδώ μεταλλοκένιο Ti ή Zr), ελέγχεται ο βαθμός πολυμερισμού των α-ολεφινών και η στερεο- χημεία του λαμβανόμενου πολυμερούς. |
Η δεκαετία του 1950-1960 συνέβη μια ανακάλυψη ιδιαίτερα μεγάλης επιστημονικής και οικονομικής σημασίας για τη βιομηχανία των πολυμερών. Ο Γερμανός χημικός Karl Waldemar Ziegler (1898-1973), σε συνεργασία με τον Ιταλό χημικό μηχανικό Giulio Natta (1903-1979), βρήκαν τους περίφημους καταλύτες, γνωστούς πλέον ως καταλύτες Zigler-Natta. Με τους καταλύτες αυτούς (οργανομεταλλικές ενώσεις του αργιλίου, του τιτανίου και ζιρκονίου) μπορούσαν να ελέγξουν τον πολυμερισμό α-ολεφινών (και κυρίως του αιθυλενίου και του προπυλενίου) για σχηματισμό πολυμερών καθορισμένης περιοχής μοριακής μάζας και στερεοχημείας (τακτικότητας). Για την ανακάλυψή τους αυτοί οι Ziegler και Natta τιμήθηκαν με το Nobel Χημείας του 1963.
17.4. Περίοδος 1961-1995
Το 1962 ο Αμερικανός βιοχημικός Robert Bruce Merrifield (1921-2006), καθηγητής στο Ινστιτούτο Ροκφέλλερ, Νέα Υόρκη, ανακοίνωσε για πρώτη φορά την ανακάλυψη της αυτοματοποιημένης πεπτιδικής σύνθεσης (σύνθεση στερεάς φάσης κατά Merrifield) σε υπόστρωμα πολυστυρενίου, που απλούστευσε κατά πολύ την παρασκευή πεπτιδίων. Ο Merrifield τιμήθηκε με το Nobel Χημείας του 1984.
Κατά την περίοδο 1953-1960, στα Πανεπιστήμια του Καίμπριτζ και της Οξφόρδης, ο Αυστριακής καταγωγής Βρετανός μοριακός βιολόγος Max Perutz (1914-2002) και ο 'Αγγλος χημικός John Kendrew (1917-1997) πραγματοποιούν μελέτες σφαιρικών πρωτεϊνών με ακτίνες-Χ. Είναι η "χρυσή περίοδος" της μελέτης των πρωτεϊνικών κρυστάλλων μεγάλης σημασίας βιολογικών μορίων σε ερευνητικά εργαστήρια. Οι δύο επιστήμονες επιβραβεύονται με το Nobel Χημείας του 1962 για τη εξακρίβωση της τρισδιάστατης δομής της αιμοσφαιρίνης και της μυοσφαιρίνης.
Το 1962, ο 'Αγγλος χημικός Neil Bartlett (1932-2008) στο Πανεπιστήμιο του Berkeley στην Καλιφόρνια συνέθεσε την πρώτη σταθερή χημική ένωση ευγενούς αερίου. Μέχρι τότε τα ευγενή αέρια θεωρούνταν τελείως αδρανή. Ο Bartlett ανέμειξε ατμούς PtF6 με ξένον και διαπίστωσε μια άμεση αντίδραση και σχηματισμό της ένωσης εξαφθορολευκοχρυσικό ξένον, Xe+[PtF6]-. Tην ίδια χρονιά άλλοι επιστήμονες συνέθεσαν φθοριωμένες ενώσεις ξένου (XeF2, XeF4 και XeF6). Ακολούθησαν η σύνθεση του οξειδίου του ξένου(VI), του ξενικού οξέος (H2XeO4) και υπερξενικού οξέος (H4XeO6) και αλάτων του. Σήμερα είναι γνωστές εκατοντάδες σταθερές ενώσεις του ξένου και περιορισμένος αριθμός από ασταθείς ενώσεις του κρυπτού (όπως το KrF2).
|
(1921-2006) |
Μια από τις πειραματικές διατάξεις που χρησιμοποίησε ο Merrifield για την αυτοματοποιημένη σύνθεση πεπτιδίων.
|
|
(1932-2008)
|
Τη δεκαετία του 1960 προκάλεσε έκπληξη η σύνθεση των πρώτων σταθερών ενώσεων του ευγενούς αερίου ξένον. Σήμερα, πολλές από τις ενώσεις αυτές είναι εμπορικά διαθέσιμες (στη φωτογραφία φιάλες με XeF2) |
Το ίδιο έτος, o Ούγγρος χημικός George Andrew Olah (1927) ανακαλύπτει τρόπο παρασκευής και σταθεροποίησης των καρβοκατιόντων μέσω αντιδράσεων υδρογονανθράκων με σουπεροξέα, όπως το περίφημο "μαγικό οξύ" (μίγμα SbF5 - HSO3F), τα οποία χαρακτηρίζονται από μια ισχυρότατη πρωτονιοδοτική ικανότητα. Ο Olah βραβεύθηκε για τη σημαντική του συμβολή στη χημεία των καρβοκατιόντων και των αντιδράσεων τους με το Nobel Χημείας του 1994 (βλ. Χημική ένωση του μήνα: Μαγικό οξύ).
Το 1964, η Βρετανίδα χημικός Dorothy Mary Crowfood-Hodgkin (1910-1994) τιμήθηκε με το Nobel Χημείας για τις πολυετείς έρευνές της πάνω στην εξακρίβωση της τριτογενούς δομής πρωτεϊνών με κρυσταλλογραφία ακτίνων Χ. Η Hodgkin, με κρυσταλλογραφία ακτίνων Χ, συνέβαλε στη μελέτη της ινσουλίνης, πενικιλίνης και της βιταμίνης Β12.
 |
 |
 |
 |
|
(1914-2002) |
(1917-1997) |
(1927) |
Dorothy Mary Crowfood-Hodgkin (1910-1994) |
Το 1964, ο Ελβετός φυσικοχημικός Richard Robert Ernst (1933) πρότεινε την εφαρμογή του Ταχέος Μετασχηματισμού Fourier (Fast Fourier Transform, FFT) στη φασματοσκοπία του Πυρηνικού Μαγνητικού Συντονισμού (NMR). Με την εφαρμογή σύντομων και ισχυρών παλμών κατά τη λήψη του φάσματος, αντί της συνεχούς σάρωσης, βελτιώνεται η ευαισθησία της λήψης του φάσματος και με μαθηματική επεξεργασία του λαμβανόμενου σήματος (σήμα ως προς χρόνο) λαμβάνεται το φάσμα NMR (σήμα ως προς συχνότητα). Η μέθοδος αργότερα βρήκε σημαντική εφαρμογή στο NMR δύο διαστάσεων (2D-NMR) και της απεικόνισης μαγνητικού συντονισμού, γνωστότερης ως Μαγνητική Τομογραφία (Magnetic Resonance Imaging, MRI) με εφαρμογές στην ιατρική διάγνωση ασθενειών. Ο Ernst τιμήθηκε με το Nobel Χημείας του 1991.
Το 1965, οι Αμερικανοί χημικοί Robert Burns Woodward (1917-1979) και Roald Hoffmann (1937) πρότειναν τους κανόνες Woodward-Hoffmann (rules), οι οποίοι χρησιμοποιούν τη συμμετρία των μοριακών τροχιακών για να ερμηνεύσουν τη στερεοχημεία των χημικών αντιδράσεων και ιδιαίτερα των περικυκλικών αντιδράσεων. Οι Roald Hoffman και ο Ιάπωνας χημικός Kenichi Fukui (1918-1998), ο οποίος εισήγαγε μια απλοποιημένη προσέγγιση στα μοριακά τροχιακά για τις περικυκλικές αντιδράσεις με την εξέταση των μετωπικών τροχιακών, HOMO και LUMO, τιμήθηκαν για τις ανακαλύψεις στον τομέα των μοριακών τροχιακών με το Nobel Χημείας του 1981.
Κατά τις δεκαετίες 1950, 1960 και 1970 ένα από τα πιο διάσημα εργαστήρια οργανικών συνθέσεων και ανακάλυψης νέων συνθετικών μεθόδων υπήρξε το εργαστήριο του Elias James Corey (1928) στο Πανεπιστήμιο Harvard. Η ομάδα του εργαστηρίου Corey, στην οποία εργάστηκαν πολυάριθμοι χημικοί, υπήρξε εξαιρετικά δραστήρια. Στο εργαστήριο αυτό αναπτύχθηκαν περισσότερες από 300 συνθετικές μέθοδοι και πραγματοποιήθηκαν περισσότερες από 300 ολικές συνθέσεις πολύπλοκων οργανικών ενώσεων. Ο Corey ανέπτυξε τη μεθοδολογία της ρετροσυνθετικής ανάλυσης στη χημική σύνθεση. Το 1989, οι Corey EJ και Chen X-M δημοσίευσαν το σημαντικό βιβλίο "The Logic of Chemical Synthesis", που αποτελεί σταθμό στην οργανική σύνθεση. Ο Corey τιμήθηκε με το Nobel Χημείας του 1990, για την ανάπτυξη της ρετροσυνθετικής ανάλυσης.
Το 1971, ο Γάλλος χημικός Yves Chauvin (1930) ερμηνεύει τον μηχανισμό της ολεφινικής μετάθεσης, δηλαδή ενός είδους ανακατανομής των θραυσμάτων αλκυλενίου κατά τη σχάση του διπλού δεσμού άνθρακα-άνθρακα σε ολεφίνες. Η ανακάλυψη έπαιξε σημαντικό ρόλο στην έρευνα της οργανικής σύνθεσης και στη Βιομηχανική Χημεία (πετρέλαια, φάρμακα, πολυμερή). Ο Chauvin μαζί με τους Richard R. Schrock (1945) και Robert H. Grubbs (1942) τιμήθηκαν για τη συμβολή τους στο πεδίο της ολεφινικής μετάθεσης με το Nobel Χημείας του 2005.
 |
 |
 |
 |
 |
 |
|
(1933) |
(1937) |
(1918-1998) |
(1928) |
(1930) |
(1941) |
To 1975, ο Αμερικανός χημικός Karl Barry Sharpless (1941) και οι συνεργάτες τους ανακάλυψαν τις αντιδράσεις της στερεοεκλεκτικής οξείδωσης, συμπεριλαμβανομένης της εποξείδωσης Sharpless, της ασυμμετρικής διϋδροξυλίωσης και οξυαμίνωσης Sharpless. To 2001 τιμήθηκε με Nobel Χημείας για τη συμβολή του στην ανακάλυψη των στερεοεκλεκτικών αντιδράσεων.
Το 1985, η επιστημονική κοινότητα εξεπλάγη όταν ο Βρετανός χημικός Harold Kroto (1939), ο Αμερικανός χημικός Robert Curl (1933) και ο Αμερικάνος χημικός, φυσικός και αστρονόμος Richard Smalley (1943-2005) ανακάλυψαν τα φουλερένια, μια άγνωστη μέχρι τότε μορφή άνθρακα, όπου τα άτομα είναι συνδεμένα μεταξύ τους κατά τρόπο που να σχηματίζονται μόρια με τη μορφή μπάλας, με επιφάνειες αποτελούμενες από πενταμελείς ή εξαμελείς ανθρακικούς δακτυλίους. Η πλέον γνωστή ένωση είναι αυτή με 60 άτομα άνθρακα (C60). Οι ενώσεις αυτές είναι οι μόνες μορφές άνθρακα που παρουσιάζουν κάποια διαλυτότητα σε διάφορους οργανικούς διαλύτες. Το όνομα "φουλερένια" προέρχεται από την ομοιότητα των μορίων αυτών με τους "γεωδαιτικούς" θόλους κτηρίων, που σχεδίασε ο αρχιτέκτονας Richard Buckminster Fuller (1895-1983). Οι Harold Kroto, Robert Curl και Richard Smalley τιμήθηκαν για αυτήν την ανακάλυψή τους με το Nobel Χημείας του 1996.
 |
 |
 |
 |
 |
|
(1939) |
(1933) |
(1943-2005) |
Μόριο του φουλερένιου C60 | Ο αρχιτέκτονας Richard Buckminster Fuller (1895-1983) μπροστά σε ένα γεωδαιτικό θόλο |
Το 1994-1996, πραγματοποιήθηκε η πρώτη ολική σύνθεση του αντικαρκινικού φαρμάκου Taxol (υπάρχει ως φυσικό προϊόν στον φλοιό του κορμού ενός είδους ελάτου) από τις ερευνητικές ομάδες του Κύπριου χημικού Kyriakos C. Nicolaou (1946) και των Αμερικανών χημικών Robert A. Holton και Samuel Danishefskiy (1936) (βλ. Χημική ένωση του μήνα: Ταξόλη).
 |
 |
 |
 |
|
Οι πρωταγωνιστές της ολικής σύνθεσης της ταξόλης: Αριστερά: Robert A Holton, Πολιτειακό Πανεπιστήμιο Φλόριντα. Μέσον: Kyriacos C. Nicolaou (1946, Κύπρος), Πανεπιστήμιο Καλιφόρνιας, στο San Diego. Δεξιά: Samuel J. Danishefsky (1936), Πανεπιστήμιο Columbia Νέας Υόρκης. |
Το μόριο της ταξόλης, η ολική σύνθεση της οποίας περιλαμβάνεται πλέον στα αριστουργήματα της Οργανικής Σύνθεσης. |
||
17.5. Οι σχετικά νεότερες εξελίξεις μέσω των Nobel Χημείας 1990-2010
Τα Βραβεία Nobel Χημείας των τελευταίων 15 χρόνων και η αιτιολογήσεις τους, όπως περιγράφονται από τη Επιτροπή Nobel της Βασιλικής Σουηδικής Ακαδημίας Επιστημών, αποτελούν ένα τρόπο συνοπτικής καταγραφής των σημαντικότερων επιτευγμάτων και ανακαλύψεων στους διάφορους τομείς της χημείας που πραγματοποιήθηκαν κατά τα τελευταία 30-40 χρόνια. Στις ανακαλύψεις αυτές σημαντικό υπάρχουν ανακαλύψεις με βιολογικά μόρια και βιοχημικές διεργασίες, νέες μεθόδους, νέα υλικά και ρύπανση του περιβάλλοντος. Τα βραβεία αυτά και η συνοπτική-τυπική αιτιολόγησή τους έχουν ως εξής:
1990, Elias James Corey: "Για την ανάπτυξη της θεωρίας και της μεθοδολογίας στην οργανική σύνθεση".
1991, Richard R. Ernst: "Για τη συνεισφορά του στην ανάπτυξη της μεθοδολογίας της φασματοσκοπίας πυρηνικού μαγνητικού συντονισμού (NMR) υψηλής διακριτικής ικανότητας".
1992, Rudolf A. Marcus: "Για τη συνεισφορά του στη θεωρία των αντιδράσεων μεταφοράς ηλεκτρονίων σε χημικά συστήματα".
1993, Kary B. Moullis, Michael Smith: "Για τη συνεισφορά τους στην ανάπτυξη της χημείας που βασίζεται στο DNA", κατά το ήμισυ στον πρώτο "Για την εφεύρεση των μεθόδων που βασίζονται στην αλυσιδωτή αντίδραση πολυμεράσης (PCR)" και κατά το υπόλοιπο ήμισυ στον δεύτερο "Για τη θεμελιακή συνεισφορά του στην καθιέρωση της βασιζόμενης σε ολιγονουκλεοτίδια κατευθυνόμενη κατά θέση μεταλλαξιγένεση και στην εφαρμογή της για τη μελέτη των πρωτεϊνών".
1994, George Α. Olah: "Για τη συνεισφορά του στη χημεία των καρβοκατιόντων".
1995, Paul J. Crutzen, Mario J. Molina, F. Sherwood Rowland: "Για την εργασία τους στην ατμοσφαιρική χημεία και ειδικότερα σε ό,τι αφορά τον σχηματισμό και τη διάσπαση του όζοντος".
 |
 |
 |
 |
 |
| Paul J. Crutzen (1933) | Mario J. Molina (1943) | F. Sherwood Rowland (1927) | Οι έρευνες των Crutzen, Molina και Rowland πάνω στις καταστροφικές επιπτώσεις των χλωροφθορανθράκων στο τροποσφαιρικό όζον, είχαν ως αποτέλεσμα τη σταδιακή απαγόρευση της παραγωγής και κάθε είδους χρήσης αυτών των ουσιών (βλ. Χημική ένωση του μήνα: 'Οζον) | |
1996, Harold W. Croto, Robert Curt, Richard E. Smalley: "Για την ανακάλυψη των φουλερενίων".
1997, Paul D. Boyer, John E. Walker, Jens C. Skou: Το ήμισυ του βραβείου στους δύο πρώτους "Για τη διευκρίνιση του ενζυμικού μηχανισμού σύνθεσης της τριφωσφορικής αδενοσίνης (ATP)" και το υπόλοιπο ήμισυ στον τρίτο "Για την πρώτη ανακάλυψη ενός ιοντο-μεταφορικού ενζύμου της Na+,K+ - ATPάσης".
1998, Walter Kohn, John A. Pople: Στον πρώτο "Για την ανάπτυξη της συναρτισοειδούς θεωρίας" και στον δεύτερο "για την ανάπτυξη υπολογιστικών μεθόδων στην Κβαντική Χημεία".
1999, Ahmed H. Zewall: "Για τις μελέτες του στις μεταπτωτικές καταστάσεις χημικών αντιδράσεων χρησιμοποιώντας φασματοσκοπία φεμτοδευτερολέπτων".
 |
 |
 |
| Ahmed H. Zewall (1946) |
Σύστημα υπερταχέος laser στερεάς κατάστασης (Ti : σαπφείρου) που χρησιμοποιείται για τη μελέτη ταχύτατων αντιδράσεων |
Τυπικό 3-D φάσμα (απορρόφηση ως συνάρτηση μήκους κύματος - χρόνου) |
2000, Allan J. Heeger, Allan G. McDiarmidt, Hideki Shirakawa: "Για την ανακάλυψη κα την ανάπτυξη αγώγιμων πολυμερών".
2001, William S. Knowles, Ryoji Noyori, K.Barry Sharpless: Το ήμισυ του βραβείου στους δύο πρώτους "Για την εργασία του πάνω στις χειραλικά καταλυόμενες αντιδράσεις υδρογόνωσης" και το υπόλοιπο ήμισυ στον τρίτο "Για την εργασία του πάνω στις χειραλικά καταλυόμενες αντιδράσεις οξείδωσης".
2002, John B. Fenn, Koici Tanaka, Kurt Wüthrich: "Για την ανάπτυξη μεθόδων ταυτοποίησης και δομικής ανάλυσης βιολογικών μακρομορίων", κατά το ήμισυ στους δύο πρώτους "Για την ανάπτυξη των μεθόδων ιοντισμού μαλακής εκρόφησης για αναλύσεις βιολογικών μακρομορίων με φασματομετρία μάζας" και κατά το υπόλοιπο ήμισυ στον τρίτο "Για την ανάπτυξη μεθόδων μαγνητικού πυρηνικού συντονισμού για τον προσδιορισμό της τρισδιάστατης δομής βιολογικών μακρομορίων σε διάλυμα".
2003, Peter Agre, Robert MacKinnon: "Για τις ανακαλύψεις σχετικά με τις μεμβράνες των κυττάρων", στον πρώτον "για την ανακάλυψη διαύλων ύδατος" και στον δεύτερο "Για τις δομικές και μηχανιστικές μελέτες των διαύλων ιόντων".
2004, Aaron Ciechanover, Avram Hershko, Irwin Rose: "Για την ανακάλυψη της απόπτωσης των πρωτεϊνών με την παρέμβαση της ουβικιτίνης".
2005, Ives Chauvin, Robert J. Grubbs, Richard R. Schrock: "Για την ανάπτυξη μεταθετικών μεθόδων στην οργανική σύνθεση".
2006, Rodger D. Kormberg: "Για τις μελέτες του σε μοριακή βάση των μηχανισμών αντιγραφής γενετικών πληροφοριών σε ευκαρυωτικά κύτταρα".
2007, Gerhard Ertl: "Για τις μελέτες του επί των χημικών διεργασιών σε επιφάνειες στερεών".
 |
 |
 |
|
Gerhard Ertl (1936) |
(α) Οργάνωση των ατόμων υδρογόνου (μικροί κύκλοι) σε μονοστιβάδα, επάνω σε επιφάνεια (111) λευκοχρύσου. (β) Δομή της επικάλυψης με άτομα αζώτου (μικροί κύκλοι) σε επιφάνεια (100) σιδήρου. Αριστερά: κάτοψη, δεξιά: πλευρική άποψη (Πηγή). |
|
2008, Osama Shimomura, Martin Chalfie, Rogen Y. Tsien: "Για την ανακάλυψη, ανάπτυξη και πολλαπλές εφαρμογές της πράσινης φθορίζουσας πρωτεΐνης (Green Fluorescent Protein, GFP)".
2009, Venkatraman Ramakrishnan, Thomas A. Steitz, Ada E. Yonath: "Για τις μελέτες τους πάνω στη δομή και τη λειτουργία των ριβοσωμάτων".
2010, Richard F. Heck, Erichi Negishi, Akira Suazuki: "Για τις αντιδράσεις διασταυρούμενης σύνθεσης που καταλύονται από παλλάδιο".
18. Επίλογος
Η ιστορία της Χημείας συνεχίζεται με αμείωτο ερευνητικό και επιστημονικό ενδιαφέρον. Παρά τη ραγδαία εξέλιξη των Θετικών Επιστημών και ιδιαίτερα της Χημείας, τα τελευταία 50 χρόνια, παραμένουν ανεξερεύνητες πολλές επιστημονικές περιοχές και έτσι, ακόμη και σήμερα παραμένουν πολλά ερωτήματα και πολλές ενδιαφέρουσες πλευρές των φυσικών φαινομένων που δεν έχουν εξηγηθεί επαρκώς.
'Οπως και στους άλλους κλάδους της επιστήμης, η Χημεία είχε μια εξελικτική πορεία με πολλές ανατροπές, λανθασμένες απόψεις και σφάλματα στην ερμηνεία χημικών φαινόμενων. Παρ' όλα αυτά η πολύχρονη πειραματική εργασία χιλιάδων χημικών και οι οξυδερκείς παρατηρήσεις τους διαλεύκαναν πολλές πλευρές της χημικής δομής και των χημικών ιδιοτήτων των διαφόρων ουσιών. Η Χημεία συνέβαλε αποφασιστικά στην αύξηση του προσδόκιμου ζωής του ανθρώπου, στη θεραπεία πολλών ασθενειών και στην ανακάλυψη μεθόδων και νέων υλικών, που βελτίωσαν την ποιότητα της ζωής του ανθρώπου.
Η τεκμηριωμένη πειραματική εργασία πολλών χημικών και η επανάληψη των πειραματικών δεδομένων παραμένει η μόνη ασφαλής μέθοδος για την πρόοδο της επιστήμης. Στην ιστορία της Χημείας υπήρξαν πολλοί επιστήμονες οι οποίοι με τα ευφυή πειράματά τους και την εύστοχη ερμηνεία των φυσικοχημικών αποτελεσμάτων συνέβαλαν στην πρόοδο της επιστήμης και στη διαφώτιση του ανθρώπου για τα φυσικά φαινόμενα πάνω στον πλανήτη Γη και στο Σύμπαν.
ΒΙΒΛΙΟΓΡΑΦΙΑ (Ελληνικά βιβλία για τη Χημεία)
1. Novelli, Luca: "Η Ιστορία της Χημείας σε Κόμικς. Από την Αρχή του 19ου Αιώνα έως τα Τέλη του 20ου". Κάτοπτρο, Αθήνα, 1992.
2. Novelli, Luca: "Η Ιστορία της Χημείας σε Κόμικς. Από την Αρχαία Αίγυπτο έως τις Αρχές του 19ου Αιώνα". Κάτοπτρο, Αθήνα, 1992.
3. Bensaude-Vincent, Bernadett: "Ιστορία της Χημείας", Τραυλός, Αθήνα, 1999.
4. Strathem, Paul: "Το 'Ονειρο του Μεντελέγιεφ - Η Αναζήτηση των Στοιχείων από την Αλχημεία στη Χημεία", Τραυλός, Αθήνα, 2004.
5. Leicester, Henry: "Ιστορία της Χημείας", Τροχαλία, 1993.
6. Φραγκόπουλος ΣΤ,Γ. Ιστορία της Τεχνολογίας: Αναγέννηση και Διαφωτισμός. 2004.
7. Βλαχάκης, Γεώργιος (Επιμ.): "Η Ιστορική Εξέλιξη της Χημείας στην Ελλάδα", Πρακτικά Πανελληνίου Συμποσίου. Οκτώβριος 1994, Τροχαλία, Αθήνα, 1995.
8. Βάρβογλης, Αναστάσιος: "Μεγάλοι Χημικοί. Η Παλαιά Φρουρά", Ζήτη, Θεσσαλονίκη, 1996.
9. Βάρβογλης, Αναστάσιος: "Μεγάλοι Χημικοί. Η Χρυσή Εποχή" , Ζήτη, Θεσσαλονίκη, 1997.
10. Βάρβογλης, Αναστάσιος: "Μεγάλοι Χημικοί. Οι Πρωτοπόροι", Ζήτη, Θεσσαλονίκη, 2007.
11. Βάρβογλης, Αναστάσιος: "Πορτρέτα των Χημικών Στοιχείων", Πανεπιστημιακές Εκδόσεις Κρήτης, Ηράκλειο, 2001.
ΒΙΒΛΙΟΓΡΑΦΙΑ ΞΕΝΟΓΛΩΣΣΩΝ ΒΙΒΛΙΩΝ ΓΙΑ ΤΗΝ ΙΣΤΟΡΙΑ ΤΗΣ ΧΗΜΕΙΑΣ
1. Knight D, Kragh H: "The Making of the Chemist: The Social History of Chemistry in Europe, 1789-1914", Cambridge University Press, Cambridge, 2008.
2. Partington JR: "A Short History of Chemistry", Dover Publications, New York, 3rd ed., 1989.
3. Brock WH: "The Chemistry Tree: A History of Chemistry", WW Norton, New York, 2000.
4. Jaffe B: "Crucibles: The Story of Chemistry from Ancient Alchemy to Nuclear Fission", Dover Publications, New York, 4th ed., 1976.
5. Levere TH: "Transforming Matter; A History of Chemistry from Alchemy to the Buckyball", Johns Hopkins University Press, 2001.
6. Cobb C: "Creation of Fire. Chemistry's Live History from Alchemy to the Atomic Αge", Basic Books, 2002.
7. Benfey OT, Morris PTJ (Eds): "Robert Burns Woodward. Architect and Artist in the World of Molecules", Chemical Heritage Foundation, 2001.
8. Bensaude-Vincent B, Stengers I: "A History of Chemistry", Harvard University Press, Cambridge, Mass, 1996.
9. Holmes FL, Levere TH (Eds): "Instruments and Experimentation in the History of Chemistry", The MIT Press, Cambridge, Mass, 2000.
10. Needham J: "Science and Civilization in China", 27 volumes, Cambridge University Press, Cambridge, 1980-2010.
11. Pauling L: "General Chemistry", Dover Publications, New York, 1947.
ΠΗΓΕΣ ΑΠΟ ΤΟ ΔΙΑΔΙΚΤΥΟ
1. History of Chemistry, History of Science, and Scientific Biography.
2. Wikipedia: "Timeline of Chemistry".
3. Η θεμελίωση της Χημείας, (από την εκπληκτική δουλειά του Στ. Γ. Φραγκουλόπουλου: "Ιστορία της Τεχνολογίας")
4. A brief history of Chemistry, Michael Ridenour, 2004.
|
Αποποίηση ευθυνών: Έχει καταβληθεί κάθε προσπάθεια για να εξασφαλισθεί η ορθότητα των πληροφοριών που περιλαμβάνονται σε αυτή τη σελίδα, ωστόσο ο έχων την επιμέλεια της σελίδας αυτής και το Τμήμα Χημείας δεν αναλαμβάνουν τη νομική ευθύνη για τυχόν σφάλματα, παραλείψεις ή ανακριβείς πληροφορίες. Επιπλέον, το Τμήμα Χημείας δεν εγγυάται την ορθότητα των αναφερόμενων σε εξωτερικές ιστοσελίδες, ούτε η αναφορά μέσω συνδέσμων (links) στις ιστοσελίδες αυτές, υποδηλώνει ότι το Τμήμα Χημείας επικυρώνει ή καθ' οιονδήποτε τρόπο αποδέχεται το περιεχόμενό τους. |