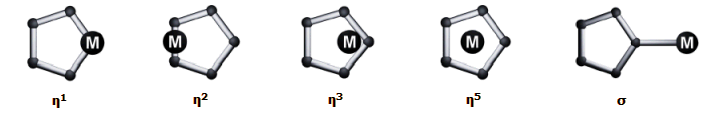Η χημική ένωση του μήνα
[Αύγουστος 2010]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής - Κωνσταντίνος Ευσταθίου, Καθηγητής
|
Φυσικoχημικές ιδιότητες [Αναφ. 1]: Εμφάνιση: Στερεό με ελαφρά πορτοκαλί χρώμα, σταθερό στον αέρα Μοριακός τύπος: C10H10Fe Σχετική μοριακή μάζα: 186,04 Σημείο τήξης: 174 ºC (με εξάχνωση) Σημείο βρασμού: 249 ºC (σταθερό μέχρι περίπου τους 470 ºC) Πυκνότητα: 1,107 g/cm3 (0 ºC) Διαλυτότητα: πρακτικά αδιάλυτο στο νερό, διαλυτό στους περισσότερους οργανικούς διαλύτες. Τυπικές διαλυτότητες (w/w%): βενζόλιο 18,6%, τολουόλιο 15,5%, τετραχλωράνθρακα 8,2%, κυκλοεξάνιο 6,1%, αιθανόλη 2,4%, n-βουτανόλη 0,3% [Αναφ. 1β] Τοξικότητα (οξεία): LD50 (σε αρουραίους): 1320 mg/kg (σχετικά μικρή τοξικότητα) [Αναφ. 1γ] |
|
|
Φερροκένιο, δις(η5-κυκλοπενταδιενυλο)σίδηρος Ferrocene, bis(η5-cyclopentadienyl)iron |
Η ταχύτατη εξέλιξη της χημείας των οργανομεταλλικών ενώσεων οφείλεται στο ενθουσιασμό που προκάλεσε στην κοινότητα των Χημικών
η ανακάλυψη του φερροκενίου στις αρχές της δεκαετίας του 1950 και στη συνέχεια η σύνθεση πολλών άλλων ανάλογων ενώσεων
|
William Christopher Zeise (1789-1847): Συνέθεσε (τυχαία) την πρώτη οργανομεταλλική ένωση |
Οι ενώσεις-σταθμοί της Οργανομεταλλικής Χημείας |
Η ανακάλυψη των οργανομεταλλικών ενώσεων
Ως οργανομεταλλικές ενώσεις χαρακτηρίζονται οι οργανικές ενώσεις που περιέχουν μέταλλα και ειδικότερα οι ενώσεις που περιέχουν δεσμούς ενός ή περισσότερων ατόμων μετάλλων με ένα ή περισσότερα άτομα άνθρακα.
Το 1827, ο Δανός χημικός William Christopher Zeise παρασκεύασε τυχαία την πρώτη οργανομεταλλική ένωση με αντίδραση αιθυλενίου με άλας του λευκοχρύσου(ΙΙ). Η ένωση αυτή, με χημικό τύπο Κ[(C2H4PtCl3]·xH2O, είναι γνωστή πλέον ως άλας Zeise [Αναφ. 2α-δ].
Το 1890, ο 'Αγγλος χημικός (γερμανικής καταγωγής) Ludwig Mond και οι συνεργάτες του παρήγαγαν μια οργανομεταλλική ένωση, το τετρακαρβονυλονικέλιο Ni(CO)4, ένα τοξικότατο πτητικό υγρό (σ.ζ. 43 ºC), με απ' ευθείας αντίδραση του νικελίου με μονοξείδιο του άνθρακα στους 130ºC. Σε υψηλότερες θερμοκρασίες η ένωση διασπάται στα αρχικά συστατικά. Η ιδιότητα του νικελίου να σχηματίζει αυτήν την ένωση αξιοποιήθηκε για τον καθαρισμό του (μέθοδος Mond). Η παρασκευή μιας τόσο πτητικής ένωσης (σχεδόν όσο ο αιθέρας) ενός δύστηκτου μετάλλου, όπως είναι το νικέλιο, ήταν κάτι που εντυπωσίασε τους χημικούς εκείνης της εποχής [Αναφ. 2ε-στ].
Ωστόσο, οι δομές πολλών από τις "περίεργες" αυτές ενώσεις ήταν δύσκολο να διευκρινισθούν χωρίς τεχνικές όπως ο Πυρηνικός Μαγνητικός Συντονισμός (Nuclear Magnetic Resonance, NMR) και η Κρυσταλλογραφία Ακτίνων-Χ, που αναπτύχθηκαν από τη δεκαετία του 1950 και μετά. Οι σύγχρονες αυτές τεχνικές έδωσαν λεπτομερείς πληροφορίες για τη φύση και τη δομή των δεσμών των μετάλλων με τις ακόρεστες οργανικές ενώσεις και με τον τρόπο αυτό οδήγησαν στην κατανόηση της χημικής συμπεριφοράς και σταθερότητας των οργανομεταλλικών ενώσεων.
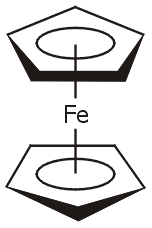
 Το φερροκένιο
(ferrocene) είναι μια οργανομεταλλική
ένωση που ανακαλύφθηκε το 1951 ανεξάρτητα και σχεδόν ταυτόχρονα από δύο ερευνητικές ομάδες
[Αναφ. 3α]. Το
φερροκένιο
αποτελεί το πλέον
αντιπροσωπευτικό παράδειγμα ένωσης-"σάντουιτς"
("sandwitch" compound), όπου δύο κυκλοπενταδιενυλικοί δακτύλιοι
διαθέτουν ηλεκτρόνια δεσμεύοντας σταθερά ανάμεσά τους ένα ιόν σιδήρου(ΙΙ). Η ανακάλυψη
του φερροκενίου και η διαπίστωση της παράδοξης (για εκείνη την εποχή) μορφής
του μορίου του ενθουσίασε την επιστημονική κοινότητα.
Το φερροκένιο
(ferrocene) είναι μια οργανομεταλλική
ένωση που ανακαλύφθηκε το 1951 ανεξάρτητα και σχεδόν ταυτόχρονα από δύο ερευνητικές ομάδες
[Αναφ. 3α]. Το
φερροκένιο
αποτελεί το πλέον
αντιπροσωπευτικό παράδειγμα ένωσης-"σάντουιτς"
("sandwitch" compound), όπου δύο κυκλοπενταδιενυλικοί δακτύλιοι
διαθέτουν ηλεκτρόνια δεσμεύοντας σταθερά ανάμεσά τους ένα ιόν σιδήρου(ΙΙ). Η ανακάλυψη
του φερροκενίου και η διαπίστωση της παράδοξης (για εκείνη την εποχή) μορφής
του μορίου του ενθουσίασε την επιστημονική κοινότητα.
Με την ανακάλυψη του φερροκενίου ξεκίνησε η "μοντέρνα περίοδος" της οργανομεταλλικής χημείας και τη σύνθεσή του ακολούθησε σχεδόν αμέσως η παρασκευή μεγάλου αριθμού αναλόγων οργανομεταλλικών ενώσεων-σάντουιτς και ιδιαίτερα εκείνων των μετάλλων του d-block, δηλ. των στοιχείων με ασυμπλήρωτα τα d-τροχιακά τους στη θεμελιώδη κατάσταση.
Η ανακάλυψη και η σύνθεση των ενώσεων-σάντουιτς και πλήθους παραγώγων τους, οδήγησε σε ευρεία ανάπτυξη της χημείας των οργανομεταλλικών ενώσεων και οδήγησε σε σημαντικότατες πρακτικές εφαρμογές ιδιαίτερα στον τομέα της χημικής κατάλυσης.
Σύνθεση του φερροκενίου
Τον Ιούλιο του 1951, οι Tom L. Kealy και Peter L. Pauson (Πανεπιστήμιο Duquesne της Πενσυλβάνιας) επεδίωξαν να συνθέσουν τη μέχρι τότε άγνωστη ένωση φουλβαλένιο (C10H8) μέσω του κυκλοπενταδιενυλομαγνησιοβρωμιδίου (C5H5MgBr). Περίμεναν ότι αυτό το αντιδραστήριο Grignard οργανικής ομάδας αλλυλικού χαρακτήρα θα μπορούσε να δώσει αντίδραση σύζευξης προς διμερές προϊόν (διυδροφουλβαλένιο). Στη συνέχεια, το προϊόν αυτό με οξείδωση θα παρείχε ζητούμενο φουλβαλένιο. Ωστόσο, αντί άνυδρου CoCl2, που χρησιμοποιείται συνήθως για αυτές τις συζεύξεις, χρησιμοποίησαν τριχλωριούχο σίδηρο, που είναι λιγότερο αποτελεσματικός, αλλά τον διέθεταν σε άνυδρη μορφή. Επιπλέον, ανέμεναν πως ο Fe(III) θα μπορούσε ίσως να δράσει και ως οξειδωτικό του διυδροφουλβαλενίου, ώστε να ληφθεί το επιθυμητό φουλβαλένιο. Η σειρά αντιδράσεων που προσδοκούσαν περιγράφεται ως εξής:

Ωστόσο, διαπίστωσαν τον σχηματισμό ενός άγνωστου μέχρι τότε πορτοκαλόχρωμου κρυσταλλικού στερεού σώματος "εξαιρετικής σταθερότητας" (σταθερό ακόμη και ως προς θερμό διάλυμα NaOH 10% και ως προς πυκνό HCl) με μοριακό τύπο C10H10Fe [Αναφ. 3α,γ].
Σήμερα βέβαια, γνωρίζουμε ότι μέρος του αντιδραστηρίου Grignard καταναλώθηκε για την αναγωγή του Fe(III) προς Fe(II) και στη συνέχεια ο FeCl2 αντέδρασε με το υπόλοιπο του αντιδραστηρίου Grignard παρέχοντας φερροκένιο, σύμφωνα με την αντίδραση:
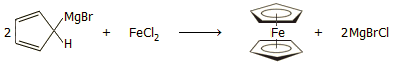
Την ίδια χρονιά οι Miller, Tebboth, Tremaine παρασκεύασαν φερροκένιο, το οποίο ονόμασαν δικυκλοπενταδιενυλο-σίδηρο, (C5H5)2Fe, διαβιβάζοντας ατμούς κυκλοπενταδιενίου (C5H6) πάνω από σκόνη πρόσφατα ανηγμένου σιδήρου σε υψηλή θερμοκρασία [Αναφ. 3β]. Η εργασία δημοσιεύθηκε το 1952, αλλά φαίνεται ότι η σύνθεση αυτή προηγήθηκε της τυχαίας σύνθεσης των Kealy και Pauson. Η αντίδραση ήταν απλά:
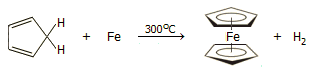
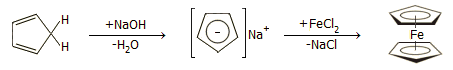
Η σύνθεση του φερροκενίου μπορεί να πραγματοποιηθεί απλούστερα με άμεση αντίδραση κυκλοπενταδιενίου με NaOH (ή με μεταλλικό νάτριο) προς σχηματισμό άλατος κυκλοπενταδιενίου - νατρίου, το οποίο στη συνέχεια αντιδρά με διχλωριούχο σίδηρο παρέχοντας φερροκένιο. Η αντίδραση πραγματοποιείται σε άνυδρο αιθερικό διάλυμα (τετραϋδροφουράνιο ή διμεθοξυαιθάνιο) και απουσία οξυγόνου. Η σύνθεση αυτή είναι απλή και αποτελεί συνηθισμένη άσκηση παρασκευής οργανομεταλλικής ένωσης στα Τμήματα Χημείας πολλών πανεπιστημίων [Αναφ. 4]. Η αλληλουχία των αντιδράσεων έχει ως εξής:
 |
 |
 |
 |
 |
|
(1) |
(2) |
(3) |
(4) |
(5) |
|
(1) Η συσκευή που χρησιμοποιείται για την άσκηση παρασκευής φερροκενίου [Αναφ. 4α]. (2-4) Καθαρισμός του ακάθαρτου προϊόντος της σύνθεσης με εξάχνωση του φερροκενίου υπό κενό με την τεχνική του "ψυχρού δακτύλου" (φωτογραφίες από εδώ). Ένα βίντεο καθαρισμού φερροκενίου με εξάχνωση υπάρχει εδώ. (5) Καθαροί κρύσταλλοι φερροκενίου. |
||||
|
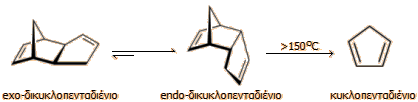
Δικυκλοπενταδιένιο και κυκλοπενταδιένιο: Οι δυο μορφές ενός χρήσιμου προϊόντος από το πετρέλαιο
Το δικυκλοπενταδιένιο (dicyclopentadiene, DCPD) είναι ένας πολυκυκλικός υδρογονάνθρακας με μοριακό τύπο C10H12. Είναι ένα από τα προϊόντα απόσταξης της λιθανθρακόπισας (10-20 g/τόνο) και της θερμικής διάσπασης της νάφθας (14 kg/τόνο) και του πετρελαίου για την παραγωγή αιθυλενίου. Αρχικά (μετά την απόσταξη) λαμβάνεται ως κυκλοπενταδιένιο, το οποίο στη συνέχεια σταθεροποιείται στη διμερή μορφή του, δηλ. ως δικυκλοπενταδιένιο. Η παγκόσμια παραγωγή του ξεπερνάει του 180.000 τόνους. Είναι ένα εύτηκτο κρυσταλλικό στερεό (ή και υγρό, ανάλογα με την καθαρότητά του) με οσμή καμφοράς. Έχει σ.τ. 32,5ºC, σ.β. 170 ºC και πυκνότητα 0,98 g/cm3 [Αναφ. 5]. Το δικυκλοπενταδιένιο του εμπορίου είναι μίγμα δύο μορφών σε ισορροπία: της endo-μορφής (97-98%) και της exo-μορφής (2-3%). Με θέρμανση πάνω από τους 150ºC αρχίζει να διασπάται παρέχοντας κυκλοπενταδιένιο, υφιστάμενο μια αντίστροφη retrο-αντίδραση Diels-Alder. Οι αντιδράσεις ισορροπίας και διάσπασης έχουν ως εξής:
Το δικυκλοπενταδιένιο χρησιμοποιείται ως πρώτη ύλη για την παρασκευή πολλών προϊόντων (πολυεστερικές ρητίνες, κόλλες, βαφές). Με χλωρίωση, το δικυκλοπενταδιένιο παρέχει το δραστικό εντομοκτόνο -απαγορευμένο πλέον- Chlordan, μέλος της περίφημης "βρωμερής δωδεκάδας" (βλ. Χημική ένωση του μήνα: "DDT"). Με υδρογόνωση παρέχει endo-τετραϋδρο-δικυκλοπενταδιένιο, το οποίο παρουσία AlCl3 μετατρέπεται σε αδαμαντάνιο. Από το αδαμαντάνιο παρασκευάζεται σειρά χρήσιμων χημικών αντιδραστηρίων για οργανική σύνθεση, όπως και φαρμακευτικές ουσίες.
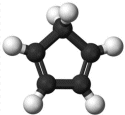
Το κυκλοπενταδιένιο (cyclopentadiene, CpH) είναι ένας ακόρεστος κυκλικός υδρογονάνθρακας με μοριακό τύπο C5H6 και επίπεδο μόριο. Είναι ένα πτητικό υγρό με σ.β. 41ºC και πυκνότητα 0,786 g/cm3 [Αναφ. 6]. Διαθέτει συζυγιακό σύστημα διπλών δεσμών και επομένως παρέχει εύκολα αντιδράσεις προσθήκης (Diels-Alder) με διενόφιλα αντιδραστήρια (π.χ. με μηλεϊνικό ανυδρίτη), αλλά και με τον... εαυτό του [Αναφ. 6β]. Για τον λόγο αυτό, σε θερμοκρασία δωματίου διμερίζεται σχετικά γρήγορα παρέχοντας δικυκλοπενταδιένιο κυρίως στην endo-μορφή. Το κυκλοπενταδιένιο είναι σταθερό για αρκετές ημέρες στους -30ºC και παραμένει πρακτικά αναλλοίωτο στους -80ºC. Όποτε χρειάζεται κυκλοπενταδιένιο (όπως π.χ. για τη σύνθεση του φερροκενίου), αυτό παρασκευάζεται εύκολα με απόσταξη του δικυκλοπενταδιενίου, το οποίο υφίσταται κατά τη διαδικασία αυτή διάσπαση. Το παραγόμενο κυκλοπενταδιένιο μπορεί να φυλαχθεί για αρκετές ώρες σε ψυγείο. Το κυκλοπενταδιένιο δρα ως ασθενέστατο μονοπρωτικό οξύ (pK = 15,5-16,0), κατά πολύ όμως ισχυρότερο από τους άλλους υδρογονάνθρακες που ουσιαστικά δεν υφίστανται την παραμικρή διάσταση. Έτσι, π.χ. αντιδρά με τα μέταλλα των αλκαλίων παρέχοντας τα αντίστοιχα άλατα. Το ανιόν κυκλοπενταδιενίου, το κυκλοπενταδιενύλιο (Cp), δρα ως υποκαταστάτης, ως ισχυρός δότης 6 ηλεκτρονίων. Στο ιόν αυτό όλα τα άτομα άνθρακα και υδρογόνου είναι ισοδύναμα.
Από τα πλέον γνωστά παράγωγα του του κυκλοπενταδιενίου, είναι το 1,2,3,4,5-πενταμεθυλο-κυκλοπενταδιένιο, το οποίο παρέχει το ανιόν 1,2,3,4,5-πενταμεθυλοκυκλοπενταδιενύλιο, το οποίο συμβολίζεται απλά ως Cp*. To Cp* είναι πλουσιότερο σε ηλεκτρόνια σε σχέση με το Cp και έτσι σχηματίζει σταθερότερα σύμπλοκα. Ο μεγαλύτερος όγκος του μειώνει τις διαμοριακές αλληλεπιδράσεις και μειώνεται έτσι η τάση σχηματισμού πολυμερών δομών. Επιπλέον, τα σχηματιζόμενα σύμπλοκα είναι περισότερο λιπόφιλα και διαλύονται ευκολότερα σε μη-πολικούς διαλύτες. |
|
T. L. Kealy |
P. L. Pauson |
E.-O. Fischer (1918-2007) |
G. Wilkinson (1921-1996) |
R.-B. Woodward (1917-1979) |
|
Οι επιστήμονες που συνέθεσαν και προσδιόρισαν τη δομή του φερροκενίου, ανοίγοντας ένα μεγάλο κεφάλαιο στη Χημεία των Οργανομεταλλικών ενώσεων |
||||
Διευκρίνιση της δομής του φερροκενίου
Αμέσως μετά τη σύνθεση του φερροκενίου και τη διαπίστωση του μοριακού τύπου του ξεκίνησε ο αγώνας προσδιορισμού του συντακτικού του τύπου. Οι Pauson και Kealy στην αρχική εργασία τους απέδωσαν στη νέα ουσία, που τυχαία παρασκεύασαν, μια εσφαλμένη δομή. Τη σωστή δομή βρήκαν ο Ernst Otto Fischer και ανεξάρτητα οι Robert Burns Woodward και Geoffrey Wilkinson.
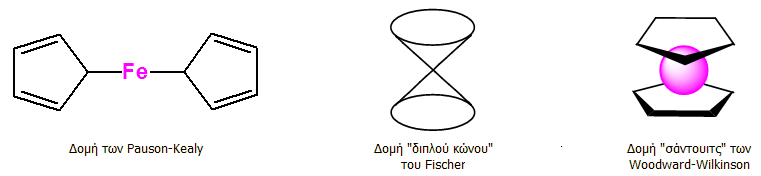
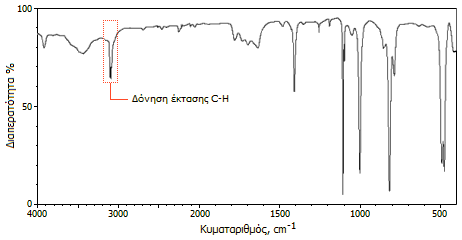
Οι διάσημοι αυτοί επιστήμονες με βάση την ασυνήθιστη σταθερότητα της νέας οργανομεταλλικής ένωσης, τον διαμαγνητικό χαρακτήρα της, τη μηδενική διπολική ροπή και το απλό φάσμα υπερύθρου της, που έδειχνε μια και μοναδική δόνηση έκτασης δεσμού C-H στα 3077 cm-1, συμπέραναν ότι η δομή των Pauson και Kealy είναι εσφαλμένη και πρότειναν την παράδοξη (για την εποχή) δομή "σάντουιτς", όπου όλα τα άτομα υδρογόνου και άνθρακα είναι ισοδύναμα. Η δομή "σάντουιτς" επιβεβαιώθηκε αργότερα με φασματοσκοπία NMR και με κρυσταλλογραφία ακτίνων Χ. Για παράδειγμα, η μία και μοναδική κορυφή στο φάσμα 1H-NMR, επιβεβαίωνε τη δομική ισοδυναμία όλων των υδρογόνων του φερροκενίου.
Πέραν από τις τεχνικές προσδιορισμού δομής, υπήρχαν και πολλές "χημικές ενδείξεις" της αρωματικότητας του φερροκενίου, όπως π.χ. η διαπίστωση, από την ομάδα του Woodward, ότι τα κυκλοπενταδιενύλια του φερροκενίου δεν μπορούσαν να υποστούν αντίδραση Diels-Alder, ούτε κατέστη δυνατή η καταλυτική υδρογόνωσή τους, γεγονός που επιβεβαιώνει ότι οι ομάδες των κυκλοπενταδιενυλίων συμπεριφέρονταν τελείως διαφορετικά από το ίδιο το κυκλοπενταδιένιο [Αναφ. 7].
|
...Ας στρέψουμε την προσοχή μας στην υποδοχή που είχαν αυτά τα δύο άρθρα στο Τμήμα Χημείας του Πανεπιστημίου Harvard. Μόλις έφτασε στη βιβλιοθήκη το άρθρο των Kealy και Pauson, τις δύο πρώτες εβδομάδες του Ιανουαρίου του 1952, προφανώς ο R. B. Woodward το διάβασε. Είχε ένα προαίσθημα πως κάτι δεν πήγαινε καλά με την προτεινόμενη δομή. Ανέθεσε σε ένα μεταπτυχιακό φοιτητή του, τον Myron Rosenblum, να συνθέσει όχι μόνο φερροκένιο, αλλά και άλλες ανάλογες ενώσεις μετάλλων μεταπτώσεως με κυκλοπενταδιένιο. Για τον σκοπό αυτό ο Rosenblum χρειάστηκε τριχλωριούχο ρουθήνιο. Πήγε και βρήκε τον Geoffrey Wilkinson, που πρόσφατα είχε διορισθεί ως Επίκουρος Καθηγητής στο Χάρβαρντ, για να ζητήσει μια μικρή ποσότητα ρουθηνίου. Κοφτά, ο Wilkinson τον ρώτησε τι το θέλει. Γράφει ο Wilkinson: "...o Mike Rosenblum ήρθε στο εργαστήριό μου και με ρώτησε αν έχω καθόλου ρουθήνιο. Δεν θυμάμαι ακριβώς πώς του το του είπα, αλλά ήταν κάτι σαν το 'ξέρω τι το θέλεις' ". Προφανώς, ο Wilkinson είχε δει τη δημοσίευση των Kealy και Pauson και αποφάσισε να εξετάσει αυτήν την προβληματική δομή του φερροκενίου. Και συνεχίζει ο Wilkinson: "Η κατάληξη ήταν να συναντηθούμε με τον Woodward στη Λέσχη των Καθηγητών του Harvard για μεσημεριανό, όπου και διευθετήσαμε το θέμα. Δεν είχα σκεφτεί ακόμη την πιθανότητα να δίνει ο δακτύλιος C5H5 της ένωσης του σιδήρου αντιδράσεις Friedel - Crafts ή άλλες αρωματικές αντιδράσεις, αλλά, πέρα από τη δομή, αυτό ήταν θέμα που ενδιέφερε κυρίως τον Bob, ενώ εγώ ενδιαφερόμουν να προχωρήσω σε άλλα μέταλλα μεταπτώσεως..." |
Κανόνας των 18 ηλεκτρονίων. Η σταθερότητα του φερροκενίου βασίζεται στη σύνδεση των d-τροχιακών του ατόμου του μετάλλου με τα p-τροχιακά των 10 ατόμων άνθρακα. Επιπλέον, πληρούται "όμορφα" ο κανόνας των 18 ηλεκτρονίων, που ισχύει στις περιπτώσεις των σταθερών οργανομεταλλικών ενώσεων και το σύστημα των 6π ηλεκτρονιακών δεσμών των δύο κυκλοπενταδιενυλίων καθιστά τους δακτυλίους αρωματικούς.
Ο "κανόνας των 18 ηλεκτρονίων" χρησιμοποιείται ευρύτατα στη Οργανομεταλλική Χημεία, όπως ακριβώς και ο "κανόνας των 8 ηλεκτρονίων" στην Οργανική Χημεία. Ενώ στους δεσμούς των οργανικών ενώσεων μετέχουν μόνο τα s και τα p ηλεκτρόνια, στις οργανομεταλλικές ενώσεις εμπλέκονται και τα d ηλεκτρόνια των μετάλλων. Και οι δύο κανόνες βασίζονται σε απλουστεύσεις και δεν έχουν γενική ισχύ, ωστόσο παρέχουν τη δυνατότητα μιας πρώτης προσέγγισης στην πρόβλεψη της χημικής σταθερότητας μιας ένωσης [Αναφ. 8] .
 |
|
| Φάσμα υπερύθρου του φερροκενίου | Εφαρμογή του κανόνα των 18 ηλεκτρονίων στην περίπτωση του φερροκενίου |
|
Δείγματα φερροκενίου και παραγώγων του που παρασκευάστηκαν κατά την περίοδο 1952-1955 στο Πανεπιστήμιο Harvard από τον Καθηγητή Goffrey Willkinson και τους φοιτητές του [Αναφ. 7η]. |
Αντίκτυπος. Ο νέος τύπος π-δεσμού, ο δεσμός μιας κυκλικής οργανικής ένωσης με μέταλλο ήταν κάτι το καινούργιο. Ο Mark Whiting, μεταδιδακτορικός συνεργάτης του Woodward στο Πανεπιστήμιο Harvard, ονόμασε τη νέα ένωση φερροκένιο (ferrocene). Η ονομασία αυτή, με κατάληξη παρόμοια με εκείνη του βενζολίου (benzene), υποδηλώνει τον αρωματικό χαρακτήρα της ένωσης.
Τη δημοσίευση αυτή του 1952 της ομάδας του Woodward [Αναφ. 7α], ακολούθησαν πολλές άλλες με συνθέσεις και άλλων παρόμοιων ενώσεων με άλλα μέταλλα του d-block, τις οποίες συλλογικά ονόμασαν μεταλλοκένια (metallocenes). Τα κυριότερα μέταλλα που σχηματίζουν μεταλλοκένια είναι τα: Fe, Mn, Ni, Cr, V, Mo, Ti, Zr, Hf, W, Ru, Os και Rh. Σήμερα, τα μεταλλοκένια που έχουν συντεθεί μετρούνται πλέον σε χιλιάδες.
Ο Fischer (Πολυτεχνείο Μονάχου) και ο Wilkinson (Imperial College Λονδίνου) τιμήθηκαν με το βραβείο Nobel Χημείας του 1973 για "την πρωτοποριακή εργασία τους, που πραγματοποιήθηκε ανεξάρτητα, πάνω στη χημεία των οργανομεταλλικών ενώσεων, που ονομάζονται ενώσεις-σάντουιτς". O Woodward είχε ήδη τιμηθεί με το βραβείο Nobel Χημείας του 1965 για "τα εξαίρετα επιτεύγματά του στην τέχνη της οργανικής σύνθεσης" [Αναφ. 9].
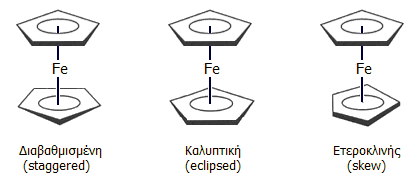
Διαμορφώσεις του φερροκενίου
Οι δύο δακτύλιοι το κυκλοπενταδιενυλίου στο φερροκένιο μπορούν να λάβουν διαφορετικές θέσεις ο ένας προς τον άλλο και έτσι προκύπτουν διάφορες διαμορφώσεις (conformations), σχηματίζοντας διάφορα στροφομερή (rotamers) του φερροκενίου. Οι δύο διακριτές διαμορφώσεις είναι η διαβαθμισμένη (staggered) και η καλυπτική (eclipsed). Κάθε άλλη ενδιάμεση ονομάζεται ετεροκλινής (skewed) (βλ. σχημα κάτω αριστερα).
Ως προτιμούμενη διαμόρφωση (μικρότερης ενέργειας) για το καθαρό φερροκένιο θεωρείται η διαβαθμισμένη, ωστόσο και οι άλλες διαμορφώσεις μπορούν να παρουσιαστούν σε διάφορα παράγωγά του. Πρέπει να σημειωθεί ότι οι ενεργειακές διαφορές μεταξύ των διαφόρων μορφών δεν είναι σημαντικές και οι δακτύλιοι του κυκλοπενταδιενυλίου θεωρούνται ως "συνεχώς περιστρεφόμενοι", εκτός αν το φερροκένιο βρίσκεται σε στερεά κατάσταση.
 |
 |
|
Διαμορφώσεις του φερροκενίου |
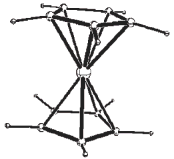
Δομή ισορροπίας του φερροκενίου, όπου φαίνεται η προτιμούμενη καλυπτική διαμόρφωση, όπως και η μικρή κάμψη των ατόμων υδρογόνου προς το άτομο σιδήρου [Αναφ. 10]. |
Σχετικώς πρόσφατα (2006) δημοσιεύτηκε μια θεωρητική μελέτη, που υποδεικνύει την καλυπτική διαμόρφωση ως διαμόρφωση ισορροπίας. Επίσης, εκτιμάται ότι τα άτομα άνθρακα και υδρογόνου των κυκλοπενταδιενυλίων δεν βρίσκονται όλα σε ένα επίπεδο, αλλά ότι οι δεσμοί C-H κάμπτονται ελαφρά (με γωνία 3,7º) προς το άτομο του σιδήρου (βλ. σχήμα επάνω δεξιά) [Αναφ. 10].
|
Απτικότητα [Αναφ. 11] Ο ικανοποιητικότερος τρόπος ταξινόμησης μιας τεράστιας ποικιλίας οργανομεταλλικών ενώσεων είναι μέσω του αριθμού των ατόμων άνθρακα σε σειρά, που συνδέονται (ή συμβάλλουν στη σύνδεση) με το άτομο του μετάλλου. Ο αριθμός αυτός μπορεί να προσδιορισθεί με αρκετές τεχνικές και είναι πιο "ξεκάθαρος" από τον θεωρούμενο αριθμό ηλεκτρονίων που μετέχουν στους δεσμούς. Ο αριθμός αυτός των "συναπτόμενων" ατόμων άνθρακα ονομάζεται απτικότητα (hapticity). Οι απτικότητες που έχουν παρατηρηθεί μέχρι σήμερα κυμαίνονται από 1 έως 8 και συμβολίζονται με το ελληνικό γράμμα η, από την ελληνική λέξη "(h)άπτω". Ο αριθμός που χαρακτηρίζει την απτικότητα ακολουθεί το η ως εκθέτης. Παραδείγματα: ο τετρααιθυλομόλυβδος, (C2H5)4Pb, το άλας Zeise (βλέπε πάνω) και το φερροκένιο, (C5H5)2Fe χαρακτηρίζονται ως η1, η2 και η5 οργανομεταλλικές ενώσεις, αντιστοίχως. Το η διαβάζεται ως "απτο" και το συστηματικό όνομα του φερροκενίου είναι δις-(πεντααπτοκυκλοπενταδιενυλο)σίδηρος(ΙΙ). Αξίζει ίσως να σημειωθεί ότι το ιόν του κυκλοπενταδιενυλίου μπορεί να δώσει σειρά οργανομεταλλικών ενώσεων διαφορετικής απτικότητας, με πιο σταθερές βέβαια τις ενώσεις με απτικότητα η5:
|
Χημικές ιδιότητες του φερροκενίου [Αναφ. 12, 7δ]
Το φερροκένιο έχει αρωματικό χαρακτήρα και παρουσιάζει τις τυπικές αντιδράσεις ηλεκτρονιόφιλης υποκατάστασης που παρέχουν οι αρωματικές ενώσεις και κατά κανόνα με πολύ μεγαλύτερη ευκολία (μερικά εκατομμύρια φορές ταχύτερες). Ωστόσο, δεν μπορεί να δώσει απ' ευθείας τις ίδιες αντιδράσεις με οξειδωτικά αντιδραστήρια (π.χ. νίτρωση με νιτρικό οξύ, αλογονώσεις με χλώριο ή βρώμιο), λόγω οξείδωσης του Fe(II) προς Fe(III).
Τυπικά παραδείγματα αντιδράσεων του φερροκενίου που έχουν μελετηθεί διεξοδικά:
Αντιδράσεις Friedel-Crafts: Οι αντιδράσεις αυτές πραγματοποιούνται με εξαιρετική ευκολία σε σχέση με τις αντίστοιχες του βενζολίου. Μπορεί π.χ. να ακετυλιωθεί με ακετυλοχλωρίδιο παρουσία AlCl3, αλλά και άλλων λιγότερο δραστικών καταλυτών (ZnCl2, SnCl4, H3PO4). Με γραμμομοριακή αναλογία ακετυλοχλωριδίου: φερροκενίου 1:1 λαμβάνεται με εξαιρετική απόδοση το μονοακετυλοπαράγωγο, ενώ με περίσσεια ακετυλοχλωριδίου λαμβάνεται (κυρίως) το 1,1'-διακετυλο-φερροκένιο και σε πολύ μικρότερη αναλογία το 1,2-διακετυλο-φερροκένιο [Αναφ. 12]:
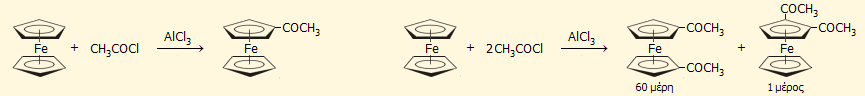
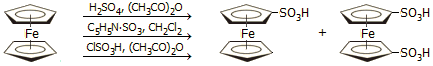
Σουλφούρωση: Μπορεί να σουλφουρωθεί με συνηθισμένα μίγματα σουλφούρωσης (θεικού οξέος, χλωροσουλφονικού οξέος ή θειικού ανυδρίτη-πυριδίνης) με ταυτόχρονο σχηματισμό παραπροϊόντων οξείδωσης:
Υδραργυρίωση: Μπορεί να αντιδράσει με άλατα υδραργύρου, αντίδραση που παρέχουν μόνο οι ονομαζόμενες "υπεραρωματικές" ενώσεις, όπως το θειοφαίνιο, το φουράνιο και πολύ δύσκολα το βενζόλιο:
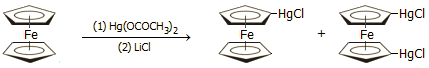
Μεταλλίωση: Αντιδρά π.χ. με αλκυλομέταλλα παρέχοντας τα μεταλλιωμένα παράγωγα, π.χ.:
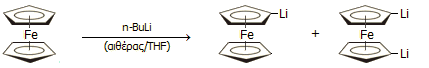
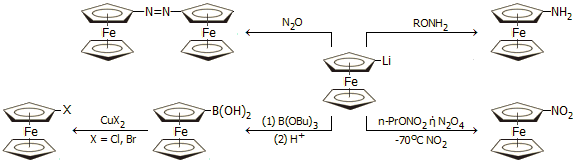
Από τα μεταλλιωμένα παράγωγα μπορούν να ληφθούν παράγωγα του φερροκενίου, όπως αλογονοπαράγωγα και νιτροπαράγωγα, τα οποία δεν είναι δυνατόν να ληφθούν άμεσα, όπως προαναφέρθηκε. Από αυτά στη συνέχεια μπορεί να ληφθεί πλήθος άλλων παραγώγων. Ορισμένες από τις αντιδράσεις του λιθιο-παραγώγου του φερροκενίου είναι:
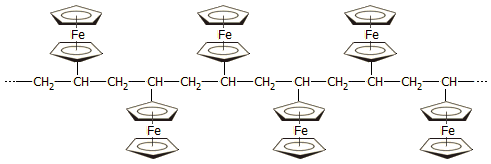
Πολυμερή με την ομάδα φερροκενίου: Έχει παρασκευασθεί μεγάλος αριθμός πολυμερών ενώσεων που περιέχουν την ομάδα του φερροκενίου. Το απλούστερο από τα πολυμερή αυτά είναι το πολυ(βινυλοφερροκένιο), που παρασκευάζεται εύκολα με πολυμερισμό βινυλοφερροκενίου και είναι εμπορικά διαθέσιμο:
Σύγκριση φερροκενίου με το βενζόλιο: Η ηλεκτρονιακή πυκνότητα του φερροκενίου είναι υψηλότερη απ' όσο στο βενζόλιο. Λόγω της διαφοράς αυτής οι ταχύτητες ηλεκτρονιόφιλης υποκατάστασης του φερροκενίου σε σχέση με τις αντίστοιχες του βενζολίου είναι περίπου τρία εκατομμύρια φορές μεγαλύτερες. Αποτέλεσμα της αυξημένης ηλεκτρονιακής πυκνότητας είναι η περιορισμένη διάσταση του φερροκενυλοκαρβοξυλικού οξέος (μεγαλύτερη δυσκολία απόσπασης πρωτονίου), το οποίο έτσι είναι ασθενέστερο από το βενζοϊκό οξύ. Αντίστοιχα, η φερροκενυλαμίνη πρωτονιώνεται ευκολότερα και έτσι είναι ισχυρότερη βάση από την ανιλίνη:

 |
 |
|
Εξαφερροκενυλοβενζόλιο, C6[C10H9Fe5]6: Ένα αρκετά παράδοξο παράγωγο του βενζολίου τύπου "τροχού Λούνα Παρκ", όπου όλα τα άτομα υδρογόνου του αρωματικού δακτυλίου του έχουν αντικατασταθεί με ομάδες φερροκενίου [Αναφ. 13]. |
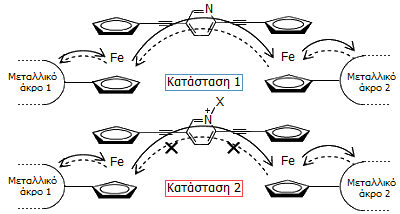
Σύνδεση μεταλλικών αγωγών μέσω μοριακού συγκροτήματος με ομάδες φερροκενίου στα άκρα του. Το μόριο αυτό δρα ως ηλεκτρονική δίοδος επιτρέποντας τη διέλευση ρεύματος προς τη μία μόνο κατεύθυνση [Αναφ.17γ]. |
|
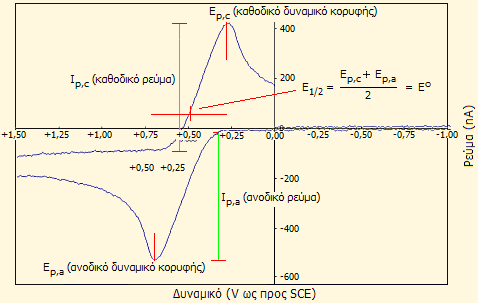
Τυπικό κυκλικό βολταμμογράφημα φερροκενίου: Διάλυμα 0,10 mM σε διμεθυλοφορμαμίδιο, φέρων ηλεκτρολύτης: 0,10 Μ [n-Bu4N]PF6. Η ομοιότητα μεταξύ ανοδικής και καθοδικής κορυφής είναι ενδεικτική της αντιστρεπτότητας του συστήματος φερροκενίου/φερρικινίου [Αναφ. 14α]. |
Οξειδοαναγωγικό σύστημα φερροκένιου - φερρικινίου [Αναφ. 14]
Μια σημαντική διαφοροποίηση του φερροκενίου σε σχέση με το βενζόλιο, αλλά και με τους περισσότερους υδρογονάνθρακες είναι το ότι οξειδώνεται σχετικά εύκολα (στα +0,64 V ως προς το κανονικό ηλεκτρόδιο υδρογόνου, ΚΗΥ) παρέχοντας το κατιόν φερρικίνιο ή φερροκίνιο (ferricinium ή ferrocinium). Ωστόσο, το φερροκένιο δεν προσβάλλεται από το οξυγόνο της ατμόσφαιρας. Το φερρικίνιο είναι σταθερό ιόν και τα άλατά του, όπως και διαλύματά τους έχουν ένα χαρακτηριστικό μπλε χρώμα και είναι παραμαγνητικά.
Σε αντίθεση με άλλες αρωματικές ενώσεις που είναι πλούσιες σε ηλεκτρόνια (όπως η ανιλίνη), που επίσης οξειδώνονται εύκολα, η αντίδραση οξείδωσης του φερροκενίου (αλλά και των περισσότερων παραγώγων του) είναι πλήρως αντιστρεπτή:
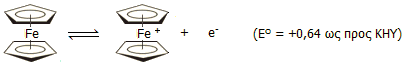
Υδατικά διαλύματα αλάτων του φερρικινίου μπορούν να ληφθούν εύκολα με οξείδωση του στερεού φερροκενίου, π.χ. με υδατικά διαλύματα Fe(III) ή με πυκνό H2SO4. Από τα υδατικά του διαλύματα το φερρικίνιο μπορεί να ληφθεί ως δυσδιάλυτο άλας με διάφορα ανιόντα όπως τα πικρικά, υπερχλωρικά, εξαφθοροφωσφορικά κ.α. χαμηλής εφυδάτωσης (βλ. Χημική ένωση του μήνα: "Υπερχλωρικό οξύ και άλατά του"):
![]()
Οξειδοαναγωγικό πρότυπο. Λόγω της πλήρους αντιστρεπτότητάς του, το οξειδοαναγωγικό ζεύγος φερροκενίου/φερρικινίου (συμβολίζεται συνήθως ως Fc/Fc+) έχει προταθεί ως πρότυπο οξειδοαναγωγικό ζεύγος για τη βαθμονόμηση της κλίμακας των δυναμικών ηλεκτροχημικών διατάξεων (π.χ. κυκλικής βολταμμετρίας) σε συστήματα μη-υδατικών διαλυτών, όπου τα συνήθη ηλεκτρόδια αναφοράς δεν λειτουργούν. Θεωρείται ότι η φύση του διαλύτη δεν επηρεάζει σημαντικά το πρότυπο δυναμικό του ζεύγους, αφού τα μόρια του διαλύτη δεν μπορούν να "πλησιάσουν" το άτομο του σιδήρου. Ακόμη, συμβατικά θεωρείται ότι η το δυναμικό αυτό είναι το ίδιο σε όλες τις θερμοκρασίες, κατ' αντιστοιχία με το κανονικό δυναμικό του υδρογόνου, όπου έχει γίνει δεκτή η ίδια σύμβαση [Αναφ. 14β,γ].
Στα παράγωγα του φερροκενίου ο αντιστρεπτός χαρακτήρας των αντίστοιχων οξειδοαναγωγικών ζευγών κατά κανόνα διατηρείται, ενώ οι τιμές των κανονικών δυναμικών τους εξαρτώνται από τους υποκαταστάτες των κυκλοπενταδιενυλίων.
Βιοαισθητήρες που βασίζονται στο φερροκένιο. Το οξειδοαναγωγικό ζεύγος Fc/Fc+, ή τα αντίστοιχα διαφόρων παραγώγων του φερροκενίου, όπως το 1,1'-διμεθυλοφερροκένιο, το φερροκενυλοκαρβοξυλικο οξύ ή ακόμη πολυμερή με την ομάδα του φερροκενίου, έχουν χρησιμοποιηθεί για την κατασκευή ηλεκτροχημικών (αμπερομετρικών) βιοαισθητήρων (biosensors) για τη μέτρηση της γλυκόζης και άλλων ουσιών βιοχημικού ενδιαφέροντος. Ορισμένοι από αυτούς τους βιοαισθητήρες χρησιμοποιούνται σε φορητά ηλεκτροχημικά συστήματα μέτρησης γλυκόζης στο αίμα [Αναφ. 15].
Στους βιοαισθητήρες αυτούς το οξειδοαναγωγικό ζεύγος Fc/Fc+ δρα ως διαμεσολαβητής (mediator) μεταφοράς ηλεκτρονίων. Η γλυκόζη οξειδώνεται επιλεκτικά από το ένζυμο οξειδάση της γλυκόζης (glucose oxidase, GOD). Η ανηγμένη μορφή του ενζύμου (GODAN), οξειδώνεται και επανέρχεται στην αρχική οξειδωμένη μορφή της (GODΟΞ) από το φερρικίνιο, το οποίο ανάγεται προς φερροκένιο. Στη συνέχεια, το φερροκένιο οξειδώνεται ηλεκτροχημικά προς φερρικίνιο. Χωρίς το οξειδοαναγωγικό σύστημα Fc/Fc+ θα ήταν αδύνατη η άμεση ηλεκτροχημική οξείδωση της ανηγμένης μορφής του ενζύμου. Έτσι το ένζυμο προσδίδει στον βιοαισθητήρα την απαραίτητα εκλεκτικότητα ως προς τη μετρούμενη ουσία, ενώ το φερροκένιο εξασφαλίζει τη δυνατότητα ηλεκτροχημικής (αμπερομετρικής) παρακολούθησης. Η αρχή της όλης διαδικασίας δείχνεται στο παρακάτω σχήμα:
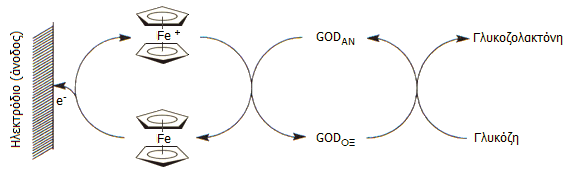
Αρχή λειτουργίας των ηλεκτροχημικών βιοαισθητήρων γλυκόζης.
GODΟΞ/GODΑΝ : Οξειδωμένη/Ανηγμένη μορφή οξειδάσης της γλυκόζης
Πρακτικές εφαρμογές του φερροκενίου [Αναφ. 16]
 |
 |
Το φερροκένιο παράγεται σε σχετικά μεγάλες ποσότητες (μερικές εκατοντάδες τόνων ετησίως) σχεδόν αποκλειστικά στην Κίνα και μια τυπική τιμή του (σε ποσότητες τόνου) είναι περίπου 12 $/kg. Η κύρια εφαρμογή του φερροκενίου (ή παραγώγων του) είναι εκείνη του προσθέτου καυσίμων. Μειώνει τον καπνό και δρα ως αντικροτικό, αντικαθιστώντας τον "παραδοσιακό" τοξικό τετρααιθυλομόλυβδο, (C2H5)4Pb.
Στο εμπόριο κυκλοφορούν πρόσθετα βενζίνης τα οποία είναι διαλύματα φερροκενίου (ή άλλων παραγώγων του) σε αλειφατικούς ή αρωματικούς υδρογονάνθρακες. Τα διαλύματα αυτά προστίθενται στην αμόλυβδη βενζίνη, για να μπορέσει να χρησιμοποιηθεί σε αυτοκίνητα παλαιάς τεχνολογίας [Αναφ. 1β].
'Αλλα πεδία εφαρμογών του φερροκενίου:
- Καταλύτες μεταφοράς ηλεκτρονίων κατά το σχηματισμό ενώσεων με ειδικές μαγνητικές, ηλεκτρικές και οπτικές ιδιότητες (μοριακοί διακόπτες) [Αναφ. 17].
- Βιοαισθητήρες (biosensors) για προσδιορισμό υποστρωματικών ενώσεων και ενζύμων [Αναφ. 15].
- Φαρμακευτικά προϊόντα, αντικαρκινικά φάρμακα [Αναφ. 18].
- Παρασκευή νανοσωληνίσκων άνθρακα.
- Πρώτη ύλη για την παρασκευή διαφόρων παραγώγων του με πολλές βιομηχανικές εφαρμογές (ως καταλύτες) στη βιομηχανία.
|
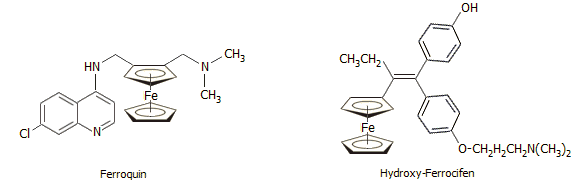
Δύο από τα πιο γνωστά φάρμακα που περιέχουν στο μόριό τους την ομάδα του φερροκενίου: Το Ferroquin είναι ένα δραστικό ανθελονοσιακό φάρμακο με δομή ανάλογη με εκείνη της χλωροκίνης (βλ. Χημική Ένωση του Μήνα: Κινίνη) [Αναφ. 17α]. Το Hydroxy-Ferrocifen είναι ένα δραστικό φάρμακο κατά του καρκίνου του μαστού [Αναφ. 17β]. |
2. (α) Zeise WC, Poggendorff's Ann Phys 9:632, 1827. (β) Zeise WC, Poggendorff's Ann Phys 21:479, 1831. (γ) Wikipedia: "Zeise's salt". (δ) Hunt LB: "William Christofer Zeise and his platinum complexes", Platinum Metals Rev. 28(2):76-83, 1984 (αρχείο PDF, 644 KB). (ε) Mond L, Langer C, Quincke F: "Action of carbon monoxide on nickel", J Chem Soc Trans 57:749-753, 1890. (στ) Wikipedia: "Nickel tetracarbonyl". (στ) ChemistryExplained.com: "Organometallic Compounds".
3. (α) Kealy TJ, Pauson PL: "A New Type of Organo-Iron Compound", Nature 168(4285):1039-1040, 1951 (Abstract). (β) Miller SA, Tebboth JA, Tremaine JF: " Dicyclopentadienyliron" J. Chem. Soc. (London) 632-635, 1952. (γ) Kauffman GB: "The discovery of ferrocene, the first sandwich compound", J. Chem. Educ. 60:185-186, 1983. (δ) Pauson PL: "Aromatic transition metal complexes - The first 25 years", Pure & Appl. Chem. 49:839-855, 1977 (αρχείο PDF, 777 KB) [με περιγραφή της "τυχαίας" σύνθεσης του φερροκενίου]. (ε) White NS (Dep. of Chemistry, University of California): "Cobalt-Catalyzed Cross-Coupling Reactions" (αρχείο PDF, 613 KB).
4. (α) Chemistry Department (The University of Hull):"Synthesis of ferrocene". (β) Department of Chemisty (University of British Columbia): "EXPERIMENT 4: The Preparation and Properties of Ferrocene, Fe(C5H5)2". (γ) "Ferrocene", Organic Syntheses, Coll. Vol. 4, p.473 (1963); Vol. 36, p.31 (1956). (δ) Tanner PS, Dantsin G, Gross SM, Lees AJ, Myers CE, Whittingham SM and Wayne Jr. EJ (State University of New York at Binghamton): "The Synthesis and Characterization of Ferrocene: A Modern Iterative Approach to a Classical Organometallic Laboratory Experiment".
5. (α) Wikipedia: "Dicyclopentadiene". (β) Dow Chemicals, Product Data Sheet: "Dicyclopentadiene (DCPD)" (αρχείο PDF, 141 KB).
6. (α) Wikipedia: "Cyclopentadiene". (β) Department of Chemistry and Biochemistry (University of Colorado): "Diels-Alder Reaction: Preparation of cis-Norbornene-5,6-endo-dicarboxylic Anhydride", (αρχείο PDF, 383 KB). (γ) Imperial College, Dept. of Chemistry: "Examples of Sigmatropic Reactions".
7. (α) Wilkinson G, Rosenblum M, Whiting MC, Woodward RB: "The Structure of Iron Biscyclopentadieny", Journal of the American Chemical, 74:2125-2126, 1952 (JACS Abstract, ChemPort Abstract). (β) Dunitz JD, Orger LE: "Bis-cyclopentadienyl Iron: a Molecular Sandwich", Nature 171:121-122, 1953 (Abstract). (γ) Laszlo P, Hoffmann R: "Ferrocene: Ironclad History or Rashomon Tale?", Angew. Chem. Int. Ed. 39(1):123-124, 2000 (Αρχείο PDF, 67 KB). (δ) Lunkenbein T (Hauptseminar Anorganische Chemie, Universität Bayreuth, Germany, 2008): "Ferrocen" (αρχείο PowerPoint). (ε) Dunitz J, Orgel L, Rich A: "The crystal structure of ferrocene", Acta Crystallographica 9: 373-375, 1956 (Abstract). (στ) Fischer EO, Pfab W: "Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels". Zeitschrift für Naturforschung B 7:377-379, 1952. (ζ) Toreki R (Interactive Learning Paradigm Inc.): "Cyclopentadienyl Ligands", 2003. (η) Rzepa HS: "Elemental and Molecular Heritage: An Internet-based Display", Molecules 3:94-99, 1998.
8. (α) easyweb.easynet.co.uk: "18 electron rule". (β) Shaughnessy K (University of Alabama, 2008): "Oxidation State and the 18-Electron Rule" (αρχείο PDF, 533 KB).
9. (α) Nobelprize.org: "The Nobel Prize in Chemistry 1973: Ernst Otto Fischer, Geoffrey Wilkinson". (β) Nobelprize.org: "The Nobel Prize in Chemistry 1965: Robert B. Woodward".
10. (α) Coriani S, Haaland A, Helgaker T, Jorgensen P: "The Equilibrium Structure of Ferrocene", ChemPhysChem 7:245-249, 2006 (αρχείο PDF, 89 KB).
11. (α) Wikipedia: "Hapticity". (β) Maslowsky Jr. Ε: "The Structures of Metal Cyclopentadienyl Derivatives", J. Chem. Educ. 55:276-280, 1978. (γ) IUPAC (ed. Salzer A): "Nomenclature of Organometallic Compounds of the Transition Elements", Pure Appl. Chem. 71(8):1557-1585, 1999 (αρχείο PDF 1,6 MB).
12. Rauch MD: "Metallocene Chemistry - A Decade of Progress", Canadian Journal of Chemistry, 41:1289-1313, 1963 (αρχείο PDF, 972 KB) [κατατοπιστική σύνοψη της βασικής χημείας του φερροκενίου (κυρίως) και άλλων μεταλλοκενίων].
13. Yu Y, Bond AD, Leonard PW, Lorenz UJ, Timofeeva TV, Vollhardt PC, Whitener GD, Yakovenko AA: "Hexaferrocenylbenzene" , Chem. Commun., 2572-2574, 2006.
14. (α) Lancashire RJ (Dep. of Chemistry, University of the West Indies, Jamaica): "CHEM2101 (C 21J) Laboratory Experiments: Aims and Objectives". (β) Bond AM, Oldham KB, Snook GA: "Use of the Ferrocene Oxidation Process To Provide Both Reference Electrode Potential Calibration and a Simple Measurement (via Semiintegration) of the Uncompensated Resistance in Cyclic Voltammetric Studies in High-Resistance Organic Solvents", Analytical Chemistry 72 (15):3492-3496, 2000 (Abstract). (γ) Delfino F, Falciola L, Mussini P, Rossi M, Viana M (ISE-online.org): "Ferricinium/ferrocene couple as a reference redox system for aqueous-organic mixed solvents", (αρχείο PDF, 27 KB).
15. (α) Cass AEG, Davis G, Francis GD, Hill HAO, , Aston WJ Higgins IJ, Plotkin EV, Scott LDL, Turner APF: "Ferrocene-Mediated Enzyme Electrode for Amperometric Determination of Glucose", Analytical Chemistry 56(4):667-671, 1984 (αρχείο PDF, 630 KB). (β) Fiorito PA, Córdoba de Torresi SI: "Glucose Amperometric Biosensor Based on the Co-immobilization of Glucose Oxidase (GOx) and Ferrocene in Poly(pyrrole) Generated from Ethanol / Water Mixtures", J. Braz. Chem. Soc. 12(6):729-733, 2001. (γ) Gao Z, Xie F, Arshad MSM, Ying JY: "A Disposable Glucose Biosensor Based on Diffusional Mediator Dispersed in Nanoparticulate Membrane on Screen-Printed Carbon Electrode", NSTI-Nanotech 1:209-212, 2004 (αρχείο PDF, 158 KB). (δ) Ghica ME, Brett CMA: "Development of a Carbon Film Electrode Ferrocene-Mediated Glucose Biosensor", Analytical Letters 38:907-920, 2005 (αρχείο PDF, 92 KB).
16. (α) ChemicalLand21: "Ferrocene". (β) Museum of Learning: "Antiknock Agent: Ferrocene". (γ) Emel'yanov VE, Simonenko LS, Skvortsov VN: "Ferrocene - a Nontoxic Antiknock Agent for Automotive Gasolines", Chemistry and Technology of Fuels and Oils 37(4):224-228, 2001 (Abstract).
17. (α) Martınez R, Ratera I, Tarraga A, Molina P, Veciana J: "A simple and robust reversible redox-fluorescence molecular switch based on a 1,4-disubstituted azine with ferrocene and pyrene units", Chem. Commun. 3809-3811, 2006 (αρχείο PDF, 304 KB). (β) University Jaume I: "Technology offer: Molecular Switches for Nanoelectronic Applications" (αρχείο PDF, 225 KB). (γ) Ding F, Chen S, Wang H: "Computational Study of Ferrocene-Based Molecular Frameworks with 2,5-Diethynylpyridine as a Chemical Bridge", Materials 3:2668-2683, 2010 (αρχείο PDF, 645 KB).
18.
(α) Dubar F,
Khalife J, Brocard J,
Dive D, Biot
C: "Ferroquine,
an Ingenious Antimalarial Drug - Thoughts on the
Mechanism of Action",
Molecules 13:2900-2907,
2008 (αρχείο
PDF, 155 KB).
(β) Top S, Vessieres A,
Leclercq
G, Quivy J, Tang
J, Vaissermann J, Huche
M, Jaouen G: "Synthesis,
Biochemical Properties and Molecular Modelling Studies of
Organometallic Specific Estrogen Receptor Modulators (SERMs),
the Ferrocifens and Hydroxyferrocifens:
Evidence for an Antiproliferative Effect
of Hydroxyferrocifens on both Hormone-Dependent and
Hormone-Independent Breast Cancer Cell Lines",
Chem. Eur. J. 9:5223-5236,
2003 (αρχείο
PDF, 392 KB). (γ)
Dagani R: "The
Bio Side of Organometallics", Chemical & Engineering News
80(37):23-29, 2002.
|
Αποποίηση ευθυνών: Έχει καταβληθεί κάθε προσπάθεια για να εξασφαλισθεί η ορθότητα των πληροφοριών που περιλαμβάνονται σε αυτή τη σελίδα, ωστόσο ο έχων την επιμέλεια της σελίδας αυτής και το Τμήμα Χημείας δεν αναλαμβάνουν τη νομική ευθύνη για τυχόν σφάλματα, παραλείψεις ή ανακριβείς πληροφορίες. Επιπλέον, το Τμήμα Χημείας δεν εγγυάται την ορθότητα των αναφερόμενων σε εξωτερικές ιστοσελίδες, ούτε η αναφορά μέσω συνδέσμων (links) στις ιστοσελίδες αυτές, υποδηλώνει ότι το Τμήμα Χημείας επικυρώνει ή καθ' οιονδήποτε τρόπο αποδέχεται το περιεχόμενό τους. |

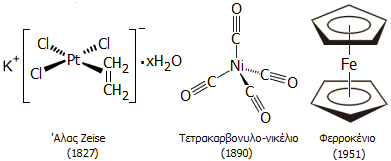
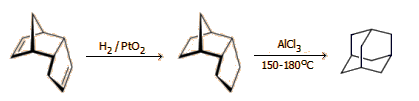

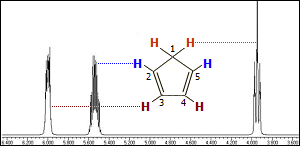 Χαρακτηριστική είναι η
εξάρτηση της μορφής του φάσματος 1Η-NMR του κυκλοπενταδιενίου από
τη θερμοκρασία: Το
φάσμα κυκλοπενταδιενίου που λαμβάνεται στους -50
Χαρακτηριστική είναι η
εξάρτηση της μορφής του φάσματος 1Η-NMR του κυκλοπενταδιενίου από
τη θερμοκρασία: Το
φάσμα κυκλοπενταδιενίου που λαμβάνεται στους -50




 Αγώνας
δρόμου (Απόσπασμα από την
[
Αγώνας
δρόμου (Απόσπασμα από την
[