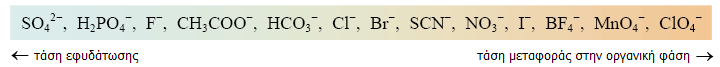Λίστα "Χημικών Ενώσεων του Μήνα"
Η χημική ένωση του
μήνα
[Απρίλιος
2008]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής
-
Κωνσταντίνος
Ευσταθίου, Καθηγητής
|
Φυσικoχημικές ιδιότητες:
Εμφάνιση: Υγρό, άοσμο.
Ευαίσθητο στις κρούσεις όταν είναι άνυδρο, σταθερό σε περιεκτικότητες
μικρότερες από 80% (w/w).
Μοριακός τύπος:
HClO4
Σχετική μοριακή μάζα:
100,46
d(25oC): 1,761 g
cm-3
Σχηματίζει αζεοτροπικό με το νερό σ.ζ. 203ºC
που περιέχει 71,6% HClO4 (αντιστοιχεί στον διυδρίτη HClO4·2H2O)
Αναμιγνύεται σε κάθε αναλογία με
το νερό, το οξικό οξύ, το χλωροφόρμιο και
μεθυλενοχλωρίδιο.
Σημειώνεται η ιδιαίτερη
επικινδυνότητα μιγμάτων του με ευοξείδωτους οργανικούς διαλύτες. Κάθε
τέτοιο μίγμα μπορεί να εκραγεί κάθε στιγμή.
[Αναφ. 1].
|
 |
|
Υπερχλωρικό οξύ και άλατά του
Perchloric acid and
perchlorates |
Η σφοδρότερη καταγεγραμμένη χημική έκρηξη
στην ιστορία του ανθρώπου ήταν αποτέλεσμα διάσπασης ενός υπερχλωρικού άλατος
Ιστορία του υπερχλωρικού οξέος και των υπερχλωρικών αλάτων [Αναφ. 2]
Η πρώτη
παρασκευή υπερχλωρικού άλατος αναφέρεται σε μια εργασία του Κόμη Friederich von
Stadion που δημοσιεύθηκε το 1816. Με επίδραση πυκνού θειικού οξέος σε χλωρικό
κάλιο (KClO3)
παρασκεύασε ένα νέο άλας, δυσδιάλυτο στο νερό, το οποίο ονόμασε "οξυγονωμένο
χλωρικό κάλιο". Η ουσία αυτή ήταν το υπερχλωρικό κάλιο
(KClO4). Με
απόσταξη μίγματος του νέου αυτού άλατος με πυκνό θειικό οξύ αραιωμένο κατά το
1/3 του βάρους του με νερό, στους 140ºC παρήχθησαν λευκοί ατμοί που
συμπυκνώθηκαν σε υγρό που περιείχε 70% υπερχλωρικό οξύ, το οποίο ονόμασε
"οξυγονωμένο χλωρικό οξύ". Σε επόμενη δημοσίευση (1818) ο Stadion περιέγραψε την
ηλεκτρολυτική παρασκευή των ίδιων ενώσεων.
Η
ονομασία "υπερχλωρικό" αναφέρεται για πρώτη φορά σε μια δημοσίευση του G.S.
Serullas (στις αρχές της δεκαετίας του 1830), ο οποίος παρασκεύασε υπερχλωρικό
αμμώνιο και πολλά άλλα υπερχλωρικά άλατα. Στα επόμενα 30 χρόνια πραγματοποιήθηκε σημαντική ερευνητική δουλειά πάνω στο υπερχλωρικό οξύ από τους Berzelius (1835), Penny (1840) και Kolbe (1862). Οι
Hare και Boye παρασκεύασαν τον εξαιρετικά επικίνδυνο υπερχλωρικό
αιθυλεστέρα (1841), ενώ ο Roscoe παρασκεύασε το επίσης επικίνδυνο άνυδρο
υπερχλωρικό οξύ (1862). O ανυδρίτης του υπερχλωρικού οξέος
(Cl2O7)
απομονώθηκε από τους Michael και Conn (1900).
Βιομηχανική παραγωγή του υπερχλωρικού οξέος
|
 Ο αναλυτικός χημικός του οποίου το
όνομα έχει άρρηκτα συνδεθεί με το υπερχλωρικό οξύ και τις ενώσεις
του Ο αναλυτικός χημικός του οποίου το
όνομα έχει άρρηκτα συνδεθεί με το υπερχλωρικό οξύ και τις ενώσεις
του
Ο George Frederick Smith (1891-1976)
υπήρξε Καθηγητής της Αναλυτικής Χημείας στο Πανεπιστήμιο του Illinois
(Urbana-Champaign) για 36 χρόνια. Σε μια επιστημονικη δημοσίευσή του
ο Smith παρουσίασε τις εξαιρετικές αφυδατικές ιδιότητες του υπερχλωρικού
μαγνησίου, Mg(ClO4)2. Η δημοσίευση
αυτή προκάλεσε έντονο ενδιαφέρον για αυτό το υπερχλωρικό άλας και για αρκετά
χρόνια (αρχές δεκαετίας 1920) ο Smith
πρόσφερε μικρές ποσότητές του, σε
πολλούς χημικούς που ήθελαν να δοκιμάσουν την καταλληλότητά της σε διάφορες εφαρμογές.
|

G. Frederick Smith
(1891-1976) |
Ως το 1928 η ζήτηση της ξηραντικής
αυτής ουσίας είχε αυξηθεί σε βαθμό που ήταν αδύνατο πλέον για τον Smith να συνεχίσει την παρασκευή της στο
εργαστήριό του και αποφάσισε να ιδρύσει μια μικρή εταιρία την G. Frederick
Smith Chemical Company (GFS) στο Columbus του Ohio. Τα πρώτα προϊόντα της εταιρίας GFS ήταν το υπερχλωρικό οξύ
και το υπερχλωρικό μαγνήσιο (με το εμπορικό όνομα Dehydrite) και υπήρξε η
πρώτη χημική εταιρία που παρήγαγε υπερχλωρικό οξύ σε εμπορική κλίμακα στις
ΗΠΑ.
Καθώς η GFS συνέχισε να αναπτύσσεται,
άρχισε να παράγει μια ποικιλία χημικών προϊόντων,
πολλά από τα οποία ήταν δύσκολο να τα βρει κανείς σε άλλους χημικούς
οίκους, όπως: υπερχλωρικά άλατα (50 διαφορετικών μετάλλων), υπεριωδικά και
ιωδικά άλατα, ενώσεις του δημητρίου (και στη συνέχεια όλων των
σπανίων γαιών), ουσίες-πρωτογενή πρότυπα για αναλυτικούς σκοπούς,
μεταλλοχρωμικά αντιδραστήρια (π.χ. φαινανθρολίνες) και μεταλλοχρωμικούς
δείκτες, αντιδραστήρια συμπλοκομετρίας, όπως και πλήθος άλλων αντιδραστηρίων
αναλυτικής καθαρότητας.
Η GFS έχει εκδώσει μεγάλο αριθμό μικρών
εγχειριδίων, όπου παρουσιάζονται οι ιδιότητες και τυπικές εφαρμογές πολλών
από από τα παραπάνω αντιδραστήρια. Τα εγχειρίδια αυτά υπήρξαν εξαιρετικά
χρήσιμα ιδιαίτερα στους αναλυτικούς χημικούς. Σήμερα η G.
Frederick Smith Chemical Company αποτελεί πλέον μια μεγάλη εταιρία
παραγωγής και διάθεσης ερευνητικών χημικών αντιδραστηρίων υψηλής
ποιότητας.
O G. Frederick Smith
θεωρείται ένας από τους σπυδαιότερους αναλυτικούς χημικούς του
20ου αιώνα. 'Ενα άρθρο προς τιμήν του G. Frederick Smith, με την ευκαιρία
των 75ων γενεθλίων του, στο οποίο περιγράφεται η ερευνητική συνεισφορά και
η σταδιοδρομία του, έχει δημοσιευθεί σε ειδικό τιμητικό τεύχος του
αναλυτικού περιοδικού Talanta [Αναφ.
4]. |
|
Περιεκτικότητα σε HClO4 (% κ.β.) |
Αντίστοιχος
υδρίτης |
Σημείο τήξης,
ºC |
Χαρακτηριστικές ιδιότητες |
|
100 |
HClO4 |
-112 |
Ευκίνητο υγρό. Παρασκευάζεται με απόσταξη του αζεοτροπικού μίγματος
(72,5% κ.β.) υπό ελαττωμένη πίεση (<1 mm Hg) σε πλήρως υάλινη συσκευή.
Ασταθέστατο, εκρήγνυται αυθόρμητα αν παραμείνει λίγες ημέρες σε
θερμοκρασία δωματίου (διασπάται κατά την παραμονή προς H3OClO4,
χλώριο και άλλα οξείδια του χλωρίου και αποκτά κίτρινο
χρώμα). Αναφέρεται ότι μπορεί να
διατηρηθεί απεριόριστα στους -80ºC. |
|
95,7 |
HClO4·0,25H2O |
-73,1 |
Ασταθές. |
|
84,8 |
HClO4·H2O |
+49,9 |
Ο μόνος στερεός (σε θερμοκρασία
δωματίου) υδρίτης. Αναφέρεται και ως υπερχλωρικό
οξώνιο: H3O+ClO4-, ασταθές.
Σχηματίζεται σταδιακά κατά την παραμονή του άνυδρου σε θερμοκρασία
δωματίου. Διασπάται
σταδιακά προς χλώριο και άλλα οξείδια του χλωρίου. |
|
73,6 |
HClO4·2H2O |
-17,8 (α-μορφή)
-19,5 (β-μορφή) |
'Ενυδρο υπερχλωρικό οξώνιο: H3O+ClO4-·H2O (α-μορφή), υπερχλωρικό διοξώνιο:
H5O2+ClO4- (β-μορφή). Αναφέρεται ως απολύτως
σταθερό. |
|
72,5 |
~ HClO4·2H2O |
|
Σταθερό, αζεοτροπικό μίγμα υπερχλωρικού οξέος - ύδατος, σ.ζ.
203οC (σε κανονική πίεση). Η
συνηθέστερη εμπορική μορφή του υπερχλωρικού οξέος. Πυκνότητα 1,66
g/cm³ (στους 25ºC) |
|
69,0 |
HClO4·2,5H2O |
-29,8 |
Σταθερό σε θερμοκρασία
δωματίου. |
|
65,0 |
HClO4·3H2O |
-37 (α-μορφή)
~ -43 (β-μορφή) |
Σταθερό. 'Ενυδρο υπερχλωρικό διοξώνιο:
H5O2+ClO4-·H2O (α-μορφή), υπερχλωρικό τριοξώνιο:
H7O3+ClO4-
(β-μορφή). |
|
61,4 |
HClO4·3,5H2O |
-41,4 |
Σταθερό. Συνήθης εμπορική μορφή του υπερχλωρικού οξέος . Πυκνότητα
1,53
g/cm³ (στους 25ºC) |
|
Υπερ-οξέα: Οι ισχυρότεροι χημικοί δότες πρωτονίων [Αναφ. 6]
Τον όρο καθιέρωσαν από το 1927 οι J. Conant και N. Hall για να περιγράψουν διαλύματα θειικού ή
υπερχλωρικού οξέος σε άνυδρο οξικό οξύ. Κάθε ουσία με οξύτητα μεγαλύτερη από
εκείνη του 100% θειικού οξέος χαρακτηρίζεται ως υπερ-οξύ (superacid). Τα κοινά υπερ-οξέα παρασκευάζονται με διάλυση ένα ισχυρού οξέος κατά Lewis (π.χ. του SbF5) σε
κατάλληλο οξύ κατά Broensted (π.χ. HF, HSO3F).
Γνωστά υπερ-οξέα είναι το μαγικό οξύ (magic
acid), ισομοριακό μίγμα HSO3F
και SbF5
και το
εξαφθοροαντιμονικό οξύ HSbF6 (ισομοριακό μίγμα HF και SbF5), που θεωρείται το ισχυρότερο υπερ-οξύ (ισχυρότερο από το θειικό οξύ κατά 1019
φορές). Τα υπερ-οξέα συμπεριφέρονται σχεδόν σαν "γυμνά πρωτόνια" και μπορούν να
πρωτονιώσουν ακόμη και απλά αλκάνια, παρέχοντας αλκανοκατιόντα (π.χ.
μεθανοκατιόν CH5+). Δεν πρέπει να συγχέονται με τα υπεροξέα (peracids), δηλ. ανόργανα
ή οργανικά οξέα που περιέχουν στο μόριό του υπεροξειδικό-δεσμό -O-O-. Για διάκριση μεταξύ τους στην ελληνική
βιβλιογραφία έχουν προταθεί αποδόσεις όπως σουπεροξέα και
υπερυπεροξέα.
|
Διαλυτότητα υπερχλωρικών αλάτων αμμωνίου, αλκαλίων και γαιαλκαλίων σε
διάφορους διαλύτες [Αναφ. 2]
|
Διαλύτης |
Διαλυτότητα
(g /
100 g
διαλύτη) στους 25οC |
|
ΝΗ4ClO4 |
LiClO4 |
NaClO4 |
KClO4 |
RbClO4 |
CsClO4 |
Mg(ClO4)2 |
Ca(ClO4)2 |
Sr(ClO4)2 |
Ba(ClO4)2 |
|
Ύδωρ |
24,9 |
59,7 |
210 |
2,06 |
1,34 |
2,00 |
99,6 |
189 |
310 |
198 |
|
Μεθανόλη |
6,86 |
182 |
51,4 |
0,105 |
0,060 |
0,093 |
51,8 |
237 |
212 |
217 |
|
Αιθανόλη |
1,91 |
152 |
14,7 |
0,012 |
0,009 |
0,011 |
23,9 |
166 |
181 |
125 |
|
Ακετόνη |
2,26 |
136 |
51,7 |
0,16 |
0,095 |
0,150 |
42,9 |
61,9 |
150 |
125 |
|
Οξικός
αιθυλεστέρας |
0,03 |
95,1 |
9,6 |
0,00 |
0,016 |
0,00 |
70,9 |
75,6 |
137 |
113 |
|
Διαιθυλαιθέρας |
0,00 |
114 |
0,00 |
0,00 |
0,00 |
0,00 |
0,29 |
0,26 |
0,00 |
0,00 |
Τα υπερχλωρικά άλατα είναι σταθερά σε σχετικά υψηλές θερμοκρασίες (π.χ.
150-250 οC), υπό
την προϋπόθεση ότι το κατιόν δεν μπορεί να υποστεί οξείδωση από τα
υπερχλωρικά ανιόντα.
|
Σε κάθε περίπτωση πρέπει να αποφεύγεται η θέρμανση προς
ξήρανση
υπερχλωρικών αλάτων οργανικών βάσεων ή συμπλόκων
μετάλλων με οργανικούς υποκαταστάτες
|
Στη βιβλιογραφία αναφέρονται
εργαστηριακά ατυχήματα που οφείλονται σε εκρηκτικές διασπάσεις υπερχλωρικών
αλάτων. Για τους λόγους αυτούς, όποτε είναι δυνατόν επιδιώκεται η αντικατάσταση
των υπερχλωρικών ανιόντων, ως αντισταθμιστικών ανιόντων, με ανιόντα που έχουν
παρόμοιες ιδιότητες χημικής αδράνειας, όπως τα τετραφθοροβορικά ή
εξαφθοροφωσφορικά ανιόντα, τα οποία είναι ασφαλέστερα αφού δεν αποτελούν
οξειδωτικούς παράγοντες σε υψηλές θερμοκρασίες.
Τα υπερχλωρικά ανιόντα χαρακτηρίζονται από ελάχιστη τάση εφυδάτωσης
γεγονός το οποίο σημαίνει ότι διευκολύνουν την εκχύλιση λιπόφιλων κατιόντων από
υδατικά διαλύματα με οργανικούς διαλύτες, σχηματίζοντας εκχυλίσιμα ιοντικά
ζεύγη. Τυπική κατάταξη διάφορων κοινών ανιόντων κατά μειούμενη τάση εφυδάτωσης (γνωστή ως σειρά Hofmeister) δείχνεται
στο επόμενο σχήμα [Αναφ. 8].
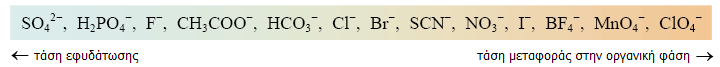
 Η
σειρά Ηofmeister υποδηλώνει κατάταξη ιόντων κατά αυξανόμενη ικανότητα
διατάραξης των δομών ύδατος - μεγαλομορίων και κυρίως των πρωτεϊνών. 'Οσο
υψηλότερα στη σειρά βρίσκεται το ιόν, τόσο εντονότερη διατάραξη στη δευτερογενή
και τριτογενή δομή της πρωτεΐνης προκαλεί. Αυτό οφείλεται στην αποδυνάμωση των
δεσμών υδρογόνου. 'Ετσι, π.χ. πυκνό διάλυμα
NaClO4 αποδιατάσσει ("ξεδιπλώνει")
πλήρως το μόριο της πρωτεΐνης. Η ιδιότητα αυτή χαρακτηρίζεται
χαοτροπισμός (chaotropism) και το NaClO4
είναι ένα από τα πλέον
δραστικά χαοτροπικά αντιδραστήρια [Αναφ.
9].
Η
σειρά Ηofmeister υποδηλώνει κατάταξη ιόντων κατά αυξανόμενη ικανότητα
διατάραξης των δομών ύδατος - μεγαλομορίων και κυρίως των πρωτεϊνών. 'Οσο
υψηλότερα στη σειρά βρίσκεται το ιόν, τόσο εντονότερη διατάραξη στη δευτερογενή
και τριτογενή δομή της πρωτεΐνης προκαλεί. Αυτό οφείλεται στην αποδυνάμωση των
δεσμών υδρογόνου. 'Ετσι, π.χ. πυκνό διάλυμα
NaClO4 αποδιατάσσει ("ξεδιπλώνει")
πλήρως το μόριο της πρωτεΐνης. Η ιδιότητα αυτή χαρακτηρίζεται
χαοτροπισμός (chaotropism) και το NaClO4
είναι ένα από τα πλέον
δραστικά χαοτροπικά αντιδραστήρια [Αναφ.
9].
Συνήθεις χρήσεις του υπερχλωρικών αλάτων: Το
υπερχλωρικό άλας που χρησιμοποιείται σε μεγάλες ποσότητες ως οξειδωτικό στα
στερεά προωθητικά καύσιμα πυραύλων είναι το NH4ClO4 και για το λόγο αυτό παράγεται ετησίως σε ποσότητες
αρκετών χιλιάδων τόννων. Ακολουθεί (σε ποσότητα) το KClO4 το οποίο επίσης χρησιμοποιείται σε στερεά καύσιμα πυραύλων, αλλά και σε
φωτοβολίδες και πυροτεχνήματα.
Το υπερχλωρικό μαγνήσιο χρησιμοποιείται
ως ξηραντικό υλικό και διατίθεται με διάφορα εμπορικά ονόματα (Dehydrite, Anhydrone). Αν και εξαιρετικό αφυδατικό μέσο (μόνο το BaO φαίνεται ως
δραστικότερο αφυδατικό υλικό), η χρήση του σε μεγάλη κλίμακα αποθαρρύνεται
πλέον λόγω των αναφορών εκρήξεων σε συστήματα ξήρανσης οργανικών αερίων
[Αναφ. 10].
Επιπλέον, η ασυνήθιστα μεγάλη διαλυτότητα του άνυδρου υπερχλωρικού λιθίου στον
διαιθυλαιθέρα έχει αξιοποιηθεί στην οργανική σύνθεση.
|
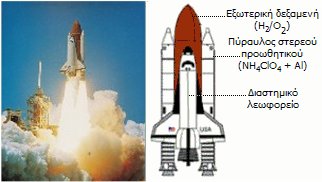
Κατά την εκτόξευση του διαστημικού λεωφορείου ο
λευκός καπνός είναι μίγμα ατμών ύδατος, υδροχλωρίου και οξειδίου του
αργιλίου [Αναφ.
11]. |
Διαστημικές και στρατιωτικές
εφαρμογές του υπερχλωρικού αμμωνίου [Αναφ.
11]
Το υπερχλωρικό αμμώνιο χρησιμοποιείται
σχεδόν αποκλειστικά ως ο κύριος οξειδωτικός παράγοντας των στερεών προωθητικών
μιγμάτων (solid propellants), που χρησιμοποιούνται σε στρατιωτικά αυτοπροωθούμενα βλήματα ως και στις εκτοξεύσεις των διαστημικών
οχημάτων, όπως τα διαστημικά λεωφορεία.
Οι ενισχυτικοί
(booster) πύραυλοι που
ανυψώνουν τα διαστημικά λεωφορεία χρησιμοποιούν ως στερεό προωθητικό υλικό,
μίγμα που τυπικά περιέχει 15% σκόνη Al, 70% NH4ClO4,
πολυμερές οργανικό υλικό, το
οποίο δρα ως
συνδετικό υλικό και μικρότερες ποσότητες Fe2O3, που δρα ως καταλύτης. Μόλις θερμανθεί, τα συστατικά του
μίγματος αντιδρούν με έκλυση μεγάλων ποσοτήτων θερμότητας που ανυψώνουν τη
θερμοκρασία των αερίων στους 3200-3400ºC. Η συνολική
αντίδραση μπορεί να αποδοθεί (απλουστευμένα) ως:
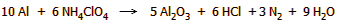
Τα παραγόμενα αέρια (κυρίως HCl, N2 και
H2O) διαστέλλονται σε μεγάλο βαθμό λόγω της υψηλής θερμοκρασίας και εκλύονται με μεγάλη
ταχύτητα δημιουργώντας τεράστια προωθητική ισχύ. Ωστόσο, το βασικό
μειονέκτημα των στερεών πρoωθητικών
είναι ότι μετά την πυροδότησή τους είναι αδύνατη η διακοπή της
αντίδρασης, η οποία θα συνεχισθεί μέχρις της εξάντλησης του μίγματος
οξειδωτικού-καυσίμου.
Οι ενισχυτικοί πύραυλοι
(οι δύο πλαϊνοί πύραυλοι) αποδίδουν αρχικά το 70% περίπου της απαιτούμενης
προωθητικής ισχύος και το υπόλοιπο ο κύριος πύραυλος (που λειτουργεί με
καύση μίγματος Η2+Ο2). Οι ενισχυτικοί πύραυλοι
λειτουργούν για 75 s και ανυψώνουν το διαστημικό όχημα μέχρι ύψους περίπου
45 km και σε ύψος περίπου 65 km
αποσπώνται.
'Εχουν εκδηλωθεί ανησυχίες ως προς τις περιβαλλοντικές επιπτώσεις από το παραγόμενο
Al2O3 και κυρίως από το τοξικό και διαβρωτικό HCl. 'Εχει εκτιμηθεί ότι η ανύψωση του διαστημικού οχήματος μέχρι τα 500 m συνεπάγεται έκλυση 25
τόννων HCl και 39 τόννων Al2O3, ενώ μέχρι την εξάντληση και απόρριψη των ενισχυτικών πυραύλων εκλύονται
συνολικά 60 τόννοι HCl και 110 τόννοι Al2O3. Χαρακτηριστικά
αναφέρεται ότι το νερό σε κλειστούς κόλπους (λιμνοθάλασσες) κοντά στην
περιοχή εκτόξευσης (διαστημικό κέντρο Κέννεντυ) μετά από κάθε εκτόξευση
γίνεται ισχυρά όξινο (pH ~1)
με αποτέλεσμα το θάνατο κάθε υδρόβιου οργανισμού. [Αναφ.
11β]. |
|
 |
 |
 |
|
Βίντεο από το
YouTube.
Bίντεο
1,
βίντεο 2: το βιομηχανικό ατύχημα της PEPCON στη Νεβάδα (Μάιος 1988).
Βίντεο 3: θερμική διάσπαση μικρής ποσότητας
NH4ClO4. |
"Διάσημα" ατυχήματα με το υπερχλωρικό οξύ και τα άλατά του.
Η χρήση του υπερχλωρικού οξέος και των αλάτων
του έχει συνδεθεί με τρομακτικά ατυχήματα. Από τα πιο καταστρεπτικά που έχουν
καταγραφεί είναι η έκρηξη σε ένα μικρό εργοστάσιο επιμετάλλωσης
(O'Connor Plating Works)
στο Los Angeles τον Φεβρουάριο του 1947. Στο
εργοστάσιο αυτό γινόταν χρήση της ηλεκτρολυτικής μεθόδου στίλβωσης Jacquet (electropolishing),
με την
οποία αντικείμενα από αλουμίνιο αποκτούν αστραφτερό λούστρο [Αναφ. 12].
Στη μέθοδο χρησιμοποιείται ως ηλεκτρολύτης μίγμα υπερχλωρικού οξέος - οξικού ανυδρίτη
(ηλεκτρολύτης Jacquet). Φαίνεται ότι λόγω βλάβης του συστήματος ψύξης του
ηλεκτρολυτικού λουτρού, σε συνδυασμό με τυχαία πτώση στο μίγμα πλαστικών υλικών, που
έδρασαν ως έναυσμα, το
μίγμα εξερράγη. Η έκρηξη ισοπέδωσε τα πάντα σε ακτίνα 100 μέτρων, προκάλεσε το
θάνατο
15 ανθρώπων και τον τραυματισμό άλλων 150, άφησε 500 άτομα άστεγα και
προκάλεσε συνολικές ζημιές 1.000.000 $ [Αναφ. 13].
Αναφέρεται ότι ο G.F.
Smith, ένθερμος υποστηρικτής της βιομηχανικής χρήσης του υπερχλωρικού οξέος, αμφισβήτησε τα
πορίσματα των αρμοδίων υπηρεσιών και απέδωσε την έκρηξη σε διαρροή αερίου θέρμανσης
[Αναφ. 4].
Διάσημο βιομηχανικό ατύχημα συνέβη τον Μάιο του 1988 στο εργοστάσιο της Pacific Engineering Production Company of Nevada (PEPCON)
στην πόλη Henderson, κοντά στο Las Vegas της Νεβάδας. Η
PEPCON ήταν ο
κύριος παραγωγός υπερχλωρικού αμμωνίου για διαστημικούς και στρατιωτικούς σκοπούς στις ΗΠΑ. Το ατύχημα αποδόθηκε σε πυρκαγιά, κατά τη διάρκεια
επισκευαστικών εργασιών, που εξαπλώθηκε σε χώρους φύλαξης μεγάλων ποσοτήτων
(4.000 τόννοι) υπερχλωρικού αμμωνίου. Το υπερχλωρικό αμμώνιο με θέρμανση στους
200ºC
διασπάται εκρηκτικά και με έντονη λάμψη σύμφωνα με την αντίδραση [Αναφ. 1]:
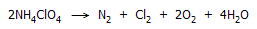
Η σφοδρότατη έκρηξη που ακολούθησε ισοπέδωσε το εργοστάσιο και τους
παρακείμενους οικισμούς, στοίχισε
τη ζωή 2 ανθρώπων (η σχετικά αργή εξάπλωση της πυρκαγιάς διευκόλυνε την έγκαιρη
απομάκρυνση του προσωπικού), τον τραυματισμό άλλων 372 και προκάλεσε συνολικές ζημιές
100.000.000 $. Εκτιμάται ότι η έκρηξη είχε ισχύ 15 κιλοτόννων TNT, καταγράφηκε ως σεισμός 3-3,5 ρίχτερ και προκάλεσε ζημιές
ακόμη και στη μητροπολιτική
περιοχή του Las Vegas 16 χιλιόμετρα μακριά [Αναφ. 14].
H έκρηξη της PEPCON θεωρείται ως η μεγαλύτερη χημική
έκρηξη στην ιστορία του ανθρώπου.
|

Εγκαταστάσεις εξόρυξης και επεξεργασίας caliche, στην έρημο Atacama της Χιλής
που θεωρείται ως η πλέον άνυδρη περιοχή του πλανήτη. Το caliche της
Atacama αποτελείται κυρίως από
CaCO3,
αλλά περιέχει ακόμη περίπου 25% NaNO3,
3% KNO3,
όπως και μικρές ποσότητες ιωδικών και βορικών αλάτων. Αποτελεί την
πηγή του ονομαζόμενου "νίτρου της Χιλής" (NaNO3),
όπως και την κύρια πηγή για την παραγωγή ιωδίου
[Αναφ. 16].
Σχετικά πρόσφατα διαπιστώθηκε η παρουσία στο νιτρικό νάτριο, που
λαμβάνεται από το caliche, μικρών ποσοτήτων υπερχλωρικών αλάτων
[Αναφ. 15]. |
Τα υπερχλωρικά στο περιβάλλον, στα
τρόφιμα, το πόσιμο νερό και αλλού
Τα
υπερχλωρικά άλατα αν και αρχικά θεωρήθηκαν ως
εξολοκλήρου ανθρωπογενείς χημικές ουσίες [Αναφ. 2], φαίνεται ότι υπάρχουν
σε πολύ μικρές ποσότητες και
στη φύση. Ανιχνεύθηκαν σε μικρά ποσοστά στο NaNO3
("νίτρο της Χιλής"),
το οποίο παραλαμβάνεται από το caliche, ένα ορυκτό μίγμα ασβεστόλιθου και
διαλυτών νιτρικών αλάτων (κυρίως), τεράστιες αποθέσεις του οποίου συναντώνται
στην έρημο Atacama
στη βόρεια Χιλή.
Yπερχλωρικά έχουν βρεθεί σε άνυδρες
εκτάσεις των νοτιοδυτικών περιοχών των ΗΠA και του Καναδά. Σε μια εργασία
βρέθηκε
ότι νιτρικό νάτριο λιπασμάτων, το οποίο προερχόταν από caliche, περιείχε 1,5-1,8 mg υπερχλωρικών ιόντων/g
[Αναφ. 15].
Ο μηχανισμός σύνθεσης των
υπερχλωρικών ιόντων στη φύση παραμένει ερώτημα αν και πιθανολογείται ότι είναι
αποτέλεσμα χημικών αντιδράσεων στην ατμόσφαιρα.
'Ιχνη υπερχλωρικών
έχουν βρεθεί στην
ατμόσφαιρα και ένα μέρος τους ανιχνεύεται στη βροχή. 'Εχουν επίσης
ανιχνευθεί
σε διάφορα
τρόφιμα και στο πόσιμο νερό ορισμένων περιοχών των ΗΠΑ. Ωστόσο, η προέλευσή τους
φαίνεται ότι είναι ανθρωπογενής και αποτέλεσμα της ευρύτατης χρήσης υπερχλωρικών
αλάτων ως καυσίμων πυραύλων και ρύπανσης από απόβλητα βιομηχανιών.
Η ρύπανση των
υδάτων με υπερχλωρικά ιόντα είναι η καθημερινή λήψη εξαιρετικά μικρών
ποσοτήτων τους με τη διατροφή και το πόσιμο νερό.
|
Μια εξαιρετική παρουσίαση των
φυσικών και χημικών ιδιοτήτων του υπερχλωρικού οξέος και των αλάτων
τους, των αναλυτικών και άλλων εφαρμογών τους, των κανόνων ασφαλούς
χρήσης τους, όπως και των επιπτώσεων της χρήσης τους στο περιβάλλον,
μπορούν να βρεθούν στο 27-σέλιδο φυλλάδιο "GFS Chemicals: Perchloric
acid & Perchlorates" (αρχείο PDF 640 ΚΒ) το οποίο μπορεί να
αναζητηθεί ως "Perchlorate Brochure" (22/2/2008) από την ακόλουθη
ιστοσελίδα δημοσιεύσεων της εταιρίας GFS Chemicals. |
Βιβλιογραφία -
Πηγές από το Διαδίκτυο
1. Greenwood NN, Earnshaw A: "Chemistry of the
Elements", Pergamon Press, 1st ed. 1984, σελ. 1015-1017.
2. Schilt AA: "Perchloric acid and perchlorates",
G. Frederick Smith Chemical Company, Columbus, Ohio, 1979.
3. Smith GF, McCurdy WH,
Diehl: "The dualistic and versatile reaction properties of perchloric acid and
the colorimetric determination of iron in raw and treated municipal water
suppllies", G. Frederick Smith Chemical Company, Columbus, Ohio
(1955).
4. Diehl H: "G. Frederick Smith", Talanta, 13:867-883 (1966).
5. (α) Harvard University: "Guidelines for Using Perchloric Acid" (last update: Oct 10,
2001). (β) Texas A&M University, Safety in the Laboratory: "Oxidizing
Materials". (γ) Stone L (Indiana Pardue University): "The
Dr Jekyll and Mr. Hyde Chemical".
6. (α) BookRags: "Superacids". (β) IUPAC, Gold Book:
"Superacids". (γ) Wikipedia:
"Superacid". (δ) Wikipedia: "Fluoroantimonic
acid".
7. Smith GF: "The wet chemical oxidation of organic compositions employing perchloric
acid", G. Frederick Smith Chemical Company, Columbus, Ohio (1965).
8. Ευσταθίου Κ: "Ιοντικά ζεύγη και ενώσεις-κορώνες", Συμπληρωματικό
εκπαιδευτικό υλικό μαθημάτων Ενόργανης Ανάλυσης Ι, 2006
(αρχείο PDF 335 KB).
9. Wikipedia: "Hofmeister
series".
10. (α) Wikipedia:
"Magnesium
Perchlorate". (β) Mallinckrodt Chemicals, Material Safety Data Sheet (MSDS):
"Magnesium
Perchlorate".
11. (α) American Chemistry: "Ammonium Perchlorate: Helping to Launch the Space
Shuttle Discovery" (August
2005). (β) New Scientist: "Poisoned plumes: Across the US, environmentalists are protesting
against rocket launches. Toxic exhaust fumes from rockets packed with solid
propellant attract the greatest concern" (1991).
12. Jacket PA:
"Metallography of aluminium and its alloys - Use of electrolytic polishing"
(National Advisory Committee for Aeronautics, Technical memorandum 1384) (αρχείο
PDF, 3,76 MB).
13. (α) Time
in partnership with CNN: "The
amazing brew". (β) GendDisasters:
Beitler S: "Los
Angeles, CA Plating Works Explosions, February 1947" (October 27, 2007).
14. (α)
Wikipedia: "PEPCON
disaster". (β) LasVegas Mercury: "Tales
of Vegas Past: PEPCON explosion was Henderson turning point" (20/3/2005).
15. Urbansky
ET, Brown SK, Magnuson ML, Kelty CA: "Perchlorate levels in samples of sodium
nitrate fertilizer derived from Chilean caliche", Environ. pollut.,
112(3):299-302, 2001. (Abstract)
16. (α) Wikipedia: "Caliche
(mineral)". (β) Ιστοσελίδα της "Atacama
Minerals Corp.".
17. US Food
and Drug Administration: "Perchlorate:
Questions and Answers".
|
Αποποίηση
ευθυνών:
Έχει καταβληθεί κάθε προσπάθεια για να εξασφαλισθεί η ορθότητα των
πληροφοριών που περιλαμβάνονται σε αυτή τη σελίδα, ωστόσο ο έχων την
επιμέλεια της σελίδας αυτής και το Τμήμα Χημείας δεν αναλαμβάνουν τη
νομική ευθύνη για τυχόν σφάλματα, παραλείψεις ή ανακριβείς πληροφορίες.
Επιπλέον, το Τμήμα Χημείας δεν εγγυάται την ορθότητα των αναφερόμενων σε
εξωτερικές ιστοσελίδες, ούτε η αναφορά μέσω συνδέσμων (links) στις ιστοσελίδες αυτές, υποδηλώνει ότι το Τμήμα
Χημείας επικυρώνει ή καθ' οιονδήποτε τρόπο αποδέχεται το περιεχόμενό
τους. |
 Η
σειρά Ηofmeister υποδηλώνει κατάταξη ιόντων κατά αυξανόμενη ικανότητα
διατάραξης των δομών ύδατος - μεγαλομορίων και κυρίως των πρωτεϊνών. 'Οσο
υψηλότερα στη σειρά βρίσκεται το ιόν, τόσο εντονότερη διατάραξη στη δευτερογενή
και τριτογενή δομή της πρωτεΐνης προκαλεί. Αυτό οφείλεται στην αποδυνάμωση των
δεσμών υδρογόνου. 'Ετσι, π.χ. πυκνό διάλυμα
NaClO4 αποδιατάσσει ("ξεδιπλώνει")
πλήρως το μόριο της πρωτεΐνης. Η ιδιότητα αυτή χαρακτηρίζεται
χαοτροπισμός (chaotropism) και το NaClO4
είναι ένα από τα πλέον
δραστικά χαοτροπικά αντιδραστήρια [Αναφ.
9].
Η
σειρά Ηofmeister υποδηλώνει κατάταξη ιόντων κατά αυξανόμενη ικανότητα
διατάραξης των δομών ύδατος - μεγαλομορίων και κυρίως των πρωτεϊνών. 'Οσο
υψηλότερα στη σειρά βρίσκεται το ιόν, τόσο εντονότερη διατάραξη στη δευτερογενή
και τριτογενή δομή της πρωτεΐνης προκαλεί. Αυτό οφείλεται στην αποδυνάμωση των
δεσμών υδρογόνου. 'Ετσι, π.χ. πυκνό διάλυμα
NaClO4 αποδιατάσσει ("ξεδιπλώνει")
πλήρως το μόριο της πρωτεΐνης. Η ιδιότητα αυτή χαρακτηρίζεται
χαοτροπισμός (chaotropism) και το NaClO4
είναι ένα από τα πλέον
δραστικά χαοτροπικά αντιδραστήρια [Αναφ.
9].

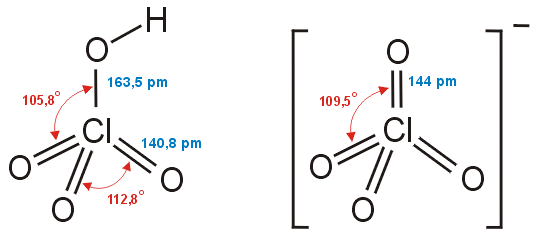
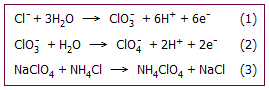 Το υπερχλωρικό οξύ παρασκευάζεται ηλεκτρολυτικά με τη μέθοδο
Kreider-Mathers. Η μέθοδος είναι απλή και ακίνδυνη και ως πρώτη ύλη
χρησιμοποιείται το NaCl. Η παρασκευαστική διαδικασία χωρίζεται σε δύο στάδια.
Το υπερχλωρικό οξύ παρασκευάζεται ηλεκτρολυτικά με τη μέθοδο
Kreider-Mathers. Η μέθοδος είναι απλή και ακίνδυνη και ως πρώτη ύλη
χρησιμοποιείται το NaCl. Η παρασκευαστική διαδικασία χωρίζεται σε δύο στάδια. Ο αναλυτικός χημικός του οποίου το
όνομα έχει άρρηκτα συνδεθεί με το υπερχλωρικό οξύ και τις ενώσεις
του
Ο αναλυτικός χημικός του οποίου το
όνομα έχει άρρηκτα συνδεθεί με το υπερχλωρικό οξύ και τις ενώσεις
του
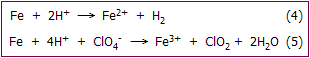 Συνήθεις χρήσεις του υπερχλωρικού
οξέος: Το υπερχλωρικό οξύ υ
Συνήθεις χρήσεις του υπερχλωρικού
οξέος: Το υπερχλωρικό οξύ υ Σε πυκνά διαλύματα και
υψηλές θερμοκρασίες το υπερχλωρικό οξύ
Σε πυκνά διαλύματα και
υψηλές θερμοκρασίες το υπερχλωρικό οξύ