|

James Bryant
Conant (1893-1978). Υπήρξε καθηγητής Οργανικής Χημείας και
Πρόεδρος του Πανεπιστημίου Harvard
[Αναφ. 4]. |
Γενικά για τα σουπεροξέα
Τον
όρο σουπεροξύ
(superacid) εισήγαγε
James Bryant Conant το 1927 για να περιγράψει
οξέα ισχυρότερα από τα συμβατικά ισχυρά ορυκτά (ανόργανα) οξέα. Η IUPAC
ορίζει ως σουπεροξύ ένα μέσο (όχι κατ'
ανάγκη ένωση) με υψηλή οξύτητα, γενικά μεγαλύτερη από εκείνη του
θειικού οξέος 100% [Αναφ. 2].
Τα σουπεροξέα μπορεί να
είναι απλές ενώσεις, αλλά και μίγματα ενός πανίσχυρου οξέος κατά Lewis
(όπως το SbF5) με ένα
οξύ κατά
Brønsted, όπως π.χ. το HF ή το HSO3F
(φθοροσουλφονικό οξύ). Το ισομοριακό μίγμα
HSO3F
και
SbF5
είναι γνωστό ως μαγικό οξύ (magic
acid) [Αναφ. 3].
Θα πρέπει να σημειωθεί ότι παρά την κάπως
"κολακευτική" ονομασία του, το μαγικό οξύ δεν είναι και το ισχυρότερο σουπεροξύ.
Ο τίτλος του ισχυρότερου σουπεροξέος -μέχρι στιγμής- ανήκει στο
φθοροαντιμονικό οξύ (fluoroantimonic acid, HSbF6),
το οποίο παρασκευάζεται με διάλυση SbF5
σε άνυδρο ΗF.
'Αλλα γνωστά σουπεροξέα, που είναι απλές ενώσεις
και εμπορικά διαθέσιμες, είναι το τριφλικό οξύ (triflic acid, CF3SO3H)
και το φθοροσουλφονικό οξύ (fluorosulfonic acid), τα οποία είναι
σχεδόν χίλιες φορές ισχυρότερα οξέα από το καθαρό (100%) θειικό οξύ.
Τα σουπεροξέα μπορούν να θεωρηθούν μέσα τα
οποία προσφέρουν εύκολα γυμνά πρωτόνια (στην κυριολεξία: με
εξαιρετικά "χαλαρή" τάσης επιδιαλύτωσης), σε σημείο που μπορούν να
πρωτονιώσουν ουσίες οι οποίες τυπικά δεν έχουν την παραμικρή "διάθεση" να δράσουν ως
βάσεις. 'Ετσι, τα σουπεροξέα πρωτονιώνουν π.χ. αλκάνια, παρέχοντας
κατιόντα (καρβοκατιόντα), τα οποία στη συνέχεια παρέχουν σταθερότερα κατιόντα
και διακλαδισμένων αλκανίων με περισσότερα άτομα άνθρακα. Οι αντιδράσεις αυτές έχουν ιδιαίτερο βιομηχανικό ενδιαφέρον.
Αντίστοιχα, υπάρχουν και
οι σουπερβάσεις (superbases), ενώσεις οι οποίες είναι σε θέση να
αποσπάσουν υδρογόνο ως πρωτόνιο από άλλες ενώσεις, που δύσκολα θα μπορούσαν
να το διαθέσουν. Τυπικά παραδείγματα
αποτελούν τα διάφορα αλκυλολίθια (π.χ. το n-βουτυλολίθιο, n-C4H9Li)
και τα αντιδραστήρια Grignard (RMgX). Από τις ισχυρότερες εμπορικά
διαθέσιμες σουπερβάσεις είναι το διισοπροπυλαμιδο-λίθιο [(CH3)2CH]2N-Li
(lithium diisopropylamide,
LDA).
Θα πρέπει ευθύς εξ αρχής να διευκρινισθεί
ότι τα σουπεροξέα χάνουν την "κολακευτική" ονομασία τους, όταν διαλυθούν στο νερό, με το οποίο είτε
αντιδρούν υδρολυόμενα, είτε υπόκεινται στο εξισωτικό φαινόμενο (leveling
effect), είτε και τα δύο οπότε παύουν να ξεχωρίζουν ως προς την οξύτητά τους από τα κοινά
ισχυρά ανόργανα ισχυρά οξέα.
|
Σημείωση
ως προς την ονομασία "σουπεροξύ"
Με
τον όρο
superacid περιγράφονται συνολικά τα μέσα με οξύτητα μεγαλύτερη από εκείνη του θειικού οξέος 100% κ.β. Η ευρύτατη
χρήση του λατινικού προθήματος super-, παράλληλα με εκείνη του ελληνικής
προέλευσης προθήματος per- (από την ελληνική πρόθεση "υπέρ") στην
ονομασία διαφόρων χημικών ενώσεων, δημιουργεί ένα πρόβλημα απόδοσης των αντίστοιχων
ονομασιών στην ελληνική. Προφανώς,
η άμεση απόδοση του όρου ως υπεροξύ θα οδηγούσε σε
σύγχυση, αφού ως "υπεροξέα" (ορθότερα: υπεροξυοξέα) στην ελληνική βιβλιογραφία χαρακτηρίζονται τα οξέα,
που διαθέτουν υπεροξειδικό δεσμό Ο-Ο, τα οποία στην Αγγλική
βιβλιογραφία αναφέρονται ως peracids
(ή peroxyacids) (π.χ.
υπεροξικό οξύ: CH3CO-O-OH).
Στην ιστοσελίδα αυτή χρησιμοποιείται ο όρος σουπεροξύ, δηλαδή θα
γίνεται χρήση του προθήματος λατινικής προέλευσης ως έχει, κατ' αντιστοιχία και κατ'
ανταπόδοση της χρήσης του ελληνικής προέλευσης προθήματος στη ξενόγλωσση
βιβλιογραφία, χωρίς αυτό να σημαίνει ότι υποδεικνύεται η καθιέρωση αυτής
της απόδοσης στα Ελληνικά χημικά κείμενα.
|
Αυτοπρωτόλυση και εξισωτικό φαινόμενο
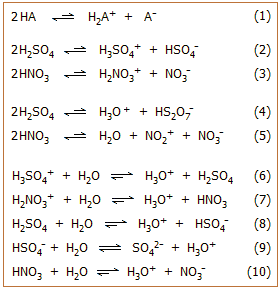 Είναι γνωστό ότι στα ασθενή οξέα, η ισχύς τους
σε υδατικά διαλύματα εκφράζεται ως η σταθερά διάστασής τους Ka
(ως έχει ή υπό τη πιο εύχρηστη μορφή του αρνητικού λογαρίθμου τους pKa
= -log
Ka).
Μέτρο της οξύτητας υδατικών διαλυμάτων των ίδιων ή αραιών διαλυμάτων
ισχυρών οξέων είναι το pH, το οποίο μετρείται εύκολα με τα σύγχρονα
πεχάμετρα μετά από βαθμονόμησή τους με ρυθμιστικά
διαλύματα γνωστού pH.
Είναι γνωστό ότι στα ασθενή οξέα, η ισχύς τους
σε υδατικά διαλύματα εκφράζεται ως η σταθερά διάστασής τους Ka
(ως έχει ή υπό τη πιο εύχρηστη μορφή του αρνητικού λογαρίθμου τους pKa
= -log
Ka).
Μέτρο της οξύτητας υδατικών διαλυμάτων των ίδιων ή αραιών διαλυμάτων
ισχυρών οξέων είναι το pH, το οποίο μετρείται εύκολα με τα σύγχρονα
πεχάμετρα μετά από βαθμονόμησή τους με ρυθμιστικά
διαλύματα γνωστού pH.
Η έννοια του pH μπορεί να χρησιμοποιηθεί σε διαλύματα ή μέσα, στα οποία
κυριαρχεί ως συστατικό το ύδωρ. 'Ετσι, δεν έχουν νόημα τιμές pH εκτός της περιοχής 0-14
ή (ρεαλιστικότερα) της περιοχής 1-13, δεδομένης της αδυναμίας ακριβούς
μέτρησης του pH στα άκρα της περιοχής. Σε τόσο όξινα (ή βασικά) διαλύματα το
οξύ (ή η βάση) γίνεται κύριο πλέον συστατικό του διαλύματος.
Στα καθαρά υγρά οξέα
κατά
Brønsted, τα μόριά τους (γενικά ΗΑ)
υπόκεινται σε μερική αυτοπρωτόλυση
(autoprotolysis), η οποία κατά κανόνα
έχει τη γενική μορφή της αντίδρασης ισορροπίας
1. Τυπικά παραδείγματα αποτελούν οι
σχετικές ισορροπίες διάστασης του θειικού και του νιτρικού οξέος (ισορροπίες
2 και 3).
Σε πολλές περιπτώσεις (όπως των Η2SO4
και ΗΝΟ3) η σταθερά της ισορροπίας αυτοπρωτόλυσης είναι κατά πολλές τάξεις
μεγέθους μεγαλύτερη από την αντίστοιχη του ύδατος (που ως γνωστόν συμβολίζεται ως Κw).
Τα κατιοντικά οξέα (στο παράδειγμα: Η3SO4+,
H2NO3+),
συγκρατούν πολύ "χαλαρά" το πρωτόνιο και έτσι είναι κατά τάξεις μεγέθους ισχυρότερα οξέα (δότες
πρωτονίων) σε σχέση με το κατιόν του υδροξωνίου (Η3Ο+). Κάποιες ενδεικτικές τιμές σταθεράς αυτοπρωτόλυσης (Καπ)
καθαρών οξέων ή άλλων υγρών ενώσεων, που μπορούν να δράσουν ως οξέα ή βάσεις, παρουσιάζονται στον
πίνακα αριστερά [Αναφ. 5].
Θα πρέπει να σημειωθεί ότι πέραν από τις
ισορροπίες αυτοπρωτόλυσης, ανάλογα με
το είδος του οξέος, μπορεί να υφίστανται και άλλες παράλληλες ισορροπίες,
όπως ισορροπίες αφυδάτωσης και διμερισμού (ισορροπίες 4
και 5).
Εξισωτικό φαινόμενο.
Αν στα καθαρά οξέα αρχίσει να προστίθεται ύδωρ, αυτό δρα ως βάση και
προσλαμβάνει το "χαλαρά συνδεμένο" πρωτόνιο των πανίσχυρων κατιοντικών οξέων (ισορροπίες
6, 7).
Τα παραγόμενα μοριακά σωματίδια (συζυγείς βάσεις των κατιοντικών οξέων, στο
παράδειγμα H2SO4,
HNO3),
εξακολουθούν να είναι ισχυρότερα οξέα από το υδροξώνιο. 'Ετσι,
με την προσθήκη επιπλέον ποσοτήτων ύδατος αντικαθίστανται και αυτά
ουσιαστικά στοιχειομετρικώς από υδροξώνια (ισορροπίες 8-10).
Το καθαρό αποτέλεσμα είναι ότι μετά την
αραίωση των καθαρών οξέων με ύδωρ, τα πανίσχυρα κατιοντικά οξέα (παραπάνω: Η3SO4+
και Η2ΝΟ3+)
ανεξαρτήτως των μεταξύ τους διαφορών οξύτητας, αντικαθίστανται από το ιόν
του υδροξωνίου και επομένως επέρχεται εξίσωση της οξύτητάς τους. Το
φαινόμενο αυτό είναι γνωστό ως εξισωτικό φαινόμενο (leveling effect)
και ο διαλύτης (ύδωρ) δρα ως εξισωτικό μέσον (leveling
medium). Επομένως:
|
Σε υδατικό διάλυμα δεν μπορεί να υπάρξει
ισχυρότερο οξύ από το υδροξώνιο (Η3Ο+)
|
Το εξισωτικό αποτέλεσμα προφανώς δεν αποτελεί "αποκλειστικότητα" του ύδατος. Παρουσιάζεται σε κάθε διαλύτη πιο όξινο ή
πιο βασικό από το ύδωρ, με ενδιαφέροντα φαινόμενα εξίσωσης των οξυτήτων. Παράδειγμα εξισωτικού φαινομένου σε μη
υδατικό διαλύτη:
Το υπερχλωρικό οξύ
(HClO4)
και το οξικό οξύ (CH3COOH)
είναι ένα τυπικό ζεύγος οξέων, από τα οποία στο
ύδωρ το πρώτο δρα ως ισχυρό οξύ (πλήρως διιστάμενο), ενώ το δεύτερο ως ασθενές
(μερικώς διιστάμενο). Ωστόσο, αν αυτά τα δύο οξέα διαλυθούν
σε ένα πιο βασικό διαλύτη από το ύδωρ (δηλ. με μόριο πιο "πρόθυμο" να προσλάβει πρωτόνια) όπως
είναι η πυριδίνη (C5H5N),
τότε στον διαλύτη αυτόν η ισχύς των δύο οξέων εξισώνεται, αφού και τα δύο
διίστανται πλήρως. Και τα δύο
αντικαθίστανται (ως οξέα), ουσιαστικά στοιχειομετρικώς, από ένα νέο οξύ, την πρωτονιωμένη πυριδίνη (κατιόν πυριδινίου) C5Η5ΝΗ+,
επομένως η πυριδίνη δρα ως εξισωτικό μέσο των δύο οξέων, ιδιότητα που δεν τη
διαθέτει το ύδωρ για τα δύο αυτά οξέα.
Η ακόλουθη πρόταση μπορεί να θεωρηθεί ως
συνέπεια του εξισωτικού φαινόμενου [Αναφ. 6]:
|
Σε διάλυμα, το ισχυρότερο οξύ και η ισχυρότερη βάση αντιδρούν με
σχηματισμό
ενός ασθενέστερου συζυγούς οξέος και μιας ασθενέστερης συζυγούς
βάσης
|
Παράδειγμα:
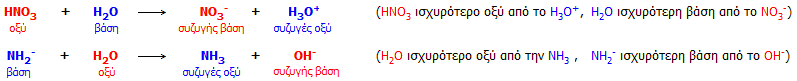
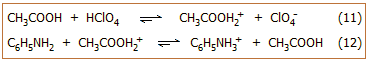
 Ογκομετρήσεις
σε μη υδατικούς διαλύτες. Στο εξισωτικό φαινόμενο βασίζονται οι
ογκομετρήσεις σε μη υδατικούς διαλύτες (non-aqueous
titrations). Mε τις ογκομετρήσεις αυτές καθίσταται εφικτός ο
ογκομετρικός προσδιορισμός ασθενέστατων οξέων ή βάσεων, που σε υδατικά
διαλύματα είναι αδύνατος (λόγω πλήρους απουσίας "τελικού σημείου").
Ογκομετρήσεις
σε μη υδατικούς διαλύτες. Στο εξισωτικό φαινόμενο βασίζονται οι
ογκομετρήσεις σε μη υδατικούς διαλύτες (non-aqueous
titrations). Mε τις ογκομετρήσεις αυτές καθίσταται εφικτός ο
ογκομετρικός προσδιορισμός ασθενέστατων οξέων ή βάσεων, που σε υδατικά
διαλύματα είναι αδύνατος (λόγω πλήρους απουσίας "τελικού σημείου").
'Ετσι, ασθενείς οργανικές βάσεις (διάφορες
φαρμακευτικές ουσίες, αλκαλοειδή κ.α.) ογκομετρούνται σαν να ήταν ισχυρές
βάσεις σε συστήματα, όπου ως διαλύτης χρησιμοποιείται το άνυδρο οξικό οξύ. Τυπικό παράδειγμα
αποτελεί η ογκομέτρηση της ανιλίνης (C6H5NH2,
ασθενής οργανική βάση) με πρότυπο διάλυμα HClO4
σε άνυδρο οξικό οξύ. Στο πρότυπο διάλυμα του οξέος, ως οξύ δρα η πρωτονιωμένη
μορφή του οξικού οξέος (ισορροπία 11), η
δε αντίδραση ογκομέτρησης είναι η αντίδραση 12.
Το τελικό σημείο εντοπίζεται πάλι με τη βοήθεια κατάλληλων δεικτών, δηλ.
οργανικών ενώσεων των οποίων η "πρωτονιωμένη" μορφή έχει διαφορετικό
χρώμα από τη "μη πρωτονιωμένη".
Η έννοια της "οξύτητας" στα πολύ πυκνά οξέα - Συνάρτηση
οξύτητας Hammett
Σύμφωνα με τον ορισμό της IUPAC, ως συνάρτηση οξύτητας
(acidity function) ορίζεται κάθε συνάρτηση που
παρέχει ένα μέτρο της θερμοδυναμικής ικανότητας διάθεσης
ή πρόσληψης πρωτονίου
(βλ. παρατήρησεις) του συστήματος διαλυτών, ή μιας
στενά συνδεδεμένης θερμοδυναμικής
ιδιότητας, όπως η τάση του αντίστοιχου εκ διαστάσεως ανιόντος (lyate
ion) να σχηματίσει ενώσεις προσθήκης (adducts)
κατά Lewis .
Οι συναρτήσεις οξύτητας δεν
εξαρτώνται αποκλειστικά από το σύστημα των διαλυτών, αλλά εξαρτώνται και
από τη διαλυόμενη ουσία (ή την οικογένεια των ουσιών) ως προς την οποία
μετρείται αυτή η θερμοδυναμική τάση [Αναφ.
7α].
Παρατηρήσεις:
(1) Ο όρος
πρωτόνιο (και τα
παράγωγά του: πρωτονίωση, διάθεση πρωτονίου, πρωτονιοδοτική ικανότητα)
αναφέρεται σε κάθε ισότοπο του υδρογόνου και όχι μόνο στο πρώτιο (1Η),
αλλά και στο δευτέριο (D ή 2Η) και στο τρίτιο (Τ ή
3Η). H IUPAC χρησιμοποιεί στον ορισμό τον όρο
hydron για να χαρακτηρίσει γενικά το κατιόν κάθε ισοτόπου του υδρογόνου.
Ωστόσο, ο όρος αυτός δεν εμφανίζεται συχνά στη βιβλιογραφία.
(2) Ο όρος
συνάρτηση οξύτητας "καλύπτει" και την περίπτωση πυκνών διαλυμάτων βάσεων ή
καθαρών βάσεων και έτσι δεν υπάρχει λόγος ύπαρξης συνάρτησης βασικότητας
(basicity function).
Οι συναρτήσεις οξύτητας αναφέρονται σε πυκνά διαλύματα οξέων, σε καθαρά οξέα ή και σε μίγματα οξέων.
Αποτελούν μέτρο της
τάσης διάθεσης πρωτονίου
των ουσιών αυτών ή της τάσης σχηματισμού
προϊόντων προσθήκης κατά Lewis του ανιόντος, που
απομένει μετά την απόσπαση του πρωτονίου. Θα πρέπει ευθύς εξαρχής να γίνει
σαφές ότι εδώ η έννοια της "οξύτητας" δεν έχει "ποσοτικό" χαρακτήρα, δηλαδή
δεν συνδέεται με το ποια είναι η συγκέντρωση του οξέος σε δεδομένο όγκο
ουσίας ή πόση ποσότητα βάσης απαιτείται για την εξουδετέρωση δεδομένης
ποσότητας των προηγουμένων. Απλά, χαρακτηρίζει την ικανότητα των μέσων αυτών να
πρωτονιώνουν άλλες ενώσεις. Προφανώς η ικανότητα αυτή σχετίζεται κυρίως με θέματα οργανικής σύνθεσης και ειδικότερα με θέματα
όξινης κατάλυσης.
Η ικανότητα διάθεσης πρωτονίων ενός πυκνού
διαλύματος οξέος θα μπορούσε έτσι να μετρηθεί (και πράγματι μετρείται σε πολλές
περιπτώσεις) με βάση κινητικά δεδομένα. Για
παράδειγμα, διαπιστώθηκε ότι η νίτρωση του βενζολίου (που υπόκειται σε όξινη
κατάλυση) πραγματοποιείται 3000
φορές ταχύτερα σε Η2SO4
90%, απ' όσο σε Η2SO4
80%. Αυτό σημαίνει ότι η τάση διάθεσης πρωτονίου διαλύματος Η2SO4
90% (κ.β.) είναι 3000 φορές μεγαλύτερη από εκείνη διαλύματος Η2SO4
80%.
Από το προηγούμενο παράδειγμα
διαπιστώνουμε και κάτι άλλο: Σχεδόν διπλασιασμός της αναλογίας μορίων ύδατος
προς τα μόρια του θειικού οξέος μειώνει κατά 3.000 φορές την "οξύτητα" του
συστήματος. Δηλαδή, μικρές ποσότητες ύδατος
επηρεάζουν δραματικά την ικανότητα διάθεσης πρωτονίου οξέων και ότι τα μόρια ύδατος σε συστήματα υψηλής οξύτητας
συμπεριφέρονται σαν "παγίδες πρωτονίων", δηλ. σαν "ισχυρή" βάση. 'Ετσι,
ισχυρά οξέα
διαφορετικής μεταξύ τους "οξύτητας", αν αραιωθούν σε νερό η
οξύτητά τους εξισώνεται, αφού όλα μετατρέπονται σε κατιόντα Η3Ο+,
όπως αναφέρθηκε προηγουμένως.
|

Louis Plack Hammett
(1894 - 1987). Διάσημος Αμερικανός Φυσικοχημικός και Οργανικός Χημικός. |
Προφανώς, οι μετρήσεις της "οξύτητας" με βάση κινητικά
δεδομένα δεν είναι κάτι το εύκολο, ούτε μπορούν να πραγματοποιηθούν σε κάθε περίπτωση. Το ερώτημα είναι πώς θα μπορούσαμε να μετρήσουμε κάπως πιο εύκολα "οξύτητες"
αυτού του είδους και αυτού του μεγέθους. Είναι προφανές ότι η μέτρηση του pH δεν έχει απολύτως κανένα νόημα, αφού
το pH αποδίδει την ενεργότητα της
ενυδατωμένης μορφή του πρωτονίου σε υδατικά διαλύματα (δηλαδή ενός
συγκεκριμένου και μόνο οξέος, του H3O+). Στα οξέα που
αναφερόμαστε μπορεί να υπάρχει ελάχιστο ύδωρ ή και καθόλου.
Συνάρτηση οξύτητας
Hammett. Μια απάντηση στο πρόβλημα του χαρακτηρισμού της
"οξύτητας" σε πυκνά ή καθαρά οξέα ή μίγματά τους έδωσε (κατά
τη δεκαετία του 1930) ο διάσημος οργανικός -
φυσικοχημικός χημικός Louis Plack Hammett. Η πρότασή του ήταν απλή: πρότεινε τη χρήση
δεικτών. Οι δείκτες αυτοί λειτουργούν με την ίδια γενική αρχή που
λειτουργούν και οι "κλασικοί" δείκτες, οι οποίοι χρησιμοποιούνται στις ογκομετρήσεις
οξέων - βάσεων. Η μόνη διαφορά είναι ότι πρόκειται για ουσίες που πρωτονιώνονται
πολύ δύσκολα (δηλ. είναι ασθενέστατες βάσεις) και φυσικά χημικώς
"ανθεκτικές" σε τόσο όξινα περιβάλλοντα. Μάλιστα πολλοί από
αυτούς, αν και χαρακτηρίζονται ως "βάσεις", δεν έχουν καμία οργανική ομάδα που θα
μπορούσε να χαρακτηρισθεί ως "βασική". Απλά
είναι οι συνθήκες ακραίας οξύτητας, στις οποίες χρησιμοποιούνται, που τις
κάνει να συμπεριφερθούν ως "βάσεις".
Τυπικά παραδείγματα δεικτών κατάλληλων για
μετρήσεις αυτού του είδους είναι διάφορες αρωματικές αμίνες, των οποίων εύκολα η ικανότητα πρωτονίωσής
τους (δηλ. η βασικότητά τους) μπορεί να "εξασθενίσει" ακόμη περισσότερο, με αντικατάσταση αρωματικών υδρογόνων με νιτροομάδες και αλογόνα
(βλ. πίνακα παρακάτω).
Η έννοια της συνάρτησης οξύτητας
μπορεί να χρησιμοποιηθεί αντίστοιχα στα διαλύματα ισχυρών βάσεων ή καθαρών βάσεων ή
μιγμάτων βάσεων, όπου εκεί αντίστοιχα αποτελεί μέτρο της θερμοδυναμικής
ικανότητας των συστημάτων αυτών να αποσπούν πρωτόνα από άλλες ενώσεις. Κατ' αναλογία,
στην περίπτωση αυτή οι δείκτες που θα χρησιμοποιηθούν θα πρέπει να είναι ουσίες που
μπορούν να δράσουν ως ασθενέστατα οξέα.
H πιο γνωστή συνάρτηση οξύτητας είναι η συνάρτηση οξύτητας Hammett (Hammett
acidity function,
Ho). Προτάθηκε από τον
Φυσικοχημικό - Οργανικό Χημικό Louis
Plack Hammett το 1932.
Η συνάρτηση οξύτητας Hammett χρησιμοποιείται
ευρύτατα στη
Φυσική
Οργανική Χημεία και ειδικά στις μελέτες αντιδράσεων που καταλύονται από
οξέα, αφού πολλές από τις αντιδράσεις αυτές απαιτούν πολύ υψηλές
συγκεντρώσεις οξέων, όπου η έννοια του pH δεν έχει πλέον νόημα. Στα μέσα που
πραγματοποιούνται οι αντιδράσεις αυτές "κυριαρχούν"
δότες πρωτονίων κατά πολλές τάξεις μεγέθους ισχυρότεροι από το υδροξώνιο.
Η
Ho
υπολογίζεται από την επόμενη εξίσωση, που θυμίζει την εξίσωση των Henderson-Hasselbalch,
η οποία όμως ισχύει σε αραιά υδατικά διαλύματα ασθενών οξέων και βάσεων:
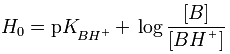
Στην παραπάνω εξίσωση, [Β] και [ΒΗ+]
είναι οι συγκεντρώσεις και όχι οι ενεργότητες της ελεύθερης και της
πρωτονιωμένης μορφής ενός δείκτη. Αρχικά ο Hammett χρησιμοποίησε ως δείκτη
την p-νιτροανιλίνη, η οποία είναι ασθενέστατη βάση και επομένως
πρωτονιώνεται δύσκολα. pKBH+
είναι ο αρνητικός λογάριθμος της σταθεράς διάστασης του συζυγούς οξέος του
δείκτη, επομένως ενός ισχυρού οξέος και ως εκ τούτου
έχει αρνητική τιμή. Οι τιμές Ηο
αποτελούν κατά κάποιο τρόπο την επέκταση των τιμών pH σε τιμές κάτω από το
0, χωρίς όμως να καλύπτονται από τον ορισμό του pH.
Οι μετρήσεις του λόγου [Β]/[ΒΗ+] πραγματοποιούνται
φασματοσκοπικά και κυρίως με φασματοσκοπία ορατού/υπεριώδους. Οι μετρήσεις
αυτές βασίζονται στα
διαφορετικά φασματικά χαρακτηριστικά των δύο μορφών του δείκτη. Επιπλέον, για τις ίδιες
μετρήσεις μπορεί να χρησιμοποιηθεί και η
φασματοσκοπία NMR. Αυτό σημαίνει ότι ο λόγος των δύο μορφών δεν μπορεί να μετρηθεί με
ικανοποιητική ακρίβεια πέραν από μια περιοχή 2 - 4 τάξεων μεγέθους, δηλ. από 10:1 έως 1:10 ή -στην
καλύτερη περίπτωση- από 100:1 έως 1:100, δηλ. 1 έως 2 (το πολύ) μονάδες Ho
πάνω και κάτω από την τιμή pKBH+.
Για
να καταστεί δυνατή η μέτρηση της Ho σε
μια ευρύτερη περιοχή τιμών, στο εμπόριο
διατίθενται σειρές ανάλογων
δεικτών, γνωστοί ως δείκτες Hammett. Οι δείκτες αυτοί είναι πλήρως
χαρακτηρισμένοι και οι τιμές pKΒΗ+
είναι επακριβώς γνωστές, έχοντας προσδιορισθεί με ειδικές μεθόδους
[Αναφ. 7β,γ].
Το μειονέκτημα της συνάρτησης οξύτητας Hammett
είναι ότι είναι μετρήσιμη μόνο σε υγρά "όξινα" μέσα και δεν μπορεί να
χρησιμοποιηθεί στην περίπτωση των στερεών σουπεροξέων, όπως είναι
διάφορα ζεολιθικά υλικά, πολυμερικές
ρητίνες με σουλφονικές ομάδες, ακινητοποιημένα σουπεροξέα και οξέα εγκλωβισμένα
σε γραφίτη (graphite intercalated superacids).
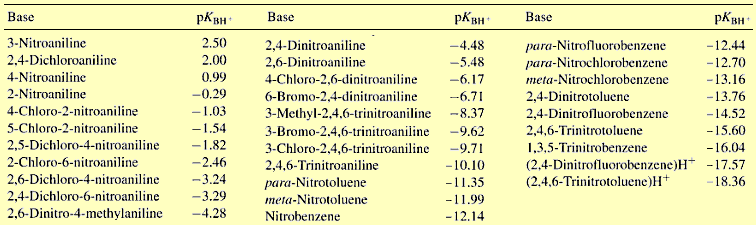
Τυπική σειρά δεικτών Hammett και οι αντίστοιχες
τιμές pKBH+ (από την [Αναφ
9ε])
Παρατήρηση: Σε αραιά υδατικά
διαλύματα είναι γνωστό ότι οι συντελεστές ενεργότητας των ιόντων είναι
κατά τι μικρότεροι από τη μονάδα και τείνουν προς τη μονάδα, όσο τα
διαλύματά τους αραιώνονται. Έτσι, οι συντελεστές ενεργότητας μειώνονται όσο αυξάνεται η ιοντική ισχύς
των διαλυμάτων και οι υπάρχουν οι σχετικές μαθηματικές σχέσεις οι κατάλληλες
κατά περιοχή ιοντικής ισχύος. Ωστόσο, σε πολύ πυκνά διαλύματα, εκεί όπου το ύδωρ
καθίσταται πλέον δευτερεύον συστατικό, τα πράγματα παίρνουν μια διαφορετική
τροπή. Οι τιμές των συντελεστών ενεργότητας, εκεί που μειώνονταν με την
πύκνωση του διαλύματος, αρχίζουν πάλι να αυξάνονται και μάλιστα εκτοξεύονται σε τιμές
πολύ μεγαλύτερες (έως και κατά τάξεις μεγέθους) από τη μονάδα. Το ίδιο
συμβαίνει και με την ενεργότητα των πρωτονίων στα πυκνά οξέα. Για παράδειγμα,
η τάση διάθεσης πρωτονίου του θειικού οξέος 100%
είναι κατά 10 δισεκατομμύρια φορές μεγαλύτερη από εκείνη υδατικού διαλύματος Η2SO4
10% και όχι απλώς 10 φορές μεγαλύτερη [Αναφ. 7ζ].
Το ίδιο ισχύει και για το υδροφθόριο. Είναι γνωστό ότι το HF σε υδατικά
διαλύματα είναι ασθενές οξύ, ωστόσο, όσο πυκνώνει το HF, τόσο η οξύτητά
του αυξάνεται και τελικά το άνυδρο HF καταλήγει να γίνει ένα ισχυρό οξύ και
η οξύτητα του οποίου εκτινάσσεται στα ύψη (αυξάνει κατά τάξεις μεγέθους) με
την προσθήκη σε αυτό οξέων κατά Lewis, όπως του BF3
και κυρίως του SbF5.
Συνάρτηση οξύτητας
Hammett στα σουπεροξέα. Η συνάρτηση οξύτητας Hammett, Ηο καθαρού
(100% ή 18,4 Μ) H2SO4
έχει τιμή -12,0. Αυτό δεν σημαίνει ότι το καθαρό οξύ έχει pH = -12, αλλά ότι έχει
τάση διάθεσης πρωτονίου αντίστοιχη με εκείνη διαλύματος ισχυρού οξέος με [Η+] = 1012
Μ. Προφανώς αυτή η συγκέντρωση υδρογονοκατιόντων δεν είναι δυνατόν να
υπάρξει σε υδατικό διάλυμα.
Ενδεικτικές τιμές
Ho καθαρών οξέων είναι:
Η2SO4:
-12,0, HClO4: -13,0, CF3SO3H
(τριφλικό οξύ): -14,1, H2S2O7
(πυροθειικό οξύ): -15, HSO3F:
-15,1, HSO3F .
SbF5
(μαγικό οξύ): -19,2, HSbF6:
-31,3
Θα πρέπει να σημειωθεί ότι στη βιβλιογραφία
εμφανίζονται και άλλες (παραπλήσιες) τιμές για τα ίδια οξέα, γεγονός
ενδεικτικό της δυσκολίας προσδιορισμού τους που οφείλεται εν μέρει στο ότι
ίχνη ύδατος μειώνουν δραστικά την οξύτητά τους (αυξάνουν αλγεβρικά την τιμή Ηο).
Με βάση τη συνάρτηση oξύτητας Hammett, ως
σουπεροξύ χαρακτηρίζεται κάθε μέσο με τιμές
Ηο μικρότερες από -12. 'Αλλα
γνωστά σουπεροξέα (με τιμες Ho<-15) είναι τα: HBF4,
HPF6,
HAsF6,
HB(C6F5)4.
Στο θέμα του "ισχυρότερου απομονώσιμου οξέος" έχουν αναφερθεί ο Christofer A. Reed
και οι συνεργάτες του.
Στο άρθρο του αναφέρεται και μια σχετικώς νέα τάξη σουπεροξέων, ένα είδος
οργανοβορικών ενώσεων, συλλογικά γνωστών ως καρβοράνια (carboranes),
τα οποία είναι στερεά και έτσι η "οξύτητά" τους δεν μπορεί να εκφρασθεί στην
κλίμακα τιμών
Ho [Αναφ. 8].
|

George
Andrew Olah (1927- ). Διάσημος αμερικανός (ουγγρικής
καταγωγής) φυσικοχημικός - οργανικός χημικός. Το 1994, τιμήθηκε
με το Νόμπελ Χημείας για την πρωτοποριακή του έρευνα στα καρβοκατιόντα. Διάσημος και για τις εργασίες του στα ηλεκτρικά
στοιχεία καυσίμων (methanol cells).
|
Η ανακάλυψη του μαγικού οξέος
To μαγικό οξύ (ορθότερα: η εκπληκτική πρωτονιοδοτική
ικανότητά του) ανακαλύφθηκε τυχαία, κατά τη διάρκεια ενός χριστουγεννιάτικου
πάρτι της ερευνητικής ομάδας του Καθηγητή George Andrew Olah, στο
Case
Western Reserve University, του Cleveland
της πολιτείας Ohio, κατά τη
δεκαετία του 1960. Ο Joe Lukas, ερευνητικός συνεργάτης του
Olah, έριξε
υπολείμματα από ένα διακοσμητικό χριστουγεννιάτικo κερί (δηλ. σχεδόν
καθαρή παραφίνη) σε ένα δοχείο που
περιείχε μίγμα SbF5
- HSO3F.
Προς έκπληξή του, είδε τα υπολείμματα αυτά να διαλύονται. Η έκπληξη έγινε ακόμη μεγαλύτερη
όταν, στο διάλυμα που προέκυψε, με φασματοσκοπία NMR διαπιστώθηκε η σταθερή παρουσία του κατιόντος (CH3)3C+,
το οποίο κανονικά θα έπρεπε να διασπαστεί σχεδόν αμέσως παρέχοντας πρωτόνιο
και ένα αλκένιο (βλ. αντίδραση παρακάτω).
Εντυπωσιασμένος, ο Lukas
ονόμασε αυτό το μίγμα μαγικό οξύ (magic acid). Η ονομασία αυτή αναφέρθηκε σε
μια από τις επόμενες
δημοσιεύσεις, καθιερώθηκε στην επιστημονική βιβλιογραφία και επιπλέον
κατοχυρώθηκε εμπορικά για το συγκεκριμένο αντιδραστήριο.
O Καθηγητής Olah (ουγγρικής καταγωγής) και οι συνεργάτες
τους αντιλήφθηκαν ότι είχαν στη διάθεσή
τους ένα μέσον με εκπληκτική τάση διάθεσης πρωτονίων, ικανό να πρωτονιώσει ακόμη και
τα αλκάνια, ενώσεις απλές και σταθερές, που δεν έχουν κανένα λόγο να
πρωτονιωθούν. Στη συνέχεια, ο Olah χρησιμοποίησε αυτό το σουπεροξύ στην πρωτοποριακή έρευνά του πάνω στα
καρβοκατιόντα που διεξήγαγε από χρόνια. Το 1994, ο Olah τιμήθηκε (μοναδικός αποδέκτης)
με το Βραβείο Nobel Χημείας του 1994 για "τη συνεισφορά του
στη Χημεία των Καρβοκατιόντων".
Ανάλογα αποτελέσματα προέκυψαν και με άλλα σουπεροξέα - συζεύγματα (conjugates) οξέων κατά
κατά
Brønsted (HF, CF3SO3H,
HSO3F)
με οξέα κατά Lewis (PF5, AsF5,
SbF5,
TaF5,
NbF5)
σε κάθε συνδυασμό. Ακόμη και τριαδικά μίγματα έχουν χρησιμοποιηθεί ως
σουπεροξέα, π.χ. μίγμα HSO3F
- SbF5
- SO3
έχει ακόμη πιο "όξινες" ιδιότητες σε σχέση με το δυαδικό μίγμα του μαγικού
οξέος [Aναφ. 9].
Παρασκευή και χημικές ιδιότητες των
συστατικών του μαγικού οξέος
 Το μαγικό οξύ τυπικά είναι ισομοριακό μίγμα
πενταφθοριούχου αντιμονίου (SbF5)
και φθοροσουλφονικού οξέος (HSO3F).
Και οι δύο ουσίες είναι εξαιρετικά επικίνδυνα υγρά που απαιτούν ιδιαίτερη
προσοχή και πείρα στον χειρισμό τους, όπως και ειδικό εργαστηριακό εξοπλισμό. Αντιδρούν
βίαια με το νερό εκλύοντας υδροφθόριο.
Το μαγικό οξύ τυπικά είναι ισομοριακό μίγμα
πενταφθοριούχου αντιμονίου (SbF5)
και φθοροσουλφονικού οξέος (HSO3F).
Και οι δύο ουσίες είναι εξαιρετικά επικίνδυνα υγρά που απαιτούν ιδιαίτερη
προσοχή και πείρα στον χειρισμό τους, όπως και ειδικό εργαστηριακό εξοπλισμό. Αντιδρούν
βίαια με το νερό εκλύοντας υδροφθόριο.
Οι κίνδυνοι από το εκλυόμενο υδροφθόριο και οι
ιδιαίτερες προφυλάξεις, που πρέπει να λαμβάνουν όσοι εργάζονται με
την ουσία αυτή ή με ουσίες που μπορούν να παράγουν HF, έχουν περιγραφεί αλλού [βλ. Χημική ένωση του μήνα:
Τριφθοριούχο χλώριο].
Πενταφθοριούχο
αντιμόνιο. Το πενταφθοριούχο αντιμόνιο
είναι ένα άχρωμο, ελαιώδες υγρό (σ.ζ. 149,5ºC)
με σχετικά μεγάλο ειδικό βάρος (d = 2,99 g/mL). Αντιδρά βίαια με το νερό. Κάθε
σταγόνα του πέφτοντας στο νερό προκαλεί μια μικρή έκρηξη.
Παρασκευάζεται με σχετικά απλές
αντιδράσεις, όπως με αντίδραση πενταχλωριούχου αντιμονίου με
άνυδρο υδροφθόριο (αντίδραση 13), με αντίδραση φθορίου με
τριφθοριούχο αντιμόνιο (αντίδραση
14) ή με αντίδραση πεντοξειδίου του αντιμονίου
με πυκνό διάλυμα υδροφθορίου
(αντίδραση 15).
Το μόριο SbF5
έχει σχήμα τριγωνικής διπυραμίδας, δρα ως ισχυρό οξύ Lewis, έχοντας και μια
ιδιαίτερη συγγένεια προς κάθε σωματίδιο - πηγή ιόντων φθορίου, από το οποίο
"επιζητεί" την απόσπαση ανιόντος φθορίου για να σταθεροποιηθεί ως οκταεδρικό
ανιόν [SbF6]-.
'Ετσι, ενισχύει την οξειδωτική ισχύ του F2,
σε σημείο που το καθιστά ικανό να οξειδώσει το μοριακό οξυγόνο (Ο2)
(αντίδραση
16).
'Οπως προαναφέρθηκε το άνυδρο HF είναι ήδη ένα
ισχυρό οξύ. Διίσταται σύμφωνα με την ισορροπία 17,
όπου ο σχηματισμός το κατιοντικού οξέος Η2F+
ευνοείται λόγω των δεσμών υδρογόνου μεταξύ Η και F (λόγος μη υφιστάμενος
στην περίπτωση των καθαρών υγρών HCl, HBr και ΗΙ). Το SbF5
όταν διαλυθεί σε άνυδρο HF ενισχύει εξαιρετικά την κατά
Brønsted οξύτητά του (ισορροπία
18), αφού το
αποσπασμένο ιόν φθορίου "βολεύεται" στη μορφή του ανιόντος
[SbF6]-
και δεν έχει την παραμικρή "διάθεση" επανασύνδεσης με το Η.
Την ίδια αύξηση οξύτητας προκαλεί η διάλυση του
SbF5 διαλυόμενο σε φθοροσουλφονικό οξύ και στο τριφλικό οξύ
[Αναφ. 10α].
Το ανιόν
[SbF6]-
μπορεί να αντιδράσει με επιπλέον ποσότητες SbF5
και να δώσει τα διμερή και τριμερή ιοντικά συμπλέγματα [Sb2F11]-
και
[Sb3F16]-.
Φθοροσουλφονικό (ή
φθοροθειικό) οξύ. Το φθοροσουλφονικό οξύ
είναι ένα σχετικά λεπτόρρευστο, άχρωμο υγρό (σ.ζ. 165,5ºC)
με αρκετά μεγάλο ειδικό βάρος (d = 1,84 g/mL). Είναι διαλυτό σε πολικούς οργανικούς
διαλύτες (νιτροβενζόλιο, οξικό οξύ και οξικό αιθυλεστέρα), όχι όμως σε μη
πολικούς διαλύτες όπως τα αλκάνια. Παρασκευάζεται με αντίδραση άνυδρου HF με SO3
(θειικό ανυδρίτη) (αντίδραση 19) ή με
αντίδραση φθοριούχων αλάτων (KHF2,
CaF2)
με oleum (διάλυμα SO3
σε Η2SO4)
στους 250ºC
(π.χ. αντίδραση 20). Το συμπαραγόμενο ΗF
απομακρύνεται με τη διαβίβαση μέσω του υγρού προϊόντος της αντίδρασης
καθαρού αέρα και στη συνέχεια το
HSO3F
μπορεί πλέον να αποσταχθεί σε υάλινες συσκευές απόσταξης για να ληφθεί στην
καθαρότερη δυνατή κατάσταση.
Το φθοροσουλφονικό οξύ
διαλύεται στο νερό με έκλυση
μεγάλων ποσοτήτων θερμότητας και υδρολύεται σταδιακά προς HF και Η2SO4.
Λόγω του παραγόμενου HF κατά την υδρόλυσή του, το
HSO3F
δεν ενδείκνυται να διακινείται σε υάλινες φιάλες και ο χειρισμός του απαιτεί
ιδιαίτερη προσοχή. Πρόκειται για μια ουσία που καλό είναι να αποφεύγεται η
χρήση της εφόσον μπορεί να αντικατασταθεί από κάποιο άλλο ασφαλέστερο
αντιδραστήριο.
Το HSO3F
είναι ένα σουπεροξύ, αλλά στις εφαρμογές που απαιτείται ένα σουπεροξύ είναι
προτιμότερη η χρήση του
τριφλικού οξέος (τριφθορομεθανοσουλφονικό οξύ, CF3SO3H).
Το τριφλικό οξύ, όπως και άλλα σουλφονικά οξέα υπερφθοριωμένων αλκανίων,
CnF2n+1SO3H,
είναι επίσης ένα υγρό σουπεροξύ, το οποίο έχει το πλεονέκτημα ότι δεν υπόκειται σε
"επικίνδυνες" υδρολύσεις όπως το φθοροσουλφονικό οξύ.
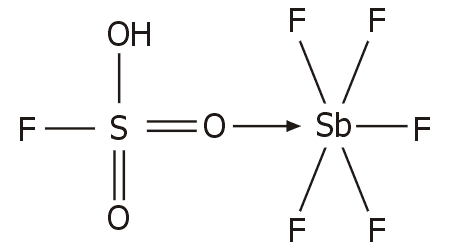
Μαγικό οξύ. Η
ισχυρή δράση του SbF5 ως οξύ κατά Lewis, έχει ως αποτέλεσμα, να ενισχύει
κατά πολύ την οξύτητα του φθοροσουλφονικού οξέος, προσελκύοντας το ζεύγος
ηλεκτρονίων ενός από τα οξυγόνα του σύμφωνα με το ακόλουθο σχήμα ισορροπιών
[Αναφ. 10β]:
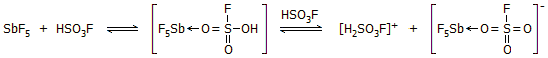
 |
 |
|
Αριστερά: Το μαγικό οξύ
και τα επιμέρους συστατικά του σε πλαστικούς περιέκτες. Δεξιά:
"Πολυκαιρισμένη" εμπορική συσκευασία ενός άλλου σουπεροξέος (του HPF6).
Είναι χαρακτηριστική η αλλοίωση της πλαστικής φιάλης του
αντιδραστηρίου από την μακρόχρονη επαφή με το σουπεροξύ, όπως και η
διάβρωση του μεταλλικού κανίστρου -περιβλήματος της φιάλης. Το
Teflon είναι μέχρι στιγμής το καταλληλότερο υλικό για αποθήκευση των
σουπεροξέων. |
 Σταθεροποίηση των καρβοκατιόντων
Σταθεροποίηση των καρβοκατιόντων
Ο Olah εξαρχής
γνώριζε ότι ο αποτελεσματικότερος τρόπος για να παρασκευάσει σταθεροποιημένα καρβοκατιόντα, ήταν η χρήση αντισταθμιστικού ιόντος (ανιόντος) τελείως
ανενεργού. Δηλαδή ένα ανιόν που δεν θα είχε διάθεση επαναπρόσληψης του
πρωτονίου. Τα φθοροσουλφονικά ανιόντα ήταν τα πιο κατάλληλα για τον σκοπό
αυτό και ήταν ένα από τα λίγα γνωστά σουπεροξέα στις αρχές της δεκαετίας του 1950.
Ο Olah, με τα πενιχρά μέσα που
μπορούσε να εξασφαλίσει στη μεταπολεμική
Ουγγαρία, παρασκεύαζε το αέριο υδροφθόριο που χρειαζόταν για τη σύνθεση του
φθοροσουλφονικού οξέος. Το υδροφθόριο σε υδατικό διάλυμα, αλλά κυρίως σε
αέρια ή υγροποιημένη μορφή, δεν είναι μια χημική ουσία που θα ήθελαν πολλοί
χημικοί να ασχοληθούν. Η όλη διαδικασία ήταν εξαιρετικά επικίνδυνη, γεγονός
που αποδεικνύει τον μεγάλο επιστημονικό ζήλο και αυταπάρνησή του
[Αναφ. 11]. Αργότερα, το σύζευγμα φθοροσουλφονικού οξέος -
πενταφθοριούχου αντιμονίου, το μαγικό οξύ, αποδείχθηκε κατά πολύ ανώτερο για
τον ίδιο σκοπό.
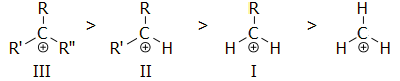
Σειρά σταθερότητας
καρβοκατιόντων.
Ολιγομερισμός μεθανίου. Τυπική σειρά αντιδράσεων πρωτονίωσης του μεθανίου και
σχηματισμού του tert-βουτυλικού κατιόντος είναι η
ακόλουθη:
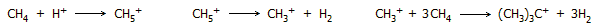
Απουσία ενός ισχυρού σουπεροξέος, όπως το
μαγικό οξύ, το tert-βουτυλικό κατιόν αποπρωτονιώνεται
αυθόρμητα σύμφωνα με την αντίδραση:
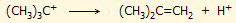
Ο Olah σε δημοσίευσή
του ανέφερε ότι μπόρεσε να προκαλέσει ολιγομερισμό του μεθανίου παρουσία μαγικού
οξέος [Αναφ. 10α]. Αυτός ο ολιγομερισμός
γίνεται ακόμη ευκολότερος αν αντί μεθανίου χρησιμοποιηθεί αιθάνιο,
ευκολότερος με προπάνιο κ.ο.κ. Η αλληλουχία των αντιδράσεων ολιγομερισμού
είναι η ακόλουθη:
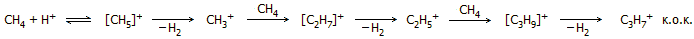
Κάθε αλκάνιο που θα αντιδράσει μέσα στο μαγικό
οξύ, καθίσταται εξαιρετικά δραστικό χημικό σωματίδιο. Καθίσταται ένα
πανίσχυρο οξύ κατά Lewis που αναζητά από κάθε υλικό ένα ζεύγος ηλεκτρονίων
για να συζευχθεί, ακόμη και από ένα άλλο αλκάνιο. Οι συνθετικές δυνατότητες
που παρέχονται από τα καρβοκατιόντα και ιδιαίτερα στη βιομηχανία των
πετροχημικών, είναι απεριόριστες.
|
Απίστευτες πρωτονιώσεις!
Ο George Andrew Olah,
στο
βιβλίο του με τίτλο
"A Life of
Magic Chemistry" [Αναφ. 9στ]
αναφέρει πλήθος αντιδράσεων πρωτονιώσεων από το μαγικό οξύ και από το
φθοροαντιμονικό οξύ (HSbF6).
Ουσιαστικά πρωτονιώνουν κάθε οργανική ένωση, αναγκάζοντάς την να
συμπεριφερθεί ως βάση. Ωστόσο, από τις εντυπωσιακότερες πρωτονιώσεις είναι εκείνες του μοριακού υδρογόνου και του ευγενούς αερίου
ξένου, σύμφωνα με τις απλές, αλλά παράδοξες σε πρώτη ματιά, ισορροπίες:

|
 Το μαγικό μεθύλιο
Το μαγικό μεθύλιο
Τα σουπεροξέα έχουν μια εξαιρετικά έντονη
τάση να διαθέσουν ένα πρωτόνιο. Με αντικατάσταση του πρωτονίου του
φθοροσουλφονικού οξέος με αλκύλιο προκύπτει ένα εξαιρετικά δραστικό
αλκυλιωτικό μέσο, το φθοροσουλφονικό μεθύλιο, το οποίο είναι γνωστό
ως μαγικό μεθύλιο (magic
methyl, FSO3CH3).
Πρόκειται για ένα σχετικά πτητικό υγρό (σ.ζ. 93ºC),
το οποίο είναι εξαιρετικά τοξικό ακριβώς λόγω της τάσης του να μεθυλιώσει τα
πάντα. Στον άνθρωπο οι ατμοί του προκαλούν πνευμονικό οίδημα, προφανώς λόγω μεθυλίωσης των
λιπιδίων της μεμβράνης των κυττάρων των πνευμόνων, ενώ η δυνατότητά του να μεθυλιώσει ακόμη
και το DNA το καθιστά επικίνδυνο μεταλλαξιγόνο
[Αναφ. 11α, 12]. Πρόκειται για μια ουσία
που κανένας χημικός δεν θα ήθελε κάποτε να βρεθεί στην ανάγκη να χρησιμοποιήσει.
Βιβλιογραφία - Πηγές από το
Διαδίκτυο
1.
(α) Wikipedia: "Antimony
pentafluoride". (β) Inchem.com: "Antimony
pentafluoride". (γ)
Wikipedia: "Fluorosulfuric
acid". (δ) Inchem.com: "Fluorosulfonic
acid".
2. International Union for Pure
and Applied Chemistry (IUPAC Gold Book): "Superacid"
(IUPAC Recommendations 1994, p.1169). (β)
Hall NF,
Conant JB:
"A Study of Superacid Solutions. I. The Use of the Chloranil
Electrode in Glacial Acetic Acid and the Strength of Certain Weak Bases", Journal of the American
Chemical Society 49:3062-3070,
1927 (Abstract).
3. Sigma-Aldrich: "175080
Aldrich: Magic Acid 100%".
4.
NuclearFiles.org: "James
Bryant Conant".
5. Greenwood NN, Earnshaw A: "Chemistry of the
Elements", Pergamon Press, 1st ed. 1984, σελ. 843.
6. (α) Wikipedia: "Leveling
effect (chemistry)". (β) Chimie General On-Line
(Univ. of Lausanne): "Solvent
leveling effect and pKa
scale".
7. (α) International Union for Pure
and Applied Chemistry (IUPAC Gold Book): "Acidity
function". (β) Yates K, Shapiro:
"A Critical Test of the Hammett Acidity Function", Canadian Journal of
Chemistry 50:581-583, 1971 (αρχείο
PDF, 154 KB) . (γ) Sigma-Aldrich: "Hammett indicators set" (αρχείο
PDF, 21 KB). (δ) Wikipedia: "Hammett
acidity function". (ε) Hammett LP, Deyrup
AJ: "A series of simple basic indicators: I. The acidity
functions of mixtures of sulfuric and perchloric acids with
water",
J. Am. Chem. Soc.
54(7):2721-2739, 1932.
(στ) Reagan MT: "Acidity function for carbon bases
in aqueous sulfuric and perchloric acids",
J. Am. Chem. Soc. 91(20):5506-5510,
1969 (Abstract).
(ζ) Westheimer FH: "Louis Plack Hammett
(1894 - 1987)", National Academy of Sciences, 1997 (αρχείο
PDF, 50 ΚΒ). (η) Wikipedia: "Superacid".
8. Juhasz M, Hoffmann S, Stoyanov
E, Kim K-C, Reed CA: "The Strongest
Isolable Acid", Angew. Chem. Int. Ed.
43:5352-5355, 2004 (αρχείο
PDF, 286 KB)
9. (α)
Olah A G: "My search for carbocations and their role in chemistry",
Nobel lecture, 1994 (αρχείο
PDF, 2,25 MB). (β) Wikipedia: "Magic
acid". (γ) Wikipedia: "George
Andrew Olah".
(δ) Jacoby M: "A
LOVE AFFAIR WITH CHEMISTRY:
Nobel Laureate George A. Olah has spent nearly six
decades in the service of chemistry",
Chemical & Engineering News, 83(11):37-40, 2005.
(ε)
Olah GA, Surya Prakash GK,
Molnar A, Sommer J: "Superacid Chemistry" (2nd Ed.), John Wiley, 2009 (Google
e-book). (στ) Olah GA: "A Life of Magic
Chemistry", Wiley InterScience, 2001 (google
e-books).
10.
(α) Herlem M: "Are reactions in superacid media due to protons or to
powerful oxidising species such as SO3
or SbF5?", Pure & Applied Chemistry 49:107-113,
1977 (αρχείο
PDF, 307 KB). (β)
Greenwood NN, Earnshaw A: "Chemistry of the
Elements", Pergamon Press, 1st ed. 1984, σελ. 664.
11. (α)
Stiles D:
"Column:
Bench Monkey",
Chemistry World (RSC), 2007. (β)
Olah
GA,
Schlosberg RH (1968). "Chemistry in Super Acids. I. Hydrogen Exchange
and Polycondensation of Methane and Alkanes in FSO3H
- SbF5
("Magic Acid") Solution. Protonation of Alkanes and the Intermediacy of
CH5+ and Related Hydrocarbon Ions. The High
Chemical Reactivity of "Paraffins" in Ionic Solution Reactions",
Journal of the American Chemical Society 90,
2726-2727, 1968.
12. (α)
Wikipedia: "Methyl
fluorosulfonate".
(β) Hite
M, Rinehart W, Braun W, Peck H: "Acute
toxicity of methyl fluorosulfonate (Magic Methyl)",
Am Ind Hyg Assoc
J., 40(7):600-603,
1979 (PubMed).

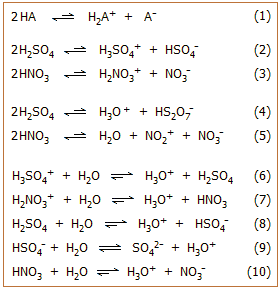 Είναι γνωστό ότι στα ασθενή οξέα, η ισχύς τους
σε υδατικά διαλύματα εκφράζεται ως η σταθερά διάστασής τους Ka
(ως έχει ή υπό τη πιο εύχρηστη μορφή του αρνητικού λογαρίθμου τους pKa
= -log
Ka).
Μέτρο της οξύτητας υδατικών διαλυμάτων των ίδιων ή αραιών διαλυμάτων
ισχυρών οξέων είναι το pH, το οποίο μετρείται εύκολα με τα σύγχρονα
πεχάμετρα μετά από βαθμονόμησή τους με ρυθμιστικά
διαλύματα γνωστού pH.
Είναι γνωστό ότι στα ασθενή οξέα, η ισχύς τους
σε υδατικά διαλύματα εκφράζεται ως η σταθερά διάστασής τους Ka
(ως έχει ή υπό τη πιο εύχρηστη μορφή του αρνητικού λογαρίθμου τους pKa
= -log
Ka).
Μέτρο της οξύτητας υδατικών διαλυμάτων των ίδιων ή αραιών διαλυμάτων
ισχυρών οξέων είναι το pH, το οποίο μετρείται εύκολα με τα σύγχρονα
πεχάμετρα μετά από βαθμονόμησή τους με ρυθμιστικά
διαλύματα γνωστού pH.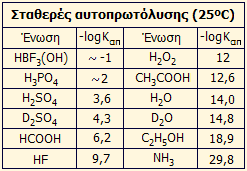
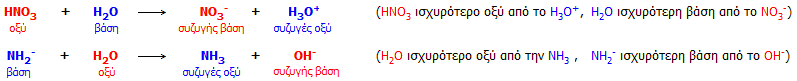
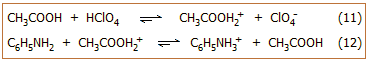
 Ογκομετρήσεις
σε μη υδατικούς διαλύτες. Στο εξισωτικό φαινόμενο βασίζονται οι
ογκομετρήσεις σε μη υδατικούς διαλύτες (
Ογκομετρήσεις
σε μη υδατικούς διαλύτες. Στο εξισωτικό φαινόμενο βασίζονται οι
ογκομετρήσεις σε μη υδατικούς διαλύτες (
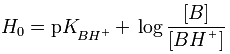


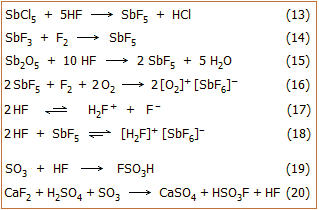 Το μαγικό οξύ τυπικά είναι ισομοριακό μίγμα
πενταφθοριούχου αντιμονίου (SbF5)
και φθοροσουλφονικού οξέος (HSO3F).
Και οι δύο ουσίες είναι εξαιρετικά επικίνδυνα υγρά που απαιτούν ιδιαίτερη
προσοχή και πείρα στον χειρισμό τους, όπως και ειδικό εργαστηριακό εξοπλισμό. Αντιδρούν
βίαια με το νερό εκλύοντας υδροφθόριο.
Το μαγικό οξύ τυπικά είναι ισομοριακό μίγμα
πενταφθοριούχου αντιμονίου (SbF5)
και φθοροσουλφονικού οξέος (HSO3F).
Και οι δύο ουσίες είναι εξαιρετικά επικίνδυνα υγρά που απαιτούν ιδιαίτερη
προσοχή και πείρα στον χειρισμό τους, όπως και ειδικό εργαστηριακό εξοπλισμό. Αντιδρούν
βίαια με το νερό εκλύοντας υδροφθόριο. 
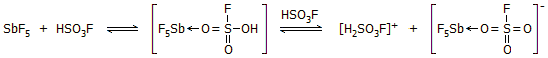


 Σταθεροποίηση των καρβοκατιόντων
Σταθεροποίηση των καρβοκατιόντων 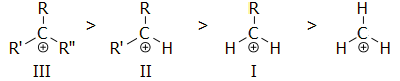
 Το μαγικό μεθύλιο
Το μαγικό μεθύλιο