Τα ορυκτά καύσιμα (πετρέλαιο, φυσικό αέριο,
γαιάνθρακες), τα οποία δημιουργήθηκαν από το φυτικό βασίλειο στη διάρκεια εκατομμύρια ετών,
σύντομα θα εξαντληθούν. H "οικονομία της μεθανόλης"
προβλέπει ένα περιβαλλοντικά φιλικό τρόπο αντικατάστασής τους.
|

Robert
Boyle (1627-1691). Διάσημος Ιρλανδός φυσιοδίφης. Ο πρώτος
που απομόνωσε τη μεθανόλη, αποστάζοντας το ξύλο ενός θαμνώδους
φυτού το
1661. |
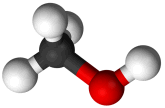
Γενικά για τη μεθανόλη
Η μεθανόλη
(methanol) είναι γνωστή και ως μεθυλική αλκοόλη (methyl
alcohol) και σπανιότερα ως καρβινόλη (carbinol)
είναι η απλούστερη αλειφατική αλκοόλη.
Απομονώθηκε για πρώτη φορά από το προϊόν της ξηράς απόσταξης ξύλου και για
τον λόγο αυτό είναι επίσης γνωστή ως
ξυλόπνευμα (wood spirit, wood naphtha).
Οι αρχαίοι Αιγύπτιοι
χρησιμοποιούσαν το απόσταγμα αυτό κατά τη διαδικασία ταρίχευσης των νεκρών
τους. Η
μεθανόλη είναι ένα εύφλεκτο, πτητικό υγρό σε θερμοκρασία δωματίου, με ελαφρά οινοπνευματώδη,
όχι δυσάρεστη οσμή, ωστόσο η εισπνοή των ατμών της πρέπει να αποφεύγεται λόγω της τοξικότητάς της (πολύ μεγαλύτερη από εκείνη της αιθανόλης)
[Αναφ. 1].
Καθαρή
μεθανόλη απομονώθηκε για πρώτη φορά από τον Robert Boyle το
1661, όταν απέσταξε το ξύλο ενός θαμνώδους φυτού και την ονόμασε "πνεύμα του
πύξου" (spirit of box) (box,
boxwood: πύξος ή πυξάρι, διακοσμητικό θαμνώδες
φυτό). Στη συνέχεια ονομάστηκε πυροξυλικό πνεύμα (pyroxylic
spirit).
Η στοιχειακή σύνθεση
της μεθανόλης προσδιορίστηκε το 1834 από τους Γάλλους χημικούς
Jean-Baptiste Dumas και Eugene
Peligot. Οι ίδιοι εισήγαγαν τη χημική ονομασία μεθυλένιο (methylene),
από την αρχαία Ελληνική λέξη "μέθυ" (μέθυ -υος: κάθε μεθυστικό
ποτό, κρασί, μπίρα: "ου πίνοντας εκ κριθών μέθυ", Αισχύλος) και "ύλη" (: κομμάτια ξύλου, π.χ. "υλοτομία"), δηλ. η μεθυστική ουσία που προέρχεται από το ξύλο. Λίγο
αργότερα, το 1840, εισήγαγαν την ονομασία μεθύλιο (methyl) και
ονόμασαν την αλκοόλη "μεθυλική αλκοόλη".
|
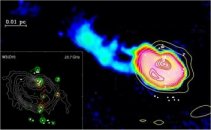
Στο γαλαξία μας
εντοπίστηκε νέφος μεθανόλης, που περιβάλλει περιοχή δημιουργίας
νέων άστρων [Αναφ. 1ε]. |
Σήμερα, η μεθανόλη είναι ένα
από τα κύρια προϊόντα της χημικής βιομηχανίας.
Χρησιμοποιείται ως καύσιμο, αντιπηκτικό, ως διαλύτης
χημικών ουσιών αλλά και ως πρώτη ύλη για τη σύνθεση πλήθους άλλων χημικών
ουσιών. Λόγω της τοξικότητάς της, η μεθανόλη
χρησιμοποιείται σε μεγάλες ποσότητες για τη μετουσίωση της αιθανόλης. 'Ετσι,
προστίθεται στην αιθανόλη (τυπικά σε αναλογία 5%), ώστε να την καταστήσει ακατάλληλη για
την παρασκευή αλκοολούχων ποτών, χωρίς ωστόσο να αλλοιώσει τις ιδιότητές της για άλλες
βιομηχανικές χρήσεις. Μεγάλες ποσότητες μεθανόλης χρησιμοποιούνται
ως καύσιμο, όπως επίσης και στην παραγωγή βιοντίζελ.
Η μεθανόλη συναντάται σε
ίχνη στην ατμόσφαιρα, ως προϊόν του αναερόβιου μεταβολισμού οργανικών ουσιών
από μεγάλη
ποικιλία βακτηρίων, αλλά υπό την επίδραση του
οξυγόνου του αέρα και του φωτός η μεθανόλη οξειδώνεται σε διοξείδιο του άνθρακα και νερό.
Αξίζει να σημειωθεί ότι η μεθανόλη είναι μια από τις 130 περίπου οργανικές
ενώσεις που έχουν εντοπιστεί στο διάστημα. Πρόσφατα, σε μια περιοχή του
γαλαξία μας εντοπίστηκε νέφος μεθανόλης από μικροκυματική ακτινοβολία που
αντιστοιχεί στο μόριό της (MASER
μεθανόλης). Το νέφος φτάνει τα 463
δισεκατομμύρια χιλιόμετρα σε μήκος (περίπου 3.100 φορές η απόσταση Γης -
Ήλιου) και περιβάλλει μια περιοχή όπου γεννούνται νέα άστρα (stellar
nursery).
 |
 |
|
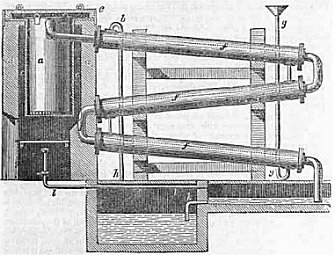
Αριστερά: Μονάδα
ξηράς απόσταξης ξύλου. Δεξιά: Μονάδα τριπλής απόσταξης για τον
καθαρισμό μεθανόλης που παρασκευαζόταν με ξηρά απόσταξη ξύλου
(αρχές 20ου αιώνα) [Αναφ. 2α, β]. |
Παραγωγή μεθανόλης
Η παλαιά μέθοδος παραγωγής μεθανόλης
βασιζόταν στην ξηρά απόσταξη ξύλων. Μεγάλες ποσότητες ξύλων στοιβάζονταν σε
σιδερένιους αποστακτήρες (retorts) και
θερμαίνονταν στους 205-260ºC, με καύση
ξύλων, όπως και των ίδιων των αερίων που δημιουργούνταν κατά τη θερμική
διάσπασή τους. Το απόσταγμα συλλεγόταν σε δεξαμενές, όπου η πίσσα
αφηνόταν να κατακαθίσει.
Tο υπερκείμενο υγρό
ήταν ένα σκούρο καφεκόκκινο υγρό, με τη χαρακτηριστική καυστική οσμή καμένου
ξύλου, γνωστό ως
πυροξυλικό οξύ (pyroligneous acid).
'Ηταν ένα
μίγμα οξικού οξέος, μεθανόλης (4%), ακετόνης, αλλυλικής αλκοόλης και άλλων
πτητικών οργανικών ουσιών. Το απόσταγμα αυτό επεξεργαζόταν με ασβέστη για να
κατακρατηθεί το οξικό οξύ ως οξικό ασβέστιο, από το οποίο λαμβανόταν στη
συνέχεια οξικό οξύ ή ακετόνη με θερμική διάσπασή του. Ακολουθούσαν διαδοχικές κλασματικές αποστάξεις για να ληφθεί μεθανόλη 82%, το ξυλόπνευμα, που περιείχε ακόμη ακετόνη όπως και άλλες
πτητικές ουσίες.
Από 1 τόνο ξηρού ξύλου, με ξηρά
απόσταξη μπορούν να ληφθούν (μεταξύ άλλων χρήσιμων
προϊόντων): 14 L μεθανόλης, 53
L οξικού οξέος και 3 L ακετόνης
[Αναφ. 2γ]. Η παραγωγή μεθανόλης με τη
μέθοδο αυτή γινόταν σε πολύ μεγάλη κλίμακα για εκείνη την εποχή. Ενδεικτικά αναφέρεται, ότι στην
Αυστροουγγαρία, κατά την περίοδο 1907-1908 είχαν παραχθεί με τη μέθοδο αυτή 7.500 τόνοι μεθανόλης [Αναφ. 2β].
Κατά τον 19ο αιώνα, τη μεθανόλη που παρασκεύαζαν με τον τρόπο αυτό χρησιμοποιούσαν κυρίως για θέρμανση, μαγείρεμα και φωτισμό, σύντομα όμως
αντικαταστάθηκε από φθηνότερα καύσιμα, όπως το πετρέλαιο και η βενζίνη.
Σύγχρονες μέθοδοι
παρασκευής μεθανόλης. Το 1923, οι Γερμανοί χημικοί
Alwin Mittasch και Mathias Pier,
της μεγάλης Γερμανικής Βιομηχανίες BASF (Badische
Anilin und Soda Fabrik), ανακάλυψαν μέθοδο
μετατροπής του συνθετικού αερίου (synthetic gas,
Syngas), ενός μίγματος κυρίως υδρογόνου και μονοξειδίου του άνθρακα (με μικρότερες ποσότητες διοξειδίου του άνθρακα), σε μεθανόλη.
Το
Syngas παρασκευάζεται με διαβίβαση υδρατμών και αέρα πάνω από
πυρακτωμένο γαιάνθρακα, οπότε πραγματοποιούνται αντιδράσεις όπως:
C + H2O
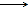 CO + H2
(ΔΗ298 = 31,3 kcal/mol)
CO + H2
(ΔΗ298 = 31,3 kcal/mol)
C + 1/2 O2
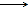 CO (ΔΗ298
= -29,4 kcal/mol)
CO (ΔΗ298
= -29,4 kcal/mol)
Η σύνθεση της μεθανόλης βασίζεται στην ακόλουθη
απλή αντίδραση:
CO + 2 H2
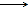 CH3OH (ΔΗ298 =
-21,7 kcal/mol)
CH3OH (ΔΗ298 =
-21,7 kcal/mol)
Η μέθοδος αυτή απαιτούσε την παρουσία καταλυτών (οξείδια
χρωμίου και μαγγανίου) και ιδιαίτερα έντονες συνθήκες αντίδρασης (πιέσεις 50
- 220 atm, θερμοκρασίες μέχρι και 450 ºC). Κατά τη δεκαετία του 1960, η μέθοδος
βελτιώθηκε με χρήση άλλων καταλυτών (κυρίως
Cu, ZnO
και Al2O3) που επέτρεψαν τη χρήση μικρότερων πιέσεων
και θερμοκρασιών (50 - 100
atm, 250 ºC)
[Αναφ.
1β, 3].
Σήμερα το
Syngas παρασκευάζεται κυρίως
από το μεθάνιο του φυσικού αερίου [βλέπε:
Χημική ένωση του μήνα: Μεθάνιο]
Κυρίως: CΗ4
+ H2O
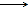 CO + 3
H2
(ΔΗ298 = 49,1 kcal/mol)
CO + 3
H2
(ΔΗ298 = 49,1 kcal/mol)
Δευτερευόντως: CΟ
+ Η2Ο
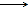 CO2 + Η2
(ΔΗ298 = -9,8 kcal/mol)
CO2 + Η2
(ΔΗ298 = -9,8 kcal/mol)
Θα πρέπει να σημειωθεί ότι η παραγωγή του
Syngas από το μεθάνιο οδηγεί στην παραγωγή 3 γραμμομορίων Η2
για κάθε γραμμομόριο CO, ενώ η σύνθεση της μεθανόλης απαιτεί μόνο 2 γραμμομόρια H2 για κάθε γραμμομόριο
CO. Για να αξιοποιηθεί το επιπλέον υδρογόνο εισάγεται CO2 στον αντιδραστήρα,
το οποίο αντιδρά με το υδρογόνο για να σχηματίσει
και αυτό μεθανόλη, σύμφωνα με την αντίδραση:
CO2
+ 3 H2
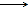 CH3OH + Η2Ο
(ΔΗ298 = -11,9 kcal/mol)
CH3OH + Η2Ο
(ΔΗ298 = -11,9 kcal/mol)
'Ετσι, η "συνολική" αντίδραση παραγωγής μεθανόλης από το
μεθάνιο κατά την οποία αξιοποιείται το σύνολο του υδρογόνου που περιέχει το
μεθάνιο, μπορεί να αποδοθεί ως εξής:
3
CΗ4
+ 2 H2O +
CO2
 4
CH3OH
4
CH3OH
Η παραγωγική ικανότητα μιας σύγχρονης
βιομηχανικής εγκατάστασης σύνθεσης μεθανόλης σε μεγάλη κλίμακα από φυσικό
αέριο σήμερα είναι περίπου 5.000 MTPD
(metric tons per day: μετρικοί τόνοι την ημέρα)
και σύντομα εκτιμάται πως θα αυξηθεί στους 10.000 MTPD
[Αναφ. 3].
|
Syngas και
"συνθετικό" πετρέλαιο
 Το
Syngas (synthesis gas, synthetic gas, SNG) [στα Ελληνικά αποδίδεται ως
αέριο σύνθεσης ή συνθετικό αέριο] είναι προϊόν μια θερμοχημικής μετατροπής κατά την
οποία κάθε είδος άνθρακα, οργανικής ύλης και βιομάζας υπόκειται σε υψηλή
θερμοκρασία σε συνδυασμένη δράση υδρατμών και οξυγόνου και παρέχει μίγμα
υδρογόνου, μονοξειδίου και διοξειδίου του άνθρακα με βάση τις γενικές
αντιδράσεις [Αναφ. 4]: Το
Syngas (synthesis gas, synthetic gas, SNG) [στα Ελληνικά αποδίδεται ως
αέριο σύνθεσης ή συνθετικό αέριο] είναι προϊόν μια θερμοχημικής μετατροπής κατά την
οποία κάθε είδος άνθρακα, οργανικής ύλης και βιομάζας υπόκειται σε υψηλή
θερμοκρασία σε συνδυασμένη δράση υδρατμών και οξυγόνου και παρέχει μίγμα
υδρογόνου, μονοξειδίου και διοξειδίου του άνθρακα με βάση τις γενικές
αντιδράσεις [Αναφ. 4]:
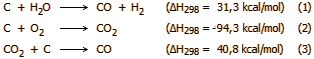
Το Syngas μπορεί να
χρησιμοποιηθεί ως καύσιμο γενικής χρήσης στη θέση του φυσικού αερίου (που
αποτελείται κυρίως
από μεθάνιο). Μπορεί να χρησιμοποιηθεί ως καύσιμο σε θερμοηλεκτρικούς σταθμούς
παραγωγής ηλεκτρικής ενέργειας ή να μετατραπεί σε βιοκαύσιμο.
Το Syngas παράγεται με μια διαδικασία γνωστή ως αεροποίηση (gasification). Στα
υλικά που θα μπορούσαν να χρησιμοποιηθούν ως πηγή άνθρακα περιλαμβάνονται
κοινά οικιακά απορρίμματα, τα οποία έτσι, αντί να θαφτούν σε
χωματερές, καθίστανται πηγές ενέργειας που μπορούν να τροφοδοτήσουν
ενεργειακά παρακείμενες πόλεις και κοινότητες.
Τα κάθε είδους οργανικά υλικά
εισάγονται στον αεροποιητή (gasifier) σε ένα περιβάλλον φτωχό σε
οξυγόνο. Τα υλικά θερμαίνονται σε θερμοκρασίες που
κυμαίνονται από 650 έως 1300ºC. Ακολουθεί διαβίβαση ύδατος στη
μορφή υπέρθερμου ατμού, μέσω του ερυθροπυρακτωμένου ανθρακούχου υλικού, οπότε
πραγματοποιείται η ενδόθερμη αντίδραση (1).
'Οταν η θερμοκρασία μειωθεί σε
σημείο που η αντίδραση (1) δεν προχωρεί με ικανοποιητική ταχύτητα,
διακόπτεται η εισαγωγή ατμού και εισάγεται αέρας, οπότε αρχίζει η εξώθερμη
αντίδραση (2), που αυξάνει πάλι τη θερμοκρασία της οργανικής ύλης. 'Ετσι, η
αντίδραση (2) καλύπτει τις ενεργειακές απαιτήσεις της αντίδρασης (1), αλλά
και της (3) που περιορίζει την περιεκτικότητα του Syngas σε διοξείδιο του
άνθρακα. Η διαδικασία καθίσταται συνεχής με συνεχή
τροφοδότηση του αεροποιητή με το ανθρακούχο (ή γενικά με το οργανικό υλικό)
με τη βοήθεια κοχλιωτού μεταφορέα.
'Ενα σημαντικό πλεονέκτημα της
εφαρμογής της διαδικασίας αυτής στην αεροποίηση απορριμμάτων είναι ότι δεν δημιουργεί τοξικές
ενώσεις (π.χ. διοξίνες) από χλωριωμένες οργανικές ενώσεις (π.χ.
PVC). Αντίθετα, ακόμη και αν υπάρχουν τοξικές ενώσεις ή βιολογικά
επικίνδυνες ουσίες στα απορρίμματα, αυτές κατακαίονται στις συνθήκες
αεροποίησης. Κατά τη διαδικασία δεν υπάρχουν
εκπομπές ρύπων προς την ατμόσφαιρα (δεν απαιτούνται καμινάδες) και το μόνο
που απομένει προς διάθεση είναι η τέφρα.
|

Franz Fischer (1877-1947
και Hans Tropsch
(1889-1935). Οι διάσημοι Γερμανοί χημικοί
εφευρέτες της μεθόδου σύνθεσης υδρογονανθράκων από
μονοξείδιο του άνθρακα και υδρογόνο. |
Syngas από το φυσικό αέριο. Μετά τον 2ο Παγκόσμιο Πόλεμο,
ένας νέος τρόπος παραγωγής του Syngas ήταν μέσω του φυσικού αερίου με βάση
τις αντιδράσεις (κατά σειρά σπουδαιότητας):
CH4 + H2O
→ CO + 3 H2
(αναμόρφωση με ατμό)
CH4
+ 1/2 O2 →
CO + 2 H2 (αυτόθερμη αναμόρφωση)
CH4
+ CO2 →
CO + 2 H2 (ξηρή αναμόρφωση)
Η περιεκτικότητα του Syngas στα
διάφορα αέρια εξαρτάται από το είδος της οργανικής ύλης, τον έλεγχο
της όλης διαδικασίας και τον προορισμό του. Τυπικές περιοχές περιεκτικοτήτων είναι: Η2
= 25-30%, CO = 30-60%, CO2
= 5-15%, Η2Ο
= 2-30%, CH4
= 0-2%, Ν2
= 0,5-4%, ακόμη μπορεί να περιέχει μικρές αναλογίες (<1%) θειούχων αερίων (Η2S,
COS).
Ανάλογα με τη χρήση του Syngas
μπορεί να ακολουθήσει στάδιο καθαρισμού (απαλλαγή από διοξείδιο του άνθρακα, θειούχες ενώσεις,
NH3,
HCN). Μια από τις αποτελεσματικότερες μεθόδους καθαρισμού,
μέθοδος Rectisol, βασίζεται στην παγίδευση των αερίων αυτών
σε κατεψυγμένη μεθανόλη (-40ºC).
Πετρέλαιο από το Syngas. Μια από τις σημαντικότερες
χρήσεις του Syngas είναι η σύνθεση αλκανίων με τη μέθοδο Fischer-Tropsch. Η πραγματοποιούμενη αντίδραση έχει τη γενική μορφή
(2n+1) H2
+ n CO →
CnH2n+2
+ n H2O
όπου n θετικός αριθμός, αν και ο
σχηματισμός μεθανίου (n = 1) είναι ανεπιθύμητος. Η αντίδραση
πραγματοποιείται σε σχετικά χαμηλές θερμοκρασίες (150 έως 300
ºC). Σε υψηλές θερμοκρασίες η αντίδραση
προχωρά ταχύτερα, αλλά ευνοείται και ο σχηματισμός μεθανίου. Για την
αντίδραση υπάρχει μια μεγάλη ποικιλία καταλυτών, αλλά οι συνηθέστεροι
καταλύτες είναι
μέταλλα μεταπτώσεως, όπως ο σίδηρος, το κοβάλτιο και το ρουθήνιο.
Με τη μέθοδο Fischer-Tropsch σχηματίζονται γραμμικά αλκάνια και σε μικρές μόνο ποσότητες διακλαδισμένα αλκάνια. Επιπλέον,
σχηματίζονται μικρές ποσότητες αλκενίων και αλκοολών, αλλά με τη χρήση
κατάλληλων καταλυτών οι ποσότητες αυτών των "μη-αλκανικών" προϊόντων μπορούν
να αυξηθούν.
Η μέθοδος Fischer-Tropsch έχει ιδιαίτερη οικονομική σημασία για χώρες που
διαθέτουν γαιάνθρακες και όχι πετρέλαια. 'Επαιξε σημαντικό ρόλο για τη
συνέχιση του 2ου Παγκοσμίου Πολέμου, εξασφαλίζοντας στη Γερμανία τους
απαραίτητους για τον πόλεμο υδρογονάνθρακες (με ετήσια παραγωγή 600.000 τόνων
υδρογονανθράκων), αφού η τροφοδοσία της από πετρελαιοπαραγωγές
χώρες είχε ουσιαστικά αποκοπεί.
|
Εναλλακτικές μέθοδοι
παραγωγής μεθανόλης. Σχεδόν στο σύνολό της η μεθανόλη σήμερα
παράγεται από το
Syngas ή από
το φυσικό αέριο (αφού μετατραπεί σε Syngas),
ωστόσο έχουν προταθεί και δοκιμαστεί με επιτυχία και άλλες
μέθοδοι.
Μεθανόλη μπορεί να παραχθεί με καλές αποδόσεις
από αγροτικά προϊόντα και αστικά απόβλητα, ξύλο και πολλά είδη βιομάζας. Μια άλλη ενδιαφέρουσα μέθοδος βασίζεται στην αναγωγή
με υδρογόνο του διοξειδίου του άνθρακα με
που παράγεται στα καυσαέρια των εργοστασίων παραγωγής ενέργειας, τσιμέντου
και άλλες βιομηχανικές μονάδες. Η αναγωγή αυτή μπορεί να συμβάλει αποφασιστικά στη μείωση του
ρυθμού αύξησης του διοξειδίου του άνθρακα στην ατμόσφαιρα, αφού ουσιαστικά
θα το ανακυκλώνει. Ωστόσο, μια 100% περιβαλλοντικά
φιλική αναγωγή θα πρέπει το υδρογόνο
να παράγεται με ηλεκτρόλυση του
ύδατος με ηλεκτρική ενέργεια, που και αυτή θα προέρχεται από
ανανεώσιμες πηγές ενέργειας (αιολική ενέργεια, ηλιακή ενέργεια, γεωθερμία, βιομάζα)
[Αναφ. 5].
|
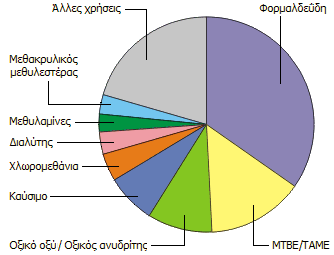
Κύριες χρήσεις της
μεθανόλης (2009) [Αναφ. 5]. |
Η μεθανόλη
ως πρώτη ύλη στη χημική βιομηχανία
Η
παγκόσμια παραγωγή της μεθανόλης κατά το 2009 ήταν περίπου 42 εκατομμύρια
τόνοι. Οικονομικές εκθέσεις αναφέρουν ότι αναμένεται μέση ετήσια αύξηση της
παραγωγής κατά 13% μέχρι το 2014 και κατά 4,1%
μέχρι το 2019. Το 30% της παραγόμενης μεθανόλης χρησιμοποιείται για την παραγωγή
φορμαλδεΰδης και από εκεί πλήθους άλλων χημικών ουσιών, όπως πολυμερή υλικά,
χρώματα, εκρηκτικά, υφάνσιμες ίνες.
Από το 1990 μεγάλες ποσότητες μεθανόλης
χρησιμοποιούνται στις ΗΠΑ για την παρασκευή των ονομαζόμενων
οξυγονούχων (oxygenates) προσθέτων της
βενζίνης κίνησης, όπως είναι ο
μεθυλο-tert-βουτυλο-αιθέρας (methyl tert-butyl
ether,
MTBE)
και (δευτερευόντως) ο tert-αμυλο-μεθυλο-αιθέρας (tert-amyl
methyl ether, TAME). Στα οξυγονούχα πρόσθετα της βενζίνης κίνησης
περιλαμβάνονται και οι αλκοόλες (μεθανόλη και αιθανόλη). Τα πρόσθετα αυτά αυξάνουν τον αριθμό οκτανίου
της βενζίνης και
αντικατέστησαν ολοκληρωτικά τον τοξικότατο τετρααιθυλομόλυβδο.
Οι παραπάνω αιθέρες παρασκευάζονται με άμεση αντίδραση μεθανόλης και της αντίστοιχης ολεφίνης
(αιθεροποίηση ολεφινών):
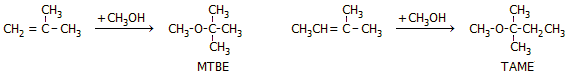
Ωστόσο και αυτά, τα μικρής
τοξικότητας αιθερικά πρόσθετα, αποδείχθηκαν ότι δημιουργούν περιβαλλοντικά προβλήματα.
'Ετσι, τo MTBE ως ένα ιδιαίτερα λεπτόρρευστο υγρό, διαρρέει εύκολα από δεξαμενές, δεν
διασπάται εύκολα και
ρυπαίνει τον υδροφόρο ορίζοντα προσδίδοντας δυσάρεστη γεύση στο πόσιμο νερό. Αν και η χρήση του συνεχίζεται σε μερικές χώρες,
στις ΗΠΑ έχει περιοριστεί σημαντικά και έχει αντικατασταθεί από άλλα
πρόσθετα αύξησης οκτανίων στη βενζίνη μηχανών εσωτερικής καύσης
[Αναφ.
5γ].
Μεγάλα ποσά μεθανόλης χρησιμοποιούνται ως "άμεσα" καύσιμα, για την παραγωγή χλωροπαραγώγων του
μεθανίου, ως διαλύτης, για την παραγωγή αντιψυκτικών διαλυμάτων, για τη
σύνθεση μεθυλαμινών και μεθακρυλικού
μεθυλεστέρα για την παραγωγή διάφανων πολυμερών (π.χ.
Plexiglas) [Αναφ. 6]. Η παρασκευή
μεθυλαμινών πραγματοποιείται με άμεση αντίδραση μεθανόλης και αμμωνίας
παρουσία ενός αφυδραντικού καταλύτη (αλουμίνα ή μίγμα αλουμίνας - πυριτίας):
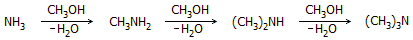
Το οξικό οξύ (και κατ' επέκταση ο οξικός ανυδρίτης) παρασκευάζεται σήμερα σχεδόν αποκλειστικά με καρβονυλίωση της
μεθανόλης, που μπορεί γενικά να περιγραφεί από την απλή αντίδραση:
CH3OH +
CO
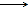 CH3COOH
CH3COOH
Η καρβονυλίωση της μεθανόλης πραγματοποιείται
παρουσία υδροϊωδίου και ενός συμπλόκου του ιριδίου που δρα ως καταλύτης (καταλύτης
Cativa [Ir(CO)2I2]−
). Η αλληλουχία των αντιδράσεων μπορεί να αποδοθεί ως εξής:
|

Λεωφορείο
κινούμενο με βιοντίζελ,
με εικόνες που προπαγανδίζουν τη διάδοση της χρήσης του. |
Η μεθανόλη ως καύσιμο αυτοκίνησης
Η μεθανόλη μπορεί να θεωρηθεί γενικά ως ένα εξαιρετικό
καύσιμο. Η
καύση της είναι καθαρότερη και πιο ασφαλής σε περίπτωση πυρκαγιάς σε σχέση
με τη βενζίνη. Αν η μεθανόλη αναφλεγεί, μπορεί να σβήσει εύκολα με
νερό, αντίθετα η βενζίνη, επειδή δεν διαλύεται στο νερό, επιπλέει σε
αυτό φλεγόμενη και το νερό μπορεί να μεταφέρει τη φλόγα και σε άλλες
περιοχές. Σε αντίθεση με το πετρέλαιο, αν λόγω κάποιου ναυτικού ατυχήματος
αδειάσουν χιλιάδες τόνοι μεθανόλης στη θάλασσα, αυτοί θα διαχυθούν ταχύτατα
και η μεθανόλη θα μεταβολισθεί εύκολα από τους θαλάσσιους οργανισμούς.
Το σημείο ανάφλεξης της μεθανόλης είναι 12ºC, ενώ της βενζίνης είναι -43°C. Ως
σημείο ανάφλεξης (flash point) ορίζεται η χαμηλότερη θερμοκρασία στην οποία
ένα υγρό εξατμίζεται αρκετά, ώστε να σχηματίσει αναφλέξιμο μίγμα με τον
αέρα.
Η Υπηρεσία Προστασίας Περιβάλλοντος των ΗΠΑ (EPA) έχει εκτιμήσει
πως αντικατάσταση της βενζίνης (ως καυσίμου) με μεθανόλη θα μειώσει τις
πυρκαγιές καυσίμων κατά 90%. Ωστόσο, βασικό μειονέκτημα της μεθανόλης είναι
ότι περιέχει κατ' όγκον τη μισή ενέργεια της βενζίνης (15,6 MJ/L
ως προς 32,4 MJ/L).
Η μεθανόλη καθαρή ή ως μίγμα με βενζίνη
χρησιμοποιείται ως καύσιμο αυτοκινήτων (Research Octane Number 107 και Motor Octane Number
92). Στους αγώνες αυτοκινήτου Indianapolis 500 η μεθανόλη αποτελεί το αποκλειστικό καύσιμο των αγώνων. Τα
μίγματά της με βενζίνη χαρακτηρίζονται από το γράμμα Μ και έναν αριθμό που
δηλώνει την % περιεκτικότητα του μίγματος σε μεθανόλη (π.χ. Μ80, Μ85, Μ100).
Λόγω της μικρής πτητικότητας της μεθανόλης, η
καθαρή μεθανόλη δεν είναι κατάλληλη ως καύσιμο αυτοκινήτων σε πολύ ψυχρές
θερμοκρασίες. Οι μηχανές δεν ξεκινούν εύκολα και η απόδοσή τους είναι χαμηλή
μέχρις ότου θερμανθούν. Αυτός είναι ο λόγος που προτιμότερο ως καύσιμο είναι
μίγμα 85% μεθανόλης - 15% βενζίνης (Μ85). Αυτή η έστω και μικρή
περιεκτικότητα του καυσίμου σε βενζίνη επιτρέπει την εκκίνηση της μηχανής
ακόμη σε πολύ χαμηλές θερμοκρασίες.
Βιοντίζελ. Μια από τις σύγχρονες χρήσεις μεγάλων ποσοτήτων
μεθανόλης είναι στην παραγωγή βιοντίζελ. Το βιοντίζελ είναι μίγμα εστέρων
ανώτερων λιπαρών οξέων με "χαμηλές" αλκοόλες και κυρίως με μεθανόλη, αφού
είναι και πλέον φθηνή αλκοόλη. Το βιοντίζελ είναι προϊόν μετεστεροποίησης τριγλυκεριδίων
φυτικής προέλευσης (π.χ. σογιέλαιο) με μεθανόλη. Παρασκευάζεται με θέρμανσή
τους με περίσσεια μεθανόλης παρουσία οξέος που δρα ως καταλύτης
[Αναφ. 7].
Το γενικό σχήμα της αντίδρασης μετεστεροποίησης
(transesterification) των φυτικών ελαίων είναι:
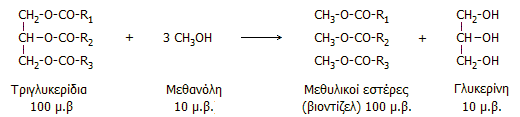
Σε αντίθεση με τα ίδια τα φυτικά έλαια, οι
μεθυλικοί εστέρες των οξέων τους έχουν πρακτικά τις ίδιες ιδιότητες ως προς
την καύση τους με εκείνες του πετρελαίου ντίζελ και βέβαια είναι καύσιμο
φιλικό προς το περιβάλλον, αφού προέρχεται από φυτική ύλη (βιομάζα) που
είναι μια ανανεώσιμη πηγή ενέργειας.
Το βιοντίζελ χρησιμοποιείται συνήθως σε μίγμα
με κανονικό πετρέλαιο ντίζελ (πετροντίζελ). Τα μίγματα αυτά χαρακτηρίζονται
από το γράμμα Β και έναν αριθμό που δηλώνει την % περιεκτικότητα του
μίγματος σε βιοντίζελ (π.χ. Β5, Β20, Β100).
Προφανώς, όσο μεγαλύτερος είναι ο αριθμός αυτός, τόσο πιο
"φιλικό" προς το περιβάλλον είναι το καύσιμο. Επιπλέον, το
βιοντίζελ είναι κατά πολύ πιο βιοαποδομήσιμη ουσία σε σχέση με το πετρέλαιο.
Το καθαρό βιοντίζελ (Β100) εμφανίζει κάποια
διαβρωτική δράση σε ορισμένα εξαρτήματα των μηχανών εσωτερικής καύσεις
(κυρίως τα παρεμβύσματα), αλλά και σε μεταλλικά τμήματα τους (κράματα
χαλκού, κασσιτέρου, ψευδαργύρου, μαγγανίου). Η μερική υδρόλυσή του με
απελευθέρωση λιπαρών οξέων αυξάνει τη διαβρωτική δράση τους. Μίγματα
5-20% βιοντίζελ με πετρέλαιο (Β5 - Β20) δεν παρουσιάζουν προβλήματα διάβρωσης και δεν απαιτούν
τροποποιήσεις σε μηχανές και στα συστήματα διάθεσης και αποθήκευσης.
Παραπροϊόν της σύνθεσης βιοντίζελ είναι η γλυκερίνη,
που παράγεται έτσι σε μεγάλες ποσότητες με αποτέλεσμα την υπερπροσφορά της.
Για να αξιοποιηθούν αυτές οι ποσότητες γλυκερίνης αναζητούνται νέες πιθανές χρήσεις της ως πρώτης ύλης
στη χημική βιομηχανία.
Η οικονομία της μεθανόλης
 Τα αποθέματα των ορυκτών καυσίμων δεν είναι
ανεξάντλητα. Σήμερα, το πετρέλαιο, το φυσικό αέριο και οι
γαιάνθρακες συνεισφέρουν το 35%, το 21% και το 23%
της ενέργειας που χρειάζεται ο παγκόσμιος πληθυσμός. Τα γνωστά και
οικονομικώς αξιοποιήσιμα αποθέματά τους επαρκούν -με τους σημερινούς
ρυθμούς κατανάλωσης- για περίπου 40, 60 και 170 χρόνια,
αντιστοίχως.
Τα υλικά αυτά χρειάστηκαν να περάσουν εκατομμύρια έτη και να
πραγματοποιηθούν μεγάλης έκτασης γεωλογικές αναστατώσεις για να δημιουργηθούν
από την αρχαία βιομάζα,
αλλά απ' ό,τι φαίνεται λίγες εκατονταετίες ανθρωπίνων δραστηριοτήτων θα είναι αρκετές για να
τα εξαντλήσουν σχεδόν πλήρως.
Τα αποθέματα των ορυκτών καυσίμων δεν είναι
ανεξάντλητα. Σήμερα, το πετρέλαιο, το φυσικό αέριο και οι
γαιάνθρακες συνεισφέρουν το 35%, το 21% και το 23%
της ενέργειας που χρειάζεται ο παγκόσμιος πληθυσμός. Τα γνωστά και
οικονομικώς αξιοποιήσιμα αποθέματά τους επαρκούν -με τους σημερινούς
ρυθμούς κατανάλωσης- για περίπου 40, 60 και 170 χρόνια,
αντιστοίχως.
Τα υλικά αυτά χρειάστηκαν να περάσουν εκατομμύρια έτη και να
πραγματοποιηθούν μεγάλης έκτασης γεωλογικές αναστατώσεις για να δημιουργηθούν
από την αρχαία βιομάζα,
αλλά απ' ό,τι φαίνεται λίγες εκατονταετίες ανθρωπίνων δραστηριοτήτων θα είναι αρκετές για να
τα εξαντλήσουν σχεδόν πλήρως.
Η επερχόμενη εξάντληση των ορυκτών καυσίμων δεν
αποτελεί το μόνο πρόβλημα. Ο άνθρακας, που για εκατομμύρια χρόνια βρισκόταν
χημικά εγκλωβισμένος με ασφάλεια σε αυτά, κατά την καύση τους μετατρέπεται σε
CO2, ανατρέποντας το φυσικό ισοζύγιο του αερίου αυτού στην
ατμόσφαιρα του πλανήτη μας. Στην αύξηση της περιεκτικότητας της ατμόσφαιρα
σε CO2,
που αποτελεί το κυρίως υπεύθυνο
αέριο για το φαινόμενο του θερμοκηπίου, αποδίδονται οι παρατηρούμενες
αλλαγές στο κλίμα με όλα τα
οδυνηρά αποτελέσματά τους [βλέπε:
Χημική ένωση του μήνα:
Εξαφθοριούχο θείο]. Επιπλέον, όταν εξαντληθεί το
πετρέλαιο, η ανθρωπότητα θα στερηθεί την πρώτη ύλη για ένα πλήθος χημικών
προϊόντων που είναι πλέον απαραίτητα για τη ζωή μας.
Είναι προφανές ότι σύντομα (ίσως σε λίγες
δεκαετίες) θα πρέπει να υπάρξουν εναλλακτικές και πιο μόνιμες λύσεις, αν
ληφθεί μάλιστα υπόψη η αύξηση τόσο του παγκόσμιου πληθυσμού, όσο και η
αυξητική τάση των παγκόσμιων ενεργειακών αναγκών
[Αναφ. 8α].
Η οικονομία μεθανόλης έχει προταθεί ως
ένα εφικτό μοντέλο οικονομίας του
μέλλοντος. Η μεθανόλη αντικαθιστά τα ορυκτά καύσιμα ως καύσιμο, ως ύλη για
την παραγωγή συνθετικών υδρογονανθράκων και των προϊόντων τους, αλλά (και
κυρίως) ως μέσο αποθήκευσης ενέργειας. Η οικονομία της μεθανόλης αποτελεί
εναλλακτική λύση έναντι της οικονομίας του υδρογόνου και της
οικονομίας της αιθανόλης [Αναφ. 8].
Κύριος υποστηρικτής της οικονομίας της
μεθανόλης είναι ο George A. Olah (βραβείο Nobel Χημείας 1994, για τις
εργασίες στο θέμα των καρβοκατιόντων, βλέπε:
Χημική ένωση του μήνα: Μαγικό
οξύ) και ένας από τους κύριους εφευρέτες της μπαταρίας καυσίμου μεθανόλης (methanol fuel cell). Ο Olah
και οι συνεργάτες του συνέγραψαν πολλά βιβλία και άρθρα, όπου συνοψίζουν την τρέχουσα
κατάσταση πάνω στα ορυκτά καύσιμα, τις προοπτικές, τις εναλλακτικές πηγές ενέργειας και
τη διαθεσιμότητά τους και στη συνέχεια παρουσιάζουν τα πλεονεκτήματα, αλλά
και τα προβλήματα της μεθανόλης ως καυσίμου, ως τρόπου αποθήκευσης της
ενέργειας και ως πρώτης ύλης για τη σύνθεση κάθε άλλης οργανικής ένωσης στο
μέλλον [Αναφ. 9].
 |
 |
Μια ενδιάφερουσα
συνέντευξη (δόθηκε τον Απρίλιο του 2006) του
George A. Olah (βραβείο Nobel
Χημείας 1994) στο θέμα της οικονομίας της
μεθανόλης (από την εκπομπή "Talk to the Nation" του
Νational Public Radio, NPR), μπορείτε να ακούσετε
από εδώ. |
|
 Πλεονεκτήματα της
μεθανόλης έναντι του υδρογόνου. Τα πλεονεκτήματα της μεθανόλης
έναντι του υδρογόνου συνοψίζονται στα εξής:
Πλεονεκτήματα της
μεθανόλης έναντι του υδρογόνου. Τα πλεονεκτήματα της μεθανόλης
έναντι του υδρογόνου συνοψίζονται στα εξής:
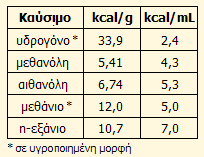
- Αποδοτικότερη κατ' όγκο αποθήκευση
ενέργειας, αλλά και κατά βάρος, αν ληφθεί υπόψη το βάρος των δεξαμενών
αποθήκευσης υδρογόνου υπό πίεση. Η κατ' όγκο περιεκτικότητα της μεθανόλης σε
ενέργεια είναι κατά πολύ μεγαλύτερη από εκείνη του υγρού υδρογόνου,
δεδομένης της πολύ μικρής πυκνότητας του υγρού υδρογόνου (μόλις 71 g/L). Η
μεθανόλη περιέχει 99 g υδρογόνου/L και δεν απαιτεί τα ειδικά κρυογονικά
δοχεία και δεξαμενές που είναι απαραίτητα για τη μεταφορά και αποθήκευση του υγρού υδρογόνου. Στον παραπλεύρως
πίνακα δίνεται συγκριτικά το ενεργειακό περιεχόμενο ανά μονάδα βάρους και
μονάδα όγκου διάφορων υγρών καυσίμων και αερίων στην υγρή τους μορφή.
Το υδρογόνο απαιτεί θερμοκρασία
-253 °C για να διατηρείται στην υγρή μορφή και στη μορφή αυτή είναι ένα
εξαιρετικά δύσχρηστο και επικίνδυνο υλικό. Διάθεση υγρού υδρογόνου με τον
ίδιο τρόπο που διατίθενται σήμερα τα υγρά καύσιμα από πρατήρια είναι
ουσιαστικά αδύνατη. Αντίθετα, η μεθανόλη, πέραν του ότι είναι ένα σχετικά
πτητικό και εύφλεκτο υγρό (λιγότερο από τη βενζίνη), δεν παρουσιάζει ιδιαίτερα προβλήματα αποθήκευσης
και διακίνησης σε μεγάλες ποσότητες.
- Η υπάρχουσα υποδομή για την αποθήκευση,
μεταφορά και διανομή βενζίνης και άλλων υγρών υδρογονανθράκων με λίγες μόνο
τροποποιήσεις μπορεί να χρησιμοποιηθεί για τη μεθανόλη. Αντίθετα, η
αντίστοιχη υποδομή για το υδρογόνο θα πρέπει να δημιουργηθεί από την αρχή
και θα είναι απαγορευτικά δαπανηρή.
- Η μεθανόλη μπορεί να αναμιχθεί με τη βενζίνη
και να χρησιμοποιηθεί ως καύσιμο οχημάτων, όχι όμως το υδρογόνο.
- Η μεθανόλη είναι φιλική προς τον χρήστη, δεν
δημιουργεί τους ίδιους κινδύνους με εκείνους του υδρογόνου (π.χ. σε
περίπτωση διαρροής) και δεν απαιτεί κρυογονικά δοχεία και υψηλές πιέσεις για
την αποθήκευσή της.
Πλεονεκτήματα της
μεθανόλης έναντι της αιθανόλης. Τα πλεονεκτήματα της μεθανόλης
έναντι της αιθανόλης συνοψίζονται στα εξής:
- Η μεθανόλη μπορεί να παρασκευασθεί από κάθε
οργανική ύλη μέσω του Syngas. Δεν απαιτούνται καλλιέργειες και δεν
ανταγωνίζεται την παραγωγή τροφής. Οι ποσότητες της μεθανόλης που μπορούν να
παραχθούν από τη βιομάζα είναι πολύ μεγαλύτερες από τις αντίστοιχες της
αιθανόλης.
- Η χρήση της μεθανόλης μπορεί να ανταγωνισθεί
αλλά και να συμπληρώσει τη χρήση της αιθανόλης. Η μεθανόλη που παράγεται από
ορυκτά καύσιμα έχει πολύ μικρότερο κόστος από το κόστος της αντίστοιχα
παραγόμενης αιθανόλης.
- Η μεθανόλη μπορεί να αναμιχθεί με τη βενζίνη,
όπως και η αιθανόλη. Το καύσιμο Μ85 (μίγμα 85% μεθανόλης - 15% βενζίνης)
μπορεί να χρησιμοποιηθεί όπως το καύσιμο Ε85 (μίγμα 85% αιθανόλης - 15%
βενζίνης), που διατίθεται ως καύσιμο οχημάτων σε πολλά πρατήρια καυσίμων του
κόσμου.
Μειονεκτήματα της
μεθανόλης. Η μεθανόλη ως καύσιμο και ως μέσο αποθήκευσης
ενέργειας παρουσιάζει ορισμένα μειονεκτήματα όπως:
- Το κόστος παραγωγής υδρογόνου, που απαιτείται
για τη σύνθεση μεθανόλης, είναι προς το παρόν υψηλό. Ανάλογα με το είδος της πρώτης ύλης
που χρησιμοποιείται για το σκοπό αυτό, η παραγωγή υδρογόνου μπορεί και να
μην είναι περιβαλλοντικά φιλική.
- Σήμερα, η παραγωγή μεθανόλης από το Syngas εξαρτάται ακόμη από τα ορυκτά καύσιμα, αν και θεωρητικά μπορεί να
χρησιμοποιηθεί κάθε πηγή ενέργειας.
- Η ενεργειακή κατά βάρος και κατ' όγκο
πυκνότητα της μεθανόλης είναι το 50% της βενζίνης και το 76% της αιθανόλης.
- Η μεθανόλη δρα διαβρωτικά έναντι ορισμένων
μετάλλων (αλουμίνιο, ψευδάργυρο, μαγγάνιο). Για παράδειγμα, είναι γνωστό ότι
το νερό δεν προσβάλλει το αργίλιο (αλουμίνιο) λόγω του πρoστατευτικού
στρώματος Al2O3.
Αντίθετα, η μεθανόλη δρα σαν ασθενές οξύ,
διαλύει το οξείδιο, σχηματίζοντας μεθοξείδιο του αργιλίου το οποίο και
διαλύει. Ακόμη, η μεθανόλη μπορεί να δράσει οξειδωτικά αντιδρώντας άμεσα με
το αργίλιο με έκλυση υδρογόνου:
Al2O3
+ 6 CH3OH
 2 Al(OCH3)3 + 3H2O
2Al + 6 CH3OH
2 Al(OCH3)3 + 3H2O
2Al + 6 CH3OH
 2 Al(OCH3)3 + 3H2
2 Al(OCH3)3 + 3H2
Οι παραπάνω αντιδράσεις προχωρούν αργά, αλλά σε
βάθος χρόνου τα αποτελέσματά τους μπορεί να είναι καταστροφικά. Το ίδιο πρόβλημα
παρουσιάζει και η αιθανόλη. Ορισμένα
τμήματα εισαγωγής του καυσίμου στις μηχανές, στις δεξαμενές καυσίμων και στα στεγανωτικά παρεμβύσματα (τσιμούχες) θα πρέπει να αντικατασταθούν.
Αντίστοιχα, προβλήματα θα παρουσιάσουν και οι αγωγοί καυσίμων που σήμερα
χρησιμοποιούνται για μεταφορά πετρελαίου.
Ουδέτερος κύκλος
άνθρακα. O
Olah και οι συνεργάτες του
προτείνουν την οικονομία της μεθανόλης ως πλήρες υποκατάστατο της οικονομίας
των ορυκτών καυσίμων, τονίζουν δε ότι η επικράτηση της οικονομίας αυτής θα
λύσει και το πρόβλημα του φαινομένου του θερμοκηπίου από την αύξηση του
διοξειδίου του άνθρακα. Ουδέτερη ως προς άνθρακα (carbon neutral)
χαρακτηρίζεται κάθε σύνθεση οργανικού καυσίμου, που ως πηγή άνθρακα
χρησιμοποιεί το διοξείδιο του άνθρακα και ως πηγή ενέργειας μόνο τις
ανανεώσιμες. Είναι προφανές ότι αυτές οι συνθέσεις και τα αντίστοιχα καύσιμα
δεν αυξάνουν την περιεκτικότητα της ατμόσφαιρας σε CO2
και επομένως δεν συμβάλλουν στο φαινόμενο του θερμοκηπίου.
Ο ουδέτερος κύκλος άνθρακα (carbon
neutral cycle) είναι ένα από
τα μεγάλα πλεονεκτήματα της οικονομίας της μεθανόλης
[Αναφ. 10]. Ο κύκλος αυτός περιγράφεται συνοπτικά από το
επόμενο σχήμα:
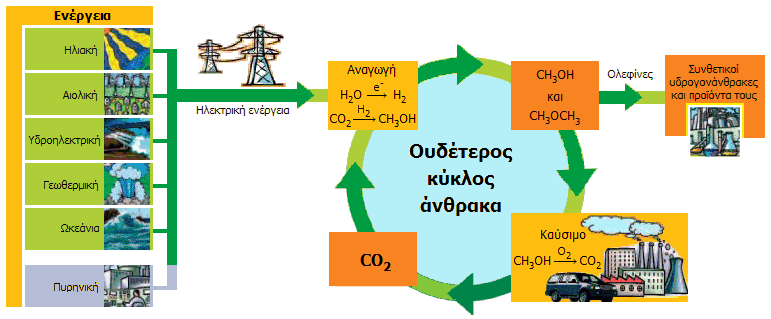
Όπως προαναφέρθηκε μεθανόλη μπορεί να παρασκευασθεί με
άμεση αναγωγή του διοξειδίου του
άνθρακα με υδρογόνο σύμφωνα με την αντίδραση:
CO2
+ 3 H2
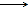 CH3OH + Η2Ο
(ΔΗ298
= -11,9 kcal/mol)
CH3OH + Η2Ο
(ΔΗ298
= -11,9 kcal/mol)
Η παραπάνω αντίδραση αυτή είναι γνωστή στους χημικούς
εδώ και 80 χρόνια και πλέον. Μάλιστα είχε χρησιμοποιηθεί στις ΗΠΑ κατά τη
δεκαετία του 1920-30 για την παραγωγή μεθανόλης από διοξείδιο του άνθρακα
που παραγόταν από διάφορες διαδικασίες, όπως κατά τη ζύμωση. Πολύ καλές αποδόσεις επετεύχθησαν με
καταλύτη συνδυασμό οξειδίων χαλκού και ψευδαργύρου και θερμοκρασία περίπου
260 ºC. Πιλοτική μονάδα παραγωγής μεθανόλης με
βάση την άμεση υδρογόνωση του διοξείδιο του άνθρακα
παρουσιάστηκε το 1998
στην Ιαπωνία με παραγωγή 50
kg/ημέρα με εξαιρετική επιλεκτικότητα ως προς
το λαμβανόμενο προϊόν (99,8%).
Για να διατηρείται ουδέτερος
(κλειστός) ο κύκλος του
άνθρακα, είναι αυτονόητο ότι το απαιτούμενο υδρογόνο θα πρέπει να παράγεται
μόνο με ηλεκτρόλυση και η απαιτούμενη ηλεκτρική ενέργεια θα πρέπει να
προέρχεται αποκλειστικά και μόνο από ανανεώσιμες πηγές ενέργειας (αιολική
ενέργεια, ηλιακή ενέργεια, βιομάζα). Ωστόσο, η ηλεκτρόλυση του ύδατος είναι
μια ιδιαίτερα ενεργοβόρος διαδικασία. Η ολική αντίδραση είναι:
Η2Ο
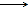 Η2 + 1/2 Ο2 (ΔΗ298
= 68,3 kcal/mol)
Η2 + 1/2 Ο2 (ΔΗ298
= 68,3 kcal/mol)
|

Πιλοτική μονάδα
μετατροπής του CO2
σε
μεθανόλη της
Mitsui Chemicals (Osaka, Ιαπωνία) |
Θεωρητικά, απαιτούνται 39,4
kWh ηλεκτρικής ενέργειας για κάθε kg
υδρογόνου, στην πράξη όμως, οι ενεργειακές απαιτήσεις αυτές φτάνουν τα
50 έως 65 kWh/kg Η2.
Εναλλακτικά, εξετάζεται η δυνατότητα άμεσης
φωτοχημικής διάσπασης του ύδατος. 'Ετσι, στην Ιαπωνία από την εταιρεία
Mitsui Chemicals
κατασκευάζεται πιλοτική
μονάδα με ετήσια παραγωγή 100 τόνων μεθανόλης με υδρογόνο που θα παράγεται
αποκλειστικά με φωτοχημική διάσπαση του ύδατος από την ηλιακή ακτινοβολία.
Αξιοσημείωτη πρόοδος υπάρχει στο θέμα της
άμεσης φωτοηλεκτροχημικής αναγωγής του διοξειδίου του άνθρακα σε μεθανόλη σε
ημιαγωγά ηλεκτρόδια από p-GaP, σύμφωνα με την
αντίδραση:
CO2
+ 6 H+
+ 6 e-
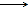 CH3OH + Η2Ο
CH3OH + Η2Ο
Εκτός από μεθανόλη παράγονται και άλλα προϊόντα
μερικής αναγωγής (μυρμηκικό οξύ, φορμαλδεΰδη), τα
οποία ωστόσο με απ' ευθείας υδρογόνωση μπορούν να μετατραπούν σε μεθανόλη.
Οι παραπάνω διαδικασίες ως πρώτη ύλη
χρησιμοποιούν το CO2
σε σχετικά πυκνή μορφή. 'Ετσι, παράλληλα με τις έρευνες πάνω στη δυνατότητα
της άμεσης αναγωγής του διοξειδίου του άνθρακα
προς μεθανόλη, ερευνητικά εξετάζεται και η δυνατότητα της αντιστρεπτής
δέσμευσής του από τα αέρια απόβλητα βιομηχανιών, όπως και η
δυνατότητα άμεσης δέσμευσής του κατ' ευθείαν από την ατμόσφαιρα, όπου
περιέχεται σε αναλογία 0,08%.
Ως κατάλληλες και αντιστρεπτές "χημικές
παγίδες" του διοξειδίου του άνθρακα εξετάζονται διάφορες οργανικές αμίνες ή πολυμερικές αμινοενώσεις,
που ήδη χρησιμοποιούνται για την παγίδευση του
από κλειστούς χώρους, όπως π.χ. τα
υποβρύχια. Τυπικό παράδειγμα αποτελεί η δέσμευση του CO2
από μονοαιθανολαμίνη προς
καρβαμιδικό άλας της οργανικής βάσης. Με σχετικά ελαφρά θέρμανση, το άλας
διασπάται αποδίδοντας το δεσμευμένο CO2
και την ελεύθερη οργανική βάση:
2 ΗΟCH2CH2NH2
+ CO2
 HOCH2CH2NHCOO-
.
+Η3ΝCH2CH2OH
HOCH2CH2NHCOO-
.
+Η3ΝCH2CH2OH

Η ουσία της οικονομίας της
μεθανόλης: Καύσιμα (γαλάζια καύσιμα, blue fuel) από ανανεώσιμες πηγές
ενέργειας [Αναφ. 8ε].
Πετροχημικά από τη μεθανόλη.
Η εξάντληση των αποθεμάτων πετρέλαιο
δεν θα στερήσει την ανθρωπότητα μόνο από ένα "εύκολο" καύσιμο, αλλά και από
ένα πλήθος άλλων χημικών υλών, που παράγονται σήμερα με σταδιακή σύνθεση από
προϊόντα πυρόλυσης του πετρελαίου. Πώς είναι δυνατόν να καλύψει αυτό το κενό
η μεθανόλη. Ο Olah και οι συνεργάτες προτείνουν ως
λύση την ακόλουθη σειρά αντιδράσεων που μπορεί να οδηγήσει στην παραγωγή
ολεφινών, γνωστή methanol to olefin process (MTO):
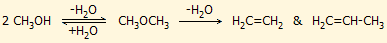
Η αφυδάτωση της μεθανόλης προς διμεθυλαιθέρα
(dimethyl ether, DMA) και η περαιτέρω
διάσπαση του διμεθυλαιθέρα προς ολεφίνες καταλύονται από ζεολιθικούς καταλύτες. Θα πρέπει
να σημειωθεί ότι ο διμεθυλαιθέρας (ο απλούστερος δυνατός αιθέρας, ένα
εξαιρετικά εύφλεκτο αέριο με σ.ζ. −23,6°C) μπορεί να παραχθεί απ' ευθείας από το Syngas με καταλύτη
Cu/Zn/γ-Al2O3,
σε ένα και μόνο στάδιο, χωρίς να χρειαστεί η προηγούμενη σύνθεση και
απομόνωση της μεθανόλης. Η αντίδραση σύνθεσής του είναι:
2 CO + 4 H2
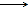 CH3OCH3 + H2O
ή (συνολικά από το μεθάνιο) 2 CH4 + O2
CH3OCH3 + H2O
ή (συνολικά από το μεθάνιο) 2 CH4 + O2
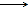 CH3OCH3 + H2O
CH3OCH3 + H2O
Οι λαμβανόμενες ολεφίνες (αιθυλένιο και προπυλένιο)
από τη διάσπαση του διμεθυλαιθέρα μπορούν να
υποστούν ολιγομερισμό και για να παραχθούν υδρογονάνθρακες ελεγχόμενου
μήκους ανθρακικής αλυσίδας ή πολυμερισμό για να ληφθεί πολυαιθυλένιο ή
πολυπροπυλένιο. Το αιθυλένιο και το προπυλένιο είναι από τα πλέον χρήσιμα
προϊόντα θερμικής διάσπασης του πετρελαίου, αφού από αυτά μπορεί να παραχθεί
ουσιαστικά οποιοδήποτε άλλο πετροχημικό προϊόν [Αναφ. 8,
10]:
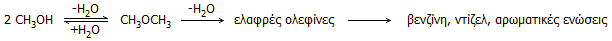
 Διμεθυλαιθέρας. Ο διμεθυλαιθέρας είναι ένα σχετικά
σύγχρονο προϊόν με ιδιαίτερη οικονομική σημασία και παράγεται
πλέον σε ποσότητες εκατοντάδων χιλιάδων τόνων ετησίως. Τον συναντούμε σε διάφορα
καταναλωτικά προϊόντα π.χ. ως προωθητικό αέριο σε διάφορα σπρέυ, σε
αντικατάσταση των απαγορευμένων πλέον χλωροφθορανθράκων. Επίσης,
παρουσιάζει μεγάλο ενδιαφέρον ως καύσιμο ανάλογο με το LPG
(Liquified Petroleum Gas, δηλ. υγροποιημένο προπάνιο ή βουτάνιο υπό ελαφρά πίεση, το γνωστό υγραέριο) με
το οποίο μπορεί εύκολα να αναμιχθεί. 'Ηδη ορισμένες αυτοκινητοβιομηχανίες
κατασκεύασαν οχήματα κινούμενα με διμεθυλαιθέρα [Αναφ.
9δ].
Διμεθυλαιθέρας. Ο διμεθυλαιθέρας είναι ένα σχετικά
σύγχρονο προϊόν με ιδιαίτερη οικονομική σημασία και παράγεται
πλέον σε ποσότητες εκατοντάδων χιλιάδων τόνων ετησίως. Τον συναντούμε σε διάφορα
καταναλωτικά προϊόντα π.χ. ως προωθητικό αέριο σε διάφορα σπρέυ, σε
αντικατάσταση των απαγορευμένων πλέον χλωροφθορανθράκων. Επίσης,
παρουσιάζει μεγάλο ενδιαφέρον ως καύσιμο ανάλογο με το LPG
(Liquified Petroleum Gas, δηλ. υγροποιημένο προπάνιο ή βουτάνιο υπό ελαφρά πίεση, το γνωστό υγραέριο) με
το οποίο μπορεί εύκολα να αναμιχθεί. 'Ηδη ορισμένες αυτοκινητοβιομηχανίες
κατασκεύασαν οχήματα κινούμενα με διμεθυλαιθέρα [Αναφ.
9δ].
Η διάσπαση του διμεθυλαιθέρα έχει εξετασθεί διεξοδικά και το κύριο
προϊόν της μπορεί να επιλεγεί με βάση τον χρησιμοποιούμενο καταλύτη και με έλεγχο των συνθηκών της αντίδρασης. Για
παράδειγμα, αφυδάτωσή του πάνω στον ζεολιθικό καταλύτη
ZSM-5, παρέχει βενζίνη με περιεκτικότητα >80% σε υδρογονάνθρακες
C5 ή μεγαλύτερους. Η
διαδικασία αυτή είναι άμεσα αξιοποιήσιμη στη μετατροπή του
φυσικού αερίου σε υγρά καύσιμα (μεθάνιο →
Syngas →
μεθανόλη →
διμεθυλαιθέρας →
υδρογονάνθρακες >C5) και είναι γνωστή ως
Αέριο-προς-Υγρό διεργασία (Gas to Liquid, GTL)
[Αναφ. 9].
Με
τα καύσιμα GTL πιστεύεται ότι θα καλυφθεί η
επικείμενη εξάντληση των πηγών πετρελαίου μέσω του φυσικού αερίου τα
αποθέματα του οποίου προβλέπεται πως θα διαρκέσουν περισσότερο. 'Ηδη
πραγματοποιήθηκε πτήση επιβατικού αεροπλάνου με μίγμα
(50+50) καυσίμων συμβατικού χαρακτήρα (κηροζίνη)
και συνθετικού καυσίμου GTL
[Αναφ. 9ε].
Ο διμεθυλαιθέρας, πέραν της δυνατότητάς του να
μετατραπεί σε υδρογονάνθρακες με ρυθμιζόμενο αριθμό ανθράκων, μπορεί να
χρησιμοποιηθεί ως πρώτη ύλη για τη σύνθεση άλλων χρήσιμων χημικών ουσιών,
όπως του θειικού μεθυλίου (ισχυρού μεθυλιωτικού αντιδραστηρίου) και οξικού
μεθυλεστέρα με αντιδράσεις όπως:
2 CΗ3OCH3 +
SO3
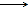 (CH3O)2SO2 CΗ3OCH3 +
CO
(CH3O)2SO2 CΗ3OCH3 +
CO
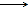 CH3COOCH3
CH3COOCH3
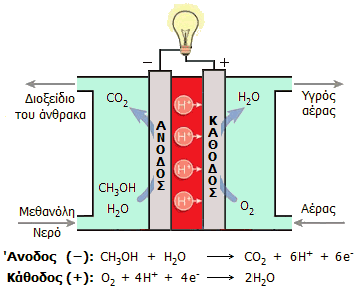 Μπαταρίες
μεθανόλης
Μπαταρίες
μεθανόλης
Μια από τις πλέον σύγχρονες
εφαρμογές της μεθανόλης είναι τα ηλεκτρικά στοιχεία
καυσίμου μεθανόλης (direct methanol fuel cells, DMFC).
Τα στοιχεία καυσίμου μεθανόλης αναπτύχθηκαν από τους
George A. Olah και Surya Praka στο Loker
Hydrocarbon Institute του Πανεπιστημίου της Νότιας
Καλιφόρνιας στις αρχές της δεκαετίας του 1990. Τα στοιχεία
αυτά ήταν μια "επέκταση" των ήδη γνωστών ηλεκτρικών
στοιχείων υδρογόνου [Αναφ.
11].
Τα στοιχεία DMFC, όπως κάθε
άλλο ηλεκτρικό στοιχείο, αποτελούνται από δύο ηλεκτρόδια
(άνοδο και κάθοδο), που χωρίζονται μεταξύ με ένα ηλεκτρολύτη.
Στην άνοδο η μεθανόλη (ως υδατικό διάλυμα περίπου 1 Μ)
οξειδώνεται προς διοξείδιο του άνθρακα. Η άνοδος είναι από
πλέγμα λευκοχρύσου, γεγονός που αυξάνει το κόστος της. 'Ενα
άλλο μειονέκτημα είναι το ότι για να αυξηθεί η απόδοσή τους
πρέπει να λειτουργούν σε κάπως υψηλή θερμοκρασία (50-120
ºC) και να είναι σφραγισμένο υπό πίεση για να μη
διαφύγει η μεθανόλη. Χαμηλότερες θερμοκρασίες λειτουργίας απαιτούν
μεγαλύτερες ποσότητες λευκοχρύσου.
Στην άνοδο οξειδώνεται η
μεθανόλη προς διοξείδιο του άνθρακα με σύγχρονη παραγωγή
υδρογονοκατιόντων. Η άνοδος διαχωρίζεται από την κάθοδο μέσω
μεμβράνης η οποία επιτρέπει τη διέλευση των
υδρογονοκατιόντων (proton
exchange membrane, PEM).
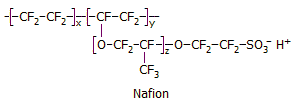 Στην κάθοδο πραγματοποιείται
αναγωγή οξυγόνου (από τον αέρα) κατά την οποία
καταναλώνονται τα διερχόμενα υδρογονοκατιόντα. Η μεμβράνη
είναι κατασκευασμένη από Nafion, ένα σχετικά δαπανηρό υπερφθοριωμένο πολυμερές με όξινες σουλφονικές ομάδες (με
δράση σουπεροξέος, βλέπε:
Χημική ένωση του μήνα: Μαγικό
οξύ), που αυξάνει επιπλέον το κόστος του στοιχείου.
Στην κάθοδο πραγματοποιείται
αναγωγή οξυγόνου (από τον αέρα) κατά την οποία
καταναλώνονται τα διερχόμενα υδρογονοκατιόντα. Η μεμβράνη
είναι κατασκευασμένη από Nafion, ένα σχετικά δαπανηρό υπερφθοριωμένο πολυμερές με όξινες σουλφονικές ομάδες (με
δράση σουπεροξέος, βλέπε:
Χημική ένωση του μήνα: Μαγικό
οξύ), που αυξάνει επιπλέον το κόστος του στοιχείου.
Η μεμβράνη που διαχωρίζει τα δύο ηλεκτρόδια ιδανικά θα έπρεπε να επιτρέπει τη διέλευση
αποκλειστικά και μόνο στα υδρογονοκατιόντα, ωστόσο μικρές ποσότητες μεθανόλης
διαχέονται προς την
κάθοδο με αποτέλεσμα τη μειωμένη ενεργειακή απόδοση του
στοιχείου. Η σημερινή έρευνα στα στοιχεία DMFC εστιάζεται
ιδιαίτερα στην κατασκευή αποτελεσματικότερων και
ανθεκτικότερων μεμβρανών, όπως και στην κατασκευή
ηλεκτροδίων με βελτιωμένες καταλυτικές
ιδιότητες.
Τα στοιχεία DMFC βρίσκονται
ακόμη σε πρώιμο στάδιο ανάπτυξης. Ωστόσο, αυτό δεν εμπόδισε
την εμφάνισή τους στο εμπόριο, όπως και την πιλοτική εφαρμογή
τους από ορισμένες εταιρείες κατασκευής ηλεκτρονικών
συσκευών (κινητά τηλέφωνα, ραδιόφωνα, μαγνητόφωνα). Μέχρι
στιγμής τα στοιχεία αυτά είναι κατάλληλα για παροχή
ηλεκτρικού ρεύματος μικρής σχετικά έντασης αλλά για
μεγαλύτερα χρονικά διαστήματα και έτσι δεν έχουν
χρησιμοποιηθεί ακόμη στην αυτοκίνηση, παρά μόνο σε
ελαφριά οχήματα ειδικής κατασκευής.
Θα πρέπει να σημειωθεί
ότι τα στοιχεία DMFC από άποψη ενεργειακής
πυκνότητας υπερτερούν σαφώς έναντι άλλων πλέον εξελιγμένων
συστημάτων ηλεκτρικών στοιχείων. 'Ετσι, η θεωρητική
ενεργειακή πυκνότητα των DMFC φτάνει τα 5 kWh/L, ενώ οι
μπαταρίες λιθίου έχουν ενεργειακή πυκνότητα 1,5 kWh/L.
Ηλεκτρονικές μικροσυσκευές
(κινητά τηλέφωνα) που λειτουργούν με μπαταρίες
μεθανόλης, εμπορικά διαθέσιμα
συστήματα
μπαταριών μεθανόλης και
όχημα που λειτουργεί με παρόμοιες
μπαταρίες
Εφαρμογές της μεθανόλης στην επεξεργασία
αποβλήτων
 Κατά
την είσοδό τους σε μονάδα επεξεργασίας τα υγρά απόβλητα γενικά περιέχουν
μεγάλες συγκεντρώσεις αμμωνίας. Μέσω βακτηριακής δράσης η αμμωνία
μετατρέπεται σε νιτρικά ανιόντα. Ωστόσο, τα νιτρικά ιόντα είναι ανεπιθύμητα
στα επεξεργασμένα λήμματα. Η παρουσία νιτρικών στα απόβλητα οδηγεί σε
φαινόμενα ευτροφισμού, δηλαδή σε μια υπερβολική ανάπτυξη ορισμένων
αλγών, που μειώνουν τα επίπεδα οξυγόνου προκαλώντας ασφυξία στους υδρόβιους
οργανισμούς και δημιουργούν "νεκρές ζώνες" στους αποδέκτες των λημμάτων.
Κατά
την είσοδό τους σε μονάδα επεξεργασίας τα υγρά απόβλητα γενικά περιέχουν
μεγάλες συγκεντρώσεις αμμωνίας. Μέσω βακτηριακής δράσης η αμμωνία
μετατρέπεται σε νιτρικά ανιόντα. Ωστόσο, τα νιτρικά ιόντα είναι ανεπιθύμητα
στα επεξεργασμένα λήμματα. Η παρουσία νιτρικών στα απόβλητα οδηγεί σε
φαινόμενα ευτροφισμού, δηλαδή σε μια υπερβολική ανάπτυξη ορισμένων
αλγών, που μειώνουν τα επίπεδα οξυγόνου προκαλώντας ασφυξία στους υδρόβιους
οργανισμούς και δημιουργούν "νεκρές ζώνες" στους αποδέκτες των λημμάτων.
Για την απομάκρυνση των νιτρικών ιόντων, τα
επεξεργασμένα λήμματα υπόκεινται στη διαδικασία της
απονιτροποίησης (denitrification), μια συνδυασμένη δράση χημικών ουσιών
και ειδικών βακτηρίων. Κατά την απονιτροποίηση, τα βακτήρια μετατρέπουν τα
νιτρικά ανιόντα σε ακίνδυνο αέριο άζωτο, το οποίο απομακρύνεται στην
ατμόσφαιρα. Η διαδικασία αυτή είναι αναερόβια και απαιτεί μια πηγή
οξειδώσιμου άνθρακα
ως τροφή των βακτηρίων. Η μεθανόλη αποτελεί ιδανική πηγή άνθρακα και με
την παρουσία της επιταχύνει σημαντικά τη δράση τους
[Αναφ. 12]. Η συνολική αντίδραση μπορεί να περιγραφεί ως εξής:
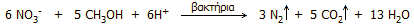
 Τοξικότητα της μεθανόλης
Τοξικότητα της μεθανόλης
Η
μεθανόλη
είναι τοξική ένωση και μπορεί να
εισαχθεί στον ανθρώπινο οργανισμό με κατάποση, εισπνοή ή απορρόφηση από το
δέρμα. Επιδρά άμεσα στο κεντρικό νευρικό σύστημα προκαλώντας κατάπτωση. Η
ίδια η μεθανόλη δεν είναι τοξική, όμως πολύ τοξικά είναι τα προϊόντα διάσπασής
της. Στο ήπαρ, μέσω του ενζύμου αλκοολική αφυδρογονάση (alcohol
dehydrogenase, ADH) οξειδώνεται
προς φορμαλδεΰδη, που προκαλεί τύφλωση με καταστροφή του οπτικού
νεύρου [Αναφ. 13].
Η φορμαλδεΰδη οξειδώνεται
περαιτέρω μέσω του ενζύμου φορμαλδεϋδική αφυδρογονάση (formaldehyde
dehydrogenase) προς
μυρμηκικό οξύ (formic acid), το οποίο σε μεγάλες συγκεντρώσεις προκαλεί
μεταβολική οξέωση και βλάβες στους ιστούς, που μπορούν να οδηγήσουν στο
θάνατο. Ο οργανισμός απαλλάσσεται από το μυρμηκικό οξύ, μέσω της οξειδωτικής
διάσπασής του προς διοξείδιο του άνθρακα.
Ο μεταβολισμός της
μεθανόλης μπορεί να αποδοθεί από την ακόλουθη σειρά αντιδράσεων:

Κατάποση
μεθανόλης σε ποσότητες 1-2 mL ανά kg σωματικού βάρους επιφέρουν το θάνατο,
ενώ μόνιμη τύφλωση μπορεί να επιφέρουν ποσότητες 0,1 mL ανά
kg σωματικού βάρους
(6 έως 10 mL σε ενήλικους). Σε μικρές ποσότητες, δεν προκαλεί βλάβες, αφού
δεν συσσωρεύεται και τα προϊόντα οξείδωσής της αποβάλλονται από τον
οργανισμό. Μικρό ποσοστό (3%) της μεθανόλης αποβάλλεται μέσω της εκπνοής και
των ούρων. Η FDA θεωρεί ως ασφαλή μια ημερήσια πρόσληψη μέχρι 500 mg
μεθανόλης από ενήλικα άτομα [Αναφ. 10].
Η
ευρύτατα χρησιμοποιούμενη γλυκαντική ουσία ασπαρτάμη, είναι μεθυλικός
εστέρας ενός πεπτιδίου και έχει κατηγορηθεί ότι υδρολυόμενη παρέχει μεθανόλη
[βλέπε:
Χημική ένωση του μήνα:
Ασπαρτάμη], που
μπορεί να φτάσει σε τοξικά επίπεδα στον οργανισμό.
Ωστόσο, οι φόβοι αυτοί είναι αβάσιμοι δεδομένης της μικρής ημερήσιας
ποσότητας της προσλαμβανόμενης μεθανόλης από τροφές που περιέχουν ασπαρτάμη. Θα χρειάζονταν περίπου 4,6 g
ασπαρτάμης για να καλυφθεί το ημερήσια επιτρεπτό όριο της μεθανόλης. Ως προς το γλυκαντικό
αποτέλεσμα, η ποσότητα αυτή ισοδυναμεί προς περίπου 900 g ζάχαρης. Θα
πρέπει ακόμη να
σημειωθεί ότι σε μικρές ποσότητες η μεθανόλη αποτελεί φυσικό συστατικό
πολλών φυτικών χυμών.
 Οι πιο συνηθισμένες
περιπτώσεις δηλητηρίασης από μεθανόλη οφείλονται στην πόση νοθευμένων
αλκοολούχων ποτών. Τα αρχικά συμπτώματα δηλητηρίασης είναι κατάπτωση του νευρικού
συστήματος, ίλιγγος, πονοκέφαλος, τάση προς εμετό, προβλήματα στην όραση, εφίδρωση και αναισθησία. Μετά
από 10-30 ώρες από την πρώτη έκθεση επέρχεται οξέωση (acidosis)
λόγω συσσώρευσης τοξικών επιπέδων μυρμηκικών εστέρων στο αίμα και είναι
πλέον πιθανός ο θάνατος λόγω αναπνευστικής ανεπάρκειας.
Οι πιο συνηθισμένες
περιπτώσεις δηλητηρίασης από μεθανόλη οφείλονται στην πόση νοθευμένων
αλκοολούχων ποτών. Τα αρχικά συμπτώματα δηλητηρίασης είναι κατάπτωση του νευρικού
συστήματος, ίλιγγος, πονοκέφαλος, τάση προς εμετό, προβλήματα στην όραση, εφίδρωση και αναισθησία. Μετά
από 10-30 ώρες από την πρώτη έκθεση επέρχεται οξέωση (acidosis)
λόγω συσσώρευσης τοξικών επιπέδων μυρμηκικών εστέρων στο αίμα και είναι
πλέον πιθανός ο θάνατος λόγω αναπνευστικής ανεπάρκειας.
Σε περιπτώσεις δηλητηρίασης ενδείκνυται η
χορήγηση ισχυρού αλκοολούχου ποτού, οπότε η εισαγόμενη στον οργανισμό
αιθανόλη ανταγωνίζεται τη μεθανόλη ως προς τη δράση της αλκοολικής αφυδρογονάσης (το ένζυμο έχει δεκαπλάσια συγγένεια με την αιθανόλη σε σχέση με
τη μεθανόλη) και περιορίζει τα ποσά της παραγόμενης φορμαλδεΰδης. Επίσης,
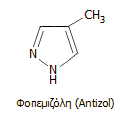
μπορεί να χορηγηθεί με ένεση η φαρμακευτική ουσία
φοπεμιζόλη (εμπορική
ονομασία: Antizol), η οποία αναστέλλει τη δράση της αλκοολικής αφυδρογονάσης.
Η φοπεμιζόλη διατίθεται ως
ειδικό αντίδοτο για δηλητηριάσεις από μεθανόλη και αιθυλενογλυκόλη
(που βρίσκεται στα αντιψυκτικά διαλύματα και είναι συχνή αιτία θανάτων από
δηλητηριάσεις) και συνιστάται να είναι πάντοτε διαθέσιμη προς χορήγηση σε
βιομηχανικές μονάδες και εργαστήρια, όπου γίνεται συνεχής χρήση μεθανόλης,
όπως και σε πρατήρια τα οποία τη διαθέτουν ως καύσιμο.
Βιβλιογραφία - Πηγές από το
Διαδίκτυο
1.
(α) Merck Index, 12th ed, σελ. 1018. (β)
Wikipedia: "Methanol".
(γ) MindFiesta.com: "Methanol".
(δ) Methanex Corporation (Canada): "Technical Information & Safe Handling Guide
for Methanol", Version 3.0, September 2006 (Αρχείο
PDF, 1,55 MB). (ε) PhysOrg.com: "Astronomers
find alcohol cloud spanning 288 billion miles", April, 2006.
2. (α) Luke H (chestofbooks.com):
"The
Engineer's and Mechanic's Encyclopaedia". (β)
Simmonds C (chestofbooks.com):
"Alcohol,
Its Production, Properties, Chemistry, and Industrial Applications".
(γ) Ελαιουργική ΑΕ: "Η πυρόλυση ως μέθοδος εναλλακτικής επεξεργασίας της
βιομάζας", Απρίλιος 2007 (αρχείο
PDF, 197 KB).
3.
Aasberg-Petersen K,
Nielsen CS, Dybkjær I,
Perregaard J (Haldor Topsoe Catalysts, Co):
"Large Scale Methanol Production from Natural Gas", (αρχείο
PDF, 388 KB).
4.
(α)
BionomicFuel.com: "Syngas
from Burning Waste Materials as New Energy Source". (β)
Department of Energy (USA): "Gasifipedia:
Gasification in Detail". (γ) Wikipedia: "Syngas".
(δ) Wikipedia: "FischerTropsch
process". (ε) Max Planck Society: "The
Return of a Classic to Fuel Production", December, 2005
(αρχείο
PDF 159 KB).
5. (α) Wikipedia:
"Green
Methanol Synthesis".
(β) Bain RL: "Material and Energy Balances for Methanol from Biomass Using
Biomass Gasifiers", National Renewable Energy Laboratory (NREL), January
1992 (αρχείο
PDF, 3,36 MB). (γ) Environmental Protection Agency
(EPA) USA: "Methyl
Tertiary Butyl Ether". (δ) www.water-research.net: "Methyl
Tertiary Butyl Ether MTBE Well/Groundwater Contamination Issues".
6.
(α) SRI
consulting: "Methanol
(abstract)". (β) Institute for the Analysis of Global
Security (IAGS): "Sources
of Methanol". (γ) Institute for the Analysis of Global Security (IAGS):
"EU study:
Methanol from Biomass - Competitive with Gasoline".
7. (α)
Alabama Cooperative
Extension System (Alabama AGM and Auburn Universities): "Small-scale
Biodiesel Production: Safety Considerations".
(β) ChemistryLand.com: "Biodiesel
Homepage: 'Small Scale Production'". (γ) Virginia Cooperative
Extension System: "Small-Scale
Biodiesel Production: Safety, Fuel Quality, and Waste Disposal
Considerations".
(δ) Nelson B: "Biodiesel
corrosion could cause leaks in fuel infrastructure",
Mother Nature Network, June 2,
2010. (ε) Biodiesel Education Network: "Frequently
Asked Questions".
8. (α)
Metzger JO: "Κριτική για το βιβλίο των
Olah GA, Goeppert A, and Surya Prakash GK: 'Beyond
Oil and Gas: The Methanol Economy',
Wiley-VCH, Weinheim 2006"
Angewandte Chemie International Edition
45:
5045-5047, 2006,
αρχείο PDF 481 KB).
(β) Olah GA: "Beyond Oil and Gas: The Methanol Economy",
Angewandte Chemie
International Edition, 44:2636-2639,
2005 (αρχείο
PDF, 89 KB).
(γ)
Bullis K: "The
Methanol Economy",
Technology Review (MIT), March, 2006. (δ)
Wikipedia: "Methanol
Economy". (ε) Blue Fuel Energy: "Renewable
Electricity to Low-Carbon Fuels", 2009.
9.
(α)
UOP Petrochemicals LLC: "UOP/HYDRO
MTO Process Methanol to Olefins Conversion",
2004 (αρχείο
PDF, 434 KB). (β)
Joseph S, Shah YT: "IA Methanol to Gasoline Process",
Chemical and Petroleum Engineering Department,
University of Pittsburgh (αρχείο
PDF, 1,70 MB). (γ)
Wikipedia: "Gas
to Liquids". (δ) ChemSystems (Pepr Program): "Dimethyl Ether
Technology and Markets", PEPR07/08-S3, December 2008 (αρχείο
PDF 144 KB). (ε) DownStream.com: "Qatar
Airways Makes GTL History"
(Oct. 13, 2009). (στ) Lee S (Missuri University of Science and
Technology): "Dimethyl
Ether Synthesis and Conversion to Value-Added Chemicals".
10.
Olah GA, Suray Prakash
GK, Goeppert
A: "Chemical Recycling of Carbon Dioxide to Methanol and Dimethyl Ether:
From Greenhouse Gas to Renewable, Environmentally Carbon Neutral Fuels
and Synthetic Hydrocarbons".
Journal of Organic Chemistry
74(2): 487-498, 2009 (αρχείο
PDF, 659 KB).
[Εξαιρετικό άρθρο με πλήθος πληροφοριών πάνω στο
θέμα της Οικονομίας της Μεθανόλης]
11.
(α) Wikipedia: "Direct methanol fuel
cell". (β) MIT Media Relations: "MIT
creates new material for fuel cells",
May 16, 2008. (γ) FCtec.com: "Fuel
Cell Basics:
Direct Methanol Fuel Cells (DMFC)".
(δ) Machine-Histrory.com: "Direct
Methanol Fuel Cell (DMFC)". (ε)
Wikipedia: "Nafion".
12. (α) Methanol Institute: "Wastewater
Treatment with Methanol Denitrification" (αρχείο
PDF, 104 KB). (β) Sperl GT, Hoare DS: "Denitrification with Methanol: a
Selective Enrichement for Hyphomicrobium Species", Journal of
Bacteriology, 108(2):733-736, 1971 (αρχείο
PDF, 474 KB). (γ) Brian K, Pratt S,
Gapes D, Shilton: "Investigation into Methanol as a Carbon Source for
Denitrification in Wastewater Treatment", Rotorua Wastewater Treatment Plant,
New Zealand, πρακτικά συνεδρίου, 2007, (αρχείο
PDF, 203 KB).
13.
(α) Becker CE:
"Methanol poisoning", J Emerg Med 1:51-58, 1983
(PubMed).
(β)
Jaconbsen D, McMartin KE: "Methanol and ethylene glycol
poisoning. Mechanism of toxicity, clinical course, diagnosis and
treatment", Med Toxicol 1:309-334, 1986 (PubMed).
(γ) No author: "Agency for Toxic Substances and Disease Registry.
Methanol Toxicity", Am Fam Physician 47: 163-171, 1993 (PubMed).
(δ) Brent J, McMartin K, Phillips S,
Aaron C, Kulig K: "Fomepizole for
the treatment of methanol poisoning", N. Engl J Med 344:424-429, 2001.
(ε)
Lanigan S: "Final report on the safety assessment of Methyl alcohol.
Review", Int J Toxicol 20 (Suppl. 1): 57-85, 2001
(PubMed).
(στ) Kostic MA, Dart RC:
"Rethinking the toxic methanol level.
Review", J Toxicol Clin Toxicol 41:793-800, 2003 (PubMed).
(ζ)
McMahon DM, Winstead S, Weant KA: "Toxic alcohol
ingestion: focus on ethylene glycol and methanol. Review", Adv Emerg Nurs
31: 206-213, 2009 (PubMed).
(η) Antizol.com: "Antizol
(Fomepizol) Injections: Mechanism of Action". (θ) International
Program on Chemical Safety (INCHEM): "Methanol".
(ι) Methanol.org: "Methanol in fuel cell
vehicles: Human toxicity and risk evaluation (Revised)", 2001, (αρχείο
PDF 135 KB)
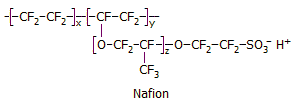 Στην κάθοδο πραγματοποιείται
αναγωγή οξυγόνου (από τον αέρα) κατά την οποία
καταναλώνονται τα διερχόμενα υδρογονοκατιόντα. Η μεμβράνη
είναι κατασκευασμένη από Nafion, ένα σχετικά δαπανηρό υπερφθοριωμένο πολυμερές με όξινες σουλφονικές ομάδες (με
δράση σουπεροξέος, βλέπε:
Χημική ένωση του μήνα: Μαγικό
οξύ), που αυξάνει επιπλέον το κόστος του στοιχείου.
Στην κάθοδο πραγματοποιείται
αναγωγή οξυγόνου (από τον αέρα) κατά την οποία
καταναλώνονται τα διερχόμενα υδρογονοκατιόντα. Η μεμβράνη
είναι κατασκευασμένη από Nafion, ένα σχετικά δαπανηρό υπερφθοριωμένο πολυμερές με όξινες σουλφονικές ομάδες (με
δράση σουπεροξέος, βλέπε:
Χημική ένωση του μήνα: Μαγικό
οξύ), που αυξάνει επιπλέον το κόστος του στοιχείου. 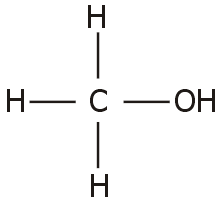




 Το
Syngas (synthesis gas, synthetic gas, SNG) [στα Ελληνικά αποδίδεται ως
αέριο σύνθεσης ή συνθετικό αέριο] είναι προϊόν μια θερμοχημικής μετατροπής κατά την
οποία κάθε είδος άνθρακα, οργανικής ύλης και βιομάζας υπόκειται σε υψηλή
θερμοκρασία σε συνδυασμένη δράση υδρατμών και οξυγόνου και παρέχει μίγμα
υδρογόνου, μονοξειδίου και διοξειδίου του άνθρακα με βάση τις γενικές
αντιδράσεις [
Το
Syngas (synthesis gas, synthetic gas, SNG) [στα Ελληνικά αποδίδεται ως
αέριο σύνθεσης ή συνθετικό αέριο] είναι προϊόν μια θερμοχημικής μετατροπής κατά την
οποία κάθε είδος άνθρακα, οργανικής ύλης και βιομάζας υπόκειται σε υψηλή
θερμοκρασία σε συνδυασμένη δράση υδρατμών και οξυγόνου και παρέχει μίγμα
υδρογόνου, μονοξειδίου και διοξειδίου του άνθρακα με βάση τις γενικές
αντιδράσεις [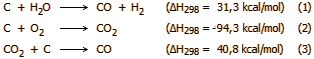


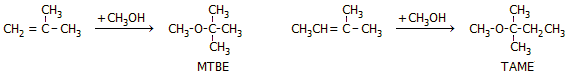
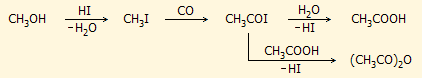






 Τα αποθέματα των ορυκτών καυσίμων δεν είναι
ανεξάντλητα. Σήμερα, το πετρέλαιο, το φυσικό αέριο και οι
γαιάνθρακες συνεισφέρουν το 35%, το 21% και το 23%
της ενέργειας που χρειάζεται ο παγκόσμιος πληθυσμός. Τα γνωστά και
οικονομικώς αξιοποιήσιμα αποθέματά τους επαρκούν -με τους σημερινούς
ρυθμούς κατανάλωσης- για περίπου 40, 60 και 170 χρόνια,
αντιστοίχως.
Τα υλικά αυτά χρειάστηκαν να περάσουν εκατομμύρια έτη και να
πραγματοποιηθούν μεγάλης έκτασης γεωλογικές αναστατώσεις για να δημιουργηθούν
από την αρχαία βιομάζα,
αλλά απ' ό,τι φαίνεται λίγες εκατονταετίες ανθρωπίνων δραστηριοτήτων θα είναι αρκετές για να
τα εξαντλήσουν σχεδόν πλήρως.
Τα αποθέματα των ορυκτών καυσίμων δεν είναι
ανεξάντλητα. Σήμερα, το πετρέλαιο, το φυσικό αέριο και οι
γαιάνθρακες συνεισφέρουν το 35%, το 21% και το 23%
της ενέργειας που χρειάζεται ο παγκόσμιος πληθυσμός. Τα γνωστά και
οικονομικώς αξιοποιήσιμα αποθέματά τους επαρκούν -με τους σημερινούς
ρυθμούς κατανάλωσης- για περίπου 40, 60 και 170 χρόνια,
αντιστοίχως.
Τα υλικά αυτά χρειάστηκαν να περάσουν εκατομμύρια έτη και να
πραγματοποιηθούν μεγάλης έκτασης γεωλογικές αναστατώσεις για να δημιουργηθούν
από την αρχαία βιομάζα,
αλλά απ' ό,τι φαίνεται λίγες εκατονταετίες ανθρωπίνων δραστηριοτήτων θα είναι αρκετές για να
τα εξαντλήσουν σχεδόν πλήρως.





 Πλεονεκτήματα της
μεθανόλης έναντι του υδρογόνου. Τα πλεονεκτήματα της μεθανόλης
έναντι του υδρογόνου συνοψίζονται στα εξής:
Πλεονεκτήματα της
μεθανόλης έναντι του υδρογόνου. Τα πλεονεκτήματα της μεθανόλης
έναντι του υδρογόνου συνοψίζονται στα εξής:







 Διμεθυλαιθέρας. Ο διμεθυλαιθέρας είναι ένα σχετικά
σύγχρονο προϊόν με ιδιαίτερη οικονομική σημασία και παράγεται
πλέον σε ποσότητες εκατοντάδων χιλιάδων τόνων ετησίως. Τον συναντούμε σε διάφορα
καταναλωτικά προϊόντα π.χ. ως προωθητικό αέριο σε διάφορα σπρέυ, σε
αντικατάσταση των απαγορευμένων πλέον χλωροφθορανθράκων. Επίσης,
παρουσιάζει μεγάλο ενδιαφέρον ως καύσιμο ανάλογο με το LPG
(Liquified Petroleum Gas, δηλ. υγροποιημένο προπάνιο ή βουτάνιο υπό ελαφρά πίεση, το γνωστό υγραέριο) με
το οποίο μπορεί εύκολα να αναμιχθεί. 'Ηδη ορισμένες αυτοκινητοβιομηχανίες
κατασκεύασαν οχήματα κινούμενα με διμεθυλαιθέρα [
Διμεθυλαιθέρας. Ο διμεθυλαιθέρας είναι ένα σχετικά
σύγχρονο προϊόν με ιδιαίτερη οικονομική σημασία και παράγεται
πλέον σε ποσότητες εκατοντάδων χιλιάδων τόνων ετησίως. Τον συναντούμε σε διάφορα
καταναλωτικά προϊόντα π.χ. ως προωθητικό αέριο σε διάφορα σπρέυ, σε
αντικατάσταση των απαγορευμένων πλέον χλωροφθορανθράκων. Επίσης,
παρουσιάζει μεγάλο ενδιαφέρον ως καύσιμο ανάλογο με το LPG
(Liquified Petroleum Gas, δηλ. υγροποιημένο προπάνιο ή βουτάνιο υπό ελαφρά πίεση, το γνωστό υγραέριο) με
το οποίο μπορεί εύκολα να αναμιχθεί. 'Ηδη ορισμένες αυτοκινητοβιομηχανίες
κατασκεύασαν οχήματα κινούμενα με διμεθυλαιθέρα [ Μπαταρίες
μεθανόλης
Μπαταρίες
μεθανόλης




 Κατά
την είσοδό τους σε μονάδα επεξεργασίας τα υγρά απόβλητα γενικά περιέχουν
μεγάλες συγκεντρώσεις αμμωνίας. Μέσω βακτηριακής δράσης η αμμωνία
μετατρέπεται σε νιτρικά ανιόντα. Ωστόσο, τα νιτρικά ιόντα είναι ανεπιθύμητα
στα επεξεργασμένα λήμματα. Η παρουσία νιτρικών στα απόβλητα οδηγεί σε
φαινόμενα ευτροφισμού, δηλαδή σε μια υπερβολική ανάπτυξη ορισμένων
αλγών, που μειώνουν τα επίπεδα οξυγόνου προκαλώντας ασφυξία στους υδρόβιους
οργανισμούς και δημιουργούν "νεκρές ζώνες" στους αποδέκτες των λημμάτων.
Κατά
την είσοδό τους σε μονάδα επεξεργασίας τα υγρά απόβλητα γενικά περιέχουν
μεγάλες συγκεντρώσεις αμμωνίας. Μέσω βακτηριακής δράσης η αμμωνία
μετατρέπεται σε νιτρικά ανιόντα. Ωστόσο, τα νιτρικά ιόντα είναι ανεπιθύμητα
στα επεξεργασμένα λήμματα. Η παρουσία νιτρικών στα απόβλητα οδηγεί σε
φαινόμενα ευτροφισμού, δηλαδή σε μια υπερβολική ανάπτυξη ορισμένων
αλγών, που μειώνουν τα επίπεδα οξυγόνου προκαλώντας ασφυξία στους υδρόβιους
οργανισμούς και δημιουργούν "νεκρές ζώνες" στους αποδέκτες των λημμάτων.








