Λίστα "Χημικών Ενώσεων του Μήνα"
Η χημική ένωση του
μήνα
[Ιούνιος
2009]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής
-
Κωνσταντίνος
Ευσταθίου, Καθηγητής
|
Φυσικoχημικές ιδιότητες:
Εμφάνιση:
Κρυσταλλικό
στερεό (εξαγωνικό σύστημα κρυστάλλωσης)
Ινσουλίνη ανθρώπου
[Αναφ. 1]:
Μοριακός τύπος:
C257H383N65O77S6
Σχετική μοριακή μάζα:
5807,7
Βόεια ινσουλίνη:
Μοριακός τύπος:
C254H377N65O75S6
Σχετική μοριακή μάζα:
5733,6
Χοίρεια ινσουλίνη:
Μοριακός τύπος:
C256H381N65O76S6
Σχετική μοριακή μάζα:
5777,6
Ισοηλεκτρικό σημείο (pH): 5,30 - 5,35
Ευδιάλυτη
σε αραιά διαλύματα οξέων και βάσεων
|
 |
|
Ινσουλίνη
Insulin
|
 Σύντομη ιστορία της ανακάλυψης της ινσουλίνης
[Αναφ. 2,
3]
Σύντομη ιστορία της ανακάλυψης της ινσουλίνης
[Αναφ. 2,
3]
Η ανακάλυψη της ινσουλίνης και του ρόλου της στο μεταβολισμό,
η απομόνωσή της και η θεραπευτική χρήση της συνιστούν μια επιστημονική εποποιία, που
διήρκεσε περίπου 100 χρόνια. Η διάθεση φθηνής ινσουλίνης και σε απεριόριστες
πλέον
ποσότητες έχει σώσει μέχρι σήμερα εκατομμύρια ασθενείς όλων των ηλικιών από τον
σακχαρώδη διαβήτη (diabetes mellitus) και
από τις διάφορες παράπλευρες ασθένειες που προκαλεί η νόσος αυτή, όπως και από πρόωρο θάνατο.
Η
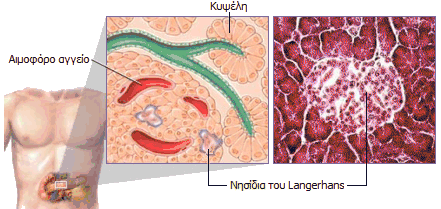
ιστορία της ινσουλίνης ξεκίνησε το 1869. 'Ενας φοιτητής ιατρικής
του Πανεπιστημίου του Βερολίνου, ο
Paul
Langerhans (1847-1888) εξετάζοντας στο μικροσκόπιο
τομές παγκρεατικού ιστού (δεξιά) εντόπισε κάποιες άγνωστες μέχρι τότε
συστάδες (clusters) κυττάρων, δεν μπόρεσε όμως να διαπιστώσει τον φυσιολογικό τους
ρόλο. Οι συστάδες αυτές ονομάστηκαν αργότερα
νησίδια του
Langerhans
(Langerhans'
islets) και είναι συναθροίσεις κυττάρων κάποια από τα οποία παράγουν και εκκρίνουν
(μεταξύ άλλων) ινσουλίνη. Η ινσουλίνη εκκρίνεται μέσω των αιμοφόρων
αγγείων απ' ευθείας στο αίμα, σε αντίθεση με τη μέχρι τότε γνωστή έκκριση
παγκρεατικού υγρού (μίγμα πεπτικών ενζύμων) στο δωδεκαδάκτυλο.
Το 1889, ο Πολωνο-Γερμανός γιατρός Oscar Minkowski (1858-1931) σε
συνεργασία με τον
Joseph von Mering
(1849-1908)
αφαίρεσαν το πάγκρεας από
ένα σκύλο για να διαπιστώσουν το ρόλο του στη διαδικασία της πέψης. Στη συνέχεια διαπίστωσαν ότι
τα ούρα του σκύλου περιείχαν αφύσικα μεγάλη συγκέντρωση σακχάρου (γλυκόζης). Από το γεγονός αυτό
έβγαλαν το συμπέρασμα ότι το πάγκρεας εμπλέκεται στο μεταβολισμό των υδατανθράκων και
πως θα πρέπει να
σχετίζεται με τη νόσο του διαβήτη. Το 1901, ο
Eugene
Lindsay Opie
(1873-1971), στο Johns Hopkins,
διαπίστωσε ότι ο διαβήτης συνδέεται με τα νησίδια του
Langerhans,
αφού η καταστροφή
τους οδηγούσε στην εμφάνιση της νόσου. Κατά τις επόμενες δύο δεκαετίες
οι γιατροί και ερευνητές σε όλο τον κόσμο προσπάθησαν να διερευνήσουν το έκκριμα των νησιδίων
του
Langerhans.
Το 1911-1912 ο ερευνητής
Ernest Lyman Scott
(1877-1966) στο Πανεπιστήμιο του Σικάγου, χρησιμοποίησε εκχυλίσματα παγκρέατος σε
πειραματόζωα και παρατήρησε μια μικρή μείωση του σακχάρου στα ούρα, αλλά δεν
μπόρεσε
να πείσει τον διευθυντή του εργαστηρίου για την σπουδαιότητα της ανακάλυψης
αυτής ώστε να συνεχίσει τις προσπάθειές του. Παρόμοια αποτελέσματα είχε το 1919 και ο ερευνητής
Israel Kleiner
(Πανεπιστήμιο
Rockefeller,
ΗΠΑ), αλλά οι έρευνες εκείνη την περίοδο ήταν δύσκολο να συνεχιστούν λόγω του Α' Παγκόσμιου Πολέμου.
Το 1921, ο καθηγητής
Φυσιολογίας του Πανεπιστημίου Ιατρικής και Φαρμακευτικής στο Βουκουρέστι
(Ρουμανία)
Nicolae Paulescu
(1869-1931) υπήρξε ο πρώτος που προσπάθησε να απομονώσει την ινσουλίνη από
το πάγκρεας, την οποία είχε ονομάσει παγκρεΐνη (pancrein).
Ο Paulescu δημοσίευσε σχετικές εργασίες και απέκτησε πατέντα της τεχνικής του στη
Ρουμανία, η οποία όμως δεν χρησιμοποιήθηκε κλινικά
[Αναφ. 4].
Το 1920, ο Καναδός χειρούργος
Frederick Banting (1876-1935) μελετώντας τις
εργασίες του Minkowski θεώρησε ότι η απομόνωση
με εκχύλιση
μια καθαρής «ουσίας» από το πάγκρεας θα μπορούσε να βοηθήσει στη ρύθμιση του
σακχάρου των διαβητικών. To 1921 ταξίδεψε στο Τορόντο για να συναντήσει τον
John
James Richard Macleod
(1876-1935),
καθηγητή Φυσιολογίας στο Πανεπιστήμιο του Τορόντο.
Ο Banting ζήτησε από τον Macleod
να χρησιμοποιήσει το εργαστήριό του για πειράματα. O Macleod αρχικά υπήρξε
διστακτικός,
τελικά όμως του παραχώρησε το εργαστήριό του για την καλοκαιρινή περίοδο, αφού ο ίδιος θα έλλειπε σε διακοπές στη Σκωτία. Επιπλέον, διέθεσε στον Banting δύο
φοιτητές-βοηθούς του εργαστηρίου του, τον Charles Best
και τον
Clark
Noble, για να τον βοηθήσουν στα πειράματα,
όπως επίσης
και δέκα σκύλους ως πειραματόζωα. Ο Banting ήθελε μόνο ένα βοηθό και με κλήρωση
ανέλαβε κατά το πρώτο ήμισυ των διακοπών ο Best και κατά το δεύτερο ο Noble. Το
αποτέλεσμα της κλήρωσης υπήρξε άτυχο για τον Noble, αφού μετά την
επιτυχία των πρώτων πειραμάτων ο Banting αποφάσισε να κρατήσει τον Best και για
το υπόλοιπο διάστημα της έρευνας.
Με πειράματα στους
σκύλους οι Banting
και
Best,
κατάφεραν να απομονώσουν ποσότητες
(ακάθαρτης) ινσουλίνης από τα νησίδια Langerhans, (την οποία ονόμασαν
isletin).
Με ενέσεις αυτού του εκχύλισματος
κατάφεραν να διατηρήσουν στη ζωή μια σκύλα (με το όνομα Alpha) από την οποία
είχαν αφαιρέσει το πάγκρεας.
|
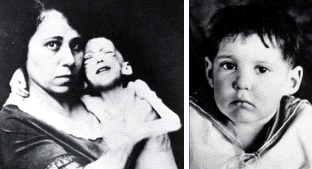
Το
θαύμα της ινσουλίνης: Αριστερά: παιδί που πάσχει από νεανικό διαβήτη
στα πρόθυρα του θανάτου (φωτογραφία 15/12/1922). Δεξιά: το ίδιο παιδί
μετά από θεραπευτική αγωγή με ινσουλίνη (φωτογραφία 15/2/1923)
[Αναφ. 2β]. |
Το φθινόπωρο του 1921,
οι Banting και Best παρουσίασαν
τα αποτελέσματα στον Macleod, οποίος πρότεινε
περισσότερα πειράματα και χρήση καλύτερων επιστημονικών οργάνων και τεχνικών. Τα
πειράματα που ακολούθησαν είχαν μεγάλη επιτυχία και δημοσιεύθηκαν σε επιστημονικά περιοδικά.
Η διαδικασία εκχύλισης της ινσουλίνης ήταν χρονοβόρα και αναγκάσθηκαν να
χρησιμοποιήσουν μεγάλες ποσότητες παγκρέατος εμβρύων βοών (fetal calf) με καλύτερα αποτελέσματα.
Οι δυσκολίες εντοπίζονταν κυρίως στις ακαθαρσίες των εκχυλισμάτων που
δημιουργούσαν πάντοτε έντονες αλλεργικές αντιδράσεις στα πειραματόζωα.
Στον
καθαρισμό της ινσουλίνης ανεκτίμητη υπήρξε η συμβολή του βιοχημικού
James Collip. Τα
πειράματα σε ανθρώπους άρχισαν τον Ιανουάριο του 1922. Θα πρέπει να σημειωθεί ότι
εκείνη την εποχή η διάγνωση νεανικού διαβήτη ισοδυναμούσε με θανατική
καταδίκη του ασθενούς και κάθε θεραπευτική αγωγή που θα παρέτεινε τη ζωή του
θα ισοδυναμούσε με ιατρικό θαύμα. Χορήγησαν ινσουλίνη στον 14χρονο διαβητικό
Leonard
(Lenny) Thompson, που βρισκόταν σε κώμα στο Γενικό Νοσοκομείο του Τορόντο, αλλά επειδή η ινσουλίνη
δεν ήταν πολύ καθαρή προκάλεσε έντονα αλλεργικά φαινόμενα στον ασθενή. Ο Collip
εργάστηκε νυχθημερόν επί 12 ημέρες για να καθαρίσει την ινσουλίνη και η χορήγηση
της επόμενη
δόσης υπήρξε εξαιρετικά επιτυχής, χωρίς παρενέργειες και ρύθμισε πολύ καλά το σακχάρου του
Lenny. Η γλυκόζη στο αίμα του νεαρού ασθενή από τα 520 mg/dL
μειώθηκε
στα 120 mg/dL. O Lenny, υπήρξε ο πρώτος ασθενής με νεανικό διαβήτη που επιβίωσε
χάρις στην ινσουλίνη και έζησε μια φυσιολογική ζωή μέχρι τα 27 του χρόνια, οπότε
πέθανε από άλλα αίτια (πνευμονία) [Αναφ. 2γ].
Η είδηση έκανε τον γύρο όλου του κόσμου, οι νεαροί ασθενείς
διαβητικοί με τους γονείς συγκεντρώνονται στο νοσοκομείο και η ομάδα
Banting,
Best
και
Collip
πηγαίνουν από κρεβάτι σε κρεβάτι
και χορηγούν ενέσεις ινσουλίνη με εκπληκτικά αποτελέσματα. 'Ολοι οι ασθενείς
συνέρχονται από το διαβητικό κώμα. Η ανακάλυψη
της ινσουλίνης και θεραπευτική αγωγή με ινσουλίνη των διαβητικών υπήρξε ένα
από τα σημαντικότερα ιατρικά επιτεύγματα και έχει μείνει ως
πρωτοφανές γεγονός στην ιστορία της θεραπευτικής ιατρικής και φαρμακολογίας. Το
1922 η μέθοδος εκχύλισης της ινσουλίνης βελτιώθηκε και άρχισε να παράγεται σε μεγάλες ποσότητες, αλλά ακόμη η καθαρότητά της ήταν
περιορισμένη.
 Από
το άρθρο του Harold Ward Dudley (του
1923): "XLII. THE PURIFICATION OF INSULIN AND SOME OF ITS
PROPERTIES"
[Αναφ. 3] Από
το άρθρο του Harold Ward Dudley (του
1923): "XLII. THE PURIFICATION OF INSULIN AND SOME OF ITS
PROPERTIES"
[Αναφ. 3]
"... Το
δραστικό κλάσμα, που μπορούμε να ονομάσουμε "ακάθαρτη
ινσουλίνη", έχει τη μορφή λευκής υγροσκοπικής σκόνης
που διαλύεται εύκολα στο νερό, παρέχοντας ένα ανοικτοκίτρινο διάλυμα
ελαφρά όξινο ως προς δείκτη ηλιοτροπίου. Η απόδοση ποικίλει
σημαντικά, αλλά η μέση απόδοση από 21 παρτίδες (βόειου παγκρέατος) συνολικού βάρους 103,6 kg
ήταν 0,718 g/kg. Η μέτρηση
της δραστικότητας αυτών των παρασκευασμάτων βασίζεται στη
"μονάδα κουνελιού Τορόντο", η οποία αντιστοιχεί στη δόση που
όταν εισαχθεί με υποδόρια ένεση σε κουνέλι 2
kg που
είναι νηστικό για 16-24 ώρες, χαμηλώνει το επίπεδο σακχάρου
στο αίμα του από τη φυσιολογική τιμή που είναι περίπου 0,1%
στα περίπου 0,04% που προκαλούν τυπικές υπογλυκαιμικές συσπάσεις μέσα σε 4 ώρες"
|
|

Ο
Nicolae Paulescu (1869-1931). Ρουμάνος καθηγητής της Ιατρικής,
πραγματοποίησε πειράματα με παγκρε- ατικό εκχύλισμα. Το έργο του
φαίνεται ότι παραβλέφθηκε από τους Banting και Macleod "εξ αιτίας
μεταφραστικού λάθους" |
Απονομή βραβείου Nobel.
Η ανακάλυψη της ινσουλίνης το
1922 αποτέλεσε ένα από τα σημαντικότερα γεγονότα στην ιστορία της ιατρικής και φαρμακευτικής.
Το
1923 η επιτροπή των Βραβείων Νόμπελ απένειμε το Βραβείο Ιατρικής και Φυσιολογίας
στους
Banting
και
MacLeod. Ο Banting
θεώρησε ως αδικία το ότι δεν απονεμήθηκε το βραβείο και στον Charles Best και με δική του πρωτοβουλία μοιράζεται τα
χρήματα του βραβείου μαζί του. Επίσης, ο
McLeod
μοιράζεται το βραβείο του με τον
Collip,
ο οποίος εργάσθηκε εντατικά στον καθαρισμό της ινσουλίνης και συνέβαλε
αποφασιστικά στα
θεραπευτικά αποτελέσματα. Οι ερευνητές θεωρούν ότι θα ήταν ανήθικη
εκ μέρους τους η χρηματική εκμετάλλευση των ερευνητικών αποτελεσμάτων και πωλούν τα δικαιώματά τους (πατέντα) στο Πανεπιστήμιο του Τορόντο
συμβολικά για ένα δολλάριο.
'Ηταν αναμενόμενο να ακολουθήσουν και
άλλες διαμαρτυρίες για τη μη απονομή βραβείων σε επιστήμονες που
ασχολήθηκαν νωρίτερα με την απομόνωση και μελέτη της ινσουλίνης. Ιδιαίτερη
περίπτωση φαίνεται να αποτελεί εκείνη του Ρουμάνου καθηγητή
Nicolae Paulescu.
Αναφέρεται ότι οι Benting και Best
προς τιμήν τους, αναγνώρισαν αργότερα ότι η εκ μέρους τους περιγραφή ως "αρνητικών"
ορισμένων δημοσιευμένων αποτελεσμάτων του Paulescu με παγκρεατικό εκχύλισμα,
υπήρξε αποτέλεσμα κακής μετάφρασης των άρθρων του Ρουμάνου
ερευνητή και εξέφρασαν τη λύπη
και την αναγνώρισή τους στο έργο του Paulescu.
Βιομηχανική παραγωγή ινσουλίνης.
Η αποτυχία των πρώτων
πειραμάτων εκχύλισης της ινσουλίνης από το πάγκρεας ζώων οφειλόταν στα
πρωτεολυτικά ένζυμα του οργάνου αυτού που κατέστρεφαν την ορμόνη. Η παρασκευή καθαρής ινσουλίνης από
εκχυλίσεις τεμαχισμένου παγκρέατος με διάφορους διαλύτες παρουσίαζε
δυσεπίλυτα
προβλήματα (όξινα ή βασικά διαλύματα νερού, ακετόνης, μεθανόλης ή αιθανόλης). Ο καθαρισμός επιτυγχάνεται με αλκοόλη, κατά την ισοηλεκτρική
καταβύθιση, ή με εξαλάτωση και άλλες τεχνικές. Η παραλαβή καθαρής ινσουλίνης για
φαρμακευτικούς σκοπούς στα πρώτα χρόνια της χρήσης της γινόταν με εκχύλιση από πάγκρεας βοειδών ή χοίρων
που παραλάμβαναν σε μεγάλες ποσότητες από σφαγεία.
Η φαρμακευτική εταιρεία
Eli Lilly
προσφέρθηκε να βοηθήσει στην παραγωγή μεγάλων
ποσοτήτων ινσουλίνης μεγαλύτερης καθαρότητας. Μέσα σε λίγους μήνες
η παραγωγή καθαρής ινσουλίνης επιτεύχθηκε σε εργοστασιακή κλίμακα σε μεγάλες
ποσότητες και άρχισε η εμπορική παραγωγή της και η διάθεσή της σε νοσοκομεία
(1923). Η ινσουλίνη που λαμβάνονταν από το πάγκρεας διαφόρων ζώων ήταν ο μόνος
τύπος ινσουλίνης στο εμπόριο επί πολλά χρόνια.
Το 1961 έγινε η παρασκευή του
πρώτου ουδέτερου διαλύματος ινσουλίνης, αλλά το 1982 επιτεύχθηκε η πρώτη
παραγωγή βιοσυνθετικής ανθρώπινης ινσουλίνης με τεχνικές ανασυνδυασμένου DNA από την εταιρεία Eli
Lilly. Το 1996 το πρώτο βιοσυνθετικό
ανάλογο ταχείας δράσης ινσουλίνης (Lispro)
Eli
από την εταιρία Eli
Lilly
ξεκίνησε την εμπορική της διάθεση.
Ινσουλίνη παράγει εδώ και πολλές δεκαετίες
και η φαρμακευτική εταιρεία
Novo Nordisk στη Δανία. Ο καθηγητής
Φυσιολογίας στο Πανεπιστήμιο της Κοπεγχάγης
August Krogh (Βραβείο Νόμπελ Φυσιολογίας και
Ιατρικής, 1920) του οποίου η γυναίκα ήταν διαβητική πήγε στην Αμερική το 1922
και άκουσε μια ομιλία των
Banting και
Best
για την ανακάλυψη και τη φαρμακευτική χρήση της ινσουλίνης και τελικά πήρε την
έγκριση για την παραγωγή ινσουλίνης στη Δανία. 'Ιδρυσε την εταιρεία
Nordisk
και άρχισε την παραγωγή
ινσουλίνης από βόειο πάγκρεας. Από το 1925 η εταιρεία διαθέτει ινσουλίνη στο
εμπόριο και με τον καιρό εξελίχθηκε σε διεθνή εταιρεία παραγωγής και πώλησης
ινσουλίνης.
Αμινοξέα: Οι
δομικοί λίθοι των πρωτεϊνών
Τα αμινοξέα είναι
οργανικά οξέα που περιέχουν μια αμινομάδα (-ΝΗ2)
σε α-θέση ως προς την καρβοξυλική ομάδα (-COOH), δηλαδή
έχουν τον γενικό τύπο H2NCHRCOOH,
όπου R είναι μια οργανική ομάδα. Τα διάφορα αμινοξέα
διαφέρουν μόνο ως προς την ομάδα R, που μπορεί να είναι
(στην απλούστερη περίπτωση) ένα άτομο υδρογόνου (στο αμινοξύ
γλυκίνη) έως μια μεγάλη ετεροκυκλική ομάδα (στο
αμινοξύ θρυπτοφάνη). Ο γενικός τύπος H2NCHRCOOH
δεν ισχύει μόνο για το αμινοξύ προλίνη, που διαθέτει μια
δευτεροταγή αμινομάδα (-ΝΗ-).
Τα κύρια αμινοξέα
που χρησιμοποιούνται από τα κύτταρα για τη βιοσύνθεση των
πρωτεϊνών είναι 20. Οι χημικοί τύποι των αμινοξέων αυτών, η
ονομασία τους, όπως και οι δύο τρόποι συντομογραφίας τους
(με 3 και 1 γράμματα) δείχνονται παρακάτω (περισσότερες
πληροφορίες πληροφορίες για τις συντομογραφίες των αμινοξέων
μπορούν να αναζητηθούν στην [Αναφ.
5]).
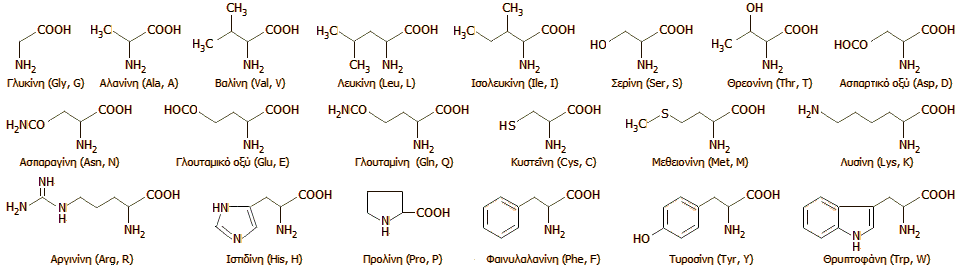
[Παρατήρηση:
Συχνά, τα
πρωτεϊνογόνα
αμινοξέα,
αναφέρονται ως
21, αν ληφθεί
υπόψη και η
σεληνοκυστεΐνη
(selenocysteine),
με την ίδια δομή
της κυστεΐνης,
αλλά με Se στη
θέση του S, ένα
αμινοξύ που
συναντάται
σπανίως σε
ορισμένες
πρωτεΐνες. Στα
αμινοξέα που
συνθέτουν τις
πρωτεΐνες (όχι
όμως "πρωτεϊνογόνα")
περιλαμβάνονται
δύο
επιπλέον
αμινοξέα, που
είναι προϊόντα
οξείδωσης
πρωτεϊνογόνων
αμινοξέων: η
3-υδροξυ-προλίνη
(2-hydroxy-proline) προϊόν
υδροξυλίωσης της
προλίνης) και η
κυστίνη
(cystine) προϊόν
οξειδωτικού διμερισμού της
κυστεΐνης.]
Κατάταξη αμινοξέων σε ομάδες
Τα αμινοξέα κατατάσσονται σε κατηγορίες
ανάλογα με διάφορες ιδιότητές τους
(βιοχημικές-διατροφικές, χημικές):
Διατροφική σημασία: 'Ολα τα αμινοξέα
είναι απαραίτητα για τη βιοσύνθεση
πρωτεϊνών, ωστόσο ανάλογα με τον οργανισμό,
πολλά αμινοξέα μπορούν να βιοσυντεθούν από
άλλα μόρια, ενώ άλλα πρέπει να ληφθούν
oπωσδήποτε μέσω της τροφής (ως προϊόντα
αποικοδόμησης των προσλαμβανόμενων φυτικών ή
ζωικών πρωτεϊνών), διότι είτε βιοσυντίθενται
σε πολύ μικρότερες από τις απαιτούμενες
ποσότητες είτε και καθόλου. Τα πρώτα
αναφέρονται ως μη απαραίτητα αμινοξέα
(non-essential amino acids) και τα δεύτερα
ως απαραίτητα αμινοξέα (essential
amino acids). Για τον άνθρωπο, τα μη
απαραίτητα αμινοξέα είναι τα: Ala, Arg,
Asn, Asp, Cys, Gln, Glu, Gly, His, Pro, Ser,
Tyr, ενώ απαραίτητα είναι τα: Ile, Leu,
Lys, Met, Phe, Thr, Trp, Val. Ωστόσο, θα πρέπει να σημειωθεί ότι η διάκριση αυτή δεν είναι
απόλυτη, δεδομένου ότι ορισμένα μη
απαραίτητα αμινοξεά (όπως τα: Arg, Cys, His
και Tyr) μπορούν να θεωρηθούν
ως απαραίτητα για νεαρά άτομα, στα οποία δεν έχουν
αναπτυχθεί πλήρως οι μηχανισμοί βιοσύνθεσής
τους.
Ουδέτερα-όξινα-βασικά αμινοξέα: Τα
αμινοξέα, ανάλογα με τη χημική φύση της
ομάδας R (παρουσία όξινων ή βασικών ομάδων)
διακρίνονται σε ουδέτερα, όξινα
και βασικά. Ουδέτερα αμινοξέα
είναι τα: Ala, Asn, Cys, Gln, Gly, Ile, Leu,
Met, Phe, Pro, Ser, Thr, Try, Tyr, όξινα
είναι τα: Asp, Glu και βασικά είναι
τα: Arg, His, Lys.
Απολικά-πολικά αμινοξέα: Ανάλογα με
την παρουσία ή απουσία πολικών ομάδων στην
ομάδα R, τα αμινοξέα κατατάσσονται σε
απολικά (non-polar) και πολικά (polar)
αμινοξέα. Απολικά αμινοξέα είναι τα:
Ala, Cys, Gly, Ile, Leu, Met, Phe, Ser, Try,
Val και πολικά είναι τα: Arg, Asn,
Asp, Gln, Glu, His, Lys, Ser, Thr, Tyr.
|
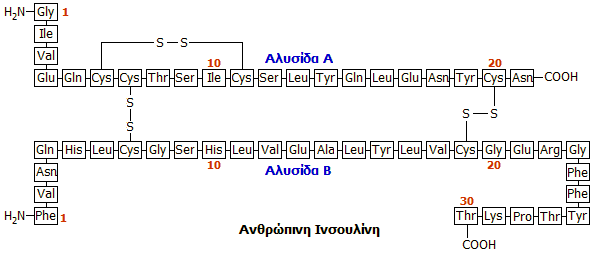
Δομή της ινσουλίνης
|

Ο
Frederick
Sanger (1918-).
Βρετανός βιοχημικός, Καθηγητής στο Πανεπιστήμιο του
Cambridge.
Τιμήθηκε δύο φορές με το Βραβείο Nobel Χημείας. Το
1958 για τη μέθοδο προδιορισμού της
αλληλουχίας αμινοξέων σε πρωτεΐ-νες (και ειδικά της ινσουλίνης) και
το 1980 για τη μέθοδο προσδιορισμού της αλληλουχίας βάσεων
στο DNA. |
Η ακολουθία των αμινοξέων και η
δομή της ινσουλίνης προσδιορίσθηκε από τον καθηγητή
Frederick
Sanger
στο Πανεπιστήμιο του
Cambridge,
στην Αγγλία και περιγράφεται σε μια σειρά 9 επιστημονικών δημοσιεύσεών του κατά
το χρονικό διάστημα 1949-1953. Η ανακάλυψη αυτή θεωρήθηκε ως ένα από τα σημαντικότερα
επιστημονικά επιτεύγματα εκείνης της εποχής και ο Sanger τιμήθηκε με το βραβείο
Nobel Χημείας του 1958. Να σημειωθεί ότι το 1980 ο Sanger (με τους
Paul Berg και
Walter Gilbert) τιμήθηκε για δεύτερη φορά με το βραβείο Nobel για τη συνεισφορά
του στον προσδιορισμό της αλληλουχίας των βάσεων στο DNA.
Ο προσδιορισμός της
αλληλουχίας βασιζόταν στη χρήση του αντιδραστηρίου
1-φθορο-2,4-δινιτροβενζολίου (FDNB), μετέπειτα γνωστού ως αντιδραστηρίου
Sanger. Το FDNB αντιδρά με την εκτεθειμένη (ελεύθερη) αμινοομάδα της
πολυπεπτιδικής αλυσίδας κάτω από ήπιες συνθήκες (αντίδραση 1).
Με υδρόλυση αποσπάται εύκολα το
2,4-δινιτροφαινυλο-παράγωγο (DNP-παράγωγο)
του πρώτου αμινοξέος (αντίδραση 2), η ταυτότητα του
οποίου προσδιορίζεται στη συνέχεια με χρωματογραφία χάρτου.
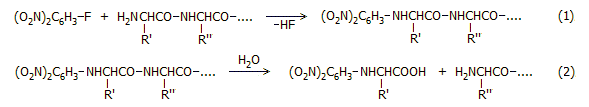
|

Η
Dorothy Crowfoot Hodgkin (1910-1994).
Βρετανή χημικός (Πανεπιστήμιο Οξφόρδης).
Το 1964 τιμήθηκε με το Βραβείο Nobel Χημείας για την εργασία
της στον τομέα προσδιορισμού της δομής πρωτεϊνών με κρυσταλλογραφία
ακτίνων Χ. |
Η διαδικασία επαναλαμβάνεται για τα υπόλοιπα
αμινοξέα της πεπτιδικής αλυσίδας. Αν και η αρχή της μεθόδου είναι απλή, στην πράξη οι πειραματικές δυσκολίες είναι σημαντικές.
Ο Sanger επέλεξε την ινσουλίνη για να δοκιμάσει τη
μέθοδό του, επειδή ήταν μια σχετικά μικρή πρωτεΐνη, σχεδόν στο όριο μεταξύ
πεπτιδίων και πρωτεϊνών (συμβατικά το όριο αυτό είναι τα 50 αμινοξέα) και υπήρχε σε πολύ καθαρή
(κρυσταλλική) κατάσταση. Το μοριακό βάρος της είχε προσδιορισθεί γύρω στο
12.000, το οποίο εκ των υστέρων διαπιστώθηκε ότι ήταν περίπου διπλάσιο από το
πραγματικό, εξαιτίας της τάσης της ινσουλίνης να σχηματίζει σταθερά μη-ομοιοπολικά διμερή.
Ο Sanger πραγματοποίησε υδρόλυση της
ινσουλίνης κάτω από διαφορετικές συνθήκες (με HCl ή χυμοθρυψίνη), οπότε το μόριό της
"κοβόταν" σε διαφορετικά σημεία δίνοντας κάθε φορά διαφορετικά πεπτίδια.
Διαχώριζε και καθάριζε τα πεπτίδια με χρωματογραφία δύο διαστάσεων (με ηλεκτροφόρηση ως
προς τη μία διάσταση και με χρωματογραφία ως προς την άλλη) και προχωρούσε στον
επίπονο προσδιορισμό της αλληλουχίας τους των επιμέρους πεπτιδίων με το FDNB. Συνδυάζοντας τις
δομές-αλληλουχίες των διαφόρων πεπτιδίων, ο Sanger εξακρίβωσε την
ορθή δομή της ινσουλίνης, γεγονός πρωτοποριακό για την εποχή εκείνη
[Αναφ. 6].
Η ινσουλίνη είναι πολυπεπτιδική
ορμόνη, μια σχετικά "μικρή" πρωτεΐνη, που αποτελείται από δύο πεπτιδικές αλυσίδες (Α και Β) που περιέχουν
συνολικά 51 αμινοξέα, 21
αμινοξέα στην Α
αλυσίδα και 30 αμινοξέα στη Β αλυσίδα. Από τα 20 κοινά αμινοξέα των πρωτεϊνών
δεν διαθέτει τα αμινοξέα θρυπτοφάνη (Try) και μεθειονίνη (Met). Διαθέτει τρεις δισουλφιδικές
γέφυρες (-S-S-) από τις οποίες οι δύο συγκρατούν τις δύο αλυσίδες. Οι δύο
αλυσίδες μπορούν να χωρισθούν εύκολα με διάνοιξη των -S-S- γεφυρών με οξείδωση
(ο Sanger χρησιμοποίησε για τον σκοπό αυτό υπερμυρμηκικό οξύ, HCOOOH). Καμία από τις δύο αλυσίδες χωριστά δεν εμφανίζει
κάποια φυσιολογική δραστικότητα και επομένως η δράση της ινσουλίνης οφείλεται
στη συνολική διαμόρφωση του μορίου της (τριτοταγής δομή) και όχι στα επιμέρους
συστατικά της πεπτίδια ή αμινοξέα.
H
ινσουλίνη υπήρξε η πρώτη πρωτεΐνη της οποίας προσδιορίσθηκε η
τριτοταγής κρυσταλλική δομή. Η μελέτη πραγματοποιήθηκε το 1969 με
κρυσταλλογραφία ακτίνων Χ από την
Dorothy Crowfoot Hodgkin
(1910-1994), στο Πανεπιστήμιο
της Οξφόρδης. Ο προσδιορισμός
αυτός υπήρξε σημαντικό επίτευγμα για εκείνη την εποχή, που δεν υπήρχαν ηλεκτρονικοί
υπολογιστές να διεξάγουν τους απαιτούμενους δύσκολους υπολογισμούς. Για το
επιστημονικό αυτό επίτευγμα αλλά και για
άλλους προσδιορισμούς δομών με την ίδια τεχνική (πενικιλλίνης το 1949, βιταμίνης Β-12
το 1955), η Hodgin τιμήθηκε με το
Βραβείο Nobel Χημείας το 1964 [Αναφ.
7].
Η ινσουλίνη σε υδατικό διάλυμα
σχηματίζει σταθερά μη-ομοιοπολικά διμερή, αλλά υπάρχουν ακόμη, τετραμερή και
εξαμερή. Τα τελευταία σταθεροποιούνται ιδιαίτερα
παρουσία ιόντων ψευδαργύρου. Ωστόσο, η φυσιολογικώς
δραστική μορφή της ινσουλίνης είναι μόνο η μονομερής. Ο σχηματισμός εξαμερούς παρουσία
ψευδαργύρου, αλλά και συνθέτων συμπλεγμάτων με απλές πρωτεΐνες (όπως η πρωταμίνη)
αξιοποιούνται φαρμακευτικά για την παραγωγή ινσουλινών "βραδείας αποδέσμευσης"
και αυξημένης διάρκειας δράσης [Αναφ.
8].
|

(α) |
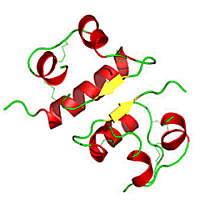
(β) |
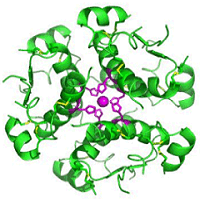
(γ) |
|
(α): Μονομερές
ινσουλίνης (βιολογικώς δραστική μορφή). (β) Διμερές ινσουλίνης (η
κυριότερη μορφή σε υδατικό διάλυμα. (γ) Εξαμερές ινσουλίνης
συγκρατούμενο από δύο ιόντα Zn(II) που
συμπλέκονται μέσω της ιστιδίνης της β-αλυσίδας
(Β10-His) [Αναφ.
8β].
|
Δομικές διαφορές στις
ινσουλίνες διαφόρων οργανισμών: Οι ινσουλίνες που λαμβάνονται από διάφορα ζώα
διατηρούν ίδια τη γενική δομή και διαφέρουν μόνο ως προς λίγα αμινοξέα που καταλαμβάνουν ορισμένες θέσεις,
όπως δείχνεται στο επόμενο σχήμα και πίνακα [Αναφ.
8γ]:
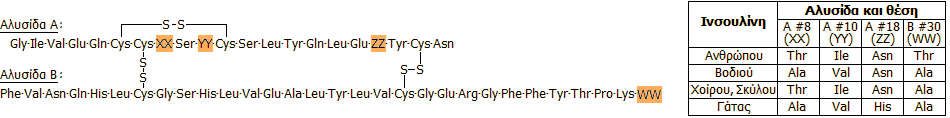
Η κούρσα για τη σύνθεση της
ινσουλίνης
Κατά την περίοδο 1963-1966
πολλά ερευνητικά εργαστήρια εργάζονταν εντατικά για τη σύνθεση της
ινσουλίνης. Στην Γερμανία, το 1963 ο
Meienhofer και οι
συνεργάτες του συνθέσανε την ινσουλίνη [Αναφ.
9α]. Το 1966 και μετά από
χρόνια εντατικής έρευνας οι Κινέζοι και στο αποκορύφωμα της "Πολιτιστικής
Επανάστασης" πέτυχαν την ολική σύνθεση της κρυσταλλικής βοείου ινσουλίνης. Οι
Κινέζοι επιστήμονες ανέφεραν ότι στην επιτυχία αυτή βοήθησε αποφασιστικά η "σκέψη του Μάο"
(!) [Αναφ. 9β].
|

Κρύσταλλοι ινσουλίνης που αναπτύχθηκαν στο διάστημα (σε συνθήκες
έλλειψης βαρύτητας) το 1998 (Φωτογραφία από
ιστοσελίδα της NASA). |
Την ίδια περίοδο, στην κούρσα της
συνθετικής ινσουλίνης συμμετείχαν και διάφορες ερευνητικές ομάδες στις ΗΠΑ.
Το 1966 ο χημικός Παναγιώτης Κατσόγιαννης
(Διευθυντής
του Τμήματος Βιοχημείας στο
Medical Research Center of
Brookhaven National
Laboratory,
Upton,
Νέα Υόρκη,
ΗΠΑ,
διδάκτορας του Τμήματος Χημείας
του Πανεπιστημίου Αθηνών, υπό την επίβλεψη του Καθηγητή Λεωνίδα Ζέρβα)
μετά από την επιτυχή σύνθεση της ινσουλίνης του προβάτου, πέτυχε τη σύνθεση της
ανθρώπινης ινσουλίνης συνδέοντας τις αλυσίδες Α και Β με τις δύο δισουλφιδικές
ομάδες [Αναφ. 9γ-δ].
Είναι αυτονόητο ότι η πλήρης
σύνθεση της ινσουλίνης (αλλά και πολλών άλλων πρωτεϊνών) αποτελεί πραγματικό
επιστημονικό άθλο και θρίαμβο της συνθετικής χημείας, ωστόσο οι μεγάλες
ποσότητες της απαιτούμενης ινσουλίνης δεν θα ήταν δυνατόν να καλυφθούν από
οποιοδήποτε σχήμα ολικής σύνθεσης με βάση τις αρχές της πεπτιδικής σύνθεσης. 'Ετσι,
ενώ αρχικά η ινσουλίνη λαμβανόταν (κυρίως) από το πάγκρεας βοοειδών,
σήμερα ουσιαστικά στο σύνολό της η ινσουλίνη (και μάλιστα η "ανθρώπινη" ινσουλίνη)
παράγεται σε μεγάλες ποσότητες και προσιτό κόστος με βιοτεχνολογικές μεθόδους.
"Ανασυνδυασμένη"
ή "Ανθρώπινη" ινσουλίνη: H
ευρύτατα πλέον χορηγούμενη ανθρώπινη ινσουλίνη (human
insulin) δεν λαμβάνεται από τα β-κύτταρα του ανθρώπινου παγκρέατος, αλλά
παράγεται σε βιομηχανική κλίμακα από γενετικώς τροποποιημένα βακτήρια E. coli ή κύτταρα ζύμης με ανθρώπινα γονίδια συνδεμένα στο γονιδίωμά
τους. Παράγονται και
απομονώνονται οι δύο αλυσίδες (Α και Β) της ινσουλίνης από δύο διαφορετικά κλωνοποιημένα E. coli ή κύτταρα ζύμης και στη συνέχεια "συνενώνονται" στο
εργαστήριο μέσω των δεσμών S-S.
Η πρώτη "ανθρώπινη" ινσουλίνη
από κλωνοποιημένα E. coli παρασκευάστηκε το 1982 από την εταιρεία
Lilly στις ΗΠΑ. Την ίδια χρονιά, μια "ημισυνθετική ανθρώπινη" ινσουλίνη
παρασκευάστηκε επίσης από ινσουλίνη χοίρου με αντικατάσταση της αλανίνης της
θέσης Β30 με θρεονίνη από την εταιρεία Novo Industrie AS, Hoechst.
Η
"ανθρώπινη" ινσουλίνη θα έπρεπε θεωρητικά να προκαλεί μικρότερες ανοσογονικές
αντιδράσεις στον άνθρωπο, όμως οι κλινικές μελέτες δεν απέδειξαν κάτι τέτοιο. Σε σύγκριση
όμως με τη βόειο ή άλλες ινσουλίνες ζωικής προέλευσης, η ανθρώπινη είναι "ταχύτερη" ως προς τη φυσιολογική δράση
[Αναφ. 10α-β].
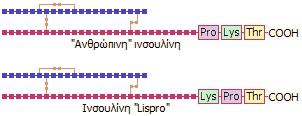 "Τροποποιημένες" ινσουλίνες: Είναι νεότεροι τύποι ινσουλινών. Η
σύνθεσή τους ξεκινάει από την ανασυνδυασμένη "ανθρώπινη" ινσουλίνη με αλλαγές
στην αλληλουχία αμινοξέων σε περιοχές που δεν έχουν "φυσιολογική" σημασία και
επομένως η δομή τους διαφέρει από τη φυσική ανθρώπινη ινσουλίνη. Τυπικό
παράδειγμα είναι η ινσουλίνη Humalog (ινσουλίνη lispro), όπου έχει
αντιστροφή η αλληλουχία των Β28-Β29 αμινοξέων από Pro-Lys σε Lys-Pro. Αυτή η
φαινομενικά μικρή τροποποίηση αποσταθεροποιεί το διμερές της φυσικής ινσουλίνης,
με αποτέλεσμα την άμεση διαθεσιμότητα του φυσιολογικά δραστικού μονομερούς και
επομένως διευκολύνει την ταχύτερη απορρόφησή του μέσω των τριχοειδών αιμοφόρων αγγείων.
'Ετσι δρα ταχύτερα, οπότε και η δράση της διαρκεί λιγότερο
[Αναφ. 10γ]. 'Αλλοι τροποποιημένοι
τύποι ινσουλίνης (aspart, glulisine, glargine) αναφέρονται παρακάτω στους
"τύπους ινσουλίνης".
"Τροποποιημένες" ινσουλίνες: Είναι νεότεροι τύποι ινσουλινών. Η
σύνθεσή τους ξεκινάει από την ανασυνδυασμένη "ανθρώπινη" ινσουλίνη με αλλαγές
στην αλληλουχία αμινοξέων σε περιοχές που δεν έχουν "φυσιολογική" σημασία και
επομένως η δομή τους διαφέρει από τη φυσική ανθρώπινη ινσουλίνη. Τυπικό
παράδειγμα είναι η ινσουλίνη Humalog (ινσουλίνη lispro), όπου έχει
αντιστροφή η αλληλουχία των Β28-Β29 αμινοξέων από Pro-Lys σε Lys-Pro. Αυτή η
φαινομενικά μικρή τροποποίηση αποσταθεροποιεί το διμερές της φυσικής ινσουλίνης,
με αποτέλεσμα την άμεση διαθεσιμότητα του φυσιολογικά δραστικού μονομερούς και
επομένως διευκολύνει την ταχύτερη απορρόφησή του μέσω των τριχοειδών αιμοφόρων αγγείων.
'Ετσι δρα ταχύτερα, οπότε και η δράση της διαρκεί λιγότερο
[Αναφ. 10γ]. 'Αλλοι τροποποιημένοι
τύποι ινσουλίνης (aspart, glulisine, glargine) αναφέρονται παρακάτω στους
"τύπους ινσουλίνης".
Τροποποιημένες
ινσουλίνες έχουν παρασκευασθεί κατά καιρούς για ερευνητικούς σκοπούς, όπως π.χ.
για τη διαπίστωση της χρησιμότητας κάθε αμινοξέος των
πεπτιδικών αλυσίδων. Ακόμη, η τροποποίηση μπορεί να έγκειται στην
προσκόλληση στο μόριο λιπόφιλων ομάδων (π.χ. με ακυλίωση των ελεύθερων
αμινοομάδων). Μια "λιπόφιλη" ινσουλίνη θα μπορούσε να απορροφηθεί από το έντερο,
ανοίγοντας έτσι τον δρόμο στην από το στόμα χορήγηση σε κατάλληλη φαρμακευτική
μορφή. H φυσική ινσουλίνη είναι αδύνατον να ληφθεί από το στόμα,
αφού θα
καταστραφεί στο στομάχι υπό την επίδραση του υδροχλωρικού οξέος και των
πρωτεολυτικών ενζύμων [Αναφ. 10δ].
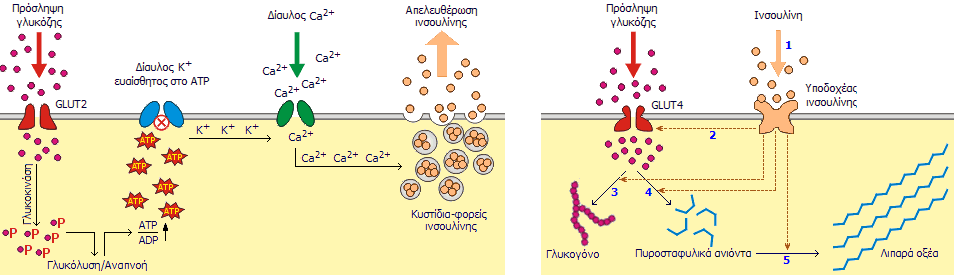
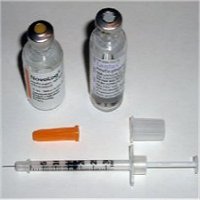
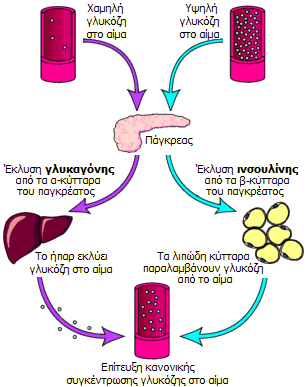 Ο βιολογικός ρόλος της
ινσουλίνης
Ο βιολογικός ρόλος της
ινσουλίνης
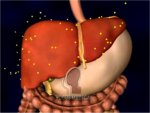
Η ινσουλίνη και η γλυκαγόνη
(glucagon) είναι πολυπεπτιδικές ορμόνες οι οποίες εκκρίνονται απ' ευθείας στην
κυκλοφορία του αίματος από το πάγκρεας (ενδοκρινείς ορμόνες). Με τις δύο αυτές
ορμόνες ρυθμίζεται η συγκέντρωση γλυκόζης στο αίμα, που κατά μέσον όρο πρέπει να
παραμένει σε μια στενή περιοχή (70 mg/dL έως 110 mg/dL). Και οι δύο ορμόνες
παράγονται στα νησίδια Langerhans
του παγκρέατος και έχουν ακριβώς αντίθετη δράση, γεγονός στο οποίο
οφείλεται και η ρυθμιστική τους ικανότητα. 'Ενα αρκετά απλουστευμένο σχήμα που
δείχνει τον κεντρικό ρόλο του παγκρέατος στη ρύθμιση της γλυκόζης παρουσιάζεται στο σχήμα αριστερά
[Αναφ. 11].
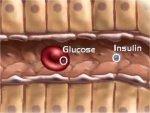
Η ινσουλίνη εκκρίνεται
από τα β-κύτταρα που αποτελούν το 60-85% των κυττάρων των νησιδίων Langerhans. Tα
β-κύτταρα "διεγείρονται" από τα μόρια γλυκόζης και η δράση της
είναι ξεκάθαρα αναβολική. 'Οσο αυξάνει η συγκέντρωση γλυκόζης στο αίμα, τόσο
αυξάνει ο ρυθμός έκκρισης ινσουλίνης. Με τη σειρά της η ινσουλίνη διευκολύνει την πρόσληψη
γλυκόζης από τα περισσότερα είδη κυττάρων του οργανισμού, όπως τα μυικά κύτταρα, τα ερυθρά
αιμοσφαίρια και τα λιπώδη κύτταρα (adipocytes). Χωρίς την ινσουλίνη
τα κύτταρα αυτά δεν μπορούν να προσλάβουν γλυκόζη που αποτελεί την κύρια πηγή
χημικής ενέργειας. Επιπλέον, η ινσουλίνη προκαλεί
την "αποταμίευση" γλυκόζης στα κύτταρα και κυρίως στο ήπαρ υπό τη μορφή γλυκογόνου (glycogen).
Εάν το ήπαρ "κορεσθεί" σε γλυκογόνο, η γλυκόζη
αρχίζει να κατευθύνεται στα λιπώδη κύτταρα όπου χρησιμοποιείται για τη σύνθεση λιπαρών οξέων και γλυκερόλης και τελικά τριγλυκεριδίων.
Η ινσουλίνη "καθοδηγεί" τα κύτταρα, όταν αυτά αναζητούν ενέργεια, να
καταναλώσουν γλυκόζη αντί λιπαρών οξέων και επομένως εμπλέκεται στους
μηχανισμούς συσσώρευσης λίπους στο σώμα. Πέραν της εμπλοκής της ινσουλίνης στο ισοζύγιο σακχάρου/λίπους, η ινσουλίνη
διευκολύνει την πρόσληψη αμινοξέων για σχηματισμό πρωτεϊνών, ενώ η έλλειψή της
(όπως π.χ. σε καταστάσεις νηστείας) οδηγεί σε κατανάλωση και αλλοίωση των
ενδοκυτταρικών πρωτεϊνών.
Η
γλυκαγόνη εκκρίνεται
από τα α-κύτταρα των παγκρεατικών νησιδίων και η δράση της είναι ξεκάθαρα
καταβολική. Αντίθετα με την ινσουλίνη, η έκκρισή της διεγείρεται από την
πτώση της συγκέντρωσης γλυκόζης του αίματος. Η
έκκρισή της ενισχύεται από ορισμένα αμινοξέα και από τη μυική δραστηριότητα. Η
γλυκαγόνη αυξάνει τη στάθμη γλυκόζης στο αίμα επειδή διασπά το αποταμιευμένο στο
ήπαρ (κυρίως) και στους μυς προς
γλυκόζη. Επιπλέον, ενεργοποιεί τη λιπόλυση στους λιπώδεις ιστούς με αποτέλεσμα την αποδέσμευση λιπαρών οξέων στην
κυκλοφορία
[Αναφ. 11γ].
|
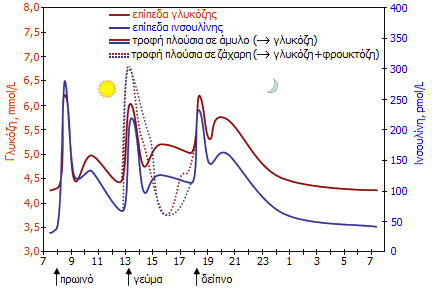
Τυπικές
διακυμάνσεις των συγκεντρώσεων της γλυκόζης και της ινσουλίνης στο
αίμα ενός υγιούς ατόμου κατά τη διάρκεια της ημέρας
[Αναφ. 2δ]. |
Σύνοψη των πολλαπλών
φυσιολογικών
δράσεων της ινσουλίνης:
Στον μεταβολισμό: (1) 'Ελεγχος της πρόσληψης
ορισμένων ουσιών και κυρίως της γλυκόζης από τους μυικούς και τους λιπώδεις ιστούς.
(2) Ενίσχυση των μηχανισμών αντιγραφής του DNA και της πρωτεϊνοσύνθεσης μέσω
ελέγχου της πρόσληψης αμινοξέων. (3) Τροποποίηση της δραστικότητας πολλών
ενζύμων.
Η δράση της στα κύτταρα περιλαμβάνει: (1) Ενίσχυση
του μηχανισμού σύνθεσης γλυκογόνου και αποθήκευσής του. (2) Ενίσχυση των
μηχανισμών σύνθεσης λιπαρών οξέων και τριγλυκεριδίων στα λιπαρά
κύτταρα. (3) Περιορίζει τη διάσπαση των πρωτεϊνών. (4) Περιορίζει τον σχηματισμό
γλυκόζης από μη υδατανθρακικά μόρια. (5) Περιορίζει τις βλάβες που υφίστανται
οργανίδια των κυττάρων. (6) Βελτιώνει την πρόσληψη αμινοξέων. (7) Βοηθά στην
πρόσληψη καλίου από τα κύτταρα και έτσι μειώνει τη συγκέντρωσή του στο αίμα. (8) Χαλαρώνει τον μυικό τόνο, αυξάνει τη ροή αίματος ιδιαίτερα μέσω των μικροαρτηριών. (9) Βοηθά
στην έκκριση υδροχλωρικού οξέος από τα επιθηλιακά καλυπτήρια
κύτταρα (parietal
cell) του στομάχου.
Ασθένειες που
σχετίζονται με τη μειωμένη έκκριση ινσουλίνης:
Χωρίς καμία αμφιβολία, η σπουδαιότερη μεταβολική
νόσος του ανθρώπου, ο σακχαρώδης διαβήτης (diabetes mellitus) είναι
αποτέλεσμα έλλειψης ινσουλίνης. Και όχι μόνο στον άνθρωπο, αλλά στους σκύλους
και τις γάτες. Οι δύο κυριότερες μορφές της νόσου είναι
[Αναφ. 12]:
-
Διαβήτης τύπου Ι ή
ινσουλινοεξαρτώμενος σακχαρώδης διαβήτης. Είναι αποτέλεσμα ανεπάρκειας ινσουλίνης. Εμφανίζεται
κυρίως κατά την παιδική ηλικία και οφείλεται
σε βλάβη των β-κυττάρων του παγκρέατος. Αυτό είναι αποτέλεσμα
επίθεσης του ανοσοποιητικού συστήματος στον ίδιο τον οργανισμό και επομένωςι αποτελεί
"αυτοάνοσο" νόσο. Ο διαβήτης τύπου Ι ελέγχεται
αποτελεσματικά με χορήγηση ινσουλίνης. Με τον έλεγχο
της γλυκόζης του αίματος, με τη χορήγηση ινσουλίνης και τον έλεγχο της
διατροφής ελαχιστοποιούνται οι πιθανότητες μελλοντικών βλαβών στα αιμοφόρα αγγεία,
στα νεύρα και στα διάφορα όργανα, επιτρέποντας έτσι στους πάσχοντες να έχουν μια
φυσιολογική
ζωή.
 Από
το άρθρο του Harold Ward Dudley (του
1923): "XLII. THE PURIFICATION OF INSULIN AND SOME OF ITS
PROPERTIES"
[Αναφ. 3]
Από
το άρθρο του Harold Ward Dudley (του
1923): "XLII. THE PURIFICATION OF INSULIN AND SOME OF ITS
PROPERTIES"
[Αναφ. 3]







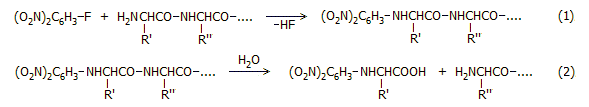




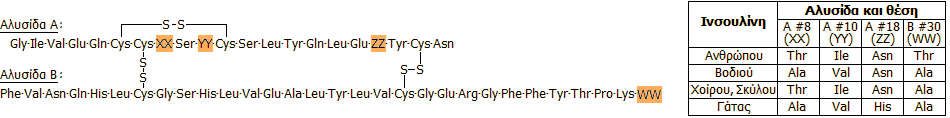

 "Τροποποιημένες" ινσουλίνες: Είναι νεότεροι τύποι ινσουλινών. Η
σύνθεσή τους ξεκινάει από την ανασυνδυασμένη "ανθρώπινη" ινσουλίνη με αλλαγές
στην αλληλουχία αμινοξέων σε περιοχές που δεν έχουν "φυσιολογική" σημασία και
επομένως η δομή τους διαφέρει από τη φυσική ανθρώπινη ινσουλίνη. Τυπικό
παράδειγμα είναι η ινσουλίνη Humalog (ινσουλίνη lispro), όπου έχει
αντιστροφή η αλληλουχία των Β28-Β29 αμινοξέων από Pro-Lys σε Lys-Pro. Αυτή η
φαινομενικά μικρή τροποποίηση αποσταθεροποιεί το διμερές της φυσικής ινσουλίνης,
με αποτέλεσμα την άμεση διαθεσιμότητα του φυσιολογικά δραστικού μονομερούς και
επομένως διευκολύνει την ταχύτερη απορρόφησή του μέσω των τριχοειδών αιμοφόρων αγγείων.
'Ετσι δρα ταχύτερα, οπότε και η δράση της διαρκεί λιγότερο
[
"Τροποποιημένες" ινσουλίνες: Είναι νεότεροι τύποι ινσουλινών. Η
σύνθεσή τους ξεκινάει από την ανασυνδυασμένη "ανθρώπινη" ινσουλίνη με αλλαγές
στην αλληλουχία αμινοξέων σε περιοχές που δεν έχουν "φυσιολογική" σημασία και
επομένως η δομή τους διαφέρει από τη φυσική ανθρώπινη ινσουλίνη. Τυπικό
παράδειγμα είναι η ινσουλίνη Humalog (ινσουλίνη lispro), όπου έχει
αντιστροφή η αλληλουχία των Β28-Β29 αμινοξέων από Pro-Lys σε Lys-Pro. Αυτή η
φαινομενικά μικρή τροποποίηση αποσταθεροποιεί το διμερές της φυσικής ινσουλίνης,
με αποτέλεσμα την άμεση διαθεσιμότητα του φυσιολογικά δραστικού μονομερούς και
επομένως διευκολύνει την ταχύτερη απορρόφησή του μέσω των τριχοειδών αιμοφόρων αγγείων.
'Ετσι δρα ταχύτερα, οπότε και η δράση της διαρκεί λιγότερο
[ Ο βιολογικός ρόλος της
ινσουλίνης
Ο βιολογικός ρόλος της
ινσουλίνης