 Ιστορικά
και γενικά στοιχεία για το μυρμηκικό οξύ
[Αναφ. 1]
Ιστορικά
και γενικά στοιχεία για το μυρμηκικό οξύ
[Αναφ. 1]
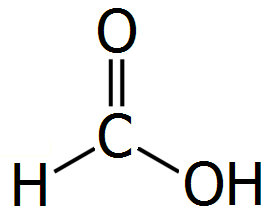
Το μυρμηκικό οξύ είναι το απλούστερο καρβοξυλικό οξύ με χημικό τύπο HCOOH και μια από τις απλούστερες οργανικές ενώσεις. Η κατά IUPAC ονομασία του είναι μεθανοϊκό οξύ (methanoic acid).
Το μυρμηκικό οξύ βρίσκεται κυριολεκτικά παντού: Στον ζωικό κόσμο σε έντομα όπως μυρμήγκια και σκαθάρια, στον φυτικό κόσμο, όπως στις κοινές τσουκνίδες (Urtica urens και Urtica dioica), στις πευκοβελόνες, στον ανθρώπινο οργανισμό ως προϊόν μεταβολισμού άλλων ουσιών, στην ατμόσφαιρα σε ίχνη προερχόμενο κυρίως από εκπομπές από τα δάση.
 |
 |
| John Ray (1627-1705) |
Η απόχρωση των πετάλων των ανθέων του κιχωρίου εξαρτάται από την οξύτητα του εδάφους. |
Το 1971 διαπιστώθηκε η παρουσία μυρμηκικού οξέος στον διαστρικό χώρο και υπήρξε το πρώτο οργανικό οξύ το οποίο ανιχνεύθηκε στον διαστρικό χώρο. Ιχνοποσότητες αλάτων μυρμηκικού και οξικού οξέος διαπιστώθηκαν και σε χονδριτικούς μετεωρίτες. Το μυρμηκικό οξύ θεωρείται ως μια από τις ουσίες απλής χημικής δομής, που συνέβαλαν στην εμφάνιση ζωής στην αρχέγονη Γη.
Σε αντίθεση με το οξικό οξύ το οποίο ως προϊόν της οξικής ζύμωσης των οίνων ήταν γνωστό από την αρχαιότητα, το μυρμηκικό οξύ έγινε γνωστό, ως μια διαφορετική ουσία, μόλις κατά τον 17ο αιώνα.
Αλχημιστές και φυσιοδίφες γνώριζαν ήδη από τον 15ο αιώνα ότι οι φωλιές μυρμηγκιών συχνά ανέδιδαν μια οσμή παρόμοια με εκείνη του ξυδιού. Επιπλέον, το 1671, ο 'Αγγλος φυσιοδίφης John Ray (1627-1705) διαπίστωσε ότι μυρμήγκια που περπατούσαν στα λευκά πέταλα των ανθέων κιχωρίου (πικραλίδα, chicory) εκκρίναν από το κεντρί τους σταγονίδια που δημιουργούσαν στα πέταλα έντονα ερυθρές κηλίδες, γεγονός που υποδήλωνε την έκκριση οξέος. Είναι γνωστό ότι ουσίες που προσδίδουν το χρώμα στα πέταλα των ανθέων (φλαβόνες, ανθοκυάνες κ.α.) έχουν ιδιότητες οξεοβασικού δείκτη και συχνά το χρώμα των ανθέων τους εξαρτάται από την οξύτητα του εδάφους.
Για να διαπιστώσει ο Ray αν τα μυρμήγκια περιείχαν κάποιο οξύ, "απέσταξε" σε αποστακτική συσκευή μεγάλο αριθμό κόκκινων μυρμηγκιών (Formica rufa, L.). Στο απόσταγμα που έλαβε διαπίστωσε την παρουσία ενός άγνωστου μέχρι τότε οξέος, του οποίου η οσμή θύμιζε το οξικό οξύ, αλλά ήταν αρκετά πιο έντονη. Το νέο αυτό οξύ, ως εκ της προέλευσής του, ο Ray το ονόμασε acidum formicum, δηλ. μυρμηκικό οξύ (από τη λατινική ονομασία του μυρμηγκιού: formica). Τα μυρμήγκια, όπως και άλλα υμενόπτερα, εκκρίνουν το μυρμηκικό οξύ για αμυντικούς και επιθετικούς λόγους.
Το 1811, ο διάσημος Γάλλος χημικός Joseph Gay-Lussac (1778-1850) με απόσταξη μίγματος Hg(CN)2 και HCl, απομόνωσε για πρώτη φορά σε υγρή μορφή το τοξικότατο υδροκυάνιο (HCN, σ.ζ. 25-26ºC), γνωστό τότε ως πρωσικό οξύ (prussic acid), και λαμβάνοντας κάθε προφύλαξη μελέτησε τις φυσικές και χημικές ιδιότητές του ("Note: Sur l' acid prussique", Annales de Chimie, 128, 1811). Απέδειξε ότι το υδροκυάνιο δεν περιείχε οξυγόνο καταρρίπτοντας τη θεωρία του Lavoisier ότι όλα τα οξέα περιέχουν οξυγόνο.
Μεταξύ πολλών άλλων ευρημάτων σχετικών με τη χημεία του υδροκυανίου, ο Gay-Lussac διαπίστωσε ότι η ουσία αυτή υδρολύεται σχετικώς εύκολα παρουσία ισχυρού οξέος, παρέχοντας ως τελικό προϊόν μυρμηκικό οξύ με βάση την ακόλουθη σειρά διαδοχικών υδρολύσεων:
|
(1778-1850) |
(1827-1907) |
![]()
Τόσο η "απόσταξη" μυρμηγκιών του Ray, όσο και η υδρόλυση του εξαιρετικά επικίνδυνου υδροκυανίου δεν αποτελούσαν μεθόδους, οι οποίες θα μπορούσαν να εξασφαλίσουν στους επιστήμονες των αρχών του 19ου αιώνα αρκετές ποσότητες μυρμηκικού οξέος για περαιτέρω μελέτες πάνω στο νέο αυτό οξύ και την αναζήτηση πιθανών εφαρμογών του.
Το 1855, το μυρμηκικό οξύ επανέρχεται στο προσκήνιο χάρις στον Γάλλο χημικό Marcellin Berthelot (1827-1907), διάσημο για τις πρωτοποριακές οργανικές συνθέσεις του. Ο Berthelot ανακάλυψε μέθοδο η οποία θα μπορούσε να εξασφαλίσει μια σχετικώς εύκολη σύνθεση μυρμηκικού οξέος και σε μεγαλύτερες ποσότητες. Θέρμανε υγραμένο καυστικό κάλιο σε ατμόσφαιρα μονοξειδίου του άνθρακα για 70 ώρες με αποτέλεσμα τον σχηματισμό μυρμηκικού καλίου, το οποίο αποσταζόμενο με θειικό οξύ έδωσε μυρμηκικό οξύ ("Transformation de l'oxyde de carbone en acide formique", Comptes rendus, 41, 1855). Η σειρά των αντιδράσεων είναι:
![]()
Αρκετά αργότερα, με βάση τη μέθοδο του Berthelot άρχισε η βιομηχανική παρασκευή του μυρμηκικού οξέος σε μεγάλες ποσότητες. Ωστόσο, και η μέθοδος αυτή αντικαταστάθηκε κατά τις τελευταίες δεκαετίες από άλλες οικονομικότερες και αποδοτικότερες βιομηχανικές μεθόδους (βλ. παρακάτω). Θα πρέπει να σημειωθεί ότι μέχρι το 1960, το μυρμηκικό οξύ αποτελούσε χημική ουσία δευτερεύουσας σημασίας από εμπορική άποψη. Παρ' όλα αυτά, η παραγωγή του σε σχετικώς μεγάλες ποσότητες ως παραπροϊόν της σύνθεσης του οξικού οξέος, υπήρξε η αφορμή αναζήτησης περισσότερων εφαρμογών του.
Αξίζει να σημειωθεί ότι κατά τον 19ο αιώνα είχαν αποδοθεί στο μυρμηκικό οξύ κάποιες θεραπευτικές ιδιότητες, έτσι η Γερμανική Φαρμακοποιία περιέγραφε φάρμακο με της ονομασία "Spiritus Formicarum" αποτελούμενο από 2 μέρη μυρμηκικού οξέος, 26 μέρη ύδατος και 70 μέρη αλκοόλης κατά του χρόνιου ρευματισμού και ως φλογιστικό του δέρματος για την πρόκληση τοπική υπεραιμίας (rubefacient) .
Η παραγωγή μυρμηκικού οξέος (2009-2010) σε παγκόσμια κλίμακα έφθασε τους 720.000 τόνους. Η μεγαλύτερη παραγωγός βιομηχανία μυρμηκικού οξέος είναι η Γερμανική χημική βιομηχανία BASF (Badische Anilin und Soda Fabrik) με εγκαταστάσεις στην Ευρώπη, στην Κίνα και στις ΗΠΑ. Μεγάλη παραγωγός είναι η Κινέζικη χημική βιομηχανία Feicheng Acid Chemicals (100.000 τόνοι ετησίως). 'Αλλη σημαντική παραγωγός χώρα είναι η Φινλανδία, όπου παράγεται η μεγάλη Φινλανδική χημική βιομηχανία (κυρίως χαρτοπολτού και χάρτου) Kemira παράγει περίπου 100.000 τόνους μυρμηκικού οξέος ετησίως. Συνήθως, το μυρμηκικό οξύ διατίθεται σε περιεκτικότητες 85%, 90%, 95% και 99% w/w %. Το 2010, οι αναφερόμενες εμπορικές τιμές του ήταν περίπου US$ 650/t (Ευρώπη) και US$1250 /t (ΗΠΑ).
Το μυρμηκικό οξύ αποτελεί την πρώτη ύλη για τη σύνθεση άλλων χημικών ενώσεων, αλλά και το ίδιο, ως έχει, χρησιμοποιείται σε διάφορες άλλες βιομηχανίες, όπως η βυρσοδεψία, η βιομηχανία καουτσούκ και η βιομηχανία τροφίμων, όπου χρησιμοποιείται ως συντηρητικό τροφίμων (Ε236). Επίσης χρησιμοποιείται ευρύτατα στην κτηνοτροφία ως βακτηριοκτόνο και ακαριοκτόνο. Επιπλέον, μυρμηκικό οξύ περιέχεται σε ορισμένα σκευάσματα οικιακής χρήσης για την απομάκρυνση δυσδιάλυτων αλάτων ασβεστίου από πλυντήρια, σωληνώσεις κ.α. Οι εφαρμογές του μυρμηκικού οξέος συνεχώς αυξάνονται και μπορεί γενικά να χρησιμοποιηθεί οπουδήποτε απαιτείται ένα αρκετά ισχυρό οξύ φιλικό προς το περιβάλλον.
Η ονομασία "μυρμηκικό οξύ" στην Ελληνική ΒιβλιογραφίαΗ ελληνική εμπειρική ονομασία του μεθανοϊκού οξέος, καθιερώθηκε ήδη από τα πρώτα ελληνικά συγγράμματα Οργανικής Χημείας ως μυρμηκικό οξύ (από το: μύρμηξ, μύρμηκ-ος) και αποτελεί την άμεση ελληνική απόδοση της λατινογενούς εμπειρικής ονομασίας του οξέος: acidum formicum. Ανάλογες ελληνικές ονομασίες έχουν δοθεί και εδραιωθεί για πλήθος άλλων ανάλογων οργανικών ενώσεων (κυρίως οξέων) όπως π.χ. τα: οξικό οξύ (acidum aceticum), τρυγικό οξύ (acidum tartaricum), μηλικό οξύ (acidum malonicum), πυροσταφυλικό οξύ (acidum pyruvicum), ηλεκτρικό οξύ (acidum succinicum), γαλακτικό οξυ (acidum lacticum).
Ωστόσο, πολλές είναι οι περιπτώσεις ελληνικών εμπειρικών ονομασιών χημικών ενώσεων που τελικά δεν επικράτησαν στην ελληνική βιβλιογραφία. 'Ετσι, ελληνικές ονομασίες όπως: ιτεϋλικο οξύ, καπνικό οξύ, φελλικό οξύ, δαφνικό οξύ και φοινικικό οξύ, έχουν πλέον ξεχασθεί και έχουν αντικατασταθεί οριστικά με τις ονομασίες λατινογενούς προέλευσης: σαλικυλικό οξύ, φουμαρικό οξύ, σουβερικό οξύ, λαυρικό οξύ και παλμιτικό οξύ, αντιστοίχως. Στην περίπτωση του μυρμηκικού οξέος, η ελληνική απόδοση χρησιμοποιείται μόνο για το ίδιο, τα άλατά του (π.χ. μυρμηκικό νάτριο) και τους εστέρες του (π.χ. μυρμηκικός αιθυλεστέρας), όχι όμως και για τα παράγωγά του και για οργανικές ομάδες που προέρχονται από αυτό. Στις περιπτώσεις αυτές επικρατεί το θέμα φορμ- που προέρχεται από τη λατινογενή ονομασία του. 'Ετσι, η μεθανάλη (HCHO) αναφέρεται σχεδόν πάντοτε ως φορμαλδεΰδη και πολύ σπάνια ως μυρμηκική αλδεΰδη, ενώ η ομάδα HCO- αναφέρεται πάντοτε ως φορμύλιο και σχεδόν ποτέ ως μυρμηκύλιο. Κατ' αντιστοιχία ονομάζονται τα παράγωγά του (π.χ. φορμαμίδιο, διμεθυλοφορμαμίδιο). Το ίδιο ισχύει για την ονομασία των σχετικών αντιδράσεων (π.χ. αντίδραση φορμυλίωσης). Θα πρέπει να σημειωθεί ότι σε πολλά σύγχρονα ελληνικά συγγράμματα ή μεταφράσεις ξενόγλωσσων συγγραμμάτων έχει αρχίσει η "αφελλήνιση" και του ίδιου του μυρμηκικού οξέος, το οποίο αρχίζει να αναφέρεται συχνά ως φορμικό οξύ. |
 |
 |
 |
|
|
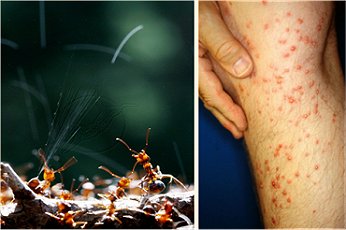
Μυρμηκικό οξύ εκκρίνεται από το κεντρί του μυρμηγκιού (λατ. formica). Συνήθως ψεκάζεται (περιεκτικότητα ψεκάσματος σε HCOOH: 65%), όπως δείχνεται στη φωτογραφία. Τα ψεκάσματα και τα κεντρίσματα αυτά μπορούν να προκαλέσουν έντονα αλλεργικά φαινόμενα. |
|
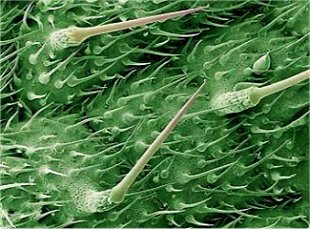
Στον συνδυασμό του μυρμηκικού οξέος με ισταμίνη και χολίνη, που εισέρχεται μέσω των "τριχιδίων - ενέσεων" οφείλεται το άμεσο ερέθισμα (τσούξιμο), το οποίο προκαλεί η άμεση επαφή του δέρματος με τα φύλλα της κοινής τσουκνίδας (Urtica urens και Urtica dioica). |
|
|
|
Απόσπασμα από την εφημερίδα Los Angeles Herald (Vol.34, 274, 2 July 1907) [πηγή]. |
Σε ορισμένα είδη μυρμηγκιών (κόκκινα μυρμήγκια) οι ποσότητες μυρμηκικού οξέος είναι ιδιαίτερα μεγάλες και μπορεί να φθάσουν το 4,2% του βάρους τους. Είναι χαρακτηριστικό το γεγονός ότι για φυλές των περιοχών της Λίμνης Βικτώριας στην Αφρική τα μυρμήγκια είναι φαγώσιμα και μάλιστα οι ιθαγενείς τα χρησιμοποιούν σε σαλάτες αντί για ξύδι.
Πολλά είδη πτηνών, για να απαλλαγούν από ενοχλητικά ακάρια, μύκητες, ψείρες και άλλα μικροσκοπικά έντομα, συνηθίζουν να κάθονται με απλωμένες τις φτερούγες τους πάνω από μυρμηγκοφωλιές. Εκεί, οι εκλυόμενοι ατμοί από τη φωλιά και τα ψεκάσματα μυρμηκικού οξέος ή από τη σύνθλιψη μυρμηγκιών, τα απαλλάσσει από παράσιτους οργανισμούς. Αυτή η κάπως παράδοξη συμπεριφορά των πτηνών ακόμη διερευνάται και αναφέρεται στην αγγλική βιβλιογραφία ως anting (ant: μυρμήγκι).
'Αλλες εκδοχές είναι ότι αυτή η τακτική των πτηνών, που συνηθίζεται κατά την άνοιξη και το καλοκαίρι, προκαλεί κάποιο είδος ευεξίας, τα βοηθάει στην απολέπιση και καταπραΰνει την επιδερμίδα τους κατά τη διάρκεια της αντικατάστασης των φτερών τους.
 |
 |
|
Τυπικές μορφές "υπόγειων" και "υπέργειων" μυρμηγκοφωλιών (ant hills). |
Πτηνό σε "θέση anting". |
Παραγωγή μυρμηκικού οξέος από μυρμηγκοφωλιές. Το 1907 δημοσιεύτηκε μια μάλλον παράδοξη είδηση στην εφημερίδα Los Angeles Herald. Η είδηση αφορούσε την αγορά μιας μεγάλης ορεινής έκτασης με πλήθος μυρμηγκοφωλιών από ένα συνδικάτο της Νέας Υόρκης, με σκοπό την απομόνωση του μυρμηκικού οξέος από το χώμα των μυρμηγκοφωλιών και τη συστηματική και τακτική "εμφύτευση" νέων αποικιών μυρμηγκιών για τη συνεχή παραγωγή αυτής της προφανώς δυσεύρετης κατά την εποχή εκείνη οργανικής ένωσης. Δυστυχώς δεν είναι γνωστό το κατά πόσο η επιχείρηση προχώρησε και αν ναι, το κατά πόσο είχε οικονομική επιτυχία.
|
Το μυρμηκικό οξύ από τα μυρμήγκια εξασφαλίζει την απαραίτητη για την πέψη οξύτητα στο στομάχι των μυρμηγκοφάγων. |
Μυρμηκικό οξύ και μυρμηγκοφάγοι. Οι μυρμηγκοφάγοι (anteaters) είναι εντομοφάγα θηλαστικά της Κεντρικής και Νότιας Αμερικής γνωστά για το μακρύ τους ρύγχος. Η κύρια τροφή τους είναι τα μυρμήκια, οι τερμίτες και άλλα έντομα. Δεν έχουν δόντια και ρουφούν απ' ευθείας τα έντομα στο στομάχι τους μαζί με χαλίκια που τα βοηθούν στο ανακάτεμα και πέψη της τροφής τους. Σε αντίθεση με τα άλλα θηλαστικά, στο στομάχι τους δεν εκκρίνεται υδροχλωρικό οξύ για την πέψη της τροφής τους και η απαιτούμενη υψηλή οξύτητα εξασφαλίζεται από το μυρμηκικό οξύ της κύριας τροφής τους, δηλαδή των μυρμηγκιών.
Πόσο μυρμηκικό οξύ εισάγουν τα μυρμήγκια στην ατμόσφαιρα ετησίως; Οι Graedel και Eisner σε μια ενδιαφέρουσα μελέτη τους του 1988 επιχείρησαν να υπολογίσουν χονδρικά την ποσότητα του μυρμηκικού οξέος που παράγεται κατά φυσικό τρόπο από τα μυρμήκια. Χρησιμοποιούν τη σχέση: Φ = Νa ma ψ / δ, όπου Φ η ζητούμενη ετήσια ποσότητα, Νa αριθμός των μυρμηγκιών που φέρουν μυρμηκικό οξύ (formicin ants), ma η μέση μάζα των μυρμηγκιών, ψ το κλάσμα του βάρους του μυρμηγκιού που αντιστοιχεί σε μυρμηκικό οξύ και δ η κλίμακα χρόνου.
Με βάση την εξίσωση αυτή και με τιμές εκτιμούμενες τιμές (από άλλες εργασίες): Νa = 1x1016 (x 0,3), ma = 0,005 g , ψ = 0,02 και κλίμακα χρόνου 0,5 έτη, η εκτιμούμενη ποσότητα μυρμηκικού οξέος που εισάγεται στην ατμόσφαιρα είναι 0,6 Τg/yr (6x1011 g/yr) ή 600.000 τόνοι/yr (προφανώς η εκτίμηση αυτή είναι αρκετά χονδρική) [Αναφ. 2στ].

Σύνθεση του μυρμηκικού οξέος
Βιομηχανική σύνθεση [Αναφ. 3]. Ο παλαιότερος βιομηχανικός τρόπος παραγωγής μυρμηκικού οξέος βασίζεται στην αντίδραση υγρανθέντος μονοξειδίου του άνθρακα με υδροξείδιο του νατρίου σε υψηλή θερμοκρασία (190-210ºC) και πίεση με βάση την αντίδραση που ανακάλυψε ο Berthelot το 1855, όπως προαναφέρθηκε. Ωστόσο, φαίνεται πως η μέθοδος αυτή θεωρείται αντιοικονομική και αν χρησιμοποιείται ακόμη σήμερα, συνεισφέρει ελάχιστα πλέον στην παγκόσμια παραγωγή μυρμηκικού οξέος. Παρ' όλα αυτά συχνά αναφέρεται -λανθασμένα βέβαια- ως κύρια βιομηχανική μέθοδος σύνθεσης μυρμηκικού οξέος.
Ο σύγχρονος τρόπος βιομηχανικής παραγωγής μυρμηκικού οξέος βασίζεται στην αντίδραση μεθανόλης και μονοξειδίου του άνθρακα παρουσία ισχυρής βάσης, προς σχηματισμό μυρμηκικού μεθυλεστέρα. Η αντίδραση πραγματοποιείται σε υγρή φάση σε αυξημένη θερμοκρασία και πίεση (80ºC και 40 atm) και η χρησιμοποιούμενη βάση είναι το μεθοξείδιο του νατρίου (CH3ONa). Στη συνέχεια πραγματοποιείται υδρόλυση του μυρμηκικού μεθυλεστέρα με σχηματισμό μυρμηκικού οξέος και μεθανόλης, η οποία επανέρχεται στον κύκλο της αντίδρασης:
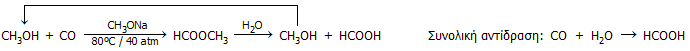
|
|
|
Περιστρεφόμενοι φούρνοι παραλαβής του μυρμηκικού οξέος από το μίγμα του με θειικό αμμώνιο. Η συνεχής περιστροφή ήταν απαραίτητη για να αποφευχθεί η συσσωμάτωση του μίγματος. Ο θόρυβος και η οσμή του μυρμηκικού οξέος καθιστούσαν αφόρητες τις συνθήκες εργασίας στον εργαστασιακό χώρο [πηγή]. |
Για να αυξηθεί η απόδοση απαιτείται μεγάλη περίσσεια ύδατος, γεγονός που δυσκολεύει την παραλαβή του μυρμηκικού οξέος από το προκύπτον αραιό διάλυμά του, αφού κάθε αποστακτική διαδικασία θα κατανάλωνε μεγάλα ποσά ενέργειας.
Εδώ, πρέπει να σημειωθεί ότι αρχικά η υδρόλυση του εστέρα γινόταν με αντίδραση με αμμωνία (αμμωνιόλυση), οπότε σχηματιζόταν φορμαμίδιο (υγρό, σ.ζ. 210ºC υπό μερική διάσπαση). Ακολουθούσε όξινη υδρόλυση του φορμαμιδίου με θειϊκό οξύ:
HCOΟCH3 + NH3
![]() HCΟNH2 + CH3OH
2 HCΟNH2 + 2H2O + H2SO4
HCΟNH2 + CH3OH
2 HCΟNH2 + 2H2O + H2SO4
![]() 2 HCOΟH + (NH4)2SO4
2 HCOΟH + (NH4)2SO4
Εξάλλου, το φορμαμίδιο βιομηχανικά παράγεται (αλλά σε μικρότερη κλίμακα) και με άμεση αντίδραση αμμωνίας και μονοξειδίου του άνθρακα:
![]()
Ωστόσο, η παραγωγή μυρμηκικού οξέος μέσω της όξινης υδρόλυσης του φορμαμιδίου ("διαδρομή φορμαμιδίου") παρουσίαζε προβλήματα. 'Επρεπε να αντιμετωπισθεί το πρόβλημα της παραλαβής του μυρμηκικού οξέος από το μίγμα του με το στερεό παραπροϊόν θειϊκό αμμώνιο, η οποία γινόταν σε περιστρεφόμενους φούρνους.
Η παραγωγική διαδικασία δεν ήταν συνεχής, αφού θα έπρεπε να διακόπτεται για την απαλλαγή των περιστρεφόμενων φούρνων από το θειικό αμμώνιο. Η διαδικασία ήταν ιδιαίτερα δαπανηρή, χρονοβόρα, ενεργειακώς ασύμφορη, ανυπόφορη για τους εργαζόμενους και με παραπροϊόν, το θειικό αμμώνιο, με ελάχιστες δυνατότητες οικονομικής εκμετάλλευσης.
|
Εγκαταστάσεις (steam cracker) της κοινοπραξίας BASF - Sinopec στην Κίνα (Nanjing). Το μυρμηκικό οξύ είναι ένα από τα προϊόντα αυτού του τεράστιου βιομηχανικού συγκροτήματος πετροχημικών [πηγή]. |
Για να αποφευχθεί η "διαδρομή φορμαμιδίου" οι χημικές βιομηχανίες (κυρίως η BASF) επικεντρώθηκαν στην άμεση υδρόλυση του μυρμηκικού μεθυλεστέρα και ανέπτυξαν ενεργειακώς αποτελεσματικότερες διεργασίες απομόνωσης του μυρμηκικού οξέος από τις μεγάλες ποσότητες ύδατος της άμεσης υδρόλυσης. Η απομόνωση του μυρμηκικού οξέος από το υδρόλυμα βασίζεται πλέον στην εκχύλιση υγρού-με-υγρό, με τη βοήθεια μιας οργανικής βάσης. Περισσότερες λεπτομέρειες ως προς τη φύση της βάσης και την όλη διαδικασία δεν παρέχονται από την BASF.
Η μέθοδος αυτή εφαρμόζεται σήμερα, στις εγκαταστάσεις της BASF στην πόλη Ludwigshafen της Γερμανία (με ετήσια παραγωγή 255.000 μετρικών τόνων, στοιχεία 2012), στην πόλη Oulu της Φινλανδίας (105.000 μετρικοί τόνοι, στοιχεία 2010) και στην πόλη Nanjing της Κίνας (100.000 μετρικοί τόνοι, στοιχεία 2010), ενώ προγραμματίζεται η λειτουργία από το 2014 μιας νέας μονάδας παραγωγής μυρμηκικού οξέος με ετήσια παραγωγή 50.000 μετρικών τόνων στις εγκαταστάσεις της BASF στην πόλη Geismar της Λουιζιάνας στις ΗΠΑ.
Κάποιες ποσότητες μυρμηκικού οξέος λαμβάνονταν (δεκαετία 1960 και μετά) ως παραπροϊόν μιας παλαιότερης μεθόδου βιομηχανικής παραγωγής οξικού οξέος, η οποία σήμερα δεν χρησιμοποιείται (βλ. Χημική ένωση του μήνα: Οξικό οξύ). Το οξικό οξύ παραγόταν σε μεγάλες ποσότητες με οξείδωση αλκανίων, μια διεργασία που παρήγαγε και σημαντικές ποσότητες μυρμηκικού οξέος ως παραπροϊόν. Αυτή η μέθοδος παραγωγής μυρμηκικού οξέος είναι προφανές πως έχει πλέον βιομηχανική σημασία.
Μια
άλλη μέθοδος σύνθεσης μυρμηκικού
οξέος που βρίσκεται ακόμη σε
ερευνητικό στάδιο και ίσως
μελλοντικά αποκτήσει κάποια
βιομηχανική σημασία, βασίζεται στην
καταλυτική υδρογόνωση του διοξειδίου
του άνθρακα: CO2
+
H2
![]() HCOOH.
Η έρευνα πάνω στην ανακάλυψη
αποδοτικών καταλυτών συνεχίζεται με
αμείωτο ενδιαφέρον.
HCOOH.
Η έρευνα πάνω στην ανακάλυψη
αποδοτικών καταλυτών συνεχίζεται με
αμείωτο ενδιαφέρον.
Εργαστηριακή σύνθεση [Αναφ. 4]. Λόγω της ευρύτατης διαθεσιμότητας και του χαμηλού του κόστους, σπάνια χρειάζεται η παρασκευή μυρμηκικού οξέος στο εργαστήριο. Ωστόσο, αν ποτέ χρειασθεί, η πιο αποδοτική μέθοδος παρασκευής του σε μικρή κλίμακα βασίζεται στην αποκαρβοξυλίωση του οξαλικού οξέος με θέρμανσή του σε γλυκερίνη, η οποία παίζει καταλυτικό ρόλο (με ενδιάμεσο σχηματισμό μυρμηκικού εστέρα της γλυκερίνης) (Berthelot, Comptes Rendus, March 1856). 'Ετσι, με κάθε νέα προστιθέμενη δόση οξαλικού οξέος αποστάζει μια νέα ποσότητα μυρμηκικού οξέος, ενώ η ίδια ποσότητα γλυκερίνης μπορεί να χρησιμοποιείται συνεχώς με προσθήκες επιπλέον ποσοτήτων οξαλικού οξέος:
HOCH2CH(OH)CH2OH + HOCOCOOH
![]() HCOO-CH2CH(OH)CH2OH + CO2 + H2O
HCOO-CH2CH(OH)CH2OH + CO2 + H2O
HCOO-CH2CH(OH)CH2OH
+ H2O
![]() HOCH2CH(OH)CH2OH + HCOOH
HOCH2CH(OH)CH2OH + HCOOH
Συνολική αντίδραση:
HOCO-COOH
![]() HCOOH
+
CO2
HCOOH
+
CO2
'Αλλη εργαστηριακή μέθοδος βασίζεται στην οξείδωση της μεθανόλης ή μεθανάλης (φορμαλδεΰδης) με ένα σχετικώς ήπιο οξειδωτικό (π.χ. KMnO4 σε ουδέτερο διάλυμα), αφού σε πιο έντονες οξειδωτικές συνθήκες θα οξειδωθεί το ίδιο προς διοξείδιο του άνθρακα. Σε κάθε περίπτωση η απομόνωση του καθαρού μυρμηκικού οξέος από το μίγμα της αντίδρασης είναι αρκετά δύσκολη:
3 CH3OH + 4
MnO4- +
4 H+
![]() 3
HCOOH
+ 4 MnO2 +
5 H2O
3 HCHO +
2 MnO4- +
2 H+
3
HCOOH
+ 4 MnO2 +
5 H2O
3 HCHO +
2 MnO4- +
2 H+
![]() 3
HCOOH
+ 2 MnO2 + H2O
3
HCOOH
+ 2 MnO2 + H2O
Ξήρανση μυρμηκικού οξέος. Το άνυδρο μυρμηκικό οξύ λαμβάνεται δύσκολα, αφού κάθε απόπειρα ξήρανσής του με τα συνήθη αφυδραντικά μέσα (π.χ. π.Η2SO4, P2O5) οδηγεί σε διάσπαση του προς μονοξείδιο του άνθρακα, ενώ η χρήση άνυδρου CaCl2 δεν παρέχει ικανοποιητικά αποτελέσματα. Ωστόσο, αναφέρεται η δυνατότητα χρήσης θειικού οξέος αν η θερμοκρασία κρατηθεί κάτω από τους 75ºC και η απόσταξη πραγματοποιηθεί υπό ελαττωμένη πίεση (L. Maquenne, Bull. sec. chim., 5:662, 1888).
Για την αφυδάτωση του αζεοτροπικού μυρμηκικού οξέος -
ύδατος (77,5% μυρμηκικό οξύ) έχει
προταθεί ο ανυδρίτης του βορικού
οξέος, ο οποίος παρασκευάζεται με πυράκτωση
βορικού οξέος σε ηλεκτρικό φούρνο
στους 900ºC (2H3BO3
![]() B2O3
+ 3H2O),
όπως επίσης και ο άνυδρος CuSO4
[Αναφ.
4δ].
B2O3
+ 3H2O),
όπως επίσης και ο άνυδρος CuSO4
[Αναφ.
4δ].
'Ενας κάπως απλός τρόπος παρασκευής άνυδρου μυρμηκικού οξέος βασίζεται στον σχηματισμό μυρμηκικού νατρίου, ξήρανσή του και θέρμανσή του με ισοδύναμη ποσότητα άνυδρου οξαλικού οξέος:
HCOONa
+
HOCO-COOH
![]() HOCO-COONa
+
HCOOH
HOCO-COONa
+
HCOOH
 |
ΠΡΟΣΟΧΗ !!! 'Εχουν αναφερθεί εκρήξεις καλά σφραγισμένων φιαλών με πυκνό HCOOH (>98%) μετά από μακρόχρονη αποθήκευση, λόγω μερικής διάσπασης του οξέος προς CO και ανάπτυξης μεγάλης πίεσης στο εσωτερικό τους [Αναφ. 4ε]. Τα πώματα αυτών των φιαλών πρέπει να διαθέτουν βαλβίδες εκτόνωσης. |
 |
Παλαιές μέθοδοι παρασκευής. 'Αλλες μέθοδοι παρασκευής του μυρμηκικού οξέος (αλάτων του), με ιστορικό μόνο ενδιαφέρον, βασίζονται στις αντιδράσεις:
|
- Αλκαλική υδρόλυση του χλωροφορμίου (J. Dumas, Berzelius Jahresberichte, 15, p. 371, 1834): - Αντίδραση υγρανθέντος CO2 με μεταλλικά αλκάλια (H. Kolbe and R. Schmitt, Ann., 119, p. 251, 1861): - Αντίδραση ξηρού CO2 ή CO με υδρίδιο του καλίου (H. Moissan, Comptes rend., 134, p. 261, 1902): |
CHCl3
+ 4 KOH
CO2 +
H2O + 2 K
CO2 + KH
|
 Χημικές ιδιότητες του μυρμηκικού
οξέος [Αναφ.
5]
Χημικές ιδιότητες του μυρμηκικού
οξέος [Αναφ.
5]
Το μυρμηκικό οξύ είναι το ισχυρότερο μη υποκατεστημένο καρβοξυλικό οξύ. Η pK του μυρμηκικού οξέος είναι 3,77, επομένως ως οξύ είναι 10 φορές ισχυρότερο από το οξικό οξύ (pK = 4,77). Η διαφορά αυτή οφείλεται στο ότι η μεθυλοομάδα του οξικού οξέος είναι ισχυρότερος δότης ηλεκτρονίων σε σχέση με το απλό υδρογόνο του μυρμηκικού οξέος. 'Ετσι, το αρνητικό φορτίο της μεθυλοομάδας του οξικού οξέος επάγεται στην καρβοξυλοομάδα του και δυσχεραίνει την απόσπαση του υδρογονοκατιόντος από αυτήν.
Το μυρμηκικό οξύ, σε αντίθεση με τα υπόλοιπα μέλη της ομόλογης σειράς καρβοξυλικών οξέων, δρα και ως αναγωγικό μέσο, εφόσον ουσιαστικά μπορεί να θεωρηθεί ότι διαθέτει αλδεϋδική ομάδα (η απλούστερη υδροξυ-αλδεΰδη) και υπόκειται σε οξείδωση σύμφωνα με την ημιαντίδραση:
HCOOH
![]() CO2
+ 2H+ + 2e-
(αλλά και: 2 HCOOH
CO2
+ 2H+ + 2e-
(αλλά και: 2 HCOOH
![]() CO2
+ CO + 2H+ + 2e-).
CO2
+ CO + 2H+ + 2e-).
'Eτσι, το μυρμηκικό οξύ συνδυάζει ιδιότητες οργανικού οξέος και αλδεΰδης και παρέχει τις τυπικές αντιδράσεις οξείδωσης των αλδεϋδών με αντιδραστήρια Fehling και Tollens (βλ. Χημική ένωση του μήνα: Ακεταλδεΰδη). Τυπικές αντιδράσεις, όπου φαίνεται η αναγωγική ισχύς των μυρμηκικών ιόντων:
HCOO-
+ 2 Ag+
![]() 2 Ag
+ CO2 +
H+
2 HCOO- + Hg2+
2 Ag
+ CO2 +
H+
2 HCOO- + Hg2+
![]() Hg + CO2
+ CO + H2O
Hg + CO2
+ CO + H2O
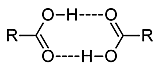
Το μυρμηκικό οξύ σε διαλύματα σε μη πολικούς διαλύτες, αλλά και σε αέρια φάση σχηματίζει διμερή μόρια μέσω δεσμών υδρογόνου και για τον λόγο αυτό οι ατμοί του δεν υπακούουν στον νόμο των τέλειων αερίων.
Σχηματισμός διμερών μορίων Τα καρβοξυλικά οξέα, όπως και οι αλκοόλες συνδέονται μεταξύ τους με δεσμούς υδρογόνου, λόγω της παρουσίας του πολωμένου δεσμού Ο-Η (τα τρία στοιχεία F, Ο και Ν είναι ισχυρώς ηλεκτροαρνητικά σε σχέση με το ηλεκτροθετικό Η). Το αποτέλεσμα είναι ότι ο ομοιοπολικός δεσμός να είναι πολωμένος με κλάσμα αρνητικού φορτίου στο άτομο οξυγόνου και κλάσμα θετικού φορτίου στο άτομο υδρογόνου). 'Οταν τα δύο μόρια των οξέων πλησιάσουν σε απόσταση μερικών Angstrom (1 Å = 10-10 m) σχηματίζονται δεσμοί υδρογόνου (διαμοριακός δεσμός, ασθενέστερος του ιοντικού και του ομοιοπολικού δεσμού). Τα περισσότερα καρβοξυλικά οξέα απαντούν ως κυκλικά διμερή όπου τα δύο μόρια συνδέονται μεταξύ τους με δεσμούς υδρογόνου (εκτός από τα πολύ αραιά υδατικά διαλύματα). |
Το μυρμηκικό οξύ σχηματίζει εύκολα εστέρες και αμίδια, όπως και τα άλλα αλειφατικά οξέα. Ωστόσο, λόγω της μεγαλύτερης οξύτητας του ίδιου του μυρμηκικού οξέος, η παρουσία καταλυτικής ποσότητας ανόργανου οξέος για την εστεροποίηση με διάφορες αλκοόλες δεν είναι απαραίτητη. Ενδεικτικά, σε σχέση με το καθαρό οξικό οξύ, το καθαρό μυρμηκικό οξύ αντιδρά με αλκοόλες 15.000 έως 20.000 φορές ταχύτερα. Για τον ίδιο λόγο παρέχει εύκολα αντιδράσεις μετεστεροποίησης (transesterification) χωρίς την καταλυτική παρουσία άλλου ισχυρού οξέος. Η ιδιότητα αυτή αξιοποιείται στην περίπτωση σύνθεσης άνυδρου ακρυλικού οξέος από τον μεθυλεστέρα του (ουσιαστικά έχουμε "άνυδρη υδρόλυση" εστέρα):
CH2=CHCOOCH3
+ HCOOH
![]() CH2=CHCOOH +
HCOOCH3
CH2=CHCOOH +
HCOOCH3
Αντιδράσεις προσθήκης. Το μυρμηκικό οξύ είναι το μόνο αλειφατικό οξύ που παρέχει αντιδράσεις προσθήκης σε αλκένια παρέχοντας εστέρες μυρμηκικού οξέος:
RCH=CH2
+
HCOOH
![]() HCOO-CH(CH3)R
HCOO-CH(CH3)R
Ωστόσο, παρουσία οξέων, όπως το θειικό και το υδροφθορικό οξύ, η προσθήκη μπορεί να οδηγήσει στον σχηματισμό ενός μεγαλύτερου καρβοξυλικού οξέος (παραλλαγή αντίδρασης Koch):
RCH=CH2
+
HCOOH
![]() RCH(CH3)-COOH
RCH(CH3)-COOH
Χλωρίδιο και ανυδρίτης μυρμηκικού οξέος. Το μυρμηκικό οξύ διαφέρει από τα υπόλοιπα αλειφατικά οξέα κατά το ότι δεν σχηματίζει απομονώσιμο και σταθερό ακυλοχλωρίδιο και ανυδρίτη. Το ακυλοχλωρίδιο του μυρμηκικού οξέος, το μυρμηκυλοχλωρίδιο, μεθανοϋλοχλωρίδιο ή (συνηθέστερα) φορμυλοχλωρίδιο, HCOCl είναι ασταθές. Κάθε απόπειρα σύνθεσής του με τις συμβατικές αντιδράσεις σύνθεσης ακυλοχλωριδίων (αντιδράσεις άνυδρων οξέων με "υδροχλωριωτικά" ανιδραστήρια), καταλήγει στον σχηματισμό μίγματος HCl και CO, π.χ.
HCOOH
+ SOCl2
![]() 2 HCl + CO
+ SO2
3 HCOOH + PCl3
2 HCl + CO
+ SO2
3 HCOOH + PCl3
![]() 3 HCl + 3
CO + H3PO3
3 HCl + 3
CO + H3PO3
Έχει αναφερθεί ό παροδικός σχηματισμός φορμυλοχλωριδίου κατά την αντίδραση όζοντος με χλωριωμένους υδρογονάνθρακες, όπως επίσης και η παρασκευή του με διοχέτευση ατμών μυρμηκικού οξέος υπεράνω PCl5 (στερεό) σε θερμοκρασία δωματίου και ο χρόνος υποδιπλασιασμού του είναι περίπου 30 min [Αναφ. 5γ] (δεν διευκρινίζεται το κάτω από ποιες συνθήκες):
HCOOH + PCl5
![]() HCl + ΗCOCl + POCl3
HCl + ΗCOCl + POCl3
Ωστόσο, ισομοριακό αέριο μίγμα HCl και CO δρα ως φορμυλοχλωρίδιο και παρέχει αντιδράσεις ακυλίωσης τύπου Friedel-Crafts (αντίδραση Gattermann-Koch). 'Ετσι, π.χ. φορμυλιώνει το βενζόλιο με σχηματισμό βενζαλδεΰδης (η ομάδα φορμύλιο, HCO- είναι η ίδια η αλδεϋδική ομάδα, -CHO):
![]()
'Ενας απλός και εύχρηστος τρόπος παρασκευής στο εργαστήριο ξηρού ισομοριακού μίγματος HCl και CO, κατάλληλου για συνθέσεις Gattermann-Koch είναι η αντίδραση μυρμηκικού οξέος με χλωροσουλφονικό οξύ:
![]()
Ωστόσο, κάπως σταθερό σε χαμηλές θερμοκρασίες είναι το φορμυλοφθορίδιο (HCOF, σ.τ. -142ºC, σ.ζ. -29ºC), το οποίο διασπάται σε θερμοκρασίες δωματίου προς HF και CO.
O μυρμηκικός ανυδρίτης (formic anhydride) ουσιαστικά δεν είναι απομονώσιμος, αλλά μπορεί να παρασκευασθεί με αντίδραση φορμυλοφθοριδίου με μυρμηκικό νάτριο σε διαιθυλαιθέρα στους -78ºC:
HCOONa
+ HCOF
![]() (HCO)2O + NaF
(HCO)2O + NaF
Ο μυρμηκικός ανυδρίτης μπορεί να παρασκευασθεί ευκολότερα με απόσπαση του ύδατος με διάλυμα Ν,Ν'-δικυκλοεξυλο-καρβοδιιμιδίου σε διαιθυλαιθέρα στους -10ºC:
2 HCOOΗ
+ C6H11-N=C=N-C6H11
![]() (HCO)2O + C6H11-NHCONH-C6H11
(HCO)2O + C6H11-NHCONH-C6H11
 |
 |
|
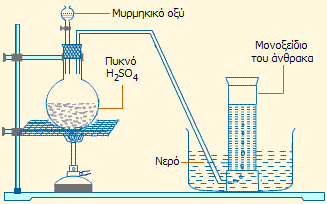
Αριστερά: Παραγωγή φυσαλίδων μονοξειδίου του άνθρακα στην επιφάνεια επαφής μυρμηκικού οξέος (επάνω στιβάδα) - πυκνού θειικού οξέος (κάτω στιβάδα) [πηγή]. Δεξιά: απλή πειραματική διάταξη για την παρασκευή μονοξειδίου του άνθρακα με την ίδια αντίδραση. |
|
Και ο μυρμηκικός ανυδρίτης (σ.ζ. 24ºC στα 20 mm Hg) είναι ασταθής σε συνθήκες δωματίου και διασπάται ταχύτατα προς CO και ΗCOOH:
(HCO)2O
![]() HCOOH + CO
HCOOH + CO
Σταθεροί είναι οι μικτοί ανυδρίτες του μυρμηκικού οξέος με άλλα καρβοξυλικά οξέα, όπως ο οξικός-μυρμηκικός ανυδρίτης (σ.ζ. 27-28°C/10 mmHg, ένα εξαιρετικό αντιδραστήριο φορμυλίωσης), ο οποίος παρασκευάζεται σχετικώς εύκολα με αντίδραση μυρμηκικού νατρίου και ακετυχλωριδίου σε διαιθυλαιθέρα:
HCOONa
+ CH3COCl
![]() HCO-O-COCH3 + NaCl
HCO-O-COCH3 + NaCl
|
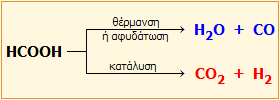
Οι δύο βασικοί τρόποι διάσπασης του μυρμηκικού οξέος. |
Διάσπαση μυρμηκικού οξέος. Το μυρμηκικό οξύ διασπάται κατά δύο διαφορετικούς τρόπους: προς μονοξείδιο του άνθρακα με θέρμανση (ή αφυδάτωση) και προς διοξείδιο του άνθρακα και υδρογόνο παρουσία καταλύτη.
Το μυρμηκικό οξύ χρησιμοποιείται ευρύτατα ως αντιδραστήριο στο εργαστήριο, όποτε απαιτείται η παραγωγή μικρών ποσοτήτων μονοξειδίου του άνθρακα για επίδειξη των αναγωγικών ιδιοτήτων του τελευταίου, με βάση την αντίδραση αφυδάτωσής του με πυκνό θειικό οξύ (βλ. Χημική ένωση του μήνα: Μονοξείδιο του άνθρακα):
![]()
Γενικά, το μυρμηκικό οξύ χρησιμοποιείται στην οργανική σύνθεση ως μια in situ πηγή μονοξειδίου του άνθρακα.
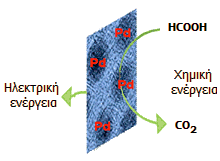
Το μυρμηκικό οξύ ερχόμενο σε επαφή με ορισμένα ευγενή μέταλλα υπόκειται σε αυτόματη διάσπαση παρέχονται υδρογόνο και διοξείδιο του άνθρακα:
![]()
Η παραπάνω καταλυτική διάσπαση του μυρμηκικού οξέος αξιοποιείται στην κατασκευή ηλεκτρικών στοιχείων καυσίμων, τα οποία τροφοδοτούνται άμεσα με μυρμηκικό οξύ ως "καύσιμο".
Τα μυρμηκικά άλατα των αλκαλίων, με προσεκτική θέρμανση διασπώνται προς οξαλικά άλατα και υδρογόνο:
2 HCOONa
![]() (COONa)2 +
H2
(COONa)2 +
H2
 |
ΠΡΟΣΟΧΗ !!! Η ανάμιξη πυκνού μυρμηκικού οξέος με πυκνό θειικό οξύ θα οδηγήσει σε εξώθερμη παραγωγή μεγάλων ποσοτήτων του άοσμου αλλά τοξικότατου μονοξειδίου του άνθρακα. Το ίδιο αέριο θα παραχθεί και κατά τη ισχυρή θέρμανση ατμών μυρμηκικού οξέος. Σε κάθε περίπτωση το μυρμηκικό οξύ θα πρέπει να θεωρείται ως μια επικίνδυνη εν δυνάμει πηγή μονοξειδίου του άνθρακα. |
 |
Ηλετρόλυση μυρμηκικών αλάτων. Η ηλεκτρόλυση των μυρμηκικών αλάτων παρουσιάζει το -εκ πρώτης όψεως- παράδοξο φαινόμενο της έκλυσης υδρογόνου τόσο στην κάθοδο, όσο και στην άνοδο, π.χ. για την ηλεκτρόλυση υδατικού διαλύματος HCOONa:
Κάθοδος: 2
Η2Ο + 2 e-
![]() 2 OH- + H2
'Ανοδος: 2 HCOO-
2 OH- + H2
'Ανοδος: 2 HCOO-
![]() 2 CO2 + H2 + 2
e-
2 CO2 + H2 + 2
e-
|
|
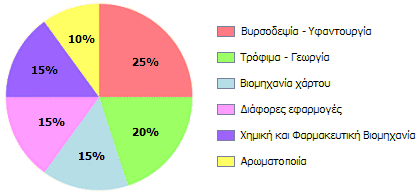
Πεδία εφαρμογών μυρμηκικού οξέος κατά το 2011 [πηγή]. |
Εφαρμογές μυρμηκικού οξέος [Αναφ. 7]
Οι μεγαλύτερες ποσότητες μυρμηκικού οξέος, τουλάχιστον στην Ευρώπη, διοχετεύονται στην κτηνοτροφία, όπου χρησιμοποιείται ως συντηρητικό και αντιβακτηριακό πρόσθετο των κτηνοτροφών. Επιβραδύνει τις διαδικασίες αποσύνθεσης και παρέχει τη δυνατότητα μακρόχρονης αποθήκευσης των κτηνοτροφών κατά τον χειμώνα και σταδιακά αντικαθιστά τα χρησιμοποιούμενα αντιβιοτικά, η χρήση των οποίων υπόκειται σε συνεχώς αυξανόμενους περιορισμούς.
Μυρμηκικό οξύ και άλατά του χρησιμοποιούνται ως συντηρητικά τροφίμων (Ε236: μυρμηκικό οξύ, Ε237: μυρμηκικό νάτριο, Ε238: μυρμηκικό ασβέστιο). Ωστόσο, η χρήση αυτή μυρμηκικών αλάτων απαγορεύεται σε ορισμένες χώρες (Γαλλία, Αυστραλία).
Το μυρμηκικό οξύ είναι σχετικά ισχυρό και περιβαλλοντικά φιλικό οργανικό οξύ και επιπλέον χαμηλού κόστους. 'Οπου χρειάζεται εξουδετέρωση ισχυρώς βασικών διαλυμάτων ή λημμάτων εξετάζεται η δυνατότητα χρήσης του και ως εκ τούτου οι εφαρμογές του συνεχώς επεκτείνονται. Τυπικό παράδειγμα αποτελεί η βιομηχανία χαρτοπολτού, όπου χρησιμοποιείται για την εξουδετέρωση των ισχυρώς αλκαλικών διαλυμάτων. Ακόμη, το μυρμηκικό κάλιο χρησιμοποιείται ως αντιπαγωτικό μέσο στους αεροδιαδρόμους ως λιγότερο διαβρωτικό για τα αεροσκάφη και περιβαλλοντικώς φιλικότερο σε σχέση με το κοινό αλάτι.
Στην υφαντουργία το μυρμηκικό οξύ χρησιμοποιείται για την εξουδετέρωση της περίσσειας των βάσεων μετά από κάθε επεξεργασία του υφάσματος με αλκάλεα, όπως είναι η προεπεξεργασία βάμβακος, ο αποχρωματισμός, ο μερσερισμός (φινίρισμα, γυάλισμα), η βαφή και καθαρισμός. Απαιτείται σχετικά μικρότερη ποσότητά του και επιπλέον εξασφαλίζει την τελική σωστή περιοχή pH. Αποσυντίθεται τελικά ευκολότερα και απαιτεί λιγότερο οξυγόνο για την αποσύνθεσή του σε σχέση με άλλα οργανικά οξέα.
Το μυρμηκικό οξύ χρησιμοποιείται ευρύτατα στη βιομηχανία φυσικού καουτσούκ (natural rubber, latex) ως πηκτικός παράγοντας (coagulant). To μυρμηκικό οξύ θρομβώνει ("σπάει") το φυσικό γαλάκτωμα και προκαλεί την καθίζηση των μικκυλίων του φυσικού καουτσούκ. Διαθέτει την κατάλληλη οξύτητα για να πραγματοποιηθεί η διαδικασία αυτή με τη σωστή ταχύτητα, δεν αφήνει υπολείμματα στα σχηματιζόμενα φύλλα καουτσούκ και δεν επηρεάζει την ελαστικότητα και το χρώμα τους.
 |
 |
 |
 |
|
|
Αριστερά: Συλλογή γαλακτώματος καουτσούκ από καουτσουκόδεντρο (rubber tree). Δεξιά: Φύλλα φυσικού καουτσούκ (latex) κατά τη φάση της ξήρανσής τους. Μεγάλες ποσότητες μυρμηκικού οξέος κατευθύνονται στη βιομηχανία φυσικού καουτσούκ [πηγή]. |
Αριστερά: Μηχανή μερσερισμού βαμβακερού υφάσματος [πηγή]. Δεξιά: Οι ίνες βαμβακερού υφάσματος πριν (επάνω) και μετά τον μερσερισμό (κάτω). Για την εξουδετέρωση της βάσης καταλληλότερο οξύ είναι το μυρμηκικό [πηγή]. |
|||
Στη βυρσοδεψία και γενικά στη βιομηχανία δέρματος καταναλίσκονται μεγάλες ποσότητες μυρμηκικού οξέος. Το μυρμηκικό οξύ εξασφαλίζει ομαλή και ομοιόμορφη δέψη (tanning) του ακατέργαστου δέρματος, που πραγματοποιείται σε όξινες συνθήκες και σε όλη τη μάζα, αφού διαπερνά ευκολότερα τις ίνες κολλαγόνου, προετοιμάζοντάς το να δεχθεί τη επίδραση αλάτων χρωμίου για την ολοκλήρωσης της δεψικής διαδικασίας. Επιπλέον, κατά τη διαδικασία της βαφής του δέρματος, εξασφαλίζει σταθερότερο pH, όπως και σταθερότερη καθήλωση των διαφόρων χρωμάτων.
|
Μεγάλες ποσότητες πυκνών υδατικών διαλυμάτων αλάτων μυρμηκικού οξέος χρησιμοποιούνται ως ρευστά γεώτρησης. |
'Αλλες χρήσεις του μυρμηκικού οξέος: Παρασκευή όξινων απορρυπαντικών διαλυμάτων οικιακής χρήσης για την απομάκρυνση αλάτων ασβεστίου από υδραυλικές εγκαταστάσεις, ως συντηρητικό τροφίμων, σύνθεση μυρμηκικών εστέρων (αρωματικά πρόσθετα) και ως πρώτη ύλη για τη σύνθεση πλήθους χημικών και φαρμακευτικών ενώσεων.
'Αλατα μυρμηκικού οξέος με διάφορα μέταλλα παρουσιάζουν άφθονη διαλυτότητα στο νερό (π.χ. στους 20ºC η διαλυτότητα των HCOOK και HCOOCs είναι 337 και 450 g/100 mL και ειδικά βάρη: από 1,6 έως 2,3 g/mL). Τα υπερπυκνά διαλύματα των αλάτων αυτών, γνωστά ως μυρμηκικές άλμες (formate brines) χρησιμοποιούνται στις γεωτρήσεις για αναζήτηση πετρελαίου και αποτελούν μια ξεχωριστή ομάδα των ονομαζόμενων ρευστών γεώτρησης (drilling fluids).
Ο ρόλος των ρευστών γεώτρησης είναι πολλαπλός: δρουν ως μη διαβρωτικά λιπαντικά κατά τις γεωτρήσεις, αποτρέπουν την υπερθέρμανση της διατρητικής κεφαλής του γεωτρυπάνου, οι μεγάλες συγκεντρώσεις σε άλατα δεν επιτρέπουν την ενυδάτωση των πετρωμάτων και τον σχηματισμό ενοχλητικών πηλών, κάτι που θα συνέβαινε αν γινόταν χρήση καθαρού νερού, ενώ το μεγάλο ειδικό βάρος τους διευκολύνει την απομάκρυνση του χώματος κατά την πρόοδο της γεώτρησης.
|
Video από το Youtube που δείχνει έναν τρόπο χρήσης του μυρμηκικού οξέος για την αντιμετώπιση του ακάρεος βαρρόα. |
Μίγμα ίσων μερών μυρμηκικού και μηλονικού θαλλίου, HCOOTl + CH2(COOTl)2, διαλύεται άφθονα σε νερό παρέχοντας διάλυμα που μπορεί να φθάσει σε πυκνότητα 4,25 g/mL, ένα από τα πυκνότερα γνωστά υδατικά διαλύματα (τυπική σύνθεση: 300 g από το κάθε άλας + 40 mL ύδατος). Στο διάλυμα αυτό επιπλέουν ορυκτά, όπως οι σπινέλιοι, οι γρανάτες, το κορούνδιο και τα διαμάντια.
Το παραπάνω κορεσμένο διάλυμα των δύο οργανικών αλάτων του θαλλίου είναι γνωστό ως διάλυμα Clerici και το χρησιμοποιούσαν κυρίως για τη μέτρηση της ακριβούς πυκνότητας μικρών κόκκων ορυκτών και κυρίως ημιπολύτιμων και πολύτιμων λίθων. Πρόβλημα αποτελούσε η διαβρωτικότητα και η μεγάλη τοξικότητα του διαλύματος Clerici εξαιτίας του περιεχόμενου θαλλίου. Σήμερα, το διάλυμα Clerici ουσιαστικά δεν χρησιμοποιείται λόγω της επικινδυνότητάς του.
Το μυρμηκικό οξύ χρησιμοποιείται στη μελισσοκομία για την αντιμετώπιση του καταστροφικού ακάρεος βαρρόα (Varroa destructor). Το άκαρι αυτό είχε καταστρέψει κατά το παρελθόν τη μελισσοκομία μεγάλων περιοχών όπως και ολόκληρων χωρών (είχε συμβεί το 1978-80 στη χώρα μας). Οι μελισσοκόμοι αναφέρονται σε αυτό το καταστροφικό άκαρι περιγράφοντάς το ως "μικρό καβούρι".
Η βαρρόα αναπτύσσεται στα κλειστά κελιά του γόνου και κυρίως στα κηφηνοκελιά, όπου γεννά τα αυγά του (έως και επτά), από τα οποία τελειοποιούνται ακόμη και τα μισά. Το άκαρι προσκολλάται στο σώμα της μέλισσας και έτσι μεταφέρονται τα αυγά του στα διάφορα κελιά της κυψέλης. Το αναπτυγμένο άκαρι τρέφεται από τον γόνο (προνύμφες) των μελισσών με τελικό αποτέλεσμα την καταστροφή της κυψέλης. Η βαρρόα καταπολεμείται αποτελεσματικά με μυρμηκικό οξύ είτε σε μορφή ατμού , είτε ποτισμένο σε τεμάχια χαρτονιού ή μοριοσανίδων σε θερμοκρασίες 18-25ºC (μέση απαιτούμενη ποσότητα μυρμηκικού οξέος: 85 g/κυψέλη).

Η βαρρόα (δεξιά) είναι ένα άκαρι (γνωστό και ως "μικρό καβούρι") που έχει καταστρέψει κατά το παρελθόν την μελισσοκομία μεγάλων περιοχών, αλλά και ολόκληρων χωρών.
Ο αποτελεσματικότερος τρόπος αντιμετώπισης της βαρρόα είναι η έκθεση των πλαισίων με τις τεχνητές φωλιές σε ατμούς μυρμηκικού οξέος.
Μεταβολισμός και τοξικότητα του μυρμηκικού οξέος [Αναφ. 8]
Μεταβολισμός. Το μυρμηκικό οξύ και τα ιόντα του εμφανίζονται ως φυσιολογικά προϊόντα του μεταβολισμού ενώσεων με ένα άτομο άνθρακα (κυρίως της μεθανόλης). Το τελικό προϊόν του μεταβολισμού του είναι το διοξείδιο του άνθρακα. Αν χορηγηθούν άλατά του αναμένεται να υπεισέλθουν στον μεταβολισμό ενώσεων με ένα άτομο άνθρακα. Ωστόσο, ο βαθμός μεταβολισμού τους φαίνεται πως εξαρτάται και από το είδος του οργανισμού. Για παράδειγμα, μετά τη χορήγηση μεθανόλης σε κουνέλια, δεν παρατηρείται αποβολή μυρμηκικών στα ούρα (πλήρης μεταβολισμός), ενώ στους σκύλους η μισή ποσότητα αποβάλλεται (ατελής μεταβολισμός). Για τον άνθρωπο, ο μεταβολισμός του μυρμηκικού οξέος βρίσκεται κάπου ενδιάμεσα.
|
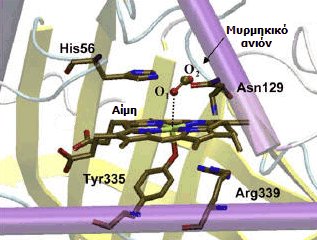
Θέση πρόσδεσης αίμης-μυρμηκικού ανιόντος σε μια καταλάση [Αναφ. 8στ]. |
Το μυρμηκικό οξύ είναι τοξικότερο από τα άλλα λιπαρά οξέα, πιθανώς λόγω της ανασχετικής δράσης σε διάφορα ένζυμα, παρ' όλα αυτά δεν έχουν παρατηρηθεί σωρευτικά τοξικά αποτελέσματα. Το μυρμηκικό οξύ δρα ως αναστολέας της μιτοχονδριακής κυτοχρωμικής οξειδάσης και προκαλεί ιστοτοξική υποξία (παρεμποδίζει την οξυγόνωση των ιστών). Η δράση των μυρμηκικών ανιόντων είναι ανάλογη με εκείνη των κυανιούχων και των όξινων θειούχων ιόντων, αλλά κατά πολύ ασθενέστερη.
Οξεία τοξικότητα. Δεν αναφέρονται τιμές LD50. Χορήγηση σε σκύλους μυρμηκικού νατρίου 4 g/kg από το στόμα και 3 g/kg ενδοφλεβίως προκάλεσε μεθαιμοσφαιριναιμία (υπερβολική ποσότητα μεθαιμοσφαιρίνης -αιμοσφαιρίνης που ο Fe(II) έχει οξειδωθεί σε Fe(III)- στο αίμα, το οποίο χάνει έτσι την ικανότητα μεταφοράς οξυγόνου στους ιστούς) και καρδιακή συμφόρηση. Σε ποσότητες 50 mg/kg σε σκύλους (από το στόμα) και 6 mg/kg σε κουνέλια (υποδερμικά) προκάλεσε μεθαιμοσφαιριναιμία που διήρκησε περίπου 10 ημέρες.
Η βραδεία μείωση της μεθαιμοσφαιριναιμίας ενδεχομένως οφείλεται στην παρεμποδιστική δράση των μυρμηκικών πάνω στο ένζυμο καταλάση (η θέση πρόσδεσης των μυρμηκικών στο ένζυμο έχει εντοπισθεί με μελέτες με ακτίνες Χ [Αναφ. 8στ]). Χορήγηση σε καθημερινή βάση 2-4 g μυρμηκικού νατρίου σε ανθρώπους δεν προκάλεσε κάποια τοξικά συμπτώματα, ακόμη και όταν υπήρχε νεφρική δυσλειτουργία.
Μελέτες in vitro έδειξαν ότι οι τοξικές επιπτώσεις για την όραση από την κατάποση μεθανόλης, που μπορεί να οδηγήσουν ακόμη και στην τύφλωση, μπορούν να αποδοθούν στη δράση των μυρμηκικών ανιόντων στους φωτοϋποδοχείς του αμφιβληστροειδούς χιτώνα. Χορήγηση μυρμηκικών αλάτων οδηγούν στα ίδια συμπτώματα με εκείνα που προκαλεί η λήψη μεθανόλης, παρά το γεγονός ότι δεν μεσολαβεί η παρουσία φορμαλδεΰδης ως ενδιάμεσου προϊόντος οξείδωσης, όπως όταν χορηγείται μεθανόλη.
Η επαφή πυκνού μυρμηκικού οξέος με το δέρμα προκαλεί σοβαρότερα εγκαύματα από εκείνα που προκαλεί το οξικό οξύ αντίστοιχης περιεκτικότητας. Ωστόσο, όπως διαπιστώθηκε στην περίπτωση ενός 15χρονου κοριτσιού, τα εγκαύματα έχουν μικρότερη σημασία, απ' όση έχουν τα τοξικά αποτελέσματα του μυρμηκικού οξέος στα οποία περιλαμβάνονται μεταβολική οξέωση, ενδαγγειακή αιμόλυση και αιμοσφαιρινουρία, ανάλογα με εκείνα που προκαλούνται μετά την κατάποση μεγάλων ποσοτήτων μυρμηκικών αλάτων. Επομένως το μυρμηκικό οξύ εισέρχεται μέσω του δέρματος στην κυκλοφορία του αίματος.


 Μυρμήγκια,
μυρμηγκοφωλιές και μυρμηκικό οξύ [
Μυρμήγκια,
μυρμηγκοφωλιές και μυρμηκικό οξύ [