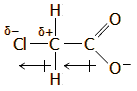 |
 |
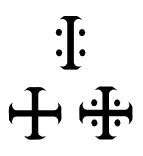 |
|
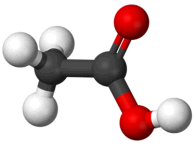
To ξίδι περιέχει οξικό οξύ σε αναλογία 4 έως 8%. |
Αλχημιστικά σύμβολα του ξιδιού (λατινικά: acetum) |
Γενικά για το οξικό οξύ
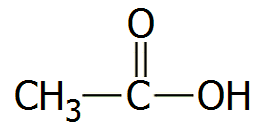
Το οξικό οξύ (αιθανικό οξύ ή αιθανοϊκό οξύ -κατά IUPAC-, acetic acid από το λατινικό acetum: ξίδι) με χημικό τύπο CH3COOH, είναι το δεύτερο μέλος της ομόλογης σειράς των καρβοξυλικών οξέων (πρώτο είναι το μυρμηκικό οξύ, HCOOH). Το οξικό οξύ είναι το πιο κοινό και ευρύτερα χρησιμοποιούμενο οργανικό οξύ. Αποτελεί σημαντική πρώτη ύλη για πολλές χημικές βιομηχανίες, για την παραγωγή πλήθους σημαντικών οργανικών ενώσεων. Η παγκόσμια ζήτησή του φθάνει τα 6,5 εκατομμύρια τόνους (1,5 εκατομμύριο τόνοι λαμβάνονται με ανακύκλωση). Ακόμη, το οξικό οξύ είναι ένα από τα παλαιότερα οξέα που έχει χρησιμοποιήσει ο άνθρωπος, αφού αποτελεί το κύριο συστατικό του ξιδιού (όξους) (vinegar, από την παλαιά Γαλλική λέξη vinaigre: ξινό κρασί), το οποίο είναι ένα αραιό (4-8%) διάλυμα του οξικού οξέος και προϊόν της οξικής ζύμωσης των οίνων.
Ιστορικά, το οξικό οξύ (ως ξίδι), ως ευφραντικό αλλά και ως συντηρητικό (καρπών, κρέατος, ψαριών), είναι γνωστό στον άνθρωπο από χιλιετίες. Πέραν των χρήσεων αυτών, ήταν γνωστή και η χρήση του ως αντισηπτικού και απολυμαντικού τραυμάτων. Ο Ιπποκράτης συνιστούσε το ξίδι για πολλές ασθένειες. Οι παλαιότερες γραπτές πηγές που αναφέρονται στο ξίδι είναι Κινεζικές και χρονολογούνται γύρω στο 2000 π.Χ., αν και ίχνη του (προφανώς αλάτων του) βρέθηκαν σε αιγυπτιακές υδρίες χρονολογούμενες από το 3.000 π.Χ.
Η διαβρωτική δράση του οξικού οξέος πάνω σε μέταλλα όπως ο χαλκός και η μόλυβδος, ήταν γνωστή από την αρχαιότητα. Οι Ρωμαίοι έβραζαν ξινισμένο κρασί σε μολύβδινα δοχεία για να παρασκευάσουν ένα γλυκό σιρόπι (sapa), που το χρησιμοποιούσαν ως γλυκαντικό(!) και ως φάρμακο. Η γεύση του οφειλόταν στον σχηματισμό οξικού μολύβδου (γνωστό άλας στους αλχημιστικούς κύκλους ως "ζάχαρη μολύβδου" ή "άλας του Κρόνου"), ο οποίος έχει γλυκιά γεύση. Το σιρόπι αυτό το χρησιμοποιούσε η ρωμαϊκή αριστοκρατία και σε αυτό οφείλεται η παρουσία αφύσικα μεγάλων ποσοτήτων μολύβδου στα οστά αρχαίων ρωμαίων. Σύμφωνα με κάποιες θεωρίες, σε δηλητηρίαση από μόλυβδο (μολυβδίαση) αποδίδονται οι διαταραγμένες συμπεριφορές πολλών γνωστών Ρωμαίων αυτοκρατόρων και αξιωματούχων, όπως και γενικότερα η κατάρρευση της Ρωμαϊκής Αυτοκρατορίας.
Μέθοδοι παρασκευής οξικού οξέος
Οξικό οξύ μπορεί να παρασκευασθεί με ζύμωση (αερόβια ή και αναερόβια) που αποβλέπει κυρίως στην παρασκευή ξιδιού. Κατά το παρελθόν, σε βιομηχανική κλίμακα οξικό οξύ παρασκευαζόταν με ξηρά απόσταξη ξύλων. Στο εργαστήριο μπορεί να παρασκευασθεί με μεγάλη ποικιλία μεθόδων (χωρίς οικονομική βέβαια σημασία). Σήμερα, οι βιομηχανικές μέθοδοι σύνθεσης οξικού οξέος βασίζονται σε φθηνές πρώτες ύλες που επιτρέπουν την παρασκευή του σε ποσότητες της τάξης μερικών εκατομμυρίων τόνων ετησίως. Ακολουθούν συνοπτικές περιγραφές των μεθόδων αυτών.
Αερόβια ζύμωση. Το οξικό οξύ, ως αραιό υδατικό διάλυμα (ξίδι) είναι προϊόν ζύμωσης ουσιών που περιέχουν υδατάνθρακες. Το πρώτο προϊόν της ζύμωσης είναι η αιθανόλη που στη συνέχεια οξειδώνεται προς οξικό οξύ από τα βακτήρια οξικού οξέος (acetic acid bacteria, AAB). Πρόκειται για αερόφερτα, ραβδόμορφα βακτήρια που αφθονούν στη φύση και βρίσκονται σε κάθε περιβάλλον, όπου σχηματίζεται αιθανόλη με ζύμωση υδατανθράκων, όπως και στα "χαλασμένα" (π.χ. από χτύπημα) φρούτα και φυσικά στους χαλασμένους (ξινισμένους) οίνους [Αναφ. 2].
|
Τα "χέλια του ξιδιού" (vinegar eels). Νηματώδεις οργανισμοί (Turbatrix aceti ) που ζουν μέσα σε ξίδια που δεν έχουν παστεριωθεί. Είναι ορατοί με το μάτι (φτάνουν τα 2 mm) και είναι αβλαβείς, αν και σε ορισμένες χώρες δεν επιτρέπεται η παρουσία τους στο ξίδι. |
Τα βακτήρια του οξικού οξέος παράγουν το ένζυμο αιθανολοξειδάση. Αυτά ως τροφή χρησιμοποιούν αζωτούχες θρεπτικές ουσίες που βρίσκουν στους οίνους. Η όλη διαδικασία (οξοποίησης) πραγματοποιείται σε συνήθεις θερμοκρασίες (συνήθως 18-35ºC). Ο αερισμός αποτελεί κρίσιμο στάδιο της διαδικασίας ζύμωσης και βασικός παράγοντας της ποιότητας του λαμβανόμενου ξιδιού. Υπερβολικός αερισμός μπορεί να είναι καταστρεπτικός οδηγώντας σε πλήρη οξείδωση των υδατανθράκων προς διοξείδιο του άνθρακα από τη ζύμη και άλλα αερόβια βακτήρια, ενώ περιορισμένος αερισμός οδηγεί στην ανάπτυξη μεγάλων συγκεντρώσεων αιθανόλης, που προκαλούν τον θάνατο των βακτηρίων οξικού οξέος. 'Ετσι, η συγκέντρωση της αιθανόλης δεν πρέπει να είναι μικρότερη του 2% ούτε ανώτερη του 12%. Αρχικά η αιθανόλη οξειδώνεται προς ακεταλδεΰδη (CH3CHO) και στη συνέχεια η ακεταλδεΰδη οξειδώνεται προς οξικό οξύ. Η συνολική αντίδραση μπορεί να αποδοθεί ως εξής:
![]()
'Εχουν αναπτυχθεί διάφορες μέθοδοι ζύμωσης, με απώτερο σκοπό την επιτάχυνση της διαδικασίας. Από αυτές, οι πλέον χρησιμοποιούμενες είναι οι ακόλουθες:
1. Μέθοδος της Ορλεάνης: Η μέθοδος φέρει το όνομα της Γαλλικής πόλης, όπου τελειοποιήθηκε. Απαιτεί ιδιαίτερη τέχνη και εμπειρία. Ο οίνος (από σταφύλια ή μηλίτης -για το "μηλόξιδο"-) φέρεται σε μεγάλα βαρέλια με τρύπες για να εισέρχεται αέρας. Η παλαιότητα των βαρελιών και το είδος του ξύλου τους είναι καθοριστικός παράγοντας για την καλή ποιότητα του ξιδιού. Εκεί το κρασί αναμιγνύεται με ένα βλεννώδες υλικό από κυτταρίνη και πηκτίνες, πλούσιο στα απαραίτητα βακτήρια οξικής ζύμωσης. Το υλικό αυτό είναι γνωστό ως mother of vinegar και μικρές ποσότητές του συναντούμε συχνά ως ίζημα ή αιώρημα και στο ξίδι του εμπορίου. Αυτό το βλεννώδες υλικό προέρχεται από προηγούμενες παρτίδες οξοποίησης. Ο οίνος αφήνεται στα βαρέλια για μεγάλο διάστημα. Η ιδανική θερμοκρασία του χώρου ζύμωσης είναι 29ºC. Η μέθοδος μπορεί να είναι "συνεχής", δηλ. από τα βαρέλια παραλαμβάνεται ποσότητα έτοιμου ξιδιού και συμπληρώνονται με επιπλέον ποσότητες κρασιού. Μικρό κλάσμα της αιθανόλης του οίνου παραμένει αναλλοίωτο και συχνά το ξίδι περιέχει μικρές ποσότητες οξικού αιθυλεστέρα, που συνεισφέρει στην οσμή του. Το ξίδι που παράγεται με τη μέθοδο Ορλεάνης περιέχει 4-8% οξικό οξύ.
2. Γερμανική μέθοδος ή μέθοδος ταχείας οξοποίησης: Εφαρμόστηκε για πρώτη φορά στη Γερμανία το 1823 από τον χημικό Schützenbach. Η μέθοδος βασίζεται σε ζύμωση που πραγματοποιείται σε ένα όρθιο βαρέλι χωρισμένο σε τρία μέρη. Το μεσαίο (και μεγαλύτερο) είναι πακεταρισμένο με ροκανίδια ή ξυλάνθρακα, που συγκρατούν τα βακτήρια. Το αλκοολούχο υγρό εισέρχεται από πάνω και αέρας από τον πυθμένα. Κατά την οξείδωση της αιθανόλης εκλύεται θερμότητα. Έτσι, στο επάνω τμήμα η θερμοκρασία είναι 27ºC, ενώ στον πυθμένα φθάνει τους 35ºC. Στα σύγχρονα συστήματα ελέγχεται η θερμοκρασία με σπειράματα ψύξης για να αποφευχθεί η υπερθέρμανση. Με τη μέθοδο αυτή η οξοποίηση μπορεί να πραγματοποιηθεί σε λίγες ημέρες και η περιεκτικότητα του λαμβανόμενου ξιδιού σε οξικό οξύ είναι 10 έως 12% [Αναφ. 2στ].
3. Σύγχρονη οξοποίηση (μέθοδος γνωστή ως "submerged culture": βυθισμένη καλλιέργεια): Η μεγαλύτερη ποσότητα ξιδιού σήμερα παράγεται με τη μέθοδο που περιέγραψαν πρώτοι το 1949 οι Otto Hromatka και Heinrich Ebner. Το αλκοολούχο διάλυμα υφίσταται ζύμωση προς ξίδι σε μια δεξαμενή (από ανοξείδωτο χάλυβα), όπου αναδεύεται συνεχώς, ενώ το οξυγόνο τροφοδοτείται με μορφή φυσαλίδων μέσα στο διάλυμα. Η ιδανική θερμοκρασία είναι περίπου 27ºC. Με αυτό τον τρόπο, μετατρέπεται σε ξίδι με συγκέντρωση 15% οξικό οξύ μέσα σε 2 - 3 ημέρες. Με τη μέθοδο αυτή όλη η αιθανόλη μετατρέπεται σε οξικό οξύ και έτσι το παραγόμενο ξίδι έχει πολύ δριμύτερη γεύση λόγω της μεγαλύτερης περιεκτικότητας σε οξικό οξύ.
 |
 |
 |
 |
|
Παραγωγή ξιδιού: (1) Γερμανική μέθοδος (μέθοδος Schützenbach). (2-3): Χώροι παρασκευής με τη μέθοδο Ορλεάνης (Goelles Distillery & Vinegar Production). (4) Αντιδραστήρες ταχείας οξοποίησης. |
|||
Αναερόβια ζύμωση. Ορισμένα είδη αναερόβιων βακτηρίων, όπως πολλά μέλη του γένους Clostridium [Αναφ. 3], όπως το Clostridium acetobutylicum μπορούν να μετατρέψουν τη γλυκόζη (και άλλα σάκχαρα), απευθείας σε οξικό οξύ, χωρίς να χρειαστεί σχηματισμός ή η παρουσία αιθανόλης. Σε αυτήν τη βακτηριακή δράση συχνά οφείλεται το ονομαζόμενο "ξύνισμα" ορισμένων πολλών γλυκών φρούτων. Η στοιχειομετρική εξίσωση της αντίδρασης που γίνεται είναι η εξής:
![]()
Ωστόσο, τα βακτήρια αυτά είναι λιγότερο ανθεκτικά στα οξέα με αποτέλεσμα να μπορούν να παράγουν ξίδι πολύ χαμηλής περιεκτικότητας σε οξικό οξύ, σε αντίθεση με τα αερόβια που μπορούν να φτάσουν μέχρι και 20%. Βιομηχανικό ενδιαφέρον παρουσιάζει το γεγονός ότι αυτά τα οξογόνα βακτήρια μπορούν να συνθέσουν οξικό από οργανικές ενώσεις με ένα άνθρακα, όπως η μεθανόλη, το μονοξείδιο του άνθρακα, ακόμη και από μίγμα διοξειδίου του άνθρακα και υδρογόνου:
![]()
 |
|
 |
|
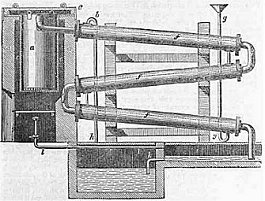
Μονάδα ξηράς απόσταξης ξύλου [Αναφ. 4α]. |
Εργοστάσιο παραγωγής οξικού οξέος (Γερμανία, 1884) |
Πυροξυλικό οξύ, ξύλοξος, ξίδι ξύλου (wood vinegar) |
Παραγωγή με ξηρά απόσταξη ξύλου. Πρόκειται για μια παλαιά μέθοδο παραγωγής οξικού οξέος, όπως και άλλων χημικών (μεθανόλη, ακετόνη) η οποία βασιζόταν στην ξηρά απόσταξη ξύλων. Μεγάλες ποσότητες ξύλων στοιβάζονταν σε σιδερένιους αποστακτήρες (retorts) και θερμαίνονταν στους 205-260 ºC, με καύση ξύλων, όπως και των ίδιων των αερίων που δημιουργούνταν κατά τη θερμική διάσπασή τους. Το απόσταγμα συλλεγόταν σε δεξαμενές, όπου η πίσσα αφηνόταν να κατακαθίσει [Αναφ. 4].
Tο υπερκείμενο υγρό ήταν ένα σκούρο καφεκόκκινο υγρό, με τη χαρακτηριστική καυστική οσμή καμένου ξύλου, το πυροξυλικό οξύ (pyroligneous acid), γνωστό και ως ξύλοξος ή ξίδι ξύλου (wood vinegar). Πρόκειται ένα υδαρές (80-90% νερό) μίγμα οξικού οξέος, μεθανόλης, ακετόνης, αλλυλικής αλκοόλης και άλλων πτητικών οργανικών ουσιών. Το απόσταγμα αυτό επεξεργαζόταν με ασβέστη για να κατακρατηθεί το οξικό οξύ ως οξικό ασβέστιο, από το οποίο λαμβανόταν στη συνέχεια οξικό οξύ με επίδραση θειικού οξέος ή ακετόνη με θερμική διάσπασή του. Σήμερα χρησιμοποιείται σε μικρή κλίμακα ως βελτιωτικό εδάφους (λίπασμα) και ως (αμφιβόλου αποτελεσματικότητας) απολυμαντικό.
Γενικά, από 100 μέρη ξύλου λαμβάνονται 35-45 μέρη πυροξυλικού οξέος, το οποίο περιέχει 3 έως 9% οξικό οξύ (ανάλογα με το είδος του ξύλου) [Αναφ. 4β]. Στο παρελθόν, η παραγωγή οξικού οξέος με τη μέθοδο αυτή γινόταν σε μεγάλη κλίμακα. Το 1910, στη Γερμανία η παραγωγή οξικού οξέος με ξηρά απόσταξη ξύλου είχε φτάσει τους 10.000 τόνους και η μεγαλύτερη ποσότητά του κατευθυνόταν στη βιομηχανία χρωμάτων.
Θα πρέπει να σημειωθεί ότι η απομόνωση καθαρού οξικού οξέος από το ξίδι είναι μια όχι ιδιαίτερα αποδοτική διαδικασία. Διαδοχικές αποστάξεις οδηγούν σε απόσταγμα συνεχώς και πλουσιότερο σε οξικό οξύ (δεν σχηματίζεται αζεοτροπικό μίγμα), αλλά στο τέλος είναι ουσιαστικά αδύνατον να ληφθεί καθαρό οξύ. Ωστόσο, το νερό μπορεί να απομακρυνθεί αν στο εμπλουτισμένο σε οξικό οξύ μίγμα οξικού οξέος - ύδατος προστεθεί οξικός αιθυλεστέρας, ο οποίος σχηματίζει αζεοτροπικό με το νερό που ζέει στους 70,4°C. 'Ετσι, ο οξικός αιθυλεστέρας παρασέρνει το νερό και αφήνει πίσω σχεδόν καθαρό οξικό οξύ [Αναφ. 4γ].
Εργαστηριακές μέθοδοι παρασκευής οξικού οξέος. Οι μέθοδοι αυτές έχουν μόνο ιστορικό ή εκπαιδευτικό χαρακτήρα. Σε πολλές περιπτώσεις ξεκινούν από χημικές ουσίες, οι οποίες είναι είτε παράγωγα του οξικού οξέος ή είναι κατά πολύ ακριβότερες από το ίδιο. 'Επιπλέον, αυτές οι μέθοδοι είναι γενικές για την παρασκευή οργανικών οξέων. Τυπικά παραδείγματα αποτελούν η οξείδωση της αντίστοιχης πρωτοταγούς αλκοόλης (δηλ. της αιθανόλης) με ισχυρά οξειδωτικά αντιδραστήρια, όπως τα διχρωμικά άλατα σε όξινο περιβάλλον. Ανάλογα με τις πυκνότητες των αντιδραστηρίων και τον έλεγχο της θερμοκρασίας (η αντίδραση είναι έντονα εξώθερμη) η οξείδωση μπορεί να οδηγήσει σε ακεταλδεΰδη ή σε οξικό οξύ:
![]()
'Αλλες γενικές μέθοδοι είναι η παρασκευή από το μεθυλοϊωδίδιο: (α) μέσω σχηματισμού νιτριλίου και υδρόλυσή του σε όξινο ή βασικό περιβάλλον και (β) μέσω σχηματισμού αντιδραστηρίου Grignard, αντίδραση με CO2 και υδρόλυση της ένωσης προσθήκης:
![]()
Το 1847 ο Γερμανός χημικός Hermann Kolbe συνέθεσε για πρώτη φορά οξικό οξύ από ανόργανες ενώσεις. Ξεκίνησε από διθειάνθρακα, ο οποίος παρασκευάζεται με διαβίβαση ατμών θείου μέσω ερυθροπυρακτωμένου άνθρακα. Φυσικά η σύνθεση αυτή έχει μόνο ιστορικό ενδιαφέρον και περιγράφεται από την επόμενη αλληλουχία αντιδράσεων:
Βιομηχανικές μέθοδοι παρασκευής οξικού οξέος
Καρβονυλίωση της μεθανόλης. Η πιο αποτελεσματική βιομηχανική μέθοδος παρασκευής οξικού οξέος βασίζεται στην καρβονυλίωση της μεθανόλης με μονοξείδιο του άνθρακα [Αναφ. 5]. Mε τη μέθοδο αυτή παρασκευάζεται το 65% της παγκόσμια παραγωγής οξικού οξέος. Η συνολική αντίδραση είναι απλή:
CH3OH + CO
![]() CH3COOH
CH3COOH
Για την αντίδραση χρησιμοποιείται υδροϊώδιο (ΗΙ) το οποίο ανακυκλώνεται σύμφωνα με το επόμενο σχήμα αντιδράσεων:
![]()
|
Καταλύτης Cativa |
Ο παραπάνω κύκλος αντιδράσεων ήταν γνωστός ήδη από το 1913. Το 1925 ο Henry Dreyfus κατασκεύασε μια πιλοτική μονάδα καρβονυλίωσης της μεθανόλης, αλλά λόγω έλλειψης κατάλληλων υλικών που θα αντιμετώπιζαν τη διαβρωτική δράση των εμπλεκόμενων χημικών ουσιών, αλλά και των απαιτούμενων ιδιαίτερα υψηλών υψηλών πιέσεων (> 200 atm), η μέθοδος δεν μπορούσε να είναι οικονομικώς βιώσιμη.
To 1960, η μέθοδος άρχισε να χρησιμοποιείται από τη μεγάλη Γερμανική χημική βιομηχανία BASF (Badische Anilin und Soda Fabrik), όταν διαπιστώθηκε ότι μπορούσε να καταλυθεί επιτυχώς από το ιωδιούχο κοβάλτιο (CoI2). Οι συνθήκες ήταν: θερμοκρασία 250ºC, πίεση 680 atm, απόδοση 90% με βάση τη μεθανόλη.
Το 1968 ανακαλύφθηκε ένας ροδιούχος καταλύτης (cis−[Rh(CO)2I2]−) χάρις στον οποίο η σύνθεση μπορούσε πλέον να πραγματοποιηθεί σε χαμηλότερες πιέσεις. Το 1970, η πολυεθνική χημική βιομηχανία Monsanto δημιούργησε το πρώτο εργοστάσιο παραγωγής οξικού οξέος με καρβονυλίωση της μεθανόλης με βάση αυτήν τον καταλύτη στον οποίο είχε την αποκλειστικότητα. Οι συνθήκες ήταν: θερμοκρασία 150-200ºC, πίεση 20-60 atm, απόδοση >99% με βάση τη μεθανόλη.
Το 1996 άρχισε η χρήση του ιριδιούχου καταλύτη Cativa ([cis−Ir(CO)2I2]−), ο οποίος αξιοποιήθηκε από την Βρετανική εταιρεία BP Chemicals. Τα πλεονεκτήματά του ήταν: σταθερότερος και φθηνότερος καταλύτης, μεγάλες ταχύτητες παραγωγής, μεγάλες αποδόσεις και ως προς τα δύο αντιδρώντα.
Να σημειωθεί ότι η όλη διαδικασία μπορεί να πραγματοποιηθεί με αποκλειστική πρώτη ύλη το μεθάνιο (π.χ. από το φυσικό αέριο), από το οποίο μπορεί να παραχθεί τόσο η μεθανόλη, όσο και το μονοξείδιο του άνθρακα (βλέπε: Χημική ένωση του μήνα: Μεθανόλη).
|
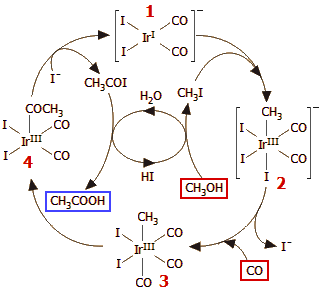
Διεργασία Cativa [Αναφ. 5]
[Σημείωση: Οι τιμές των ευγενών μετάλλων υπόκεινται σε έντονες χρηματιστηριακές διακυμάνσεις. Ενδεικτικές πρόσφατες τιμές (Johnson-Matthey, monthly price report, Ιούλιος 2011) ορισμένων από αυτά (σε $/g) είναι: Rh = 69, Pt = 64, Ir = 37, Pd = 30, Ru = 6,5].
Αναφέρεται ότι
η διεργασία Cativa απαιτεί μικρότερες
ποσότητες νερού στο αντιδραστήριο μίγμα, μειώνοντας τον αριθμό
των στηλών ξήρανσης (μείωση κόστους), περιορίζει τις απώλειες
CO λόγω της αντίδρασης μετατόπισης
ύδατος (water shift reaction, WSR: CO + H2O
Ο γενικός μηχανισμός της αντίδρασης δείχνεται στο πραπλεύρως σχήμα. Ο καταλυτικός κύκλος ξεκινά με την αντίδραση του μεθυλοϊωδιδίου (CH3I) με τη δραστική μορφή (τετραγωνική επίπεδη) του καταλύτη (σύμπλοκο 1) και σχηματισμό του οκταεδρικού συμπλόκου 2. Ακολουθεί αντίδραση ανταλλαγής υποκαταστάτη, όπου ένα Ι αντικαθίσταται από το εισαγόμενο CO (σύμπλοκο 3). Ακολουθεί μετακίνηση ενός CO προς την ομάδα του μεθυλίου, με σχηματισμό του συμπλόκου 4 με διάταξη τετραγωνικής πυραμίδας. Από το σύμπλοκο αυτό αποσπάται το ακετυλοϊωδίδιο (CH3COI) με αναγέννηση της αρχικής μορφής του καταλύτη (σύμπλοκο 1). Το CH3COI υδρολύεται παρέχοντας το τελικό προϊόν (οξικό οξύ) και υδροϊώδιο. Το υδροϊώδιο με την εισαγόμενη μεθανόλη σχηματίζει το CH3I, το οποίο επανεισάγεται στον κύκλο και έτσι η κατανάλωση ιωδίου είναι πρακτικά μηδενική. |
Οξείδωση της ακεταλδεΰδης. Αποτελεί μέθοδο που χρησιμοποιείται ακόμη στην Ευρώπη, αλλά οικονομικώς δεν μπορεί να ανταγωνισθεί την καρβονυλίωση της μεθανόλης. Η ακεταλδεΰδη προέρχεται από την οξείδωση του αιθυλενίου (Διεργασία Wacker: οξείδωση του αιθυλενίου παρουσία χλωριοσυμπλόκου του παλλαδίου(ΙΙ)). Η παραγόμενη ακεταλδεΰδη οξειδώνεται σε υγρή φάση με διαβίβαση αέρα ή καθαρού οξυγόνου παρουσία οξικών αλάτων μαγγανίου, κοβαλτίου ή χαλκού:
![]()
|
Το άνυδρο οξικό οξύ στερεοποιείται σε λευκούς κρυστάλλους σε θερμοκρασίες μικρότερες από τους 16,6ºC για αυτό αναφέρεται και ως "παγόμορφο" (glacial acetic acid). Ελάχιστες ποσότητες ύδατος υποβιβάζουν σημαντικά το σημείο τήξεως. |
Από την Ιαπωνική βιομηχανία Showa Denko αναπτύχθηκε μέθοδος με την οποία πραγματοποιείται σε ένα στάδιο η οξείδωση του αιθυλενίου στην αέρια φάση παρουσία παλλαδιούχου καταλύτη στους 150-160ºC. Αναφέρεται ότι η επιλεκτικότητα της αντίδραση ξεπερνά το 86%, ενώ η σχετική απλότητά της καθιστά οικονομικώς βιώσιμες ακόμη και μικρές βιομηχανικές μονάδες με ετήσια παραγωγή 50.000 - 100.000 τόνων [Αναφ. 5γ].
Οξείδωση ελαφρών υδρογονανθράκων. Οξικό οξύ μπορεί να παραχθεί με οξείδωση του βουτανίου ή ελαφριών κλασμάτων νάφθας (κυρίως πεντανίου και εξανίου) μέσω ενδιάμεσου σχηματισμού ακεταλδεΰδης. Η αντίδραση πραγματοποιείται σε όσο το δυνατόν υψηλότερες θερμοκρασίες αλλά και υψηλή πίεση, ώστε το βουτάνιο να παραμένει υγρό. Τυπικές συνθήκες είναι: θερμοκρασία 150°C, πίεση 55 atm και η παρουσία οξικών αλάτων μαγγανίου, κοβαλτίου ή χρωμίου. Η ενδιαμέσως παραγόμενη ακεταλδεΰδη οξειδώνεται προς οξικό οξύ και η συνολική αντίδραση παραγωγής οξικού οξέος μπορεί να αποδοθεί από την ακόλουθη εξίσωση:
2 C4H10 + 5 O2
![]() 4 CH3COOH + 2 H2O
4 CH3COOH + 2 H2O
Η αντίδραση συνοδεύεται από αρκετά παραπροϊόντα όπως: μεθανόλη, βουτανόνη, οξικός αιθυλεστέρας, μυρμηκικό οξύ, προπιονικό οξύ. Πολλά από τα παραπροϊόντα έχουν εμπορική αξία και οι συνθήκες της αντίδρασης μπορούν να τροποποιηθούν, έτσι ώστε να αυξηθεί το ποσοστό ορισμένων από αυτά. Ωστόσο, η ανάγκη απαλλαγής του οξικού οξέος από τα παραπροϊόντα αυτά επιβαρύνει το κόστος της μεθόδου.
Είναι απίθανο να κατασκευασθούν άλλες μονάδες παραγωγής οξικού οξέος με αυτήν τη μη επιλεκτική μέθοδο στο μέλλον. Παρ' όλα αυτά η Σαουδαραβική εταιρεία SABIC ενδιαφέρθηκε να κατασκευάσει πιλοτική μονάδα μονάδα παραγωγής οξικού οξέος με άμεση οξείδωση αιθανίου, που αφθονεί ως παραπροϊόν στα διυλιστήρια πετρελαίου της χώρας. Με καταλύτη μίγμα οξειδίων Mo, V, Nb και Pd αναφέρεται επιλεκτικότητα ως προς το οξικό οξύ που φθάνει το 71%. Δεδομένου του μικρού κόστους του αιθανίου πιθανολογείται κόστος παραγωγής ανταγωνιστικό εκείνου που προσφέρει η τεχνολογία της καρβονυλίωσης της μεθανόλης [Αναφ. 5γ].
Χημικές ιδιότητες του οξικού οξέος
Το οξικό οξύ είναι ένα ασθενές οξύ (pK = 4,79) γεγονός που σημαίνει ότι διίσταται ένα πολύ μικρό κλάσμα του (π.χ. σε υδατικό διάλυμα 0,10 Μ διίσταται μόλις το 1,2% των μορίων του). Παρέχει το σύνολο των τυπικών αντιδράσεων των οργανικών οξέων, όπως αντιδράσεις εστεροποίησης, σχηματισμού ακυλοχλωριδίου (ακετυλοχλωρίδιο) με αντιδραστήρια όπως τα PCl5, PCl3, SOCl2, ενώ με ισχυρά αναγωγικά μέσα, όπως το LiAlH4, ανάγεται προς την αντίστοιχη αλκοόλη (αιθανόλη):
![]()
Σε υψηλή θερμοκρασία (700-750°C) το οξικό οξύ διασπάται παρέχοντας κετένιο, ένα αέριο (σ.ζ. -56°C) με δριμύτατη οσμή [Σημείωση: "κετένια" ονομάζονται γενικώς οι ενώσεις του τύπου R-CH=C=O και η συστηματική ονομασία της συγκεκριμένης είναι: "αιθενόνη", ωστόσο είναι ευρύτερα γνωστή ως "κετένιο"]. Το κετένιο είναι πανίσχυρο ακετυλιωτικό μέσο. Το κετένιο μπορεί να ακετυλιώσει το ίδιο το οξικό οξύ παρέχοντας οξικό ανυδρίτη, ένα ισχυρό και πολύ πιο εύχρηστο ακετυλιωτικό μέσο. Απουσία άλλης ουσίας, το κετένιο ακετυλιώνει τον ίδιο τον εαυτό με αντίδραση κυκλοπροσθήκης παρέχοντας το δικετένιο, μια σταθερή λακτόνη (υγρό σ.ζ. 127°C), που μπορεί να χρησιμοποιηθεί ως μια εύχρηστη πηγή κετενίου (διασπάται με θέρμανση προς κετένιο):
![]()
|
Το οξικό οξύ μπορεί εύκολα να ενωθεί με το χλώριο παρέχοντας μονο-, δι- και τριχλωριωμένα παράγωγα στο μεθύλιο. Το ίδιο και με το βρώμιο. Ειδικές μέθοδοι υπάρχουν και για τη σύνθεση φθορο- και ιωδο-παραγώγων. 'Οσο αυξάνεται ο αριθμός των ατόμων χλωρίου, τόσο αυξάνεται και η ικανότητα διάστασης (και επομένως η ισχύς) του αντίστοιχου οξέος. 'Ετσι, το τριχλωροξικό οξύ ουσιαστικά δρα ως ισχυρό οξύ. Η αύξηση της ισχύος του υποκατεστημένου οξικού οξέος από την παρουσία ηλεκτροαρνητικών ατόμων (όπως το Cl) ή άλλων ομάδων μπορεί να ερμηνευθεί ως αποτέλεσμα της επαγωγικής δράσης του υποκαταστάτη, η οποία διαδίδεται προς την καρβοξυλομάδα μέσω των σ-δεσμών του μορίου. Τα σ-ηλεκτρόνια του δεσμού Cl-C έλκονται προς το χλώριο, αφήνοντας το άτομο του α-άνθρακα με ελαφρά θετικό φορτίο. Το ελαφρά θετικό άτομο του α-άνθρακα έλκει ηλεκτρόνια από την αρνητικά φορτισμένη καρβοξυλοομάδα, οπότε καθίσταται σταθερότερο το ανιόν λόγω της διασποράς του φορτίου του ή (ισοδύναμα) η απόσπαση του ιόντος υδρογόνου γίνεται ευκολότερη. Χαρακτηριστικές ιδιότητες των χλωριωμένων παραγώγων του οξικού οξέος σε σύγκριση με τις αντίστοιχες τους οξικού δείχνονται στον επόμενο πίνακα [Αναφ. 6γ].
|
Διμερή οξικού οξέος. Στο κρυσταλλικό (glacial) οξικό οξύ, όπως συμβαίνει και στην περίπτωση μορίων και άλλων "χαμηλών" καρβοξυλικών οξέων στην κρυσταλλική κατάσταση, τα μόρια σχηματίζουν ζεύγη συγκρατούμενα μεταξύ τους μέσω δεσμών υδρογόνου. Τα διμερή αυτά υφίστανται και σε διαλύματα οξικού οξέος, αλλά σε διαλύτες που δεν μπορούν να σχηματίσουν δεσμούς δεσμούς υδρογόνου και θα μπορούσαν να δράσουν ανταγωνιστικά. Αποτέλεσμα αυτών των έντονων διαμοριακών έλξεων των μορίων του οξικού οξέος (και των άλλων καρβοξυλικών οξέων) είναι τα υψηλότερα σημεία ζέσεως και (ιδιαίτερα) τήξεως σε σχέση με τους υδρογονάνθρακες και τις οξυγονούχες ενώσεις συγκρίσιμου μεγέθους (παραπλήσιες μοριακές μάζες) και σχήματος [Αναφ. 6α]:
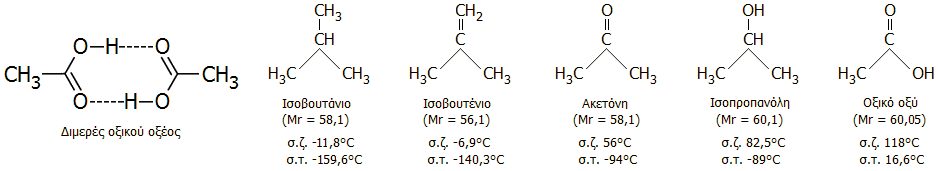
Το οξικό οξύ ως διαλύτης. Το οξικό οξύ δρα ως εξαιρετικός πρωτικός διαλύτης τόσο στο εργαστήριο, όσο και στη βιομηχανία (π.χ. στην παραγωγή τερεφθαλικού οξέος: οξείδωση p-ξυλολίου διαλυμένου σε οξικό οξύ από το οξυγόνο του αέρα) με ικανοποιητική αντοχή στα οξειδωτικά αντιδραστήρια.
Στην αναλυτική χημεία, το άνυδρο οξικό οξύ χρησιμοποιείται ως διαλύτης στον οποίο είναι εφικτή η ογκομέτρηση ασθενών οργανικών βάσεων, των οποίων η ογκομέτρηση στο νερό δεν μπορεί να πραγματοποιηθεί. Τυπικό παράδειγμα αποτελεί η ογκομέτρηση διαλύματος ανιλίνης σε οξικό οξύ (όπου δρα ως ισχυρή βάση σε αντίθεση με την ελάχιστη βασικότητά της στο νερό) με διάλυμα υπερχλωρικού οξέος σε οξικό. Οι εμπλεκόμενες ισορροπίες εκφράζονται από τις αντιδράσεις που ακολουθούν [Αναφ. 7]. Για περισσότερες λεπτομέρειες για το εξισωτικό φαινόμενο και τις ογκομετρήσεις σε μη υδατικούς διαλύτες, βλέπε Χημική ένωση του μήνα: Μαγικό οξύ.
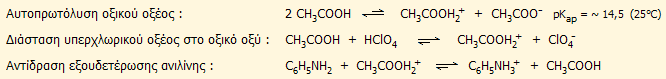
 |
 |
 |
 |
 |
|
Οξικό νάτριο
CH3COONa |
Οξικό κοβάλτιο
(CH3COO)2Co |
Οξικό νικέλιο
(CH3COO)2Ni |
Οξικός χαλκός
(CH3COO)2Cu |
Οξικός μόλυβδος
(CH3COO)2Pb |
'Αλατα του οξικού οξέος. Το οξικό οξύ σχηματίζει σταθερά άλατα με τα περισσότερα μέταλλα. Τα άλατά του κατά κανόνα είναι πολύ ευδιάλυτα στο νερό ή υπόκεινται σε υδρόλυση σχηματίζοντας αιωρήματα δυσδιάλυτων ένυδρων βασικών αλάτων. Τα άλατα του οξικού οξέος με ισχυρές βάσεις παρέχουν υδατικά διαλύματα ελαφρώς αλκαλικά, ενώ τα οξικά άλατα μετάλλων (των οποίων τα κατιόντα αποτελούν ισχυρά κατιοντικά οξέα, όπως του Al(III), Cr(III), Fe(III) κ.α.) παρέχουν ελαφρώς όξινα διαλύματα, λόγω της υδρόλυσης των κατιόντων. Τα οξικά άλατα είναι άχρωμα εκτός από εκείνα των έγχρωμων κατιόντων. 'Αλατά του (π.χ. με Cu, Pb) μπορούν να παρασκευασθούν και με απ' ευθείας δράση διαλυμάτων οξικού οξέος (ακόμα και του ξιδιού) με μέταλλα σε ρηχούς δίσκους ώστε να υπάρχει επίδραση και του οξυγόνου του αέρα:
Pb +
2 CH3COOH + 1/2 O2
![]() (CH3COO)2Pb + H2O
(CH3COO)2Pb + H2O
|
Παρά τη μεγάλη τοξικότητά του, τον οξικό μόλυβδο, ευρύτερα γνωστό ως "μολυβδοσάκχαρο" λόγω της γλυκιάς γεύσης του, χρησιμοποιούσαν παλαιότερα ως παραδοσιακό φάρμακο για μόλωπες και εγκαύματα, όπως επίσης για βαφές μαλλιών. |
Να σημειωθεί ότι τα οξικά ιόντα παρουσιάζουν μια ασθενή συμπλεκτική ικανότητα και πυκνά διαλύματά τους μπορούν να διαλύσουν άλατα μετάλλων δυσδιάλυτων στο νερό. Τυπικό παράδειγμα αποτελεί η διάλυση του λευκού δυσδιάλυτου PbSO4 σε πυκνό διάλυμα CH3COONH4, γεγονός που μπορεί να χρησιμοποιηθεί στην ποιοτική ανάλυση π.χ. για τη διάκριση του PbSO4 από το επίσης παρόμοιας εμφάνισης και δυσδιάλυτο BaSO4.
![]()
Από τα πλέον γνωστά άλατα του οξικού οξέος είναι: Το οξικό νάτριο, ένα κοινό και φθηνό εργαστηριακό αντιδραστήριο. Χρησιμοποιείται στη βιομηχανία τροφίμων ως συντηρητικό (Ε262). Τα οξικά άλατα του αργιλίου και του σιδήρου χρησιμοποιούνται ως προστύμματα χρωμάτων, ο οξικός χαλκός ως μυκητοκτόνο και για την παρασκευή χρωμάτων ζωγραφικής. Τον οξικό μόλυβδο, γνωστό και ως μολυβοσάκχαρο (sugar of lead) λόγω της γλυκιάς του γεύσης (-ΙΣΧΥΡΟΤΑΤΟ ΔΗΛΗΤΗΡΙΟ-) ο οποίος είχε χρησιμοποιηθεί κατά το παρελθόν για βαφές μαλλιών. Υδατικό διάλυμα οξικού μολύβδου είναι γνωστό ως μολυβόνερο και αποτελεί ένα παραδοσιακό "γιατροσόφι" για εγκαύματα, μελανιές και στραμπουλήγματα. Το οξικό παλλάδιο(ΙΙ) έχει χρησιμοποιηθεί ως καταλύτης στην οργανική σύνθεση.
Το οξικό ασβέστιο κατά το παρελθόν παρασκευαζόταν σε μεγάλες ποσότητες με την εξουδετέρωση με υδροξείδιο του ασβεστίου του πυροξυλικού οξέος, το οποίο λαμβανόταν με ξηρά απόσταξη ξύλου (βλέπε παραπάνω). Το μεγαλύτερο μέρος του χρησιμοποιούσαν για την παρασκευή οξικού οξέος (με επίδραση θειικού οξέος) και το υπόλοιπο για την παρασκευή ακετόνης (με θέρμανση):
(CH3COO)2Ca
+ H2SO4
![]() CaSO4 + CH3COOH
(CH3COO)2Ca
CaSO4 + CH3COOH
(CH3COO)2Ca
![]() CaCO3 + CH3COCH3
CaCO3 + CH3COCH3
|
Τα οξικά ιόντα προσδίδουν σε διάλυμα FeCl3 ένα κόκκινο-καφέ χρώμα. |
Ανίχνευση οξικών ιόντων [Αναφ. 8]. Τα οξικά ιόντα, όπως και όλα τα ιόντα των απλών αλειφατικών οξέων και αρωματικών οξέων παρέχουν ελάχιστες χαρακτηριστικές αντιδράσεις και ο μόνος αξιόπιστος τρόπος ανίχνευσής τους, αλλά και ποσοτικού προσδιορισμού τους είναι οι σύγχρονες χρωματογραφικές τεχνικές και ειδικά η ιοντική χρωματογραφία. Σε σχετικώς παλαιά συγγράμματα ποιοτικής ανάλυσης αναφέρονται ορισμένες "πρόχειρες" μέθοδοι ανίχνευσης οξικών αλάτων σε στερεά δείγματα (σε ποσότητες της τάξης λίγων mg), όπως:
(α) Θέρμανση του δείγματος με μικρή ποσότητα π. θειικού οξέος: Απελευθέρωση οξικού οξέος που γίνεται αντιληπτό από τη χαρακτηριστική οσμή του.
(β) Θέρμανση του δείγματος με αιθανόλη παρουσία μικρής ποσότητας π. θειικού οξέος: Σχηματισμός οξικού αιθυλεστέρα με τη χαρακτηριστική ευχάριστη (φρουτώδη) οσμή.
(γ) Αντίδραση διαλύματος του δείγματος με διάλυμα FeCl3: Σχηματισμός μερικώς υδρολυμένου οξικού συμπλόκου του Fe(III) με κόκκινο-καφέ χρώμα.
(δ) Θέρμανση με περίσσεια διαλύματος πυκνού NaOH μέχρι ξηρού. Το οξικό άλας (π.χ. CH3COONa) διασπάται και στο στερεό υπόλειμμα ανιχνεύεται η παρουσία ανθρακικών που παράγονται κατά την αντίδραση (έκλυση CO2 με την επίδραση ισχυρού οξέος):
CH3COONa +
NaOH
![]() Na2CO3 + CH4
Na2CO3 + HCl
Na2CO3 + CH4
Na2CO3 + HCl
![]() 2 NaCl + CO2 + H2O
2 NaCl + CO2 + H2O
 |
 |
(ε) Θέρμανση στερεού δείγματος με ποσότητα As2O3 οπότε σχηματίζεται αντίδραση σχηματισμού κακοδυλοξειδίου (cacodyl oxide), του οποίου οι ατμοί (ΤΟΞΙΚΟΙ ! !) έχουν μια χαρακτηριστική και δυσάρεστη οσμή σκόρδου:
4 CH3COONa +
As2O3
![]() (CH3)2As-O-As(CH3)2
+ 2 Na2CO3
(CH3)2As-O-As(CH3)2
+ 2 Na2CO3
Το κακοδυλοξείδιο είναι ένα κίτρινο έως ελαφρά κοκκινωπό υγρό (ανάλογα με την καθαρότητά του) ατμίζον υγρό με εξαιρετικά δυσάρεστη οσμή. Παρασκευάσθηκε για πρώτη φορά το 1757 από τον Γάλλο φαρμακοποιό - χημικό Louis-Claude de Cassicourt) με βάση την παραπάνω αντίδραση. Ιστορικά, αποτελεί την πρώτη οργανική ένωση του αρσενικού (με δεσμό C-As) που παρασκευάσθηκε. Συχνά αναφέρεται και ως η πρώτη οργανομεταλλική ένωση, αν και το αρσενικό θεωρείται ως μεταλλοειδές και όχι μέταλλο.
Ασφαλής χρήση του οξικού οξέος. Το άνυδρο οξικό οξύ είναι ιδιαίτερα καυστικό για το δέρμα. Αν και η τοξικότητά του δεν είναι μεγάλη, το ότι διίσταται ελάχιστα και η μικρή λιποφιλικότητα που διαθέτει, διευκολύνουν τη διείσδυσή του στο δέρμα με αποτέλεσμα την πρόκληση σοβαρών ερεθισμών ή και εγκαυμάτων. Φλύκταινες (φουσκάλες) εμφανίζονται συνήθως ώρες μετά την επαφή του δέρματος με το οξύ. Συνιστάται η χρήση προστατευτικών γαντιών από ελαστικό νιτριλίου (Buna-N) και όχι απλών γαντιών από latex, τα οποία το άνυδρο οξικό οξύ διαπερνά εύκολα και τελικά τα διαλύει [Αναφ. 9].
Πρακτικές εφαρμογές του οξικού οξέος
Ετησίως καταναλώνονται περίπου 6,5 εκατομμύρια τόνοι οξικού οξέος από τους οποίους το 1,5 εκατομμύριο τόνων προέρχεται από ανακύκλωση.
Οξικός βινυλεστέρας. Περίπου το 1/3 της παραγωγής του οξικού οξέος χρησιμοποιείται για την παρασκευή οξικού βινυλεστέρα (vinyl acetate monomer, VAM). Πρόκειται για ένα υγρό δυσάρεστης οσμής με σ.ζ. 72,7°C. Η σύνθεσή του πραγματοποιείται κυρίως με την αντίδραση μίγματος αιθυλενίου - οξυγόνου με οξικό οξύ παρουσία παλλαδίου ως καταλύτη [Αναφ. 10]:
![]()
επίσης σε κάποια χρήση βρίσκεται ακόμη η παρασκευή οξικού βινυλεστέρα με βάση την αντίδραση οξικού οξέος με ακετυλένιο σε αέρια φάση υπεράνω οξικού ψευδαργύρου/ξυλάνθρακα στους 170-250°C (παλαιότερα χρησιμοποιούσαν ως καταλύτες άλατα υδραργύρου):
![]()
Ο οξικός βινυλεστέρας χρησιμοποιείται ως πρώτη ύλη (μονομερές) για την παραγωγή είτε του ομοπολυμερούς του είτε συμπολυμερών με άλλα μονομερή, όπως για παράδειγμα το βινυλοχλωρίδιο (CH2=CHCl) ή το ακρυλικό οξύ (CH2=CHCOOH) και διάφορους εστέρες του.
Με υδρόλυση του πολύ(οξικού βινυλεστέρα) λαμβάνεται η πολυβινυλική αλκοόλη (polyvinyl alcohol, PVA), η οποία είναι ένα υδατοδιαλυτό πολυμερές, χρήσιμο βιομηχανικό προϊόν (γαλακτωματοποιητές, κόλλες), αλλά και πρώτη ύλη για την παρασκευή άλλων πολυμερών με εστεροποίηση των υδροξυλίων. Επειδή οι αντιδράσεις σαν αυτές, πραγματοποιούνται σε μεγάλη κλίμακα, το παραγόμενο οξικό οξύ συνήθως παραλαμβάνεται και επαναχρησιμοποιείται (ανακυκλώνεται):

 Οξικός
ανυδρίτης
[Αναφ. 11].
Η
δεύτερη μεγαλύτερη χρήση του οξικού οξέος είναι στην παραγωγή
του οξικού
ανυδρίτη
(περίπου το 25-30% της παραγωγής οξικού οξέος). Ο οξικός ανυδρίτης
είναι ένα διαυγές
καυστικότατο υγρό, ιδιαίτερα αποπνικτικής οσμής και σε κάποιο βαθμό δακρυγόνο.
'Εχει σημείο
ζέσεως 139,8°C, ενώ το σημείο τήξεως είναι -73,1°C. Η
διαλυτότητά του στο ψυχρό νερό είναι περιορισμένη (2,6 g / 100 mL).
Ωστόσο, τα υδατικά διαλύματά του είναι ασταθή, αφού εφυδατώνεται (με
ταχύτητα που εξαρτάται από τη θερμοκρασία) προς οξικό οξύ.
Οξικός
ανυδρίτης
[Αναφ. 11].
Η
δεύτερη μεγαλύτερη χρήση του οξικού οξέος είναι στην παραγωγή
του οξικού
ανυδρίτη
(περίπου το 25-30% της παραγωγής οξικού οξέος). Ο οξικός ανυδρίτης
είναι ένα διαυγές
καυστικότατο υγρό, ιδιαίτερα αποπνικτικής οσμής και σε κάποιο βαθμό δακρυγόνο.
'Εχει σημείο
ζέσεως 139,8°C, ενώ το σημείο τήξεως είναι -73,1°C. Η
διαλυτότητά του στο ψυχρό νερό είναι περιορισμένη (2,6 g / 100 mL).
Ωστόσο, τα υδατικά διαλύματά του είναι ασταθή, αφού εφυδατώνεται (με
ταχύτητα που εξαρτάται από τη θερμοκρασία) προς οξικό οξύ.
Μίγμα μεγαλύτερων ποσοτήτων οξικού ανυδρίτη με νερό, ενώ αρχικά διαχωρίζεται σε δύο φάσεις (πυκνότητα οξικού ανυδρίτη: 1,082 g/mL) κατά την παραμονή αρχίζει να θερμαίνεται λόγω της αντίδρασης εφυδάτωσης. Η αντίδραση επιταχύνεται ακόμη περισσότερο και μπορεί να φθάσει σχεδόν σε εκρηκτικό βαθμό αν δεν ψυχθεί το αντιδρών μίγμα. Η εφυδάτωση του οξικού ανυδρίτη καταλύεται επίσης από την παρουσία ισχυρού οξέος. Για τους λόγους αυτούς πρέπει να αποφεύγεται η ανάμιξη οξικού ανυδρίτη - ύδατος.
Αν και ο οξικός ανυδρίτης είναι ένα κοινό και φθηνό αντιδραστήριο, στο εργαστήριο μπορεί να παρασκευασθεί (ως άσκηση οργανικής σύνθεσης) εύκολα με επίδραση άνυδρου οξικού νατρίου ακετυλοχλωρίδιο σύμφωνα με την αντίδραση:
CH3COONa +
CH3COCl
![]() CH3CO-O-COCH3 + NaCl
CH3CO-O-COCH3 + NaCl
Στη βιομηχανία ο οξικό ανυδρίτης παρασκευάζεται κυρίως με καρβονυλίωση του οξικού μεθυλεστέρα παρουσία ιωδιούχων αλάτων του ροδίου και του λιθίου (κάτω από τελείως άνυδρες συνθήκες). Η συνολική αντίδραση είναι η ακόλουθη:
CH3COOCH3
+ CO
![]() CH3CO-O-COCH3
CH3CO-O-COCH3
που αποτελεί το άθροισμα του ακόλουθου κύκλου αντιδράσεων:
![]()
Σε μικρότερο ποσοστό, οξικός ανυδρίτης παράγεται με αντίδραση του κετενίου (προϊόν θερμικής διάσπασης του οξικού οξέος ή της ακετόνης, βλ. παραπάνω) με οξικό οξύ υπό χαμηλή πίεση και θερμοκρασία:
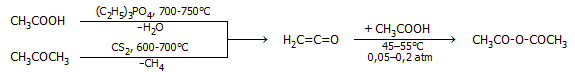
Ο οξικός ανυδρίτης βρίσκει πλήθος εφαρμογών στην οργανική σύνθεση, στη σύνθεση φαρμάκων και γενικά στη χημική βιομηχανία και δρα ως αποτελεσματικό και ήπιο ακετυλιωτικό αντιδραστήριο (δηλ. εισάγει την ομάδα του ακετυλίου CH3CO-). 'Αλλο επίσης δραστικό (δραστικότερο και από τον οξικό ανυδρίτη) ακετυλιωτικό μέσο είναι το ακετυλοχλωρίδιο (acetyl chloride, CH3COCl), αλλά είναι αρκετά πιο δύσχρηστο επειδή είναι πτητικό (ατμίζον υγρό σ.ζ. 52°C με αποπνικτική οσμή) και παρέχει κατά τις ακετυλιώσεις HCl, το οποίο συχνά είναι ανεπιθύμητο.
Ο οξικός ανυδρίτης αντιδρά εύκολα και ποσοτικά με αλκοόλες παρέχοντας τους αντίστοιχους οξικούς εστέρες, σε αντίθεση με το οξικό οξύ όπου το παραγόμενο κατά την αντίδραση ύδωρ φέρει την αντίδραση σε μια κατάσταση ισορροπίας, οπότε απαιτείται επιπλέον κάποιο ισχυρό μέσο δέσμευσής του (π.χ. π. H2SO4). Ωστόσο, το αφυδραντικό μπορεί να οδηγήσει σε ανεπιθύμητα παραπροϊόντα αφυδάτωσης των αλκοολών (π.χ. διάσπασή τους προς αλκένια). Οι αντίστοιχες αντιδράσεις είναι:
![]()
Έτσι, ο οξικός ανυδρίτης είναι το προτιμούμενο μέσο σχηματισμού εστέρων του οξικού οξέος στην περίπτωση "υψηλών" αλκοολών ή ευαίσθητων στην αφυδάτωση πολυυδροξυενώσεων (π.χ. γλυκερίνη, σάκχαρα, πολυσακχαρίτες).
Ανάλογα με την κλίμακα της αντίδρασης μπορεί οικονομικώς να συμφέρει η παραλαβή και η ανακύκλωση του οξικού οξέος, που παράγεται κατά τη χρήση του οξικού ανυδρίτη ως ακετυλιωτικού μέσου. 'Ετσι π.χ. έχουν αναπτυχθεί μέθοδοι παραλαβής του οξικού οξέος από τα απόβλητα αντίστοιχων βιομηχανιών, πολλές από τις οποίες βασίζονται σε σχήματα συνεχούς εκχύλισης του οξικού οξέος με τριτοταγείς αμίνες.
Εκτός από τις αλκοόλες (και γενικότερα τις υδροξυλοομάδες οργανικών ενώσεων) εύκολα ακετυλιώνονται οι αμίνες, όπως επίσης και οι αρωματικοί δακτύλιοι (αντίδραση ακυλίωσης Friedel-Crafts). Από τις πιο χαρακτηριστικές ακετυλιώσεις που πραγματοποιούνται μέσω του οξικού ανυδρίτη είναι η ακετυλίωση του σαλικυλικού οξέος κατά τη σύνθεση της ασπιρίνης (βλέπε: Χημική ένωση του μήνα: Ακετυλοσαλικυλικό οξύ), αλλά και η δι-ακετυλίωση του φυσικού αλκαλοειδούς μορφίνη για να παραχθεί ηρωίνη:
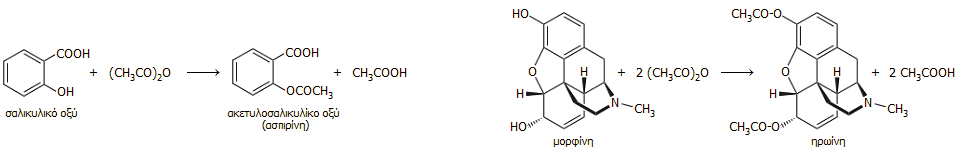
Στην τελευταία αντίδραση οφείλεται το ότι ο οξικός ανυδρίτης ιστορικά αποτελεί μία από τις πρώτες χημικές ουσίες των οποίων η παραγωγή και η διάθεση υπήρξε και εξακολουθεί να είναι αυστηρά ελεγχόμενη (controlled substances). Σήμερα, οι μεγαλύτερες ποσότητες οξικού ανυδρίτη χρησιμοποιούνται στην παραγωγή οξικής κυτταρίνης (cellulose acetate), ενός χημικώς τροποποιημένου φυσικού πολυμερούς με αφθονία εφαρμογών. Ειδικά για τις ΗΠΑ μια πηγή αναφέρει ότι το 75% της παραγωγής του οξικού ανυδρίτη πηγαίνει στην παραγωγή της οξικής κυτταρίνης, ενώ το 1,5% στην παραγωγή ασπιρίνης [Αναφ. 11ε].
 |
 |
 |
 |
 |
|
 |
|
Μερικά από τα προϊόντα καθημερινής χρήσης από οξική κυτταρίνη, η βιομηχανία της οποίας είναι ο κύριος καταναλωτής οξικού ανυδρίτη. |
||||||



 Η
διεργασία
Η
διεργασία