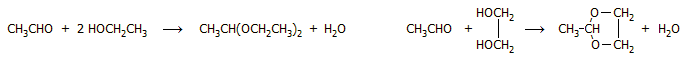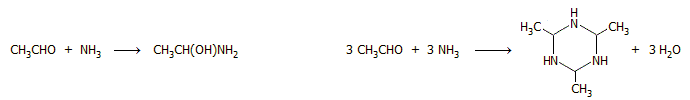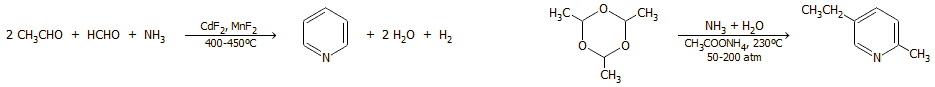Λίστα "Χημικών Ενώσεων του Μήνα"
Η χημική ένωση του
μήνα
[Νοέμβριος
2013]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής
-
Κωνσταντίνος
Ευσταθίου, Καθηγητής
|
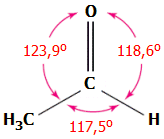
Φυσικoχημικές ιδιότητες
[Αναφ. 1]:
Εμφάνιση: 'Aχρωμο πτητικό και
λεπτόρρευστο υγρό με δυσάρεστη διαπεραστική οσμή, δακρυγόνο. Σε πολύ
μικρές συγκεντρώσεις οι ατμοί της έχουν μια φρουτώδη οσμή, που θυμίζει
μήλο. Η οσμή της γίνεται αισθητή και σε συγκεντρώσεις (odor threshold)
0,07-0,2 ppm
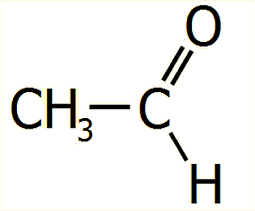
Μοριακός τύπος:
C2H4O
Σχετική μοριακή μάζα:
44,05
Σημείο τήξεως:
-123,37ºC
Σημείο ζέσεως:
20,2ºC, πρέπει να φυλάσσεται σε ψυγείο (2ºC-8ºC)
Πυκνότητα: 0,784 g/cm³ (20ºC)
Σημείο ανάφλεξης: -39ºC (συγκριτικά: βενζίνη: -40ºC, αιθανόλη: +13ºC)
Διαλυτότητα:
Αναμιγνύεται σε οποιαδήποτε αναλογία με το νερό, όπως και με την αιθανόλη,
μεθανόλη, διαιθυλαιθέρα, βενζόλιο, τερεβινθέλαιο, ακετόνη. Ελαφρά
διαλυτή στο χλωροφόρμιο
Συντελεστής κατανομής (οκτανόλη/νερό):
log POW = -0,34
(ελάχιστη λιποφιλικότητα )
Δείκτης διάθλασης (nD):
1,3316
Τοξικότητα: LD50:
660 mg/kg (σε αρουραίους). Ηπατοτοξική και πιθανώς μεταλαξιγόνος,
καρκινογόνος και τερατογόνος ένωση. Ερεθιστική για το δέρμα και τα μάτια (δακρυγόνος)
ουσία. Συναντάται στον καπνό των τσιγάρων και θεωρείται συνεργιστικός
παράγοντας της νικοτίνης στον εθισμό του καπνίσματος. Γενικά, συνιστάται
ιδιαίτερη προσοχή κατά τη χρήση της ένωσης αυτής.
ΠΡΟΣΟΧΗ:
Προσθήκη ισχυρών οξέων στην ακεταλδεΰδη καταλύει μια ιδιαίτερα έντονη
εξώθερμη αντίδραση συμπύκνωσή της.
|
 |
|
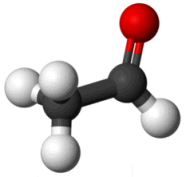
Ακεταλδεΰδη (Αιθανάλη)
Acetaldehyde
(Ethanal)
|
ή αιθανάλη (ethanal,
συστηματική ονομασία κατά IUPAC) είναι η απλούστερη
αλδεΰδη μετά το πρώτο μέλος της ομόλογης σειράς τη φορμαλδεΰδη, HCHO.
Πρόκειται για ένα
εξαιρετικά πτητικό υγρό (σ.ζ. 20,2ºC) με δριμεία, ερεθιστική οσμή και δακρυγόνους
ιδιότητες. Ωστόσο, η ακεταλδεΰδη σε πολύ αραιές συγκεντρώσεις στην ατμόσφαιρα έχει μια φρουτώδη και
όχι δυσάρεστη οσμή, που θυμίζει "χτυπημένο" μήλο.
 |
 |
|
Η οσμή της ακεταλδεΰδης
είναι δυσάρεστη, δριμεία και προκαλεί δάκρυα. Ωστόσο, σε μικρές
συγκεντρώσεις έχει μια φρουτώδη οσμή που θυμίζει χαλασμένο μήλο. |
|

Πρώιμος τύπος
μετρητή αλκοόλης στην εκπνοή (breathanalyzer). Ορισμένος όγκος
εκπνεόμενου αέρα διαβιβάζεται μέσω σωλήνα που περιέχει πυριτία
διαβρεγμένη με μίγμα K2Cr2O7
- Η2SO4.
Το μήκος της πράσινης ζώνης από Cr(III) είναι ανάλογο της
περιεκτικότητας της εκπνοής σε αλκοόλη. Οι σύγχρονοι τύποι μετρητών
βασίζονται σε μετρήσεις απορρόφησης υπέρυθρης ακτινοβολίας
[πηγή].
|
 |
 |
|
Αριστερά: Βαγόνι μεταφοράς
δεξαμενής ακεταλδεΰδης. Δεξιά: Φιάλη με ακεταλδεΰδη. Οι φιάλες του
αντιδραστηρίου πρέπει κατά το δυνατόν να είναι γεμάτες για να αποφεύγεται η
αλλοίωση της ένωσης από το υπερκείμενο ατμοσφαιρικό οξυγόνο. Η αλλοιωμένη
ακεταλδεΰδη αποκτά σταδιακά ένα σκούρο κίτρινο χρώμα |
|
|
|
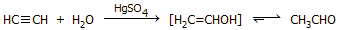
Ακεταλδεΰδη από
ακετυλένιο: Μέθοδος ιστορικής μόνο σημασίας
Η πρώτη
παραγωγή ακεταλδεΰδης σε βιομηχανική κλίμακα προέκυψε από τη μεγάλη
ανάγκη για ακετόνη για τη γερμανική βιομηχανία εκρηκτικών υλών κατά
τη διάρκεια του 1ου Παγκοσμίου Πολέμου. Η πρώτη μονάδα συνεχούς
σύνθεσης ακεταλδεΰδης εγκαταστάθηκε στο εργοστάσιο της
Hoechst (τότε Farbwerke Meister, Lucius & Bruening) κοντά στη Φρανκφούρτη το 1917.
Η σύνθεση της
ακεταλδεΰδης βασιζόταν στην εφυδάτωση του ακετυλενίου (αντίδραση
Kucherov, 1881). Για να εξασφαλιστεί ο συνεχής εφοδιασμός της
μονάδας με ακετυλένιο, η Hoechst αγόρασε ένα μεγάλο εργοστάσιο
παραγωγής ανθρακοκαρβιδίου στην πόλη Knapsack κοντά στην
Κολωνία. Η παραγωγή ακετόνης βασιζόταν στην ακόλουθη αλληλουχία
αντιδράσεων:
|

'Αποψη
του σύγχρονου χημικού βιομηχανικού πάρκου της
γερμανικής πόλης Knapsack
[πηγή]. |
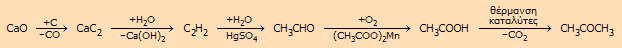
Μετά το τέλος
του πολέμου, η παραγωγή ακεταλδεΰδης με πρώτη ύλη το ακετυλένιο
συνεχίστηκε, αλλά μεγάλο μέρος της χρησιμοποιήθηκε για την
παραγωγή διαλυτών και άλλων χρήσιμων οργανικών ενώσεων. Τυπικό
παράδειγμα αποτελούσε η σύνθεσης της κ-βουτανόλης, με βάση την
ακόλουθη αλληλουχία αντιδράσεων:
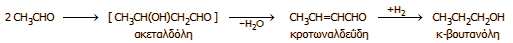
Επιπλέον,
έγινε εφικτή η παραγωγή οξικού αιθυλεστέρα,
μέσω μιας αυτοοξειδοαναγωγικής αντίδρασης της ακεταλδεΰδης,
η οποία καταλύεται από αλκοξείδια
(αντίδραση
Tischtschenko):
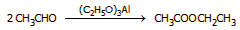
'Ενα επιπλέον
πρόβλημα της μεθόδου σύνθεσης της ακεταλδεΰδης μέσω της
εφυδάτωσης του ακετυλενίου, ήταν η χρήση ως καταλύτη των
τοξικότατων ενώσεων του υδραργύρου.
Η ρύπανση του κόλπου της
Minamata στην Ιαπωνία, με ενώσεις του υδραργύρου με όλες τις τραγικές
επιπτώσεις για
την υγεία των κατοίκων της περιοχής κατά τις δεκαετίες του 1950 και 1960, οφειλόταν στα απόβλητα της βιομηχανίας Shin Nichitsu, η οποία παρήγαγε ακεταλδεΰδη
με εφυδάτωση του ακετυλενίου (βλ. Χημική
ένωση του μήνα:
Διμεθυλοϋδράργυρος,
ασθένεια
Minimata). |
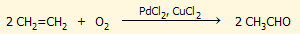

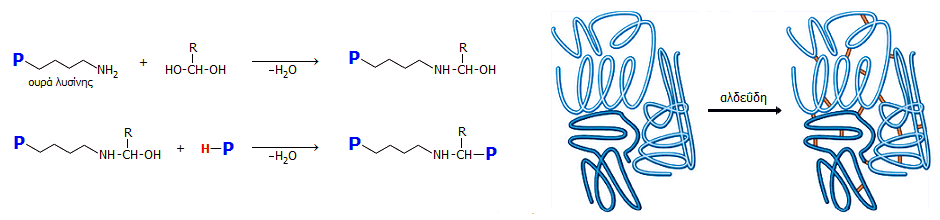
'Αλλες μέθοδοι.
Η ακεταλδεΰδη εμφανίζεται ως προϊόν σε πλήθος αντιδράσεων βιομηχανικού ή
εργαστηριακού ενδιαφέροντος. Ωστόσο, σε καμιά περίπτωση δεν μπορούν να
θεωρηθούν αυτές ως πρακτικές μέθοδοι σύνθεσης της ακεταλδεΰδης. Θα ήταν παράλογο
να προταθεί σύνθεση μιας πάμφθηνης χημικής ένωσης με χρήση δαπανηρών
αντιδραστηρίων. Ορισμένες από αυτές
είναι καταλληλότερες για τη σύνθεση υψηλότερων αλδεϋδών ή για την εισαγωγή της
αλδεϋδικής ομάδας σε άλλες ενώσεις. Ενδεικτικά αναφέρονται ορισμένες από αυτές:
- Καταλυτική οξείδωση πετροχημικών όπως το αιθάνιο
και το αιθυλοβενζόλιο (παραπροϊόν παραγωγής φαινόλης):
CH3CH3 + O2
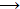 CH3CHO + H2O
C6H5CH2CH3 + O2
CH3CHO + H2O
C6H5CH2CH3 + O2
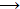 C6H5OH + CH3CHO
C6H5OH + CH3CHO
- Αντίδραση μεταξύ οργανομαγνησιακών ενώσεων
(αντιδραστήρια Grignard) και μυρμηκικών εστέρων ή ορθομυρμηκικών εστέρων (γενική μέθοδος εισαγωγής της αλδεϋδικής
ομάδας):
CH3MgI +
HCOOC2H5 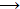 CH3CHO + C2H5OMgI CH3MgI
+ HC(OC2H5)3
CH3CHO + C2H5OMgI CH3MgI
+ HC(OC2H5)3 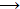 CH3CH(OC2H5)3
+ C2H5OMgI
CH3CH(OC2H5)3
+ H2O
CH3CH(OC2H5)3
+ C2H5OMgI
CH3CH(OC2H5)3
+ H2O 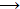 CH3CHO +
2 C2H5OH
CH3CHO +
2 C2H5OH
-
Οζονόλυση 2-βουτενίου:
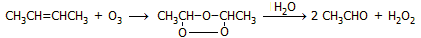
- Διάσπαση 2,3-βουτανοδιόλης με υπεριωδικά ιόντα (αντίδραση
Malaprade):
CH3CH(OH)CH(OH)CH3 +
IO4-
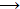 2 CH3CHO + ΙΟ3- + H2O
2 CH3CHO + ΙΟ3- + H2O
|

Οι
σύγχρονες εγκαταστάσεις της βιομηχανίας Wacker 10
χλμ βόρεια της Κολωνίας
[πηγή]. |
Μέθοδος Wacker [Αναφ. 4]
Σήμερα, για τη
βιομηχανική παραγωγή της ακεταλδεΰδης χρησιμοποιείται σχεδόν
αποκλειστικά η μέθοδος Wacker, η οποία
βασίζεται στην οξείδωση του αιθυλενίου από το ατμοσφαιρικό
οξυγόνο. Η αντίδραση αυτή καταλύεται από άλατα παλλαδίου και
χαλκού. Η κατάλυση είναι ομοιογενής (πραγματοποιείται σε υδατική
φάση) και αποτελεί τυπικό παράδειγμα της τεράστιας συνεισφοράς
της Οργανομεταλλικής Χημείας στη βιομηχανική χημική σύνθεση.
Η ιστορία της μεθόδου
Wacker ξεκίνησε το 1956 από τη γερμανική χημική βιομηχανία
Wacker Chemie και αφορμή υπήρξε η κατασκευή ενός νέου
διυλιστηρίου πετρελαίου της Esso στην Κολωνία, σε μικρή απόσταση
από τις εγκαταστάσεις της
βιομηχανίας Wacker. Το διυλιστήριο αυτό θα εξασφάλιζε στην Wacker
φθηνή και σταθερή παροχή αιθυλενίου, δηλ. της πρώτης ύλη της
σύνθεσης.
Αρχικός σκοπός της βιομηχανίας Wacker ήταν η σύνθεση αιθυλενοξειδίου με οξείδωση του αιθυλενίου παρουσία ετερογενούς
καταλύτη (Pd-C). Ωστόσο, διαπιστώθηκε σχεδόν αμέσως (από την
οσμή των προϊόντων) ότι η αντίδραση αυτή παρείχε ακεταλδεΰδη και
εκδόθηκε σχετική πατέντα με βάση την ετερογενή
κατάλυση οξείδωσης του αιθυλενίου από το ατμοσφαιρικό οξυγόνο.
Στη συνέχεια, η
εταιρία Wacker συνενώθηκε με την εταιρία
Hoechst
AG και με βάση μια
πατέντα της δεύτερης, η μη αποδοτική (λόγω αδρανοποίησης του
καταλύτη) ετερογενής κατάλυση αντικαταστάθηκε με την ομοιογενή
κατάλυση (σε υδατικό περιβάλλον) της οξείδωσης του αιθυλενίου.
Μάλιστα, η χρησιμοποίηση τιτανίου για την κατασκευή των
αντιδραστήρων (που έπρεπε να αντέχουν στη διάβρωση από πυκνό ΗCl)
υπήρξε ένα αποφασιστικό βήμα. Ουσιαστικά, η παραγωγή
ακεταλδεΰδης με τη μέθοδο Wacker ξεκίνησε το 1960.
Ταχύτατα και μετά από
εντατική έρευνα, η μέθοδος βελτιώθηκε και αντικατέστησε πλήρως
και σε παγκόσμια κλίμακα την παλαιά σύνθεση ακεταλδεΰδης με
εφυδάτωση του ακετυλενίου.
|
Συνοπτικός μηχανισμός των καταλυτικών κύκλων που
εμπλέκονται στη σύνθεση ακεταλδεΰδης (R=H) και
μεθυλοκετονών από 1-αλκένια με τη μέθοδο Wacker. |
Βασικές αντιδράσεις. 'Ηταν
γνωστό ήδη από τα τέλη του 19ου αιώνα ότι το αιθυλένιο
αντιδρούσε με διαλύματα αλάτων παλλαδίου παρέχοντας μαύρο ίζημα
από μεταλλικό παλλάδιο (F.C.
Phillips, Am. Chem. J., 1894, 16, 255277).
Μάλιστα, η αντίδραση αυτή είχε χρησιμοποιηθεί για την ανίχνευση
του αιθυλενίου σε μίγμα με άλλα αέρια. Η συνολική αντίδραση είχε ως εξής:
H2C=CH2
+ [PdCl4]2- + H2O
 CH3CHO + Pd + 2H+
+ 4 Cl-
CH3CHO + Pd + 2H+
+ 4 Cl-
Το μεταλλικό παλλάδιο
προφανώς ήταν πλέον άχρηστο, ωστόσο με αντίδρασή του σε ισχυρώς
όξινο με HCl περιβάλλον με CuCl2
μπορεί να
επανασχηματίσει το αρχικό χλωριοσύμπλοκό του:
Pd +
2 CuCl2 + 2 Cl-
 [PdCl4]2- + 2 CuCl
[PdCl4]2- + 2 CuCl
Ο παραγόμενος CuCl επανοξειδώνεται προς CuCl2
από το οξυγόνο του αέρα:
2 CuCl +
1/2 O2 + 2 HCl
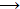 2 CuCl2 + H2O 2 CuCl2 + H2O
'Ετσι, με τη
μεσολάβηση δύο καταλυτικών κύκλων Pd(II)
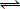 Pd(0) και Cu(II)
Pd(0) και Cu(II)
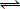 Cu(I), η συνολική αντίδραση αποκτά τη μορφή:
Cu(I), η συνολική αντίδραση αποκτά τη μορφή:
H2C=CH2
+ 1/2 O2
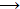 CH3CHO
CH3CHO
Η αντίδραση Pd(ΙΙ) -
αιθυλενίου πραγματοποιείται στους 50-120ºC και σε πίεση 3-10 atm, ενώ η αντίδραση επανοξείδωσης Cu(I)
- Ο2
πραγματοποιείται σε διαφορετικό αντιδραστήρα.
Τα επιμέρους
βήματα των καταλυτικών κύκλων έχουν μελετηθεί διεξοδικά. 'Ενα από
τα πιο ενδιαφέροντα πειραματικά δεδομένα, που βοήθησαν στη
διευκρίνιση των μηχανισμών των εμπλεκόμενων αντιδράσεων ήταν το ότι δεν υπάρχει ανταλλαγή
υδρογόνων μεταξύ αιθυλενίου και ύδατος. 'Ετσι, το δευτεριωμένο
αιθυλένιο C2D4
παρέχει πλήρως δευτεριωμένη ακεταλδεΰδη CD3CDO.
Αντίστοιχα, η αντίδραση C2H4
σε βαρύ ύδωρ D2O
παρέχει μη δευτεριωμένη ακεταλδεΰδη CH3CHO.
Η μέθοδος Wacker
μπορεί να χρησιμοποιηθεί για τη σύνθεση μεθυλοκετονών, έτσι π.χ.
αν χρησιμοποιηθεί προπυλένιο, τότε το προϊόν της αντίδρασης
είναι η ακετόνη (110-120ºC / 10-14 atm), ενώ αν χρησιμοποιηθεί
1-δεκένιο, το προϊόν της
αντίδρασης (σε μίγμα διμεθυλοφορμαμιδίου-ύδατος) είναι η 2-δεκανόνη,
αντίδραση που μπορεί να πραγματοποιηθεί σε εργαστηριακή κλίμακα
(οξείδωση Wacker - Tsuji):
CH3CH=CH2
+ 1/2 O2
 CH3COCH3
κ-C8H17CH=CH2 +
1/2 O2
CH3COCH3
κ-C8H17CH=CH2 +
1/2 O2
 κ-C8H17COCH3
κ-C8H17COCH3 |
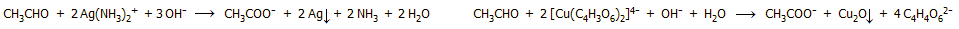
 |
 |
 |
 |
 |
|
Κατοπτρική απόθεση
αργύρου, ως αποτέλεσμα της αναγωγής του
αντιδραστηρίου Tollens με μια αλδεΰδη. Στη θέση της αλδεΰδης μπορεί
να χρησιμοποιηθεί και ένα ανάγον σάκχαρο, όπως η γλυκόζη που
περιέχει στο μοριό της την αλδεϋδική ομάδα (βλ. Χημική ένωση του
μήνα:
Γλυκόζη). |
Bernhard Tollens
(1841-1918). Γερμανός
χημικός, γνωστός για το ομώνυμο αντιδραστήριο και τις μελέτες του
πάνω στη δομή των σακχάρων. |
Αριστερά:
Αντιδραστήριο Fehling. Δεξιά: το ίδιο μετά την αντίδραση με ένα
αναγωγικό σάκχαρο (π.χ. γλυκόζη). |
Hermann von Fehling
(1812 - 1885). Ο Γερμανός χημικός που
ανέπτυξε τη μέθοδο ανίχνευσης και
προσδιορισμού αναγωγικών σακχάρων με το
ομώνυμο αντιδραστήριο. |
|

Περίπου το 1/10 της
παραγωγής ακεταλδεΰδης κατευθύνεται στη βιομηχανία σύνθεσης
πενταερυθριτόλης. |
|

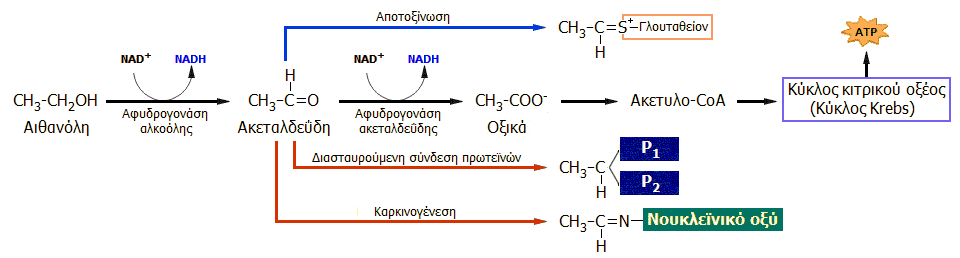
Η μικρότερη αντοχή
εσκιμώων και ινδιάνων στην κατανάλωση αλκοολούχων ποτών, οφείλεται
στη γενετική ανεπάρκειά τους στο ένζυμο αφυδρογονάση της ακεταλδεΰδης
(ALDH).
|
|
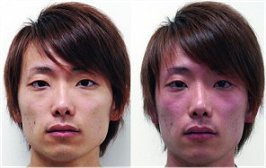
Ερυθρότητα προσώπου
('Asian glow') ατόμου ασιατικής καταγωγής πριν και μετά την
κατανάλωση αλκοολούχου ποτού [Αναφ.
6θ]. |
Βιβλιογραφία -
Πηγές από το Διαδίκτυο
1. (α)
Merck Index, 12th ed, σελ. 35 (acetaldehyde). (β) Wikipedia:
"Acetaldehyde".
(γ) New Jersey Department of Health: "Hazardous Substance Fact Sheet:
Acetaldehyde" (αρχείο
PDF, 78 KB). (δ) www.chemicalland21.com: "Acetaldehyde".
(δ) Liebig J:
"Sur les produits de l'oxidation de l'alcool", Annales de Chimie et de
Physique, 59:289-327, 1835. (ε) US Environmental
Protection Agency: "Chemical
Summary for Acetaldehyde", August 1994.
2. (α) Ιωαννίδης Μιλτ., Ζαγανιάρης ΙΝ: "Οργανικά Παρασκευάσματα",
Αθήνα, 1926, σελ.17-19 (αρχείο PDF,
574 KB). (β) EROWID: "Synthesis
of Acetaldehyde and Paraldehyde".
(γ) scribd.com: "Preparation
of Acetaldehyde".
3. (α) LookChem.com: "Production
of Acetaldehyde from Ethanol". (β) Ponomarev
DA, Shevchenko SM: "Hydration of Acetylene: A
125th Anniversary", J. Chem. Ed. 84(10):1725-1726,
2007 (Abstract).
4. (α)
www.organic-chemistry.org: "Wacker-Tsuji
Oxidation". (β) Wikipedia: "Wacker
process". (γ) Wilson TW: "The mechanistics studies of the Wacker
oxidation", SED group Meeting, 27-11-2007, University of Illinois (αρχείο
PDF, 1,52 MB).
5. (α) Carey FA:
"Organic Chemistry", 5th ed. (2001), McGraw-Hill, σελ. 663. (β)
CliffsNotes.com: "Reactions
of Aldehydes and Ketones". (γ) Βικιπαίδεια: "Αιθανάλη". (δ) Eek L: "Process
for the preparation of pentaerythritol",
US 5741956 A, 1998.
(ε) "5-ethyl-2-methyl-pyridine",
Organic Syntheses, Coll. (4):451,
1963; 30:41, 1950. (στ) Nielsen AT, Atkins RL, Moore DW, Scott R, Mallory D,
LaBerge JM: "Structure and chemistry of the aldehyde ammonias. 1-Amino-1-alkanols,
2,4,6-trialkyl-1,3,5-hexahydrotriazines, and N,N-dialkylidene-1,1-diaminoalkanes",
J. Org. Chem. 38(19):3288-3295, 1973 (Abstract).
6. (α)
HowStuffWorks.com: "How
Hangovers Work".
(β) Wikipedia: "Alcohol
tolerance". (γ) Kibbey H: "Genetic
Influences on Alcohol Drinking and Alcoholism", University of Indiana. (δ)
Science News: "Acetaldehyde
In Alcohol: 'Hangover Chemical' May Be Overlooked Risk Factor For Cancer",
March 20, 2009. (ε) Fowkes SW: "Living with Alcohol", Cognitive Enhancement
Research Institute, 1996 (αρχείο
PDF, 125 KB). (στ) Sprince H, Parker CM, Smith GG, Gonzales LJ: "Protection
against Acetaldehyde Toxicity in the rat byl-cysteine, thiamin andl-2-Methylthiazolidine-4-carboxylic
acid", Agents and Actions 4(2):125-130, 1974 (Abstract).
(ζ) Zakhari S: "Overview:
How Is Alcohol Metabolized by the Body?", National Institute on Alcohol
Abuse and Alcoholism (NIH). (η) The Daily of the University of Washington: "The
'Asian glow' explained", March 2003. (θ) Dartmouth Undergraduate
Journal of Science: "Esophageal Cancer and the 'Asian Glow'" (http://dujs.dartmouth.edu%2Ffall-2009%2Fesophageal-cancer-and-the-%25E2%2580%2598asian-glow%25E2%2580%2599), November 2009.
(ι) MedlinePlus: "Disulfiram".
(ια) Drugs.com: "Disulfiram
Side Effects".
7. (α) Hecht SS,
McIntee EJ, Wang M: "New DNA adducts of crotonaldehyde and acetaldehyde",
Toxicology 166(1-2):31-36, 2001 (PubMed). (β) Brooks PJ, Theruvathu JA:
"DNA adducts from acetaldehyde: implications for
alcohol-related carcinogenesis (Review)", Alcohol 35(3):187-193, 2005 (PubMed).
(γ) Homann N, Stickel F, König IR, Jacobs A, Junghanns K, Benesova M, Schuppan
D, Himsel S, Zuber-Jerger I, Hellerbrand C, Ludwig D, Caselmann WH, Seitz HK: "Alcohol
dehydrogenase 1C*1 allele is a genetic marker for alcohol-associated cancer in
heavy drinkers", Int J Cancer. 118(8):1998-2002, 2006 (PubMed).
(δ) Seitz HK, Homann N: "The role of acetaldehyde in alcohol-associated cancer of the
gastrointestinal tract", Novartis Found Symp. 285:110-119, 2007 (PubMed).
(ε) Hipolito L, Sanchez MJ, Polache A, Granero L: "Brain metabolism of
ethanol and alcoholism: An update" Curr. Drug Metab. 8:716-727, 2007 (PubMed).
(στ) Nakamura K, Iwahashi K, Furukawa A, Ameno K, Kinoshita H, Ijiri I, Sekine Y,
Suzuki K, Iwata Y, Minabe Y, Mori N: "Acetaldehyde adducts in the brain of
alcoholics", Arch. Toxicol. 77(10):591-593, 2003 (PubMed).
(ζ) Guo R, Ren J: "Alcohol and acetaldehyde in public health: from marvel to menace", Int J Environ Res Public Health 7(4):1285-1301,
2010.
|
Αποποίηση
ευθυνών:
Έχει καταβληθεί κάθε προσπάθεια για να εξασφαλισθεί η ορθότητα των
πληροφοριών που περιλαμβάνονται σε αυτή τη σελίδα, ωστόσο ο έχων την
επιμέλεια της σελίδας αυτής και το Τμήμα Χημείας δεν αναλαμβάνουν τη
νομική ευθύνη για τυχόν σφάλματα, παραλείψεις ή ανακριβείς πληροφορίες.
Επιπλέον, το Τμήμα Χημείας δεν εγγυάται την ορθότητα των αναφερόμενων σε
εξωτερικές ιστοσελίδες, ούτε η αναφορά μέσω συνδέσμων (links) στις ιστοσελίδες αυτές, υποδηλώνει ότι το Τμήμα
Χημείας επικυρώνει ή καθ' οιονδήποτε τρόπο αποδέχεται το περιεχόμενό
τους. |