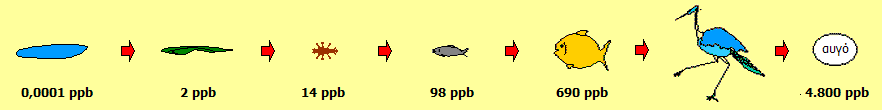Η χημική ένωση του μήνα
[Ιανουάριος 2010]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής - Κωνσταντίνος Ευσταθίου, Καθηγητής
|
Φυσικoχημικές ιδιότητες [Αναφ. 1]: Εμφάνιση: άχρωμο, πτητικό, τοξικό υγρό. Εύφλεκτο. Αναφέρεται πως έχει γλυκιά (!) οσμή. Μοριακός τύπος: C2H6Hg Σχετική μοριακή μάζα: 230,66 Σημείο βρασμού: 92 ºC (σε πίεση 740 mm Hg) Πυκνότητα: 3,1874 g/cm3 (στους 20 ºC) Δείκτης διάθλασης (nD20): 1,5452 Διαλυτότητα στο νερό: αδιάλυτο Σε οργανικούς διαλύτες: ευδιάλυτο στην αλκοόλη και τον αιθέρα Συντελεστής κατανομής (οκτανόλη/νερό): POW = 182 (Συγκριτικές τιμές POW: για την ένωση CH3HgCl είναι 1,7 και για την CH3HgOH 0,07) [Αναφ. 1γ] |
|
|
Διμεθυλοϋδράργυρος Dimethyl-mercury |
"Σε κλίμακα (επικινδυνότητας) από 1 έως 10, ο διμεθυλοϋδράργυρος είναι 15!
Πριν το ατύχημα της Karen νομίζαμε ότι ήταν 10. Τώρα ξέρουμε ότι είναι εκτός κλίμακος"
(Καθηγητής Χημείας Dean Wilcox, Darmouth College, [Αναφ. 4β])
Γενικά για τον διμεθυλοϋδράργυρο
 Ο
διμεθυλοϋδράργυρος (dimethylmercury, DMHg) είναι μία από τις τοξικότερες
χημικές ουσίες (νευροτοξίνη) που έχει συνθέσει ο άνθρωπος. Παρασκευάστηκε το 1858 από τον
χημικό George Buckton, (1818-1899) στο Royal College of Chemistry (σήμερα
Imperial College), στα πλαίσια μια
γενικότερης προσπάθειας σύνθεσης και χαρακτηρισμού οργανομεταλλικών ενώσεων
(ενώσεις με δεσμό μετάλλου-άνθρακα) [Αναφ.
2]. Τη σύνθεση των οργανομεταλλικών ενώσεων ξεκίνησε ο
Frankland (βλ. Χημική
ένωση του μήνα:
Ενώσεις τριβουτυλοκασσιτέρου)
με τη σύνθεση του διμεθυλοψευδαργύρου, (CH3)2Zn
(1849), που επισήμως θεωρείται ως η πρώτη οργανομεταλλική ένωση στην ιστορία της
Χημείας. Υπάρχουν αναφορές από την εποχή εκείνη ότι υπήρξαν θάνατοι που οφείλονταν στον
DMHg.
Ο
διμεθυλοϋδράργυρος (dimethylmercury, DMHg) είναι μία από τις τοξικότερες
χημικές ουσίες (νευροτοξίνη) που έχει συνθέσει ο άνθρωπος. Παρασκευάστηκε το 1858 από τον
χημικό George Buckton, (1818-1899) στο Royal College of Chemistry (σήμερα
Imperial College), στα πλαίσια μια
γενικότερης προσπάθειας σύνθεσης και χαρακτηρισμού οργανομεταλλικών ενώσεων
(ενώσεις με δεσμό μετάλλου-άνθρακα) [Αναφ.
2]. Τη σύνθεση των οργανομεταλλικών ενώσεων ξεκίνησε ο
Frankland (βλ. Χημική
ένωση του μήνα:
Ενώσεις τριβουτυλοκασσιτέρου)
με τη σύνθεση του διμεθυλοψευδαργύρου, (CH3)2Zn
(1849), που επισήμως θεωρείται ως η πρώτη οργανομεταλλική ένωση στην ιστορία της
Χημείας. Υπάρχουν αναφορές από την εποχή εκείνη ότι υπήρξαν θάνατοι που οφείλονταν στον
DMHg.
Το 1971 αναφέρθηκε η περίπτωση ενός 28-χρονου Τσεχοσλοβάκου χημικού, ο οποίος συνέθεσε συνολικά 6 kg (!) DMHg σε διάστημα τριών μηνών. Ο νεαρός χημικός παρουσίασε συμπτώματα δηλητηρίασης και πέθανε ένα μήνα μετά την έναρξη των συμπτωμάτων (Int. Arch. Arbeitsmed., 33, 323, 1974) [Αναφ. 2δ].
Η μεγάλη επικινδυνότητα του DMHg επανήλθε στο προσκήνιο με τον θάνατο της Καθηγήτριας Karen Wetterhahn (Dartmouth College, New Hampshire) το 1997, που οφειλόταν στην απορρόφηση από το δέρμα της ελάχιστης ποσότητας της ουσίας αυτής λίγους μήνες πριν. Ο επιστημονικός κόσμος με έκπληξη έμαθε ότι μια σταγόνα αυτού του άχρωμου και πυκνού υγρού, με την κάπως γλυκιά μυρουδιά, ήταν αρκετή για να οδηγήσει σε έναν αργό και οδυνηρό θάνατο.
Σίγουρα, ο DMHg είναι μια από τις ενώσεις που ένας χημικός δεν θα ήθελε να ασχοληθεί μαζί της, όσο έμπειρος και προσεκτικός και αν είναι στη δουλειά του. Στις πολύ λίγες εφαρμογές της ένωσης αυτής αναφέρεται η χρήση της ως ουσία αναφοράς σε τοξικολογικά πειράματα, όπως και ως πρότυπη ουσία στη φασματοσκοπία NMR-199Hg, αν και συνιστώνται πλέον άλλες ενώσεις του υδραργύρου για την εφαρμογή αυτή.
|
Από την [Αναφ. 2α] ...Όταν ο Frankland συνέχισε την έρευνά του στο Νοσοκομείο St Bartholomew του Λονδίνου, άρχισε να εξετάζει τη χημεία των ενώσεων R2Hg με τον βοηθό του Bill Odling σε συνεργασία με τον Δρ Carl Ulrich. O Ulrich πέθανε το 1865 λόγω της έκθεσής του στις ενώσεις R2Hg. Όπως ο ίδιος είχε δηλώσει, είχε αναπνεύσει μεγάλες ποσότητες της πτητικής ένωσης χωρίς να λάβει τις απαραίτητες προφυλάξεις. Την επόμενη ημέρα "εμφανίστηκε ανέκφραστος, νευρικός και σε σύγχυση" και εισήχθη στο νοσοκομείο σε άσχημη κατάσταση στις 3 Φεβρουαρίου. Στις 9 έγινε θορυβώδης και χρειάστηκε να καθηλωθεί. Την επόμενη ημέρα η εκπνοή του και το σώμα του ανέδιδαν μια άσχημη οσμή και έπεσε σε κώμα. Πότε-πότε συνερχόταν μόνο για να βγάλει άναρθρες κραυγές. Πέθανε στις 14 Φεβρουαρίου. Ένας τεχνικός από την ίδια ερευνητική ομάδα (αναφέρεται μόνο με τα αρχικά ''Τ. C.") εισήχθη επίσης στο νοσοκομείο στις 28 Μαρτίου του ίδιου έτους. Τα συμπτώματά του αρχικά ήταν πιο ήπια από εκείνα του Ulrich, αλλά σύντομα χειροτέρεψαν. Το καλοκαίρι είχε περιέλθει πλέον σε κατάσταση πλήρους άνοιας και είχε χάσει τον έλεγχο των λειτουργιών του σώματός του. Έμεινε στην κατάσταση αυτή και πέθανε στις 7 Απριλίου 1866. Στοιχεία αναφέρουν και τρίτο βοηθό που αρρώστησε, αλλά δεν αναφέρεται τίποτα επιπλέον και είναι άγνωστο αν πέθανε. |
|
George Buckton (1818-1899). Βρετανός χημικός. Παρασκεύασε το 1858 για πρώτη φορά τον DMHg στο Royal College of Chemistry (σήμερα Imperial College) [Αναφ. 2] |
Σύνθεση του διμεθυλοϋδραργύρου
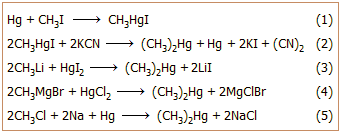 Η πρώτη σύνθεση του DMHg από τον Buckton πραγματοποιήθηκε με βάση
τις αντιδράσεις 1 και 2. 'Αλλες, αποδοτικότερες και "επικίνδυνα" απλές μέθοδοι,
βασίζονται σε αντιδράσεις αντικατάστασης άλλων ευκολότερα παρασκευαζόμενων
οργανομεταλλικών ενώσεων με ανόργανα άλατα του υδραργύρου (αντιδράσεις 2 και 4).
Επίσης μπορεί να παρασκευασθεί με επίδραση CH3Cl
σε αμάλγαμα νατρίου (αντίδραση 5)
Η πρώτη σύνθεση του DMHg από τον Buckton πραγματοποιήθηκε με βάση
τις αντιδράσεις 1 και 2. 'Αλλες, αποδοτικότερες και "επικίνδυνα" απλές μέθοδοι,
βασίζονται σε αντιδράσεις αντικατάστασης άλλων ευκολότερα παρασκευαζόμενων
οργανομεταλλικών ενώσεων με ανόργανα άλατα του υδραργύρου (αντιδράσεις 2 και 4).
Επίσης μπορεί να παρασκευασθεί με επίδραση CH3Cl
σε αμάλγαμα νατρίου (αντίδραση 5)
Δεν συνιστάται να επιχειρήσει κανείς μια τέτοια σύνθεση. Ο DMHg διατίθεται σε μικρές ποσότητες από ειδικευμένες εταιρείες μόνο σε εξουσιοδοτημένα ερευνητικά εργαστήρια.
Με ανάλογο τρόπο παρασκευάζονται και άλλες απλές διαλκυλο- ή διαρυλο-ενώσεις του υδραργύρου αλλά και των άλλων μετάλλων της ίδιας ομάδας (Zn, Cd). Σε αντίθεση με τον DMHg που είναι σταθερή ένωση ως προς το νερό και τον αέρα, οι αντίστοιχες ενώσεις του Zn και του Cd υδρολύονται και οξειδώνονται εύκολα και μάλιστα ο (CH3)2Zn αντιδρά αυθόρμητα με το οξυγόνο της ατμόσφαιρας (αυτοαναφλέγεται).
| Σύγκριση ορισμένων τυπικών οργανομεταλλικών ενώσεων του τύπου R2M [Αναφ. 2γ] | ||||||
| R | Zn | Cd | Hg | |||
| σημείο τήξης, ºC | σημείο βρασμού, ºC | σημείο τήξης, ºC | σημείο βρασμού, ºC | σημείο τήξης,ºC | σημείο βρασμού,ºC | |
| CH3- | -29,2 | 46 | -4,5 | 105,5 | - | 92,5 |
| CH3CH2- | -28 | 117 | -21 | 64 (19 mm Hg) | - | 159 |
| C6H5- | 107 | 280 (υπό αποσύνθεση) | 173 | - | 121,8 (εξάχνωση) | 204 (10 mm Hg) |
Τοξικολογικά στοιχεία για τις ενώσεις του υδραργύρου [Αναφ. 3]
 |
 |
|
Αριστερά: Κοντά στην πόλη Almaden της Ισπανίας υπάρχει (από την αρχαιότητα) ένα από τα μεγαλύτερα ορυχεία υδραργύρου στον κόσμο. Οι Ρωμαίοι έστελναν εκεί μόνο καταδικασμένους σε θάνατο -για προφανείς λόγους- για να βγάλουν το ορυκτό κιννάβαρι (HgS). Σήμερα, ένα περίεργο έκθεμα εκεί, προς τιμή των εργαζόμενων στα ορυχεία, είναι το "σιντριβάνι υδραργύρου". Καλό είναι να το θαυμάζει κανείς έξω από τη βιτρίνα στην οποία το έχουν. Δεξιά: Ο πρώτος αυτοκράτορας της ενοποιημένης Κίνας, ο Qin Shi Huang Di (259-210 π.Χ.), θεωρείται ως ένα από τα πρώτα ιστορικώς επιβεβαιωμένα θύματα του υδραργύρου, αφού ελάμβανε τακτικά υδραργυρούχα χαπάκια, τα οποία υποτίθεται πως θα του εξασφάλιζαν αιώνια ζωή. Πέθανε φρενοβλαβής σε ηλικία 50 ετών. |
|
Ο μεταλλικός υδράργυρος (Hg) συνήθως αναφέρεται ως το μόνο υγρό μέταλλο σε συνήθη θερμοκρασία (με σ.τ -38,8ºC), ωστόσο το καίσιο (σ.τ. 28,4 ºC) και το γάλλιο (σ.τ. 29,8 ºC) μπορούν επίσης να θεωρηθούν οριακά ως υγρά μέταλλα, δεδομένου ότι μπορούν να παραμείνουν υγρά και σε χαμηλότερες θερμοκρασίες από τα σημεία τήξης τους, λόγω του φαινομένου της υπέρτηξης.
Ο υδράργυρος είναι ένα από τα πλέον τοξικά μέταλλα, που μαζί με τον μόλυβδο και το κάδμιο, εκπέμπονται στο περιβάλλον από διάφορες ανθρωπογενείς βιομηχανικές και μεταλλευτικές δραστηριότητες. Ο υδράργυρος περιέχεται συνήθως σε σημαντική συγκέντρωση στα καυσαέρια των εργοστασίων παραγωγής ενέργειας που χρησιμοποιούν κάρβουνο ή λιγνίτη.
Η διαλυτότητα του μεταλλικού υδραργύρου στο νερό είναι ελάχιστη, έχει αποδειχθεί όμως, ότι τόσο ο ίδιος, όσο και πολλές ανόργανες ενώσεις του μετατρέπονται στο περιβάλλον σε εξαιρετικά τοξικές οργανικές (οργανομεταλλικές) ενώσεις και κυρίως σε ενώσεις του μεθυλοϋδραργύρου (ενώσεις όπως η χλωριούχος μεθυλοϋδράργυρος, CH3HgCl και το αντίστοιχο υδροξείδιο CH3HgΟΗ). Η μετατροπή αυτή πραγματοποιείται με την επίδραση μικροοργανισμών (βακτηριακή μεθυλίωση), που βρίσκονται στο νερό και στο έδαφος. Οι οργανικές αυτές ενώσεις Hg είναι εξαιρετικά τοξικές για τους υδρόβιους οργανισμούς λόγω της βιοσυσσώρευσής τους σε διάφορους ιστούς και πρόσληψής τους κυρίως μέσω της τροφικής αλυσίδας.
Κατηγορίες τοξικών ενώσεων του υδραργύρου. Ο υδράργυρος μπορεί να προσληφθεί από τους οργανισμούς σε τρεις μορφές: α) ως στοιχείο, β) ως ανόργανη ένωση και γ) ως οργανομεταλλική ένωση.
Στη στοιχειακή μορφή είναι επικίνδυνος στη μορφή των ατμών του. Η σημαντική τάση ατμών του στη θερμοκρασία περιβάλλοντος καθιστά τον "ακάλυπτο" υδράργυρο επικίνδυνο και επιβάλλει έντονο αερισμό στους χώρους όπου χρησιμοποιείται (βλέπε Video 1). Οι ατμοί του υδραργύρου διαχέονται ευκολότατα και είναι λιποδιαλυτοί. Εισπνεόμενοι μεταφέρονται στα ερυθρά αιμοσφαίρια και από εκεί σε ολόκληρο το σώμα και κυρίως στον εγκέφαλο.
Συνήθως τα πρώτα συμπτώματα δηλητηρίασης από ατμούς υδραργύρου είναι πονοκέφαλος, σιελόρροια και μια έντονη μεταλλική γεύση. Η αποβολή του είναι βραδεία (χρόνος ημιζωής 8 ημέρες). Σε περιπτώσεις χρόνιας εισπνοής ατμών υδραργύρου παρουσιάζεται μια ποικιλία συμπτωμάτων όπως: αναπνευστική δυσκολία, βήχας, ίλιγγοι, πόνοι στα άκρα, αιμορραγίες στα ούλα και απώλεια οδόντων, στοματίτιδα, απώλεια μνήμης και ψυχολογικές διαταραχές, όπως αδυναμία συγκροτημένης σκέψης, άγχος, νευρικότητα και αγοραφοβία (social phobia). Η χρόνια δηλητηρίαση με ατμούς υδραργύρου είναι ουσιαστικά ισοδύναμη με την αντίστοιχη δηλητηρίαση από τις οργανοϋδραργυρικές ενώσεις.
Στη μορφή ανόργανων ενώσεων ο υδράργυρος παρουσιάζει την τυπική τοξικότητα των ενώσεων των βαρέων μετάλλων, δηλ. είναι ισχυρότατα νεφροτοξικός. Περιστατικά δηλητηρίασης από ιοντικές ενώσεις υδραργύρου μπορούν να αντιμετωπισθούν μόνο με την έγκαιρη χορήγηση χηλικών φαρμακευτικών ουσιών (κυρίως πολυθειόλες). Ο υδράργυρος σχηματίζει με τις ενώσεις αυτές σταθερά σύμπλοκα υπό τη μορφή των οποίων και αποβάλλεται με τα ούρα, πριν προλάβει να δεσμευτεί από πρωτεΐνες του οργανισμού και αχρηστέψει τους νεφρούς.
Oι οργανοϋδραργυρικές ενώσεις είναι πολύ πιο επικίνδυνες από τις ανόργανες ενώσεις του. Η ισχυρή τοξική δράση του DMHg και των ενώσεων του μεθυλοϋδραργύρου, οφείλεται στο ό,τι οι ουσίες αυτές είναι λιποδιαλυτές και διαπερνούν τον αιματοεγκεφαλικό φραγμό (ο οποίος κανονικά προστατεύει τον εγκέφαλο από τοξικές ουσίες), πιθανόν με τη δημιουργία συμπλόκων-φορέων με το αμινοξύ κυστεΐνη. Αντίστοιχα, μπορούν να διαπεράσουν και τον πλακούντα και να προσβάλλουν τα εμβρυικά κύτταρα.
Οι οργανοϋδραργυρικές ενώσεις προσβάλλουν το νευρικό σύστημα και τον εγκέφαλο (νευροτοξικές ενώσεις). Ένα πολύ επικίνδυνο χαρακτηριστικό τους είναι η καθυστερημένη δράση τους, δηλ. τα συμπτώματα μπορεί να εμφανισθούν μετά από εβδομάδες και μήνες από την πρόσληψη των ενώσεων αυτών από τον οργανισμό (silent latency period), οπότε μπορεί να είναι πολύ αργά για κάποια θεραπεία. Ως λιποδιαλυτές ενώσεις αποθηκεύονται σε λιπαρούς ιστούς του οργανισμού, απ' όπου δεν είναι εύκολη η απόσπασή τους με τα ίδιες χηλικές ουσίες που δεσμεύουν τον ιοντικό υδράργυρο. Σε τοξικές ποσότητες οδηγούν σε αναισθησία των άκρων, δυσκολία στην ομιλία και στον γενικότερο συντονισμό του σώματος, τύφλωση, κώφωση, απώλεια γεύσης και οσμής και έντονα ψυχολογικά προβλήματα (ατονία, άνοια, απάθεια, παραισθήσεις).
Οι οργανοϋδραργυρικές ενώσεις απομακρύνονται από τον οργανισμό με εξαιρετικά αργό ρυθμό και έτσι σε περιπτώσεις χρόνιας δηλητηρίασης (π.χ. μέσω της τροφής) συσσωρεύονται σε αυτόν και κυρίως στον εγκέφαλο. Οι ίδιες οι ενώσεις, ως λιποδιαλυτές και μη ιοντικές, απορροφούνται εύκολα από το δέρμα. Χαρακτηριστικά αναφέρεται ότι σε δηλητηριάσεις με ενώσεις μεθυλοϋδραργύρου, η αναλογία της συγκέντρωσης υδραργύρου στον εγκέφαλο σε σχέση με τη συγκέντρωσή του στο αίμα κυμαίνεται από 5 έως 10:1.
|
Karen Wetterhahn (1948-1997). Καθηγήτρια Χημείας στο Dartmouth College. Τραγικό θύμα του DMHg. |
Η τραγική περίπτωση της καθηγήτριας Karen Wetterhahn [Αναφ. 4]
Η περίπτωση της δηλητηρίασης της καθηγήτριας Χημείας Karen Wetterhahn (Dartmouth College, New Hampshire) ήταν μία εξαιρετικά σπάνια περίπτωση, αλλά υπήρξε το έναυσμα για την ενημέρωση των ερευνητών και των χημικών για την υψηλή τοξικότητα του DMHg.
H Wetterhahn ερευνούσε στο εργαστήριό της τον τρόπο αντίδρασης των ιόντων υδραργύρου με τις πρωτεΐνες, που επιδιορθώνουν το DNA (DNA repair proteins). Πραγματοποιούσε μετρήσεις με Φασματοσκοπία Πυρηνικού Μαγνητικού Συντονισμού (NMR) για NMR-ενεργό ισότοπο Hg-199. Από το φάσμα NMR του πυρήνα του Hg-199 θα μπορούσε να καθορίσει ποια τμήματα του μορίου της πρωτεΐνης προσβάλλονται από τον υδράργυρο. Οι μετατοπίσεις των κορυφών υδραργύρου θα έπρεπε να μετρηθούν ως προς την κορυφή μιας πρότυπης ένωση υδραργύρου και αυτή ήταν ο DMHg, που ήταν γνωστό ότι έδινε την "καθαρότερη" κορυφή σε σχέση με άλλες λιγότερο επικίνδυνες ενώσεις του υδραργύρου, όπως διαλύματα ανόργανων αλάτων του.
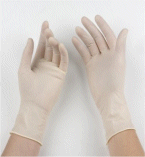
Στις 14 Αυγούστου του 1996 η Wetterhahn θέλησε να μεταφέρει ποσότητα DMHg σε σωλήνα NMR για να προχωρήσει στη σχετική βαθμονόμηση του οργάνου. Γνωρίζοντας πολύ καλά την υψηλή τοξικότητα της ουσίας, είχε φορέσει γάντια (Latex), γυαλιά ασφαλείας και εργαζόταν σε απαγωγό με πολύ μικρές ποσότητες της ουσίας.
Η Wetterhahn αντιλήφθηκε ότι κατά τη διαδικασία 1-2 σταγόνες DMHg έπεσαν στο γάντι της, σε σημείο που αντιστοιχούσε με τη ράχη της παλάμης. Αυτό που δεν είχε αντιληφθεί ήταν πως οι σταγόνες διαπέρασαν το υλικό του γαντιού και σε μικρό χρονικό διάστημα απορροφήθηκαν από το δέρμα της και εισήλθαν στον οργανισμό της. Για τους επόμενους λίγους μήνες συνέχισε τις επιστημονικές της δραστηριότητες χωρίς κάποιο πρόβλημα υγείας.
Τον Ιανουάριο του 1997 η Wetterhahn άρχισε να παρουσιάζει προβλήματα με την ισορροπία της, την όραση (λάμψεις και στένεμα οπτικού πεδίου) και την ακοή της. Τα δάκτυλά της μούδιαζαν και παρουσίαζε δυσκολία στην άρθρωση στην ομιλία της. Στις 28 Ιανουαρίου διαγνώσθηκε δηλητηρίαση του οργανισμού της από υδράργυρο.
Προσδιορισμός του υδραργύρου κατά μήκος τρίχας από τα μαλλιά της απεκάλυψε το "ιστορικό" της δηλητηρίασης (μετρήσεις με φθορισμό ακτίνων Χ). Μετρήθηκε ο Hg στα ούρα και στο αίμα με φασματομετρία ατομικής απορρόφησης. Η συγκέντρωση Hg στα ούρα βρέθηκε 234 μg/L (ανεκτά επίπεδα: 1-5 μg/L, τοξικά επίπεδα: >50 μg/L) και στο αίμα 4000 μg/L (ανεκτά επίπεδα: 1-8 μg/L, τοξικά επίπεδα: >200 μg/L).
Ακολούθησε εντατική θεραπεία με το χηλικό αντιδραστήριο 'Succimer': μεσο-2,3-διμερκαπτο-ηλεκτρικό οξύ , το οποίο χορηγήθηκε σε ποσότητες 10 mg/kg σωματικού βάρους κάθε 9 ώρες σε συνδυασμό με βιταμίνη Ε (τοκοφερόλη) ως αντιοξειδωτικό [Αναφ. 4δ]. Αμέσως άρχισε η αποβολή ποσοτήτων υδραργύρου από τα ούρα (βλ. διαγράμματα παρακάτω), αλλά η θεραπεία αυτή δεν στάθηκε ικανή να σώσει την Wetterhahn, παρά το ότι συνέβαλε στην απομάκρυνση περίπου 100 mg υδραργύρου (όπως προκύπτει από το διάγραμμα) από τον οργανισμό της. Οι βλάβες στον εγκέφαλο ήταν πλέον μη αντιστρεπτές. Στην τελική φάση της ασθένειάς της έπεσε σε κώμα από το οποίο ποτέ δεν συνήλθε και πέθανε τον Ιούνιο του 1997.
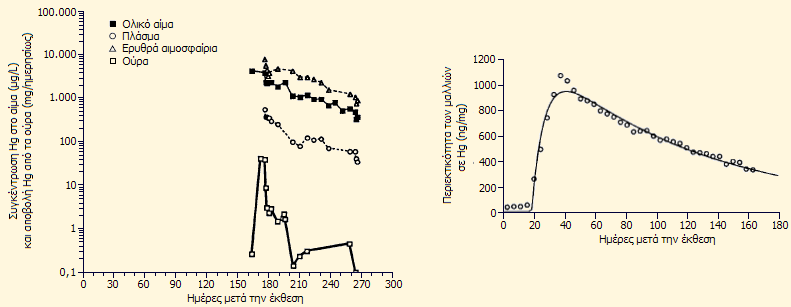
Αριστερά: Περιεκτικότητα αίματος και ούρων σε Hg, Δεξιά: Περιεκτικότητα των μαλλιών σε Hg (από την [Αναφ. 4δ])
Η ειρωνεία είναι το ότι η Wetterhahn ήταν διεθνώς γνωστή για τις επιστημονικές της εργασίες πάνω στην τοξικότητα διαφόρων βαρέων μετάλλων, αλλά υπερεκτίμησε τις προστατευτικές ιδιότητες των απλών γαντιών Latex. Δεν έδρασαν παρά μόνο σαν αγωγός της φοβερής νευροτοξικής ένωσης. Εκ των υστέρων μελέτες έδειξαν ότι ο DMHg διαπερνούσε σχεδόν ακαριαία τα προστατευτικά γάντια από Latex, PVC και νεοπρένιο και μόνο γάντια με στρώσεις προστατευτικού υλικού (laminated gloves) παρείχαν μια κάπως ικανοποιητική προστασία.
Για το τραγικό ατύχημα της Karen Wetterhahn, (απόσπασμα από την [Αναφ. 4β]) ... Η Wetterhahn είχε την πρόνοια να ζητήσει από τον συνάδελφό της David Lemal να τη βοηθήσει σε κάποια φάση της διαδικασίας -να ανοίξει το σφραγισμένο υάλινο φιαλίδιο (αμπούλα). Ο Lemal κατέψυξε το φιαλίδιο για να μειώσει την τάση ατμών του περιεχομένου του. Λιμάρισε το επάνω μέρος της αμπούλας, το έκοψε ομαλά και έφυγε από το εργαστήριο. Η Wetterhahn με μια πιπέτα τύπου σύριγγας, τράβηξε μια μικρή ποσότητα DMHg από την αμπούλα και τη μετέφερε στον σωλήνα NMR πάχους ενός μολυβιού και το υπόλοιπο το μετέφερε σε μικρό φιαλίδιο με βιδωτό καπάκι. Κατά τη διάρκεια αυτής της εργασίας 1 ή 2 σταγόνες του υγρού έπεσαν στο αριστερό της γάντι. Σφράγισε το φιαλίδιο και του έβαλε ετικέτα "dimethylmercury 8/14/96 KEW", έβγαλε τα γάντια της, τα άφησε στον απαγωγό και έπλυνε σχολαστικά τα χέρια της. 'Ολα αυτά ήταν τυπικές διαδικασίες.
Θα μπορούσε όμως να το ήξερε; Δεν υπήρχαν ορατές τρύπες στα γάντια. Ο DMHg, διαυγής σαν το νερό αλλά τρεις φορές πυκνότερος, δεν την είχε κάψει ούτε είχε με κάποιο τρόπο αναγγείλει την είσοδό του στο δέρμα της. Ακόμη και η υγρότητα μιας ή δυο σταγόνων δεν θα μπορούσε να ξεχωρίσει από αυτή που σωρεύεται (από τον ιδρώτα) μέσα στα λαστιχένα γάντια. Η Karen δεν είχε κάποιο λόγο να πιστεύει ότι εκτέθηκε στον DMHg. Πέντε μήνες αργότερα η προσεκτική στις ενέργειές της επιστήμων άρχισε να παραπατάει και να τραυλίζει. Η γυναίκα, που ποτέ δεν είχε ασθενήσει ξαφνικά, ζήτησε από τον άντρα της να την πάρει από τη δουλειά γιατί δεν αισθανόταν καλά για να οδηγήσει η ίδια. Τελικά υπό την πίεση φίλων πείσθηκε να δει ένα γιατρό. Εισήχθει στο νοσοκομείο Dartmouth-Hitchcock. Όταν ο νευρολόγος Richard Nordgen της είπε ότι τα συμπτώματά της (ναυτία, απώλεια βάρους δυσκολία στην ομιλία) πιθανόν να οφείλονται σε έκθεση σε υδράργυρο, η Wetterhahn ανέφερε το περιστατικό με τις σταγόνες DMHg, που είχε συμβεί τον προηγούμενο Αύγουστο. Δείγματα αίματος και ούρων της Wetterhahn στάλθηκαν σε εργαστήριο για εξέταση. Όταν βγήκαν οι αρχικές αναλύσεις, ήδη είχαν αρχίσει τα προβλήματα με την ακοή και την όρασή της. Όταν ήρθαν επιπλέον αποτελέσματα, που επιβεβαίωναν τη διάγνωση -σοβαρή δηλητηρίαση από υδράργυρο- ο κλινικός φαρμακολόγος του νοσοκομείου David Nierenberg της ξεκίνησε μια θεραπεία με χηλικές ενώσεις (chelation therapy). Κάθε ημέρα της έδιναν ένα φάρμακο που θα δρούσε σαν μαγνήτης τραβώντας και δεσμεύοντας τον υδράργυρο σε μια ένωση που το σώμα της θα μπορούσε να αποβάλει. Μόλις ξεκαθάρισε η διάγνωση το εργαστήριο της Wettehahn σφραγίστηκε. Ο Nierenberg εξέτασε τα μέλη της οικογένειας της Wetterhahn και τους συνεργάτες της για υδράργυρο. Σε όλα τα μέλη του Τμήματος Χημείας δόθηκε η ευκαιρία να εξεταστούν. Η Wetterhahn ζήτησε από τον Πρόεδρο του Τμήματος John Winn να εξεταστούν όλοι όσοι τη βοήθησαν με τον DMHg. Όλοι που εργάστηκαν μαζί της ή είχαν δουλέψει πρόσφατα με υδράργυρο εξετάστηκαν και βρέθηκαν κανονικοί. Το Γραφείο Περιβαλλοντικής Υγειινής και Ασφάλειας του Πανεπιστημίου ανέθεσε σε μια ειδικευμένη εταιρεία να εξετάσει τον αέρα και τις επιφάνειες του εργαστηρίου της Wetterhahn, του γραφείου, του αυτοκινήτου και του σπιτιού της. Εξετάστηκε κάθε τι που μπορεί να είχε αγγίξει, πόμολα, διακόπτες φωτισμού, τηλέφωνα. Το μόνο μέρος που βρέθηκε να περιέχει υδράργυρο ήταν το κάνιστρο, όπου βρισκόταν το φιαλίδιο με τον DMHg που χρησιμοποίησε η Wetterhahn. Το φύλαγε με ασφάλεια στον απαγωγό, μέχρις ότου τα πειράματά της θα γίνονταν δεκτά για δημοσίευση. Το είχε κρατήσει για την περίπτωση που θα χρειαζόταν να επαναλάβει κάποια πειράματα. "Γιατί δεν το πετάξατε;", ρώτησε τον Winn. Δεν ήθελε κανείς να αντιμετωπίσει αυτό που αντιμετώπιζε η ίδια. Ο υδράργυρος στο σώμα της Wetterhahn κατέστρεφε το νευρικό της σύστημα με μεγάλη ταχύτητα. Η όρασή της ελαττωνόταν. Η ακοή της είχε χαθεί. Παιδευόταν για να μιλήσει, αλλά ζήταγε από τον Winn και τον Nierenberg να κάνουν ό,τι μπορούσαν για να προειδοποιήσουν την επιστημονική κοινότητα για τους κινδύνους του DMHg. Στις 6 Φεβρουαρίου, μόλις τρεις εβδομάδες μετά που κατάλαβε ότι κάτι δεν πάει καλά, η Karen Wetterhahn έπεσε σε κώμα, από το οποίο δεν συνήλθε ποτέ. Πέθανε την Κυριακή 8 Ιουνίου. |
||||||
|
Σύνοψη των χαρακτηριστικών των NMR-ενεργών ισοτόπων του υδραργύρου [Αναφ. 5] Γενικά, όλα τα άτομα των οποίων οι πυρήνες που περιέχουν περιττό αριθμό πρωτονίων ή περιττό αριθμό νετρονίων είναι μαγνητικώς ενεργά, επειδή οι αυτοστροφορμές (σπιν) των επιμέρους νουκλεονίων δεν αλληλοεξουδετερώνονται, είναι δηλαδή I ≠ 0. Όταν τα άτομα αυτά βρεθούν σε ισχυρό μαγνητικό πεδίο ο πυρήνας αποκτά 2Ι+1 καταστάσεις, οι οποίες θα διαχωριστούν σε 2Ι+1 ενεργειακές καταστάσεις, των οποίων η ενεργειακή διαφορά εξαρτάται από την ένταση του μαγνητικού πεδίου. Ιδιαίτερα χρήσιμοι για τη φασματοσκοπία NMR είναι οι πυρήνες με σπιν Ι = 1/2 (όπως των 1Η, 13C, 19F και 31P). Από τα ισότοπα του Hg ΝΜΡ-ενεργά είναι τα 199Ηg και 201Hg. Φυσικά χαρακτηριστικά:
Πεδία εφαρμογής: Η φασματοσκοπία ΝΜΡ-199Hg εφαρμόζεται για τον χαρακτηρισμό των ανόργανων και οργανομεταλλικών ενώσεων του υδραργύρου Αναφορές NMR: Τυπικά εξωτερικά πρότυπα δείγματα είναι καθαρός DMHg (+2255 ppm ή συχνότητα 17,870535 MHz για μαγνητικό πεδίου στο οποίο το 1Η του τετραμεθυλοσιλανίου (TMS) παρατηρείται επακριβώς στους 100,00 MHz) ή 0,10 Μ Hg(ClO4)2 σε 0,10 Μ HClO4 αντιστοιχεί σε συχνότητα 17,870535 MHz. Παράμετροι NMR: Ιδιαίτερα χαρακτηριστικά: Οι χημικές μετατοπίσεις του 199Hg καλύπτουν μια περιοχή 4300 ppm (από -1200 έως +3100 ppm). |
 |
 |
|
Αριστερά: Κλασική εικόνα (tea party) από την πρώτη δημοσίευση του μυθιστορήματος του Lewis Carrol "Η Αλίκη στη Χώρα των Θαυμάτων", όπου απεικονίζεται και ο "τρελός καπελάς". Δεξιά: Πηλοποιία στο Danbury του Connecticut. Tοπικά υπήρχε μια ασθένεια γνωστή ως το "τρεμούλα του Danbury" (Danbury shakes). Από το 1941 απαγορεύθηκε η χρήση υδραργύρου στη βιομηχανία πιλήματος (τσόχας) στις ΗΠΑ [Αναφ. 6γ]. |
|
Η ασθένεια των πηλοποιών [Αναφ. 2α, 6]
Οι ενώσεις του υδραργύρου (ιδιαίτερα διαλύματα Ηg(NO3)2) άρχισαν να χρησιμοποιούνται πριν 200 χρόνια στην κατασκευή καπέλων. Τα καπέλα κατασκευάζονταν από πίλημα (τσόχα), ένα είδος μη-πλεκτού υφάσματος από αλληλοπλεγμένες τρίχες μαλλιού. Οι γούνες από λαγούς και κάστορες δεν έδιναν σταθερά πιλήματα και για να "κατσαρώσουν" οι τρίχες τους τις βύθιζαν σε διάλυμα νιτρικού οξέος.
Οι πηλοποιοί διαπίστωσαν ότι αν διέλυαν υδράργυρο στο νιτρικό οξύ, τα λαμβανόμενα πιλήματα είχαν καλύτερη ποιότητα. Ωστόσο, μετά τη ξήρανση του πιλήματος, έμενε σ' αυτό μια λεπτή σκόνη που περιείχε υδράργυρο και οι πηλοποιοί την ανέπνεαν. Τα συμπτώματα ήταν τρεμούλα των άκρων, έντονη σιελόρροια, κακή άρθρωση στην ομιλία, νευρικότητα, ατολμία, αντικοινωνικότητα. Η νόσος αυτή ήταν γνωστή και ως ασθένεια των πηλοποιών (hatter's disease).
Αυτή η επαγγελματική ασθένεια των πηλοποιών ενέπνευσε στον Lewis Carrol (1832-1898) τον χαρακτήρα του "τρελού καπελά" (mad hatter), στο γνωστό μυθιστόρημα "Η Αλίκη στη Χώρα των Θαυμάτων" ("Alice's Adventures in Wonderland", 1865). Τα συμπτώματα της νόσου αυτής είναι τυπικά συμπτώματα μακροχρόνιας δηλητηρίασης από υδράργυρο.
Οργανομεταλλικές ενώσεις υδραργύρου ως μυκητοκτόνα
Μια άλλη πηγή ρύπανσης από αλκυλιωμένα παράγωγα υδραργύρου υπήρξε η χρήση μυκητοκτόνων που περιείχαν οργανομεταλλικές ενώσεις υδραργύρου. Την περίοδο μεταξύ των δύο Παγκοσμίων Πολέμων οι εργαζόμενοι σε εργοστάσια παρασκευής μυκητοκτόνων ανέπτυξαν επαγγελματικές ασθένειες από δηλητηρίαση υδραργύρου [Αναφ. 6β].
Το 1942 κατεγράφησαν δύο θάνατοι γραμματέων που εργάζονταν σε μια αποθήκη στο Κάλγκαρι του Καναδά, όπου υπήρχε μια πολύ μεγάλη ποσότητα (10 τόνοι) αποθηκευμένου διαιθυλοϋδραργύρου, που χρησίμευε για την καταπολέμηση ενός μύκητα, της ερυσίβης (smut), που προσβάλλει τα σιτηρά. Σε πολλές αγροτικές περιοχές παρατηρήθηκαν θάνατοι πτηνών που έτρωγαν σπόρους κατεργασμένους με το υδραργυρικό μυκητοκτόνο [Αναφ. 6ε].
Η χρήση υδραργυρικών μυκητοκτόνων για σπόρους (όπως σιτάρι) στις δεκαετίες 1950 και 1960 είχε ως αποτέλεσμα να προκληθούν δηλητηριάσεις αγροτών σε χώρες της Ασίας. Οι πιο σημαντικές δηλητηριάσεις συνέβησαν το 1956 και το 1960 στο Ιράκ, όταν αγροτικές οικογένειες κατανάλωσαν σπόρους σιταριού που είχαν κατεργασθεί με μίγμα CH3CH2HgCl και C6H5HgOCOCH3, καθώς και 100 δηλητηριάσεις στο Πακιστάν το 1961 και στην Γουατεμάλα το 1965 [Αναφ. 6γ].
|
Κυριότερες πηγές εισόδου υδραργύρου στο περιβάλλον: Γεωφυσικά φαινόμενα (π.χ. εκρήξεις ηφαιστείων), παραγωγή ενέργειας (καύση γαιανθράκων), χημική βιομηχανία, ανεξέλεγκτη απόρριψη προϊόντων που περιέχουν υδράργυρο (π.χ. μπαταρίες υδραργύρου, υδραργυρικά θερμόμετρα, σύγχρονοι λαμπτήρες μικρής ενεργειακής κατανάλωσης). |
Η τύχη του υδραργύρου στο περιβάλλον [Αναφ. 7]
 Πριν
από το 1960 πίστευαν ότι ο στοιχειακός υδράργυρος στο περιβάλλον παρέμενε αδρανής και
σχετικά ασφαλής. Στη συνέχεια διαπιστώθηκε ότι ο στοιχειακός υδράργυρος στους
διάφορους οργανισμούς, μπορεί να
οξειδωθεί προς Hg(II) με τη βοήθεια της καταλάσης και στη συνέχεια να μεθυλιωθεί υπό
την επίδραση αναερόβιων βακτηρίων (μεθανογόνα βακτήρια: από τις πλέον αρχέγονες
μορφές ζωής στον πλανήτη) που βρίσκονται στο χώμα και στα ιζήματα ποταμών και
λιμνών. Οι μεθυλιωμένες μορφές του υδραργύρου μπορούν να περάσουν τις λιπιδικές
μεμβράνες των κυττάρων ζώντων οργανισμών και σωρευθούν στα κύτταρα συμπλεκόμενες
με απαραίτητες πρωτεΐνες, ένζυμα και νουκλεϊνικά οξέα.
Πριν
από το 1960 πίστευαν ότι ο στοιχειακός υδράργυρος στο περιβάλλον παρέμενε αδρανής και
σχετικά ασφαλής. Στη συνέχεια διαπιστώθηκε ότι ο στοιχειακός υδράργυρος στους
διάφορους οργανισμούς, μπορεί να
οξειδωθεί προς Hg(II) με τη βοήθεια της καταλάσης και στη συνέχεια να μεθυλιωθεί υπό
την επίδραση αναερόβιων βακτηρίων (μεθανογόνα βακτήρια: από τις πλέον αρχέγονες
μορφές ζωής στον πλανήτη) που βρίσκονται στο χώμα και στα ιζήματα ποταμών και
λιμνών. Οι μεθυλιωμένες μορφές του υδραργύρου μπορούν να περάσουν τις λιπιδικές
μεμβράνες των κυττάρων ζώντων οργανισμών και σωρευθούν στα κύτταρα συμπλεκόμενες
με απαραίτητες πρωτεΐνες, ένζυμα και νουκλεϊνικά οξέα.
|
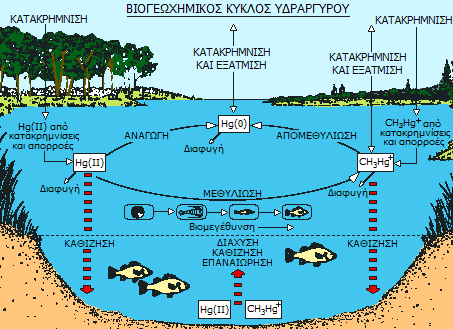
Ο βιογεωχημικός κύκλος του Hg είναι πολύπλοκος. Η μία μορφή του μετατρέπεται στην άλλη. Ιδιαίτερα ενδιαφέρει η μορφή του CH3Hg+ που είναι η τοξικότερη και υπόκειται σε βιομεγέθυνση. Τελικά ο Hg καταλήγει στα ιζήματα, στα ψάρια και σε άλλους οργανισμούς, όπως επίσης και στην ατμόσφαιρα ως (CH3)2Hg (όπου υπόκειται σε φωτοδιάσπαση) ή ατμοί Hg. |
Το ερώτημα είναι το τι "κερδίζουν" τα βακτήρια με τη μεθυλίωση (βιομεθυλίωση) του υδραργύρου. Πιθανώς, τα βακτήρια εξελικτικά ανέπτυξαν αυτήν την ικανότητα, μετά από συνεχή και για δισεκατομμύρια χρόνια έκθεση με σε ενώσεις του υδραργύρου.
Τα βακτήρια σχηματίζουν αποικίες παντού στο χώμα και στα ιζήματα και ιδιαίτερα σε περιοχές που υπάρχει άφθονη οργανική ύλη. Οι αποικίες τους υπόκεινται σε τροποποιήσεις ανάλογα με τις περιβαλλοντικές συνθήκες. 'Οπου υπήρχαν τοξικές ενώσεις υδραργύρου τα περισσότερα βακτήρια πέθαιναν, ωστόσο κάποια από αυτά έδειχναν μια αντοχή χάρις σε κάποια ένζυμα που τροποποιούσαν τη διαλυτότητα των ενώσεων του υδραργύρου. Τα ένζυμα αυτά, κωδικευμένα στο DNA των βακτηρίων, μεταφέρθηκαν από γενεά σε γενεά και ως συνέπεια των νόμων της εξέλιξης και λόγω της συνεχούς έκθεσης στον υδράργυρο, όλα αυτά τα βακτήρια των αποικιών αυτών ανέπτυξαν αυτήν την ανθεκτικότητα.
Τα ένζυμα αυτών των "υδραργυροανθεκτικών" βακτηρίων μπορούν να προκαλέσουν μια ποικιλία χημικών αλλαγών στον υδράργυρο και στις ενώσεις του: οξείδωση/αναγωγή, μεθυλίωση/απομεθυλίωση.
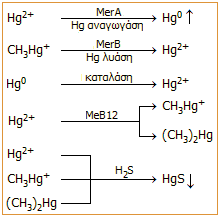
Ο ιοντικός υδράργυρος απομακρύνεται μετατρεπόμενος σε μια από τις ακόλουθες τρεις μορφές:
α) Ως εξαιρετικά δυσδιάλυτος HgS, χάρις στο υδρόθειο που παράγεται από φυσικές πηγές ή από μικροοργανισμούς που αφθονούν σε συνθήκες έλλειψης οξυγόνου.
β) Ως στοιχειακός υδράργυρος, με τη μορφή ατμών που διαχέονται προς την ατμόσφαιρα. Ως στοιχειακός ο υδράργυρος απομακρύνεται χάρις στο ένζυμο υδραργυρική αναγωγάση (mercury reductase), το οποίο εγκωδικεύεται στο γονίδιο MerA των βακτηρίων, το οποίο ενεργοποιείται παρουσία ενώσεων Hg.
γ) Ως οργανοϋδραργυρική ένωση και κυρίως ως παράγωγο του κατιόντος CH3Hg+ (π.χ. CH3HgCl, CH3HgOH) και σε μικρότερο βαθμό ως (CH3)2Hg. Οι ενώσεις αυτές σχηματίζονται αποκλειστικά με βιομεθυλίωση από ποικιλία ενζύμων σε συνεργασία με το συνένζυμο μεθυλοκοβαλαμίνη (MeB12), μια μεθυλιωμένη μορφή της βιταμίνης Β12 (κυανοκοβαλαμίνης).
Τα παράγωγα του υδατοδιαλυτού CH3Hg+ συσσωρεύονται σε οργανισμούς και η "μοίρα" του μπορεί να είναι η συσσώρευσή του σε ανώτερους οργανισμούς ή ο "αυτοκαθαρισμός" των βακτηρίων με επανασχηματισμό ιοντικού υδραργύρου. Αυτό πραγματοποιείται με απομεθυλίωση μέσω του ενζύμου υδραργυρική λυάση (mercury lyase), το οποίο εγκωδικεύεται στο γονίδιο MerB. Τα ίχνη (CH3)2Hg, ως ένωση πτητική και πρακτικά αδιάλυτη στο νερό, περνούν στην επιφάνεια των υδάτων, όπου μπορούν να σχηματίσουν CH3HgCl και μεθάνιο ή μπορούν να εξέλθουν στην ατμόσφαιρα, όπου θα υποστουν φωτοδιάσπαση και ο υδράργυρος θα επανέλθει στα νερά μέσω των κατακρημνίσεων.
|
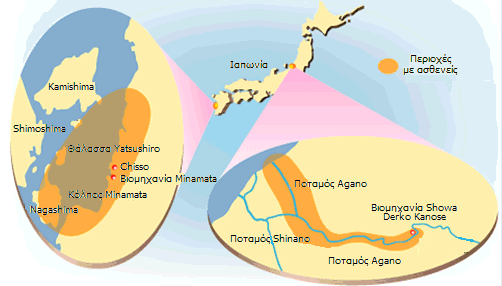
Οι περιοχές της Ιαπωνίας όπου υπήρξαν θύματα της ασθένειας Minamata (κόλπος της Minamata και περιοχή του ποταμού Agano (από την [Αναφ. 7β]). |
Το τελικό αποτέλεσμα όλων αυτών των ενζυματικών αντιδράσεων είναι η απομάκρυνση κάθε μορφής υδραργύρου από τις αποικίες των βακτηρίων, μέσω σχηματισμού πτητικών μορφών του, δυσδιάλυτων μορφών ή λιποδιαλυτών μορφών (οργανοϋδραργυρικών ενώσεων), που φεύγουν μεν από τα βακτηρίδια, αλλά παραλαμβάνονται και επιβαρύνουν άλλους ανώτερους οργανισμούς (πλαγκτόν, μικρά και μεγάλα ψάρια) και μπορούν μέσω της τροφικής αλυσίδας να φτάσουν μέχρι και τον άνθρωπο.
Η ασθένεια Minamata και ο υδράργυρος [Αναφ. 8]
Η μικρή παραθαλάσσια πόλη Minamata βρίσκεται στην επαρχία Kumamoto της Ιαπωνίας, στη θάλασσα Yasushiro στο νησί Kyushu. Η πόλη ήταν παραδοσιακά αγροτική με καλλιέργειες ρυζιού και παραγωγής αλατιού σε μια περιοχή του κόλπου. Η διατροφή των κατοίκων ήταν κυρίως ψάρια και άλλα θαλασσινά. Μετά τον πόλεμο ιδρύθηκε η χημική εταιρεία Chisso που παρήγαγε ακεταλδεΰδη και βινυλοχλώριδιο.
Το εργοστάσιο αναπτύχθηκε και επεκτάθηκε με παράλληλη πληθυσμιακή αύξηση της πόλης. Στις συνθέσεις αυτές των βιομηχανικών προϊόντων χρησιμοποιούνταν ενώσεις υδραργύρου ως καταλύτες. Η αντίδραση παρασκευής της ακεταλδεΰδης βασίζεται στην αντίδραση ακετυλενίου και ύδατος που καταλύεται από άλατα υδραργύρου:
![]()
Τα υγρά απόβλητα του εργοστασίου χωρίς κάποια κατεργασία κατέληγαν στα νερά του κόλπου. Στις αρχές του 1950 οι κάτοικοι παρατήρησαν μια περίεργη συμπεριφορά των ζώων της περιοχής και ιδιαίτερα στις γάτες. Παρουσίαζαν δείγματα τρέμουλου, κραύγαζαν με πόνο, έκαναν παράξενες κινήσεις και ορισμένες φορές "αυτοκτονούσαν" πέφτοντας στην θάλασσα. Ψάρια άρχισαν να πεθαίνουν σε μεγάλες ποσότητες και ορισμένα θαλασσοπούλια έπεφταν νεκρά.
Το 1956 εμφανίσθηκε ο πρώτος ασθενής στην περιοχή που έπασχε από νευρολογικά συμπτώματα άγνωστης αιτίας (συσπάσεις, αδυναμία ελέγχου των κινήσεων, πόνοι στα άκρα, αδυναμία ορθής άρθρωσης και ομιλίας). Οι τοπικές αρχές συνέστησαν μια επιτροπή για τη διερεύνηση της ασθένειας και της αιτιολογίας της και συνεργάσθηκαν με τους επιστήμονες του πανεπιστημίου Kumamoto.
Οι επιστήμονες διαπίστωσαν ότι επρόκειτο για δηλητηρίαση από βαρέα μέταλλα, που συσσωρεύονταν στον οργανισμό από την κατανάλωση ψαριών και διθύρων, αλλά δεν τη συσχέτισαν με την περιβαλλοντική ρύπανση της περιοχής.
 |
 |
|
Οι διάσημες φωτογραφίες (Tomoko Uemura in Her Bath) του William Eugene Smith, από το δράμα της Minamata. |
|
Το 1965 ασθένεια με ίδια συμπτώματα παρουσιάσθηκε στην περιοχή του ποταμού Agano της επαρχίας Niigata της Ιαπωνίας. Η νευρολογική ασθένεια ονομάσθηκε από τότε ασθένεια Minamata-Niigata.
Το 1968 το Υπουργείο Υγείας της Ιαπωνίας κατέληξε στο συμπέρασμα ότι η νευρολογική ασθένεια ήταν αποτέλεσμα της δηλητηρίασης από ενώσεις-παράγωγα του μεθυλιωμένου υδραργύρου. Προσδιόρισε ότι η πηγή ρύπανσης ήταν η μονάδα παραγωγής ακεταλδεΰδης του εργοστασίου της Chisso στη Minamata και από το εργοστάσιο της βιομηχανίας Showa Denko, που βρίσκονταν στον ποταμό Agano.
Οι υδραργυρούχες ενώσεις περιέχονταν σε μεγάλες συγκεντρώσεις στα υγρά απόβλητα των εργοστασίων, που αποβάλλονταν στον κόλπο Minamata και στον ποταμό της επαρχίας Niigata.
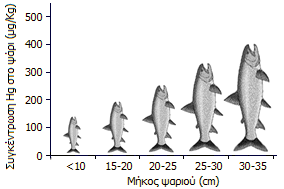 Μέση συγκέντρωση υδραργύρου σε ψάρια της λίμνης St. Clair, Ontario (κατά το διάστημα 1993-1998) [Αναφ. 9α]. |
Ο υδράργυρος με την επίδραση βακτηρίων υπόκειται σε μεθυλίωση και στο θαλάσσιο νερό. Οι μεθυλιωμένες ενώσεις του υδραργύρου συσσωρεύονται αρχικά στο πλαγκτόν, που καταναλώνεται από τα μικρά ψάρια και τα μικρά ψάρια τρώγονται από μεγαλύτερα. Η τροφική αλυσίδα λειτουργεί ως κλίμακα βιοσυσσώρευσης και βιομεγέθυνσης. Οι ενώσεις αυτές συσσωρεύονταν εξαιτίας της λιποδιαλυτότητάς τους στους λιπώδεις ιστούς των ψαριών και οι κάτοικοι δηλητηριάζονταν σιγά-σιγά με την κατανάλωση των τοπικών ψαριών, που ήταν η κύρια τροφή τους.
Μέχρι το 2001 παρουσιάσθηκαν 2.265 περιπτώσεις στην περιοχή του κόλπου Minamata με την νευρολογική ασθένεια, σε ορισμένες περιπτώσεις και νεαρά παιδιά που γεννήθηκαν με νευρολογικές διαταραχές και 690 άτομα στην περιοχή του ποταμού Agano.
Το 1968 η εταιρεία Chisso έκλεισε το εργοστάσιο ακεταλδεΰδης, όταν άλλαξε η τεχνολογία και η σύνθεσή άρχισε να πραγματοποιείται βιομηχανικά χωρίς την χρήση υδραργυρικών ενώσεων ως καταλυτών. Το 1963 ξεκίνησε η δίκη των υπευθύνων του εργοστασίου, ενώ από το 1959 ο γιατρός της εταιρείας σε πειράματα με γάτες βρήκε ότι τα υγρά απόβλητα ήταν υπεύθυνα για την νευρολογική ασθένεια. Η εταιρεία στην αρχή προσπάθησε να αποζημιώσει τους ασθενείς και τις οικογένειές τους με περιορισμένες οικονομικές αποζημιώσεις, αλλά το 1970, μετά από 7 χρόνια δικαστικών μαχών, οι δικαστές κήρυξαν την εταιρεία υπεύθυνη και ζήτησαν αποζημίωση 3,2 εκατομμυρίων $ για την πρώτη ομάδα ασθενών, που παρουσίαζαν τα σοβαρότερα συμπτώματα της νευρολογικής ασθένειας.
|
Βιοσυσσώρευση - Βιομεγέθυνση Βιοσυσσώρευση (bioaccumulation) είναι η συσσώρευση μιας ουσίας, όπως μιας τοξικής χημικής ένωσης, σε διάφορους ιστούς ενός ζώντος οργανισμού. Βιοσυσσώρευση πραγματοποιείται σε έναν οργανισμό, εάν η ταχύτητα πρόσληψης μιας ουσίας είναι μεγαλύτερη από την ταχύτητα απέκκρισης ή τον μεταβολικό μετασχηματισμό της ουσίας [Αναφ. 9β]. Βιομεγέθυνση (biomagnification) είναι η αυξανόμενη συγκέντρωση μιας ουσίας, όπως μιας τοξικής χημικής ένωσης, στους ιστούς οργανισμών ευρισκόμενων σε διαδοχικώς αυξανόμενα επίπεδα της τροφικής αλυσίδας. Ως αποτέλεσμα της βιομεγέθυνσης, οργανισμοί στην κορυφή της τροφικής αλυσίδας, γενικά, διακινδυνεύουν περισσότερο από μια έμμονη τοξική ουσία ή ρυπαντή σε σχέση με τους οργανισμούς που βρίσκονται σε χαμηλότερα επίπεδα [Αναφ. 9γ].
|
|
Κάποια αρκετά πληροφοριακά video από το YouTube Video 1: Πώς είναι δυνατόν να δούμε τους επικίνδυνους αλλά αόρατους ατμούς που εκλύει ο μεταλλικός υδράργυρος ακόμη και σε θερμοκρασία δωματίου. Video 2: Μηχανισμός καταστροφής των νευρικών κυττάρων από ενώσεις του υδραργύρου. Video 3: Αρκετά πληροφοριακό video για το δράμα της Minamata, όπου παρουσιάζονται οι επιπτώσεις της δηλητηρίασης από οργανοϋδραργυρικές ενώσεις στους ανθρώπους και τα ζώα. Video 4: Παράνομη διακίνηση και χρήση υδραργύρου στην Ινδονησία από χρυσοθήρες με αποτέλεσμα τη δηλητηρίαση των ίδιων και τη ρύπανση του περιβάλλοντος. |
1. (α) Merck Index, 12th ed, σελ. 550. (β) Material Safety Data Sheet: "Dimethylmercury, 95%". (γ) National Oceanic and Atmospheric Administration (NOAA): "Contaminants in Aquatic Habitats at Hazardous Waste Sites: Mercury", NOAA Technical Memorandum NOS ORCA 100 (1996)
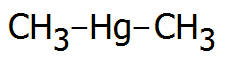




 Η
Η