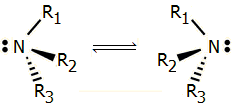Η χημική ένωση του μήνα
[Νοέμβριος 2011]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής - Κωνσταντίνος Ευσταθίου, Καθηγητής
|
Φυσικoχημικές ιδιότητες [Αναφ. 1]: Εμφάνιση: 'Αχρωμο αέριο, χαρακτηριστικής εξαιρετικά αποπνικτικής οσμής (αισθητής σε συγκέντρωση 5 ppm) Μοριακός τύπος: ΝH3 Σχετική μοριακή μάζα: 17,031 Σημείο τήξεως: -77,7ºC Σημείο ζέσεως: -33,35ºC (760 mm Hg) Πυκνότητα (σε υγρή κατάσταση στο σ.ζ.): 0,6818 g/cm3 Κρίσιμη θερμοκρασία: 132,4ºC Κρίσιμη πίεση: 111,5 atm Διαλυτότητα στο νερό: 47% (0ºC), 38% (15ºC), 31% (25ºC), 18% (50ºC) Διαλυτότητα σε 95% αιθανόλη: 15% (20ºC). pH υδατικού διαλύματος: 11,6 (διάλυμα 1 Μ), 11,1 (διάλυμα 0,1 Μ) Η αέριος αμμωνία θεωρείται άφλεκτη, ωστόσο μίγματά της με αέρα κάτω από ορισμένες συνθήκες ανάφλεξης μπορεί να αντιδράσουν εκρηκτικά. |
|
|
Αμμωνία Ammonia |
'O,τι συνθετικό υλικό περιέχει άζωτο, είτε πρόκειται για κάποιο πολυμερές, είτε λίπασμα, είτε οργανικό χρώμα, είτε εκρηκτικό,
είτε κάποιο φάρμακο, είτε οτιδήποτε άλλο, είναι σχεδόν βέβαιο ότι το άζωτό του κάποτε βρισκόταν στην ατμόσφαιρα
και από εκεί παγιδεύτηκε αρχικά ως αμμωνία με τη μέθοδο των Haber-Bosch.
 |
 |
| Τρισδιάστατη απεικόνιση του μορίου της αμμωνίας | Αλχημιστικό σύμβολο του χλωριούχου αμμωνίου |
Γενικά για την αμμωνία
Η αμμωνία (ΝΗ3) είναι η σπουδαιότερη σταθερή υδρογονούχος ένωση του αζώτου, ενώ άλλες δύο είναι η υδραζίνη (Η2ΝΝΗ2) και το υδραζωτικό οξύ (ΗΝ3). Ακόμη, είναι γνωστές και άλλες σταθερές ενώσεις υδρογόνου-αζώτου, παράγωγα των προηγούμενων (βλ. Χημική ένωση του μήνα: Υδραζωτικό οξύ και άλατά του).
Η αμμωνία είναι η πλέον διαδεδομένη χημική ένωση του αζώτου και βρίσκεται στη φύση σε διάφορες μορφές. Συγχρόνως αποτελεί μια από τις βασικότερες χημικές ουσίες, που παράγεται σε ποσότητες εκατομμυρίων τόνων ετησίως. Είναι η πρώτη σε ποσότητα συνθετική ένωση και αποτελεί την πρώτη ύλη για την παρασκευή πλήθους άλλων αζωτούχων χημικών ενώσεων και κυρίως των λιπασμάτων. Το υδατικό διάλυμα της αμμωνίας είναι ένα από τα κυριότερα χημικά αντιδραστήρια, που θα συναντήσει κάποιος σε κάθε χημικό εργαστήριο.
Σύντομη ιστορική διαδρομή της ανακάλυψης της αμμωνίας
Η αμμωνία ήταν γνωστή από τους αρχαίους Αιγυπτίους, στους Ρωμαίους, στους χυμευτές των Βυζαντίου και στους αλχημιστές του μεσαίωνα, οι οποίοι περιγράψανε την παρασκευή της και τις ιδιότητές της. Την παρασκεύαζαν από τη συνθέρμανση άλατος (NaCl) και ούρων.
Η ονομασία "αμμωνία" προέρχεται από το όνομα του 'Αμμωνος Διός (Amun-Ra, θεός των Αιγυπτίων). Οι Ρωμαίοι αποκαλούσαν τις αποθέσεις χλωριούχου αμμωνίου (ΝΗ4Cl) κοντά στον Ναό του Amun-Ra στην αρχαία Λιβύη sal ammoniacus (άλας του Amun). Κατά πάσα πιθανότητα αυτές οι αποθέσεις προέρχονταν από τα ούρα και τις κοπριές των καμηλών. Με την ονομασία αυτή εμφανίζεται στα γραπτά κείμενα του Ρωμαίου φυσιοδίφη Πλίνιου του Πρεσβύτερου (Pliny the Elder, 23-79 μ.Χ.).
|
(1) |
(2) |
(3) |
(4) |
|
(1) Απεικόνιση της αιγυπτιακής θεότητας Amun-Ra. Από το όνομα αυτού του ξεχασμένου θεού προέρχεται η ονομασία της αμμωνίας και από αυτήν η ονομασία πλήθους άλλων χημικών ενώσεων (π.χ. αμίνες, αμίδια). (2), (3) Οι καμήλες, μέσω της κοπριάς τους, υπήρξαν οι πρώτες πηγές αλάτων της αμμωνίας. Η κοπριά της καμήλας ακόμη και σήμερα χρησιμοποιείται ως καύσιμο. Κατά την καύση της παράγεται χλωριούχο αμμώνιο οι ατμοί του οποίου κρυσταλλώνονται στα ταβάνια των δωματίων. (4) Κρύσταλλοι χλωριούχου αμμωνίου πάνω σε άλλα γαιώδη υλικά. Ως ορυκτό το χλωριούχο αμμώνιο (salammoniac) είναι σπανιότατο, αφού διαλύεται από το νερό και βρίσκεται συνήθως εγκλωβισμένο κοντά σε ηφαιστειακές φουμαρόλες, από τα αέρια των οποίων παράγεται. |
|||
|
Χλωριούχο αμμώνιο (νησιαντήρι) χρησιμοποιούσαν παλιά οι γανωματήδες, ένα επάγγελμα που έχει πλέον εξαφανιστεί. |
Το χλωριούχο αμμώνιο ήταν γνωστό στους αλχημιστές του Μουσουλμανικού κόσμου ως nushadir. Κατά τον 8ο αιώνα και αναφέρθηκε για πρώτη φορά από τον Τζαμπίρ Ιμπν Χαγιάν (Jaber Ibn Hayan, 721(;)-815, Βαγδάτη), γνωστό στους Ευρωπαϊκούς αλχημιστικούς κύκλους ως Geber και ως ο "πρώτος των αλχημιστών". Το άλας αυτό συλλεγόταν από τα ταβάνια των δωματίων, όπου έκαιγαν ως καύσιμο κοπριές καμήλας (το χλωριούχο αμμώνιο εξαχνώνεται εύκολα). Πρέπει να σημειωθεί ότι το χλωριούχο αμμώνιο βρίσκεται και στη φύση και θεωρείται ως ένα σπάνιο ορυκτό. Αποθέσεις του βρίσκονται σε περιοχές κοντά σε ηφαίστεια (κοντά στις ηφαιστειακές φουμαρόλες) και είναι γνωστό ως sal-ammoniac.
Το
nushadir είναι γνωστό στα ελληνικά και ως "νησιαντήρι" και
το χρησιμοποιούσαν στη δουλειά τους οι παραδοσιακοί
"γανωματήδες",
"γανωτζήδες" ή "καλατζήδες".
Με αυτό καθάριζαν τις επιφάνειες χάλκινων ειδών (χαλκώματα ή "μπακίρια") από οξείδια πριν από το
"γάνωμα", δηλαδή πριν επιστρώσουν με κασσίτερο (καλάι) την
επιφάνειά τους για προστασία από την οξείδωση,
αλλά και για να αποφεύγονται οι δηλητηριάσεις από τον χαλκό. Ενδεικτική
αντίδραση (γανώματος): CuO + 2NH4Cl
(περίσσεια)
![]() CuCl2
(διαλυτό) + 2ΝΗ3
+ Η2Ο. Σήμερα, η διάθεση φθηνών
ανοξείδωτων μαγειρικών σκευών ουσιαστικά έχει καταργήσει αυτό το πανάρχαιο
επάγγελμα, που ήταν γνωστό ήδη από τους ρωμαϊκούς χρόνους.
CuCl2
(διαλυτό) + 2ΝΗ3
+ Η2Ο. Σήμερα, η διάθεση φθηνών
ανοξείδωτων μαγειρικών σκευών ουσιαστικά έχει καταργήσει αυτό το πανάρχαιο
επάγγελμα, που ήταν γνωστό ήδη από τους ρωμαϊκούς χρόνους.
|
|
|
|
Joseph Priestley (1733-1804). Διάσημος άγγλος χημικός γνωστότερος για την ανακάλυψη του οξυγόνου (χωρίς όμως να το αναγνωρίσει ως στοιχείο). Πρώτος απομόνωσε την αμμωνία την οποία ονόμασε "αλκαλικό αέρα". Δεξιά το εργαστήριο του Priestley. Στον πάγκο διακρίνεται το σκεύος όπου απομόνωνε τα διάφορα αέρια (πνευματική σκάφη). |
|
Η αμμωνία στους αλχημιστές του 13ου αιώνα αναφέρεται από τον Albertus Magnus. Κατά τον μεσαίωνα εποχή η αμμωνία, που προερχόταν από την ενζυματική διάσπαση της ουρίας (από ούρα "εθελοντών"), χρησιμοποιούνταν για να μεταβάλει το χρώμα των φυτικών χρωμάτων στα υφάσματα. Τον 15ο αιώνα ο Basilius Valentinus έδειξε ότι η αμμωνία παράγεται εύκολα με την αντίδραση χλωριούχου αμμωνίου και ισχυρών βάσεων.
Ο πρώτος που παρασκεύασε καθαρή αμμωνία σε αέρια μορφή ήταν ο 'Αγγλος Joseph Priestley (1733-1804). Το 1774, ο Priestley συνέλεξε αέρια αμμωνία με θέρμανση του χλωριούχου αμμωνίου με άσβεστο (CaO), στην "πνευματική σκάφη" (pneumatic trough) πάνω από επιφάνεια υδραργύρου. Παρατηρώντας την αλκαλική αντίδραση υδατικού διαλύματος αυτού του αερίου, το ονόμασε αλκαλικό αέρα (alkaline air). Ο Priestley διέσπασε την αμμωνία με σπινθήρες ηλεκτρικού ρεύματος και παρατήρησε ότι σχηματίζεται άζωτο και υδρογόνο, το οποίο καιόμενο σχημάτιζε σταγόνες νερού.
To 1785, o Claude Louis Berthollet (1748-1822) επιβεβαίωσε τη χημική σύσταση της αμμωνίας. Η μέθοδος του Priestley παρασκευής της αμμωνίας με τη αντίδραση χλωριούχου αμμωνίου και ασβέστου χρησιμοποιούνταν για την παρασκευή αμμωνίας σχεδόν μέχρι και τις αρχές του 20ο αιώνα.
Το 1909, πρωτοεφαρμόστηκε η μέθοδος των Haber-Bosch κατά την οποία αμμωνία σχηματίζεται με απ' ευθείας ένωση των συστατικών της σε υψηλή πίεση και θερμοκρασία και παρουσία διαφόρων καταλυτών. Η μέθοδος αυτή, μετά από πολλές βελτιώσεις και τροποποιήσεις επικράτησε λόγω του χαμηλού κόστους έναντι κάθε άλλης μεθόδου και μείωσε σημαντικά το κόστος της αμμωνίας.
Η μέθοδος των Haber-Bosch αποτέλεσε σημαντική βιομηχανική ανακάλυψη γιατί έτσι έγιναν διαθέσιμες οι τεράστιες ποσότητες αμμωνίας που χρειάζονταν για την παρασκευή αζωτούχων λιπασμάτων και νιτρικού οξέος που είχε ανάγκη η γεωργική παραγωγή. Σήμερα, η παγκοσμίως παραγόμενη αμμωνία σε όλο τον κόσμο με βάση τη μέθοδο των Haber-Bosch, ξεπερνά τα 100 εκατομμύρια τόνων ετησίως και θεωρείται ως η πρώτη σε ποσότητα συνθετική χημική ένωση. Η μεγαλύτερη ποσότητά της αμμωνίας (περίπου το 80%) διοχετεύεται στη βιομηχανία των λιπασμάτων για την παρασκευή αμμωνιακών και νιτρικών αλάτων.
Για το μόριο της αμμωνίας [Αναφ. 2]
|
Το μόριο της αμμωνίας (και των παραγώγων της) υπόκειται σε αναστροφή, γεγονός στο οποίο οφείλεται η αδυναμία απομόνωσης εναντιομερών μορφών των παραγώγων με τρεις διαφορετικούς υποκαταστάτες. |
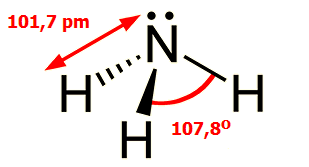
Το μόριο της αμμωνίας έχει δομή τριγωνικής πυραμίδας. Τα μήκη δεσμού N-H είναι 101,7 pm, ενώ η γωνία Η-Ν-Η είναι 107,8 μοίρες. Το μόριό της παρουσιάζει έντονη πολικότητα (1,44 D) με το αρνητικά φορτισμένο μέρος του να βρίσκεται στο Ν, όπου υπάρχει ασύζευκτο ζεύγος ηλεκτρονίων. Ακριβώς αυτό το ζεύγος ηλεκτρονίων καθιστά την αμμωνία ισχυρή βάση κατά Lewis και άριστο υποκαταστάτη (ligand).
Η σχετικά υψηλή διηλεκτρική σταθερά της υγρής αμμωνίας (ε/εο = 22, στους -33ºC, για το ύδωρ είναι ε/εο = 78,3 στους 25ºC) καθιστά την υγρή αμμωνία εξαιρετικό διαλύτη ετεροπολικών ενώσεων. Επιπλέον, στην υγρή αμμωνία σχηματίζονται αρκετά σταθεροί δεσμοί υδρογόνου (...Ν-Η...Ν-Η...). Το γεγονός αυτό ερμηνεύει το σχετικά υψηλό σ.ζ. της αμμωνίας (-33ºC), έναντι του σ.ζ. της φωσφίνης, PH3, (-87,7ºC) στην οποία δεν υφίστανται αντίστοιχοι δεσμοί. Η περίπτωση της ΝΗ3 και της PH3 είναι αντίστοιχη με την περίπτωση των Η2Ο και H2S (υγρό και αέριο αντίστοιχα, στη θερμοκρασία δωματίου).
Η ισχυρή πολικότητα, η υψηλή διηλεκτρική σταθερά και η δυνατότητα σχηματισμού δεσμών υδρογόνου με τα μόρια του ύδατος αιτιολογούν τη μεγάλη διαλυτότητα της αέριας αμμωνίας στο ύδωρ, όπως και την έκλυση σημαντικών ποσών θερμότητας κατά τη διάλυσή της σ' αυτό (37,1 kJ/mol).
Παράγωγα της αμμωνίας με τρεις διαφορετικούς υποκαταστάτες θεωρητικά θα έπρεπε να υπάρχουν σε δύο εναντιομερείς μορφές, ωστόσο δεν έχει επιτευχθεί η απομόνωσή τους. Ο λόγος είναι η ενεργειακά εύκολη αναστροφή του μορίου τους (βλ. σχήμα), όπως και της ίδιας της αμμωνίας.
Σύνθεση της αμμωνίας [Αναφ. 1]
Έργαστηριακές παρασκευές. Η αμμωνία είναι μια από τις πιο κοινές χημικές ουσίες που διατίθεται σε άφθονες ποσότητες ως υγροποιημένο αέριο ή ως υδατικό διάλυμα (περίπου 25% w/w), οπότε η σύνθεσή της στο εργαστήριο έχει μόνο εκπαιδευτικό χαρακτήρα. Ο πιο συνηθισμένος τρόπος παραγωγής μικρών ποσοτήτων αέριας αμμωνίας είναι η θέρμανση πυκνού υδατικού διαλύματος αμμωνίας. Η παρουσία ισχυρής βάσης (π.χ. NaOH) αυξάνει την απόδοση αυτής της απλής διαδικασίας.
|
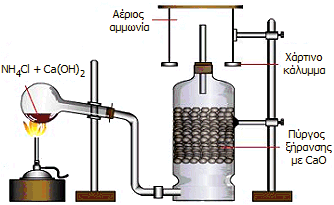
Εργαστηριακή διάταξη παρασκευής μικρής ποσότητας αέριας αμμωνίας [Αναφ. 1δ]. |
'Αλλος τρόπος είναι η θέρμανση κάποιου άλατος του αμμωνίου (συνήθως NH4Cl) με πυκνό διάλυμα ισχυρής βάσης ή με εσβεσμένη άσβεστο (Ca(OH)2). Η ξήρανση της παραγόμενης αμμωνίας μπορεί να επιτευχθεί με διαβίβαση μέσω πύργου ή σωλήνα ξήρανσης που περιέχει CaO. Η αέρια αμμωνία μπορεί να συλλεχθεί σε ανεστραμμένο κύλινδρο, επειδή είναι ειδικώς ελαφρύτερη από τον αέρα:
NaOH + NH4Cl
![]() NaCl + NH3 + H2O Ca(OΗ)2 + 2NH4Cl
NaCl + NH3 + H2O Ca(OΗ)2 + 2NH4Cl
![]() CaCl2 + 2NH3 + 2H2O
CaCl2 + 2NH3 + 2H2O
Αμμωνία παράγεται επίσης με υδρόλυση νιτριδίων. 'Ετσι, με θέρμανση ρινισμάτων μαγνησίου σε ρεύμα καθαρού αζώτου σχηματίζεται το αντίστοιχο νιτρίδιο. Αυτό αντιδρά με το νερό παρέχοντας αμμωνία (να σημειωθεί ότι δεν αντιδρούν όλα τα νιτρίδια των μετάλλων με αυτόν τον τρόπο, κάποια μάλιστα είναι εξαιρετικώς σταθερά):
3 Mg + N2
![]() Mg3N2
Mg3N2 + 6 H2O
Mg3N2
Mg3N2 + 6 H2O
![]() 3 Mg(OH)2 + 2 NH3
3 Mg(OH)2 + 2 NH3
Με θέρμανση αλάτων του αμμωνίου με μη πτητικά οξέα, π.χ.
(NH4)2SO4
![]() NH4HSO4 + NH3
NaNH4HPO4
NH4HSO4 + NH3
NaNH4HPO4
![]() NaPO3 + NH3 + H2O
NaPO3 + NH3 + H2O
'Αλλοι τρόποι παρασκευής αμμωνίας χωρίς καμιά πρακτική σημασία είναι η υδρόλυση διαφόρων αζωτούχων οργανικών ενώσεων (νιτρίλια, αμίδια). Σχετικό ενδιαφέρον παρουσιάζει η υδρόλυση της ουρίας (διαμίδιο του ανθρακικού οξέος). Η ουρία υδρολύεται εύκολα παρουσία του ενζύμου ουρεάση, όπως επίσης και με θέρμανση σε ισχυρώς όξινο ή αλκαλικό περιβάλλον:
![]()
Αμμωνία μπορεί να παραχθεί με αναγωγή των νιτρικών αλάτων με διάφορα μέταλλα σε αλκαλικό περιβάλλον. Το κράμα Devarda (45% Al - 50% Cu - 5% Zn). Η αντίδραση αυτή χρησιμοποιείται για τον ποσοτικό προσδιορισμό των νιτρικών, μετά την ποσοτική μετατροπή τους σε αμμωνία, παραλαβή της με απόσταξη και ογκομετρικό προσδιορισμό της. Η αντίδραση αναγωγής των νιτρικών είναι η ακόλουθη:
![]()
Βιομηχανικές μέθοδοι. Πριν από την έναρξη του 1ου Παγκόσμιου Πολέμου, η αμμωνία λαμβανόταν με ξηρή απόσταξη φυτικών και ζωικών προϊόντων, με αναγωγή του νιτρώδους οξέος και νιτρωδών αλάτων με υδρογόνο, όπως επίσης με διάσπαση αμμωνιακών αλάτων (κυρίως του sal-ammoniac, NH4Cl) με ισχυρές βάσεις ή με άσβεστο. Μια άλλη μέθοδος που αναπτύχθηκε στις αρχές του 20ου αιώνα και χρησιμοποιήθηκε για μικρό χρονικό διάστημα (μέθοδος Caro - Frank) βασιζόταν στην παρασκευή και στη συνέχεια υδρόλυση του ασβεστοκυαναμιδίου (CaCN2):
CaO
+ 3 C
![]() CaC2 + CO
CaC2 + N2
CaC2 + CO
CaC2 + N2
![]() CaCN2 + C
CaCN2 + 3 H2O
CaCN2 + C
CaCN2 + 3 H2O
![]() CaCO3 + 2 NH3
CaCO3 + 2 NH3
Το 1905, οι Γερμανοί χημικοί Fritz Haber (1868-1934) and Carl Bosch (1874-1940) ανέπτυξαν μια βιομηχανική μέθοδο παρασκευής αμμωνίας από το ατμοσφαιρικό άζωτο και υδρογόνο, το οποίο σήμερα παράγεται κατά κανόνα από το φυσικό αέριο (αντίδραση μεθανίου με υδρατμούς, αντίδραση γνωστή ως "αναμόρφωση μεθανίου με ατμό", βλ. Χημική ένωση του μήνα: Μεθανόλη). 'Ετσι, σήμερα η αμμωνία θεωρείται ως προϊόν που παρασκευάζεται με πρώτη ύλη το φυσικό αέριο.
Η μέθοδος παρασκευής αμμωνίας με δέσμευση του ατμοσφαιρικού αζώτου, γνωστή πλέον ως μέθοδος Haber-Bosch, έπαιξε ακρογωνιαίο ρόλο στην ανάπτυξη της χημικής βιομηχανίας και των λιπασμάτων για τη γεωργία, αλλά και των εκρηκτικών υλών, αφού με οξείδωση της αμμωνίας ήταν πλέον εύκολη η παρασκευή νιτρικού οξέος. Ο Haber τιμήθηκε με το Nobel Χημείας το 1918 και ο Bosch το 1931.
Μέχρι σήμερα δεν έχει βρεθεί αποτελεσματικότερος τρόπος χημικής δέσμευσης και αξιοποίησης του ατμοσφαιρικού αζώτου από τη μέθοδο Haber-Bosch. Πράγματι η μέθοδος αυτή φαίνεται "αξεπέραστη". 'O,τι συνθετικό υλικό περιέχει άζωτο, είτε πρόκειται για κάποιο πολυμερές, είτε οργανικό χρώμα, είτε εκρηκτικό, είτε κάποιο φάρμακο, είτε οτιδήποτε άλλο, είναι σχεδόν βέβαιο ότι το άζωτό του κάποτε βρισκόταν στην ατμόσφαιρα και από εκεί παγιδεύτηκε αρχικά ως αμμωνία με τη μέθοδο των Haber-Bosch.
 |
 |
 |
 |
|
| Αριστερά: Τμήμα του εργοστασιακού συγκροτήματος BASF (Badische Anilin und Soda Fabrik) στο Ludwigshaven-Oppau (1881). Το συγκρότημα άνοιξε το 1913, ένα χρόνο πριν από την έναρξη του 1ου Παγκόσμιου Πόλεμου για την παραγωγή αμμωνίας με τη μέθοδο Haber-Bosch, αλλά αμέσως επεκτάθηκε με μονάδες παραγωγής νιτρικού οξέος για την παρασκευή εκρηκτικών. Δεξιά: Εγκατάσταση ενός από τους πρώτους αντιδραστήρες υψηλής πίεσης για την παραγωγή αμμωνίας [Αναφ. 3ζ]. |
(1868-1934) |
(1874-1940) |
||
|
Αμμωνία και ο 1ος Παγκόσμιος Πόλεμος [Αναφ. 3στ]
Η μέθοδος Haber-Bosch αποτελεί τυπικό παράδειγμα της αντιφατικής επίδρασης της χημείας στη ζωή, που παρατηρείται σε πλήθος περιπτώσεων. Κατά την έναρξη του 1ου Παγκοσμίου Πολέμου η Γερμανία ήταν εξολοκλήρου εξαρτημένη από τις φυσικές αποθέσεις νιτρικών αλάτων της Χιλής (έρημος Ατακάμα). Από αυτά τα νιτρικά άλατα παρασκεύαζαν το νιτρικό οξύ και από αυτό τα απαραίτητα εκρηκτικά για τη συνέχιση του πολέμου. Ωστόσο, ο εφοδιασμός αυτός σύντομα διακόπηκε μετά τον αποκλεισμό των λιμανιών της Νότιας Αμερικής από τον στόλο των συμμάχων. Αν δεν υπήρχε πλέον η δυνατότητα εναλλακτικής πηγής ενώσεων αζώτου, όπως η αμμωνία μέσω της άμεσης σύνθεσής της με τη μέθοδο των Haber-Bosch, είναι σχεδόν βέβαιο ότι η Γερμανία θα είχε ηττηθεί πολύ πριν από 1918. Χάρις στη μέθοδο Haber-Bosch ο πόλεμος συνεχίστηκε και έτσι έμμεσα η ανακάλυψη της μεθόδου κόστισε τη ζωή χιλιάδων ακόμη ανθρώπων. Ωστόσο, στη συνέχεια, η εφαρμογή της μεθόδου στην παραγωγή φθηνών αζωτούχων λιπασμάτων είχε ως αποτέλεσμα την παγκόσμια αύξηση της γεωργικής απόδοσης, γεγονός που έσωσε εκατομμύρια ζωές από τον θάνατο από την πείνα. |
Η αντίδραση μεταξύ αζώτου και υδρογόνου είναι εξώθερμη και παρέχεται από την αντίδραση:
![]()
|
|
|
|
|
Μαγνητίτης (Fe3O4). Το κοινό ορυκτό μαγνητίτης αποδείχθηκε αποτελεσματικός καταλύτης αντικαθιστώντας το πανάκριβο και δυσεύρετο όσμιο που είχε αρχικά υποδειχθεί από τον Haber. |
Αντιδραστήρας υψηλής πίεσης (κατασκευής 1921) του εργοστασίου της BASF, που χρησιμοποιήθηκε για την παραγωγή αμμωνίας με τη μέθοδο των Haber-Bosch. Σήμερα στέκει ως βιομηχανικό μνημείο στο Πανεπιστήμιο της Καρλσρούης στη Γερμανία [Αναφ. 1β]. |
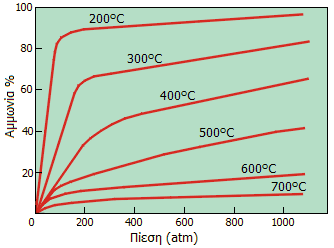
Επίδραση της θερμοκρασίας και της πίεσης στο ποσοστό μετατροπής (απόδοση) των αντιδρώντων (Ν2 + Η2) σε αμμωνία. Στους 200ºC και στις 750 atm η απόδοση προσεγγίζει το 90-95%, ωστόσο οι τόσο υψηλές πιέσεις δημιουργούν προβλήματα αντοχής, έτσι τελικά χρησιμοποιούνται θερμοκρασίες και πιέσεις γύρω στους 500ºC και 200 atm, αντίστοιχα, όπου οι αποδόσεις είναι μόλις 10-20% [Αναφ. 3ε]. |
Σύμφωνα με την αρχή Le Chatelier, σε χημικό σύστημα που βρίσκεται σε ισορροπία, κάθε μεταβολή σε συγκέντρωση, θερμοκρασία, όγκο ή μερική πίεση, προκαλεί μετατόπιση της ισορροπίας κατά τρόπο που θα εξουδετερώσει κατά το δυνατόν τη επιβαλλόμενη μεταβολή. Δεδομένου ότι στην παραπάνω ισορροπία επέρχεται μείωση του όγκου (4 όγκοι αντιδρώντων παρέχουν 2 όγκους προϊόντος) μπορεί να προβλεφθεί ότι με αύξηση της πίεσης η θέση ισορροπίας μετατοπίζεται προς τα δεξιά.
Ομοίως, από το ότι η αντίδραση είναι εξώθερμη μπορεί πάλι να προβλεφθεί ότι σε χαμηλές θερμοκρασίες η ισορροπία μετατοπίζεται προς τα δεξιά. Ωστόσο, άλλο είναι η θέση ισορροπίας και άλλο η ταχύτητα της αντίδρασης. 'Eτσι, σε χαμηλές θερμοκρασίες η αντίδραση σχηματισμού αμμωνίας (δηλ. η αποκατάσταση της παραπάνω ισορροπίας) είναι υπερβολικά αργή ακόμη και σε πολύ υψηλές πιέσεις.
Ο Haber διαπίστωσε το πανάκριβο και δυσεύρετο όσμιο μπορούσε να δράσει καταλυτικά στην παραπάνω αντίδραση. Στη συνέχεια, στα εργαστήρια της BASF εξετάστηκαν περισσότερα από 2500 υλικά για να διαπιστωθεί τελικά ότι το φθηνό μικτό οξείδιο σιδήρου(ΙΙ) και σιδήρου(ΙΙΙ), δρα ως αποτελεσματικός καταλύτης, διευκολύνοντας τη διάσπαση των δεσμών των διατομικών μορίων του αζώτου και του υδρογόνου.
Η αντίδραση αζώτου και υδρογόνου πραγματοποιείται σε υψηλή πίεση (150-250 Atm) και μετρίως υψηλές θερμοκρασίες (300-550°C). Το μίγμα των αερίων περνάει μέσα από τέσσερα στρώματα καταλύτη και ψύχεται κατά στάδια για να διατηρείται μια σχετική ισορροπία καθώς η αντίδραση είναι εξώθερμη. Οι καταλύτες που χρησιμοποιούνται είναι ένα ειδικά επεξεργασμένο μίγμα οξειδίων σιδήρου (μαγνητίτης, Fe3O4) και μολυβδαινίου, που περιέχουν επίσης K2O, CaO και Al2O3 (αργιλικά άλατα καλίου και ασβεστίου). Οι τελευταίες χαρακτηρίζονται ως ενισχυτές καταλύτη ή επικαταλύτες (promoters).
|
Εργαστηριακή συσκευή σύνθεσης αμμωνίας με τη μέθοδο Haber-Bosch. |
Σε κάθε πέρασμα των αερίων η μετατροπή του μίγματος N2 - H2 είναι δεν ξεπερνάει το 15%. Ωστόσο, μετά την ψύξη και παραλαβή της σχηματιζόμενης αμμωνίας, το μίγμα N2 - H2 που δεν αντέδρασε ανακυκλώνεται και ξαναπερνά από τον αντιδραστήρα με τους καταλύτες, έως ότου μετατραπεί σε αμμωνία το 97-98% της αρχικής ποσότητας του μίγματος.
Η διευκρίνηση του μηχανισμού της αντίδρασης έχει υπάρξει αντικείμενο έντονης ερευνητικής προσπάθειας. Στον τομέα αυτό σημαντική υπήρξε η συνεισφορά του Γερμανού Gerhard Ertl (βραβείο Nobel, 2007). Γενικά, θεωρείται ότι στον μηχανισμό ετερογενούς κατάλυσης εμπλέκονται πολλές ενδιάμεσες αντιδράσεις, όπως οι ακόλουθες:
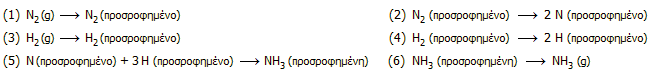
Η αντίδραση (5) θεωρείται ότι προχωράει σε τρία διαδοχικά βήματα όπου σχηματίζονται διαδοχικά τα σωματίδια NH, NH2 και τελικά ΝΗ3, ενώ ως στάδιο καθοριστικό της ταχύτητας της συνολικής αντίδρασης θεωρείται η αντίδραση (2).
Το 1913, η μέθοδος Haber - Bosch εφαρμόστηκε για πρώτη φορά στο εργοστάσιο της BASF (Badische Anilin und Soda Fabrik) στο Ludwigshaven-Oppau της Γερμανίας. Ο αρχικός ρυθμός παραγωγής ήταν 30 τόνοι αμμωνίας την ημέρα. Το απαιτούμενο άζωτο λαμβανόταν με απόσταξη υγροποιημένου αέρα και το υδρογόνο με ηλεκτρόλυση του ύδατος. Οι σημερινές μέθοδοι διαφέρουν κυρίως ως προς την πηγή υδρογόνου, αλλά και στην αποτελεσματικότητα των χρησιμοποιούμενων καταλυτών. 'Εχει πραγματοποιηθεί πλήθος μελετών πάνω στις θερμοδυναμικές αρχές που διέπουν την αντίδραση και στις μορφές των διαφόρων καταλυτών με σκοπό την περαιτέρω μείωση του κόστους της σύνθεσης.
Εκτός από τις περιοχές όπου υπάρχει εξαιρετικά φθηνή ηλεκτρική ενέργεια, η παραγωγή υδρογόνου πραγματοποιείται με αντίδραση κωκ με νερό (C/H2O) ή -κυρίως- από το φυσικό αέριο (CH4 > 90%, βλ. Χημική ένωση του μήνα: Μεθάνιο) ή από τη νάφθα (πτητικό κλάσμα του ακάθαρτου πετρέλαιο). Η χρησιμοποίηση υδρογονανθράκων αντί άνθρακα για την παραγωγή υδρογόνου παρουσιάζει σημαντικότατα οικονομικά πλεονεκτήματα. Με το ίδιο επενδυτικό κόστος η απαιτούμενη έκταση είναι μειώνεται στο 1/3, η απαιτούμενη ενέργεια στο 1/2, το ανθρώπινο δυναμικό στο 1/10, ενώ η παραγωγή ΝΗ3 είναι τετραπλάσια.
|
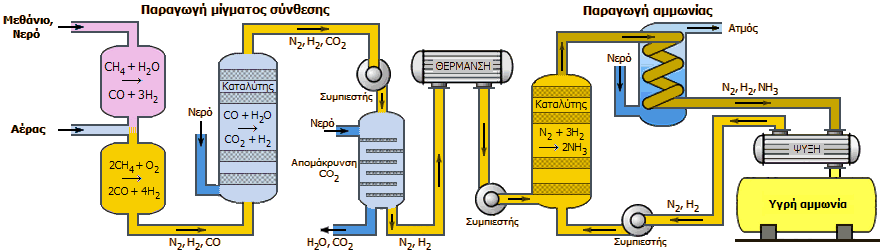
Αμμωνία από το φυσικό αέριο [Αναφ. 3]
Σήμερα ως πηγή υδρογόνου για την παραγωγή αμμωνίας με τη μέθοδο Haber - Bosch στις περισσότερες περιπτώσεις χρησιμοποιείται κυρίως το φυσικό αέριο (κυρίως CH4). Στην όλη διαδικασία εμπλέκονται πολλές προσεκτικά εξισορροπημένες αλληλουχίες αντιδράσεων, με πολλαπλά στάδια σύνθεσης, όπως και καθαρισμού/απαλλαγής από ανεπιθύμητα αέρια, των οποίων η παρουσία βλάπτει τους καταλύτες ή/και την καθαρότητα του προϊόντος. Σε μια προσεκτικά σχεδιασμένη βιομηχανική μονάδα πραγματοποιείται η όσο δυνατόν πληρέστερη αξιοποίηση της αναγωγικής ισχύος του μεθανίου, όπως και της εκλυόμενης θερμότητας από τα εξώθερμα στάδια των αντιδράσεων. Ως "συνολική" αντίδραση θα μπορούσε να θεωρηθεί η ακόλουθη:
Σύμφωνα με την παραπάνω "ιδανική" αντίδραση από 1 mol μεθανίου προκύπτουν 8/3 = 2,67 mol αμμωνίας. Ωστόσο, στην πράξη, μέρος του μεθανίου θα πρέπει να καεί για να καλύψει μέρος της συνολικά απαιτούμενης θερμικής ενέργειας και έτσι μια πιο κοντά στην πραγματικότητα συνολική αντίδραση είναι η επόμενη:
Επιμέρους στάδια. Αρχικά, το φυσικό αέριο πρέπει να υποστεί προσεκτική αποθείωση για την απομάκρυνση θειούχων ενώσεων (κυρίως ίχνη θειολών), οι οποίες δηλητηριάζουν τους μεταλλικούς καταλύτες που χρησιμοποιούνται στα επόμενα στάδια. Η αποθείωση πραγματοποιείται με καταλυτική υδρογόνωση των θειολών. Tο παραγόμενο υδρόθειο δεσμεύεται με διαβίβαση του αερίου μίγματος μέσω αντιδραστήρα που περιέχει ZnO (το οποίο αντικαθίσταται όταν εξαντληθεί):
Το αποθειωμένο φυσικό αέριο πιέζεται στις (περίπου) 30 Atm και αντιδρά με υδρατμούς πάνω από νικέλιο στους 750°C, οι αντιδράσεις, γνωστές ως αντιδράσεις αναμόρφωσης με ατμό (steam reforming reactions) είναι:
Ακολουθεί το στάδιο της εισαγωγής του αέρα. Με το στάδιο αυτό: (α) εισάγεται οξυγόνο που θα κάψει το υπόλοιπο CH4 (περίπου το 9%) και θα ανεβάσει τη θερμοκρασία σε υψηλές τιμές για περαιτέρω παραγωγή υδρογόνου από το υπόλοιπο CH4 και (β) εισάγεται το απαιτούμενο άζωτο, ώστε να προκύψει η αναλογία Η2:Ν2 στο 3:1. Ακολουθεί επιπλέον στάδιο μετατροπής του CO σε CO2 και παραγωγής επιπλέον υδρογόνου με την αντίδραση μετατόπισης (shift reaction), η οποία πραγματοποιείται σε δύο στάδια με διαφορετικούς καταλύτες και θερμοκρασίες στο καθένα. Στο πρώτο στάδιο (Fe3O4/400°C) το CO μειώνεται από 11% σε 3%, στο δεύτερο (Cu/200°C) μειώνεται από 3% σε 0,3% :
Το μίγμα Ν2, Η2, CO2 (+ ίχνη CO, CH4) απαλλάσσεται από το CO2 με διαβίβασή του μέσω υδατικού διαλύματος K2CO3 το οποίο αναγεννάται σύμφωνα με τις αντιδράσεις:
Για τον ίδιο σκοπό μπορούν να χρησιμοποιηθούν οργανικές αμίνες, όπως η αιθανολαμίνη (H2NCH2CH2OH), που μπορούν να αναγεννηθούν με τον ίδιο τρόπο (απορροφούν το CO2 σε χαμηλές θερμοκρασίες, το αποδίδουν σε υψηλές). Ακολουθεί απομάκρυνση και των τελευταίων ιχνών CO που μπορούν να δηλητηριάσουν τον καταλύτη της τελικής αντίδρασης. Αυτό πραγματοποιείται με διαβίβαση του μίγματος υπεράνω νικελίου στους 325°C και αναφέρεται ως στάδιο μεθανίωσης (αντίστροφη της αντίδραση αναμόρφωσης με ατμό):
Το αέριο που προκύπτει αποτελεί το αέριο σύνθεσης, το οποίο είναι μίγμα Η2:Ν2 στη θεωρητικά απαιτούμενη αναλογία 3:1. Επιπλέον, περιέχει μικροποσότητες άλλων αερίων που δεν παρενοχλούν τη σύνθεση της αμμωνίας. Τυπική σύνθεση του αερίου σύνθεσης που θα οδηγηθεί στο τελικό στάδιο σύνθεσης αμμωνίας είναι η εξής: Η2: 74,3%, Ν2: 24,7%, CH4: 0,8%, Ar: 0,3%, CO: 1-2 ppm.
Σχηματικό διάγραμμα της διαδικασίας παραγωγής αμμωνίας με πρώτες ύλες το φυσικό αέριο και ατμοσφαιρικό αέρα (δεν περιλαμβάνει τα στάδια αποθείωσης και απαλλαγής του αερίου σύνθεσης από ίχνη CO (στάδιο μεθανίωσης).
|
|||||||||||||
|
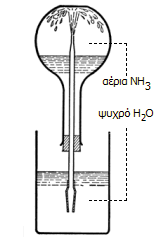
To "σιντριβάνι αμμωνία" (ammonia fountain): Το κλασικό πείραμα επίδειξης της μεγάλης τάσης της αέριας αμμωνίας να διαλυθεί σε ψυχρό νερό. |
Χημικές ιδιότητες της αμμωνίας
Η αμμωνία είναι ένα από τα πιο κοινά αντιδραστήρια στα χημικά εργαστήρια και πρώτη ύλη για τη βιομηχανική σύνθεση πλήθους άλλων χημικών ενώσεων. Η αμμωνία δρα κυρίως ως ασθενής βάση, ως συμπλεκτικό αντιδραστήριο και ως ήπιο αναγωγικό αντιδραστήριο.
Η αμμωνία ως βάση. Το ασύζευκτο ζεύγος ηλεκτρονίων της αμμωνίας την καθιστά ισχυρή βάση κατά Lewis και άριστο υποκαταστάτη (ligand). Σε υδατικά διαλύματα μικρό ποσοστό μορίων αμμωνίας αποσπά πρωτόνιο από τα μόρια του ύδατος και έτσι τα διαλύματά της παρουσιάζονται ως ελαφρώς αλκαλικά λόγω της ισορροπίας:
![]()
Ενδεικτικές τιμές pH υδατικού διαλύματος αμμωνίας: 11,6 (διάλυμα 1 Μ), 11,1 (διάλυμα 0,1 Μ).
Αν και σε αρκετά, συνήθως παλιά, βιβλία χημείας το υδατικό
διάλυμα αμμωνίας αναγράφεται ως "υδροξείδιο του αμμωνίου" (ΝΗ4ΟΗ),
η ύπαρξη χημικού σωματιδίου με αυτόν το τύπο δεν έχει διαπιστωθεί. Ωστόσο, έχουν απομονωθεί υδρίτες της αμμωνίας σταθεροί σε πολύ χαμηλές θερμοκρασίες
(ΝΗ3![]() Η2Ο
με σ.τ. -79,0ºC και 2ΝΗ3
Η2Ο
με σ.τ. -79,0ºC και 2ΝΗ3![]() Η2Ο
με σ.τ. 78,3ºC). Πάντως σε κάθε περίπτωση, η αναγραφή του χημικού
τύπου ΝΗ4ΟΗ
θα πρέπει να θεωρηθεί καταχρηστική και καλό είναι να αποφεύγεται, αφού δεν υφίσταται τέτοια ένωση.
Η2Ο
με σ.τ. 78,3ºC). Πάντως σε κάθε περίπτωση, η αναγραφή του χημικού
τύπου ΝΗ4ΟΗ
θα πρέπει να θεωρηθεί καταχρηστική και καλό είναι να αποφεύγεται, αφού δεν υφίσταται τέτοια ένωση.
Το κατιόν του αμμωνίου έχει τετραεδρική διάταξη (ανάλογη με εκείνη του μεθανίου) και η συμπεριφορά των αλάτων του είναι ανάλογη εκείνων του κατιόντος του Κ λόγω σχεδόν παρόμοιου μεγέθους και εξωτερικής ηλεκτρονιακής δομής.
Η αμμωνία ως οξύ. Η αμμωνία δρα ασθενές οξύ, λόγω του θετικού φορτίου των υδρογόνων της. Η δράση της ως οξέος εκδηλώνεται κατά την αντίδραση της υγρής αμμωνίας με δραστικά μέταλλα όπως το νάτριο, με το οποίο (παρουσία καταλυτικών ποσοτήτων Fe(NO3)3) αντιδρά παρέχοντας νατραμίδιο, ένα ιδιαίτερα χρήσιμο αντιδραστήριο κυρίως για την οργανική σύνθεση:
|
Tεχνικοί αντικαθιστούν τον καταλύτη (πλέγμα κράμματος Pt 90% - Rh 10%) σε βιομηχανική μονάδα (Nitram, Inc., Tampa, Florida) παραγωγής νιτρικού οξέος με τη μέθοδο Ostwald. |
2 Na + 2
NH3
![]() 2 NaNH2 + H2
2 NaNH2 + H2
Σε αντίθεση με ό,τι συμβαίνει στην περίπτωση του ύδατος, η αντίδραση της υγρής αμμωνίας με μέταλλα της ομάδας των αλκαλίων είναι σχετικώς ήπια. Η παρουσία καταλύτη είναι απαραίτητη για να αποφευχθεί η απλή διάλυση του μετάλλου με σχηματισμό διαλυτωμένων ηλεκτρονίων, όπως περιγράφεται παρακάτω.
Η αμμωνία ως αναγωγική ουσία. Η αμμωνία (ως αέριο) καίγεται δύσκολα στον αέρα, εύκολα όμως καίγεται σε καθαρή ατμόσφαιρα οξυγόνου με πρασινοκίτρινη φλόγα παρέχοντας άζωτο ή οξείδιo του αζώτου αν η καύση γίνει παρουσία καταλύτη (Pt ή κράμα Pt-Rh), σύμφωνα με τις αντιδράσεις:
![]()
Η τελευταία αντίδραση έχει ιδιαίτερο βιομηχανικό ενδιαφέρον, αφού σ' αυτήν βασίζεται η σύγχρονη μέθοδος παραγωγής του νιτρικού οξέος (μέθοδος Ostwald). Η συνολική αλληλουχία των αντιδράσεων έχει ως εξής:
![]()
Θα πρέπει να σημειωθεί ότι η υγρή αμμωνία, λόγω του μικρού της κόστους και του μεγάλου ενεργειακού περιεχομένου της έχει προταθεί ως περιβαλλοντικά ασφαλές καύσιμο (κατά την καύση της δεν παράγει CO2) και έχει χρησιμοποιηθεί σε δοκιμαστικό επίπεδο ως καύσιμο αυτοκινήτων και αεροσκαφών. Επιπλέον, υπάρχουν οργανισμοί που προωθούν τη χρήση της αμμωνίας ως καύσιμο (http://www.nh3fuelassociation.org).
'Αλλες αντιδράσεις, όπου η αμμωνία δρα αναγωγικά είναι η αναγωγή μεταλλικών οξειδίων και διάφορων οξειδωτικών ενώσεων (κυρίως σε αλκαλικά διαλύματα):
![]()
'Αλατα του αμμωνίου με οξειδωτικά ανιόντα υπόκεινται σε αυτοοξειδοαναγωγικές αντιδράσεις θερμικής διάσπασης, από τις οποίες από τις πιο γνωστές είναι οι ακόλουθες:
![]()
Ιδιαίτερο ενδιαφέρον έχει η αντίδραση οξείδωσης της αμμωνίας με διάλυμα υποχλωριωδών αλάτων (π.χ. χλωρίνη). ΠΡΟΣΟΧΗ! Πρόκειται για δύο χημικές ουσίες που κυκλοφορούν ελεύθερα και βρίσκονται σχεδόν σε κάθε σπίτι. Tα διαλύματα αμμωνίας που διατίθενται για οικιακή χρήση από τα φαρμακεία περιέχουν 5-10% ΝΗ3, ενώ τα διαλύματα που διατίθενται από οίκους χημικών αντιδραστηρίων και προορίζονται για χημικά εργαστήρια περιέχουν συνήθως 25-30% αμμωνία [Αναφ. 1β]. Ωστόσο, η αμμωνία αποτελεί και κύριο συστατικό πολλών οικιακών προϊόντων καθαρισμού επιφανειών (τζαμιών). Επομένως, είναι πολύ πιθανή η ανάμιξη διαλυμάτων που περιέχουν υποχλωριώδη και αμμωνία κατά λάθος ή στα πλαίσια κάποιων "πειραματισμών", γεγονός που μπορεί να οδηγήσει σε επικίνδυνες καταστάσεις.
Τα παραγόμενα προϊόντα εξαρτώνται από τις συνθήκες της αντίδρασης, των συγκεντρώσεων και τις αναλογίες των αντιδρώντων. Στην καλύτερη περίπτωση, αν τα υποχλωριώδη βρίσκονται σε περίσσεια το προϊόν οξείδωσης είναι αποκλειστικά άζωτο, ενώ αν η αμμωνία βρίσκεται σε περίσσεια αυξάνουν οι πιθανότητες παραγωγής τοξικών, αλλά και εκρηκτικών ενώσεων όπως η χλωραμίνη (NH2Cl) και η υδραζίνη (N2H4). Οι (συνολικές) αντιδράσεις που παρέχουν αυτά τα προϊόντα έχουν ως εξής [Αναφ. 4]:
![]()
Η τελευταία αντίδραση (αμμωνίας - υποχλωριωδών) χρησιμοποιείται για τη βιομηχανική παραγωγή υδραζίνης και πραγματοποιείται συνήθως παρουσία ζελατίνης (μέθοδος Raschig, 1907).
Ιδιαίτερο βιομηχανικό ενδιαφέρον έχει η οξείδωση μίγματος αμμωνίας - μεθανίου από οξυγόνο. Σε υψηλή θερμοκρασία και παρουσία καταλύτη η αντίδραση παρέχει υδροκυάνιο (μέθοδος Andrussov):
![]()
Με τη μέθοδο αυτή παρασκευάζονται εκατοντάδες χιλιάδες τόνοι υδροκυανίου ετησίως. Το υδροκυάνιο χρησιμοποιείται επί τόπου για την παρασκευή ακρυλονιτριλίου και στη συνέχεια πολυακρυλονιτριλίου, που αποτελεί το κύριο πολυμερές (για υφάνσιμες ίνες). Αναφέρεται ότι το 2000 με τη μέθοδο Andrussov παρήχθησαν 732 χιλιάδες τόνοι υδροκυανίου.
Αντιδράσεις αμμωνίας με αλογόνα. 'Αμεση αντίδραση της αμμωνίας με χλώριο παρέχει χλωραμίνες (εξαιρετικώς ερεθιστικά υγρά, συναντούνται σε πολύ μικρές συγκεντρώσεις σε πισίνες, όπου χρησιμοποιείται χλώριο για την απολύμανση των υδάτων τους) και τριχλωριούχο άζωτο (ή τριχλωραμίνη, NCl3), ένα επικίνδυνα ασταθές εκρηκτικό υγρό (σ.ζ. = 71°C). Αναφέρεται ότι ο Pierre Louis Dulong που παρασκεύσε τριχλωριούχο άζωτο για πρώτη φορά το 1812, έχασε δύο δάκτυλα και ένα μάτι σε δύο ξεχωριστές εκρήξεις.
Αντίστοιχες ασταθείς ενώσεις παρέχει και με το βρώμιο. Με το φθόριο αντιδρά παρέχοντας το άοσμο αλλά τοξικό αέριο τριφθοριούχο άζωτο (NF3, σ.ζ. = -129,1°C), το μόνο σταθερό τριαλογονίδιο του αζώτου.
Η αντίδραση υδατικών διαλυμάτων αμμωνίας με ιώδιο παρέχει ένα μέλαν σώμα, το οποίο περιγράφεται ως τριιωδιούχο άζωτο (ΝΙ3), στην πραγματικότητα όμως πρέπει να είναι μικτή ένωση πολυμερικού χαρακτήρα. Το ΝΙ3 όταν είναι ξηρό είναι εξαιρετικά ασταθές και διασπάται στα συστατικά του εκρηκτικά με εκκωφαντικό κρότο ακόμη και αν αγγιχθεί "με φτερό". ΠΡΟΣΟΧΗ!: Στα πειράματα επίδειξης παρασκευής και έκρηξης NI3 πρέπει να χρησιμοποιείται ελάχιστη ποσότητα κρυσταλλικού ιωδίου (5-10 mg):
![]()
Αντίδραση αμμωνίας με διοξείδιο του άνθρακα. Μεγάλες ποσότητες ουρίας παρασκευάζονται με άμεση αντίδραση αμμωνίας με διοξείδιο του άνθρακα υπό πίεση και υψηλή θερμοκρασία. Η ουρία παράγεται σε ποσότητες δεκάδων εκατομμύριων τόνων και χρησιμοποιείται ως συστατικό αζωτούχων λιπασμάτων. Οι αντιδράσεις έχουν ως εξής:
![]()
Αντιδράσεις αμμωνίας με οργανικές ενώσεις. Η αμμωνία αντιδρά με πλήθος οργανικών ενώσεων σχηματίζοντας αμίνες και αμίδια. Τυπικές (γενικές) αντιδράσεις είναι:
Με αλκυλαλογονίδια παρέχει αμίνες (πρωτοταγείς, δευτεροταγείς και τριτοταγείς, ανάλογα με την αναλογία των αντιδρώντων, π.χ.
NH3 + RI
![]() RNH2 + HI RNH2 + RI
RNH2 + HI RNH2 + RI
![]() R2NH + HI R2NH + CH3I
R2NH + HI R2NH + CH3I
![]() R3N
+ HI
R3N
+ HI
Με εστέρες (αμμωνιόλυση), αλλά κυρίως με ακυλαλογονίδια και ανυδρίτες οξέων παρέχει αμίδια, π.χ.
RCOOR' + NH3
![]() RCONH2 + R'OH RCOCl + NH3
RCONH2 + R'OH RCOCl + NH3
![]() RCONH2 + HCl (RCO)2O + NH3
RCONH2 + HCl (RCO)2O + NH3
![]() RCONH2 + RCOOH
RCONH2 + RCOOH
Με αλδεΰδες και κετόνες παρέχει ιμινοενώσεις:
RCH=O + NH3
![]() R-CH=NH R-CO-R' + NH3
R-CH=NH R-CO-R' + NH3
![]() R-C(=NH)-R'
R-C(=NH)-R'
|
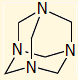
Εξαμεθυλενοτετραμίνη (ουροτροπίνη) |
Χαρακτηριστική είναι η αντίδραση αμμωνίας με φορμαλδεΰδη που παρέχει εξαμεθυλενοτετραμίνη, ένα μόριο με ενδιαφέρουσα δομή. Η εξαμεθυλενοτετραμίνη είναι γνωστή και ως ουροτροπίνη και παλαιότερα είχε χρησιμοποιηθεί ως απολυμαντικό φάρμακο του ουροποιητικού συστήματος:
6 ΗCHO + 4 NH3
![]() (CH2)6N4 + 6 H2O
(CH2)6N4 + 6 H2O
Η εξαμεθυλενοτετραμίνη υδρολύεται βραδέως σε υδατικά διαλύματα παρέχοντας φορμαλδεΰδη, στην οποία οφείλεται η απολυμαντική της δράση.
Η αμμωνία αντιδρά με εποξείδια σχηματίζοντας αμινοαλκοόλες. 'Ετσι, η βιομηχανική παρασκευή της αιθανολαμίνης, της διαιθανολαμίνης και της τριαιθανολαμίνης βασίζονται στην αντίδραση αιθυλενοξειδίου και αμμωνίας:
![]()
|
Αριστερά: Διάλυμα ιόντων χαλκού(ΙΙ) σε νερό. Δεξιά: Η ίδια συγκέντρωση χαλκού(ΙΙ) σε υδατικό διάλυμα αμμωνίας |
Η αμμωνία ως υποκαταστάτης. Η αμμωνία είναι ίσως το πιο κοινό ανόργανο συμπλεκτικό αντιδραστήριο, σχηματίζοντας σταθερά σύμπλοκα με πλήθος μεταλλικών κατιόντων, τα οποία (ιστορικά) ονομάζονται αμμίνες (με δύο μ για να διακρίνονται από τα οργανικά παράγωγα της αμμωνίας, τις αμίνες). Από τα πιο γνωστά σύμπλοκα είναι είναι εκείνα με τον χαλκό(ΙΙ) και άργυρο:
Cu2+ +
4 NH3
![]() [Cu(NH3)4]2+ + 2 H2O
Ag+ + 2 NH3
[Cu(NH3)4]2+ + 2 H2O
Ag+ + 2 NH3
![]() [Ag(NH3)2]+
[Ag(NH3)2]+
Χαρακτηριστικό είναι ότι το χρώμα διαλυμάτων έγχρωμων ιόντων γίνεται πολύ πιο έντονο παρουσία αμμωνίας (π.χ. του Cu(II)) τα αντίστοιχο σύμπλοκα με αμμωνίας είναι πολύ πιο έντονα χρωματισμένα ή ελαφρά τροποποιημένα ως προς τη χροιά (π.χ. πράσινα διαλύματα αλάτων Ni(II), παρουσία αμμωνίας χρωματίζονται ελαφρώς κυανοϊώδη).
Πολλά από τα σύμπλοκα αυτά είναι αρκετά σταθερά, γεγονός που επιτρέπει τη διάλυση δυσδιάλυτων στο νερό αλάτων, όπως του AgCl, σε υδατικά διαλύματα αμμωνίας. Επίσης χαρακτηριστική είναι το ότι ο μεταλλικός χαλκός παρουσία αμμωνίας οξειδώνεται από το ατμοσφαιρικό οξυγόνο και διαλύεται αργά, γεγονός που τον καθιστά ακατάλληλο ως υλικό για δεξαμενές, δοχεία ή σωληνώσεις που έρχονται σε επαφή με διαλύματα αμμωνίας. Οι αντιδράσεις αυτές είναι:
AgCl + 2
NH3
![]() [Ag(NH3)2]+ + 2 Cl-
Cu + 4 NH3
+ H2O + 1/2 Ο2
[Ag(NH3)2]+ + 2 Cl-
Cu + 4 NH3
+ H2O + 1/2 Ο2
![]() [Cu(NH3)4]2+ + 2 OH-
[Cu(NH3)4]2+ + 2 OH-
Η υγρή αμμωνία ως διαλύτης. Η αμμωνία διαθέτει ικανοποιητικά μεγάλη περιοχή υγρής φάσης (-77 έως -33ºC) και ως αέριο μπορεί να υγροποιηθεί εύκολα στη θερμοκρασία εξάχνωσης του ξηρού πάγου (στερεό CO2, Τεξαχν = -78,5ºC). Το ειδικό βάρος της υγρής αμμωνίας είναι μόλις 0,62 g/mL. Λόγω της αρκετά μεγάλης θερμότητας εξάτμισής της (23,35 kJ/mol), αποτέλεσμα των έντονων δεσμών υδρογόνου μεταξύ των μορίων της, μπορεί να διατηρηθεί εύκολα σε δοχεία Dewar (θερμός) και να διακινείται στο εργαστήριο σε θερμοκρασίες δωματίου, παρά το χαμηλό της σημείο ζέσεως. Το μεγάλο πρόβλημα της υγρής αμμωνίας είναι η αφόρητη οσμή της, όπως και η άμεση καταστρεπτική της δράση στο δέρμα του ανθρώπου. Η χρήση της πρέπει να γίνεται μόνο σε εργαστηριακούς απαγωγούς και απαιτεί ιδιαίτερη προσοχή [Αναφ. 5].
Η αμμωνία στην υγρή της μορφή δρα ως άριστος διαλύτης πολλών ανόργανων και οργανικών ενώσεων παρουσιάζοντας πολλές αναλογίες με το ύδωρ, αφού (όπως προαναφέρθηκε) παρουσιάζει ως μόριο μεγάλη πολικότητα, μεγάλη διηλεκτρική σταθερά και επιπλέον σχηματίζει δεσμούς υδρογόνου. Η αμμωνία σε αναλογία με το νερό υπόκεινται σε αυτοϊοντισμό:
![]()
Ο ομοιότητα ύδατος - υγρής αμμωνίας επεκτείνεται και στα ιόντα στα οποία διίστανται. Έτσι, τα κατιόντα H3O+ και ΝΗ4+, όπως και τα ανιόντα ΟΗ- και ΝΗ2- (ανιόν αμιδίου) είναι ισοηλεκτρονιακά και ουσιαστικώς ισομεγέθη μεταξύ τους. Σε γενικές γραμμές, η υγρή αμμωνία είναι καλύτερος διαλύτης σε σχέση με το ύδωρ ως προς τις οργανικές ενώσεις (π.χ. διαλύει το βενζόλιο σε αντίθεση με το ύδωρ) και κάπως χειρότερος διαλύτης ως προς τις ανόργανες ενώσεις (λόγω μικρότερης διηλεκτρικής σταθεράς). Στον επόμενο πίνακα δείχνονται τα ανιόντα των αλάτων που κατά κανόνα είναι ευδιάλυτα και δυσδιάλυτα στην υγρή αμμωνία:
| Διαλυτά στην υγρή αμμωνία | Γενικώς δυσδιάλυτα στην υγρή αμμωνία |
| SCN-, Br-, Ι-, ΝΟ3-, ΝΟ2-, ClO4-, διαλυτά είναι επίσης τα άλατα του αμμωνίου | F-, Cl-, CO32-, SO42-, O2-, OH-, S2- |
|
Αριστερά: Διάλυση σφαιριδίου κράματος Na-K σε υγρή αμμωνία. Κέντρο: Διάλυση μεταλλικού Na σε υγρή αμμωνία. Δεξιά: Πυκνό διάλυμα μεταλλικού νατρίου σε υγρή αμμωνία. Το βαθυκύανο χρώμα οφείλεται στα διαλυτωμένα (με NH3) ηλεκτρόνια. |
Οι διαλυτότητες ανόργανων αλάτων στην υγρή αμμωνία παρουσιάζουν κάποιες "τάσεις", για παράδειγμα: Οι διαλυτότητες των αλογονιδίων αυξάνονται από τα φθορίδια (ελάχιστη διαλυτότητα) προς τα ιωδίδια (μέγιστη διαλυτότητα), έτσι οι διαλυτότητες των NaF, NaCl, NaBr και NaI είναι 0,35, 3,0, 138,0 και 161,9 g/100 g υγρής NH3, αντιστοίχως. Η διαλυτότητα αλάτων με υψηλά ιοντικά φορτία (π.χ. ανθρακικά, θειικά και φωσφορικά άλατα) είναι πολύ μικρότερη σε σχέση με το τη διαλυτότητά τους στο ύδωρ. Μικρή διαλυτότητα σημαίνει (όπως και στην περίπτωση του ύδατος) ότι ενέργεια πλέγματος και μεταβολές της εντροπίας ξεπερνούν την ενέργεια διαλύτωσης των ιόντων [Αναφ. 2].
'Ετσι, για παράδειγμα, είναι εφικτή η παρασκευή νιτρώδους αμμωνίου σε υγρή αμμωνία με βάση την αντίδραση αντικατάστασης, η οποία δεν πραγματοποιείται στο ύδωρ:
![]()
Απομακρύνεται με διήθηση το NaCl και αφήνεται το διάλυμα του νιτρώδους αμμωνία στην υγρή αμμωνία να εξατμιστεί, αφήνοντας κρυστάλλους του άλατος.
Χαρακτηριστική ιδιότητα της υγρής αμμωνίας είναι το ότι διαλύει ορισμένα δραστικά μέταλλα (αλκάλια, γαιαλκάλια, λανθανίδες) σχηματίζοντας βαθυκύανα διαλύματα, τα οποία σε ακόμη μεγαλύτερες συγκεντρώσεις αποκτούν ένα μπρούτζινο λούστρο (βλ. φωτογραφία) [Αναφ. 6].
Η ιδιότητα αυτή οφείλεται στην ικανότητα της αμμωνία να σχηματίζει σταθερά διαλυτωμένα (αμμωνιωμένα) ηλεκτρόνια (στα οποία οφείλεται ο χρωματισμός τους) σε αντίθεση με το νερό στο οποίο τα διαλυτωμένα (υδατωμένα) ηλεκτρόνια είναι ασταθή, αφού οδηγούνται σε σχεδόν άμεση αναγωγή του ύδατος με παραγωγή αερίου υδρογόνου. Οι αντιδράσεις (π.χ. με μεταλλικό Na) έχουν ως εξής:
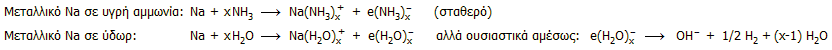
Τα διαλύματα αλκαλιμετάλλων σε υγρή αμμωνία χρησιμοποιούνται στη χημική σύνθεση ως εξαιρετικώς δραστικά αναγωγικά μέσα, αφού περιέχουν σχεδόν καθαρά ηλεκτρόνια. Θα πρέπει να σημειωθεί ακόμη ότι τα πυκνά διαλύματά τους είναι ηλεκτρικώς αγώγιμα και ουσιαστικά συμπεριφέρονται ως υγρά μέταλλα, αφού διαθέτουν πλήθος ευκίνητων ηλεκτρικών φορέων.
|
|
|
|
|
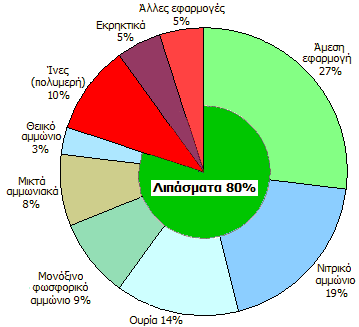
Κύριες χρήσεις/προϊόντα της αμμωνίας [Αναφ. 7] |
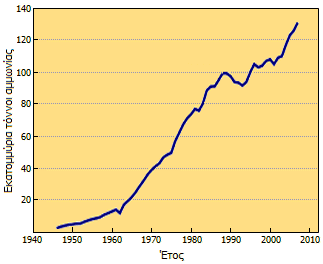
Ετήσια παγκόσμια παραγωγή αμμωνίας [Αναφ. 1β] | Ο μεγαλύτερος αγωγός υγρής αμμωνίας, από το εργοστάσιο TogliattiAzot έως την Οδησσό της Ουκρανίας. |
Παραγωγή και κύριες χρήσεις της αμμωνίας [Αναφ. 7]
Η βιομηχανική παραγωγή είναι μεγάλης σημασίας για τη γεωργία αλλά και για άλλες χρήσεις. Ιδιαίτερη σημασία έχει η αμμωνία στην παραγωγή αζωτούχων λιπασμάτων. Γενικά, σχεδόν το 80% της παραγόμενης αμμωνίας κατευθύνεται σε γεωργικούς σκοπούς (λιπάσματα). Το 2004 η παγκόσμια παραγωγή είχε φτάσει τα 109 εκατομμύρια τόνους, ενώ η εκτίμηση για το 2010 ήταν ότι θα ξεπερνούσε τα 140 εκατομμύρια. To 85% της αμμωνίας παρασκευάζεται από το φυσικό αέριο μέσω της "αναμόρφωσης του μεθανίου με ατμό, όπως περιγράφηκε παραπάνω. Στην Ελλάδα αναφέρεται ότι η παραγωγή αμμωνίας το 2010 ήταν 125 χιλιάδες τόνοι.
 |
 |
 |
|
Κύλινδροι και βαγόνι μεταφοράς υγρής αμμωνίας |
Τρακτέρ με σύστημα εισαγωγής στο έδαφος υγρής αμμωνίας. |
|
Οι κύριες χρήσεις της αμμωνίας είναι ακόλουθες: 1) Παρασκευή νιτρικού οξέος με τη μέθοδο Ostwald και από αυτό διάφορων νιτρικών αλάτων και εκρηκτικών υλών. 2) Παρασκευή λιπασμάτων, όπως θειικού, νιτρικού και φωσφορικού αμμωνίου. 3) Παρασκευή διάφορων αμμωνιακών αλάτων (χλωριούχο αμμώνιο, ανθρακικό αμμώνιο). 4) Παρασκευή άλλων αζωτούχων ενώσεων (νατριοκυαναμίδιο, ουρία, βαφές, φαρμακευτικά προϊόντα, πλαστικά υλικά όπως rayon, nylon, ακρυλικά). 5) Στη βιομηχανία σόδας (όξινο ανθρακικό νάτριο και ανθρακικό νάτριο) με τη μέθοδο Solvay. 6) Ως ψυκτικό υγρό στις βιομηχανίες πάγου. 7) Σε διάφορα καθαριστικά υγρά (υφασμάτων, υάλινων επιφανειών). 8) Ως αντιδραστήριο στα χημικά εργαστήρια.
|
||||||||||||||||||||||||
Τοξικότητα της αμμωνίας, υγιεινή και ασφάλεια εργαζομένων [Αναφ. 8]
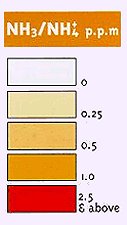
Η αμμωνία είναι ισχυρά τοξική ένωση και εισπνοή αερίου αμμωνίας σε μεγάλες συγκεντρώσεις είναι επικίνδυνη για τους πνεύμονες και το δέρμα, λόγω των ισχυρώς βασικών (καυστικών) ιδιοτήτων της. Ο OSHA (Occupational Safety and Health Administration) στις ΗΠΑ έχει θέσει όρια έκθεσης των 15 λεπτών για συγκεντρώσεις 35 ppm , ενώ το TLV (Threshold Limit Value) είναι 25 ppm (για 8-ωρη ημέρα εργασίας). Ως άμεσα επικίνδυνη για τη ζωή (όριο IDLH: Immediately Dangerous to Life and Health) έχει καθορισθεί η συγκέντρωση των 300 ppm.
Η Ανώτατη Οριακή Τιμή για το εργασιακό περιβάλλον στην Ευρώπη είναι 50 ppm. Ευτυχώς η οσμή της αμμωνίας είναι ιδιαίτερα αφόρητη (αντιληπτή γίνεται από τα 5 ppm και πάνω) και είναι απίθανο να εκτεθεί κάποιος σε επικίνδυνα επίπεδα χωρίς να το αντιληφθεί. Επανειλημμένες εκθέσεις του ανθρώπινου οργανισμού σ' αυτήν δεν προκαλούν κάποιο σωρευτικό (χρόνιο) αποτέλεσμα στον οργανισμό [Αναφ. 5γ].
Στο εμπόριο διατίθεται συσκευές μέτρησης της αμμωνίας στην ατμόσφαιρα για εργασιακούς χώρους, όπως επίσης φορητές συσκευές και κιτ αντιδραστηρίων για την ποσοτική μέτρηση σε ύδατα (πισίνες, ενυδρεία κ.λπ.). Να σημειωθεί, ότι η αμμωνία αποτελεί την μορφή με την οποία αποβάλλεται από τον οργανισμό το πλεονάζον άζωτο στους αμμωνιοτελικούς οργανισμούς, στους οποίους περιλαμβάνονται τα ψάρια και άλλοι θαλάσσιοι οργανισμοί (βλ. Χημική ένωση του μήνα: Ουρικό οξύ).
Η συσσώρευση αμμωνίας στα ενυδρεία μπορεί να αποφευχθεί επίσης με διάφορα υλικά (π.χ. ζεόλιθοι) τα οποία την προσροφούν και δεν επιτρέπουν να φτάσει η συγκέντρωσή της σε επικίνδυνα επίπεδα (στο εμπόριο διατίθενται ως "ammonia eaters").
Ανίχνευση αμμωνίας. Το "παραδοσιακό" χημικό αντιδραστήριο ανίχνευσης αλλά και ημιποσοτικού προσδιορισμού μικρών συγκεντρώσεων αμμωνίας είναι το αντιδραστήριο Nessler (Julius Nessler, 1827-1905). Το αντιδραστήριο αυτό είναι διάλυμα ιωδιοσυμπλόκου του υδραργύρου σε πυκνό διάλυμα KOH (παρασκευάζεται με διάλυση HgI2 σε πυκνό διάλυμα KI και προσθήκη περίσσειας KOH). Με ίχνη αμμωνίας το άχρωμο αντιδραστήριο αυτό παρέχει πορτοκαλόχρωμο θόλωμα ή ίζημα από βασικό ιωδιούχο αμινοπαράγωγο του υδραργύρου. Η σχετική αντίδραση συνήθως περιγράφεται ως εξής:
NH4+
+ 2 [HgI4]2−
+ 4
OH−
![]() HgO·Hg(NH2)I (πορτοκαλέρυθρο)
+ 7 I−
+ 3
H2O
HgO·Hg(NH2)I (πορτοκαλέρυθρο)
+ 7 I−
+ 3
H2O
 |
 |
 |
 |
 |
 |
| Θετική ανίχνευση αμμωνίας με αντιδραστήριο Nessler | Τυπικό κιτ που παρέχει τη δυνατότητα ανίχνευσης και ημιποσοτικού προσδιορισμού αμμωνίας στο νερό ενυδρείου και η σχετική χρωματομετρική κλίμακα | Φορητός φωτομετρικός αναλυτής αμμωνίας | Αναλυτής αμμωνίας στην ατμόσφαιρα εργασιακού χώρου (βασίζεται σε ηλεκτροχημικό αισθητήρα). |
Αισθητήριο στοιχείο αέριας αμμωνίας "στερεάς κατάστασης" (TGS2444). |
|
2. (α) Κατάκης Δ, Μεθενίτης Κ, Μητσοπούλου Χ, Πνευματικάκης Γ: "Ανόργανη Χημεία Β': Τα στοιχεία", Εκδόσεις Παπαζήση, 2002, σελ. 113-114. (β) Greenwood NN, Earnshaw A: "Chemistry of the Elements", Pergamon Press, 1st ed. 1984, σελ. 481-489.
3. (α) Wikipedia: "Haber Process". (β) "The Haber-Bosch Heritage: The Ammonia Production Technology", 50th Anniversary of the IFA Technical Conference (Sevilla, Spain), 1997 (αρχείο PDF, 444 KB). (γ) "Industrial Production of Synthetic Ammonia", στο "Chemistry of the Elements", Greenwood NN, Earnshaw A, Pergamon Press, 1984, pp.482-484. (δ) Clark J (http://www.chemguide.co.uk): "The Haber Process", 2002. (ε) ausetute.com.au: "Uses and Production of Ammonia (Haber Process)". (στ) http://www.digipac.ca: "Fritz Haber: A case study in the politics of science". (ζ) BASF, Chemical Commpany: "1902-1924: The Haber-Bosch process and the era of fertilizers". (η) http://www.inclusive-science-engineering.com: "Engineers Guide: Catalysts and Chemical Reactions".
4. (α) Helmenstine ΑΜ: "Chemical Reactions from Mixing Bleach and Ammonia". (β) Wikipedia: "Chloramine". (γ) LennTech (Water Treatment Solutions): "Disinfectants Chloramines".
5. (α) Barron AR: "Liquid Ammonia as a Solvent", ConneXions (cnx.com). (β) Nowatzki J (North Dakota State University): "Anhydrous Ammonia: Managing The Risks". (γ) Occupational Safety & Health Administration (U.S. Department of Labor): "Properties of Ammonia".
6. (α) Watt GW: "Reactions in Liquid Ammonia", J. Chem. Educ. 34(11):538, 1957 (Abstract). (β) Ilich P-P, McCormick KR, Atkins AD, Mell GJ, Flaherty TJ, Bruck MJ, Goodrich HA, Hefel AL: "Solvated Electrons in Organic Chemistry Laboratory", J. Chem. Educ. 87(4):419-422, 2010 (Abstract)