Λίστα "Χημικών Ενώσεων του Μήνα"
Η χημική ένωση του
μήνα
[Φεβρουάριος
2009]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής
-
Κωνσταντίνος
Ευσταθίου, Καθηγητής
|
Φυσικoχημικές ιδιότητες
[Aναφ.
1]:
Εμφάνιση: άχρωμο, πτητικό υγρό με
εξαιρετικά δυσάρεστη και καυστική οσμή. Ασταθές και εξαιρετικά
εκρηκτικό.
Μοριακός τύπος:
ΗΝ3
Σχετική μοριακή μάζα:
43,03
Σημείο τήξης:
−80ºC
Σημείο βρασμού:
35,7ºC
Πυκνότητα: 1,126
g/cm3 (στους 0ºC)
Ασθενές οξύ (pKa
= 4,77, στους 25ºC
[Aναφ.
1α], 4,9
[Aναφ.
1β])
Τοξικότητα
LD50 (σε
ποντίκια, IP): 21,5 mg/kg
Μέγιστη επιτρεπτή
συγκέντρωση στον αέρα (NIOSH):
0,1 ppm
Εισπνοή ατμών του προκαλεί
ισχυρότατους πονοκεφάλους, βήχα, ερεθισμό των ματιών και επικίνδυνη
πτώση της πίεσης
|
 |
|
Υδραζωτικό οξύ και άλατά του (αζίδια)
Hydrazoic acid and azides |
|

Ο Julius Wilhelm
Theodor Curtius
(1857-1928).
Καθηγητής Χημείας σε γερμανικά πανεπιστήμια (Erlagen,
Kiel, Bonn, Heidelberg). Συνέθεσε για πρώτη φορά το υδραζωτικό οξύ, την υδραζίνη και
το διαζωοξικό οξύ. Γνωστή είναι η μεταθετική αντίδραση
Curtius (μετατροπή ακυλαζιδίων σε
ισοκυανικούς εστέρες). |
Ιστορία - Σύνθεση υδραζωτικού οξέος
και των αλάτων του
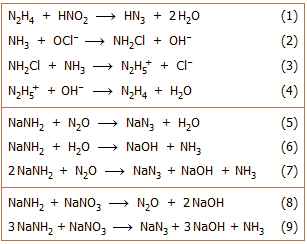 Το
υδραζωτικό οξύ (ΗΝ3)
παρασκευάστηκε για πρώτη φορά το 1890 από τον Theodor Curtius (Berichte,
1890, 23, p. 3023). Η σύνθεσή του βασιζόταν στην οξείδωση της υδραζίνης (Ν2Η4)
με νιτρώδες οξύ (αντίδραση 1). Την υδραζίνη την είχε παρασκευάσει ο ίδιος επίσης
για πρώτη φορά το
1887. Ο κυριότερος τρόπος παραγωγής της υδραζίνης βασίζεται στην ελεγχόμενη οξείδωση
της αμμωνίας με υποχλωριώδη άλατα (αντιδράσεις 2 - 4).
Το
υδραζωτικό οξύ (ΗΝ3)
παρασκευάστηκε για πρώτη φορά το 1890 από τον Theodor Curtius (Berichte,
1890, 23, p. 3023). Η σύνθεσή του βασιζόταν στην οξείδωση της υδραζίνης (Ν2Η4)
με νιτρώδες οξύ (αντίδραση 1). Την υδραζίνη την είχε παρασκευάσει ο ίδιος επίσης
για πρώτη φορά το
1887. Ο κυριότερος τρόπος παραγωγής της υδραζίνης βασίζεται στην ελεγχόμενη οξείδωση
της αμμωνίας με υποχλωριώδη άλατα (αντιδράσεις 2 - 4).
Η αντίδραση
(1) πραγματοποιείται σε διαιθυλαιθέρα στους 0ºC παρουσία CH3ONa με το οποίο το HN3 αντιδρά παρέχοντας NaN3.
Αντί του νιτρώδους οξέος μπορούν να
χρησιμοποιηθούν εστέρες νιτρώδους οξέος ή άλλα οξειδωτικά αντιδραστήρια, όπως νιτρικό
οξύ, υπεροξείδιο του υδρογόνου, υπερθειικά και χλωρικά άλατα.
Το ίδιο το υδραζωτικό οξύ δεν
αποτελεί βιομηχανικό προϊόν. Στο εργαστήριο μπορεί να παρασκευασθεί εύκολα (ΠΡΟΣΟΧΗ:
μόνο σε
πολύ μικρές ποσότητες) με αντίδραση υδατικού διαλύματος άλατός του με αραιό
διάλυμα θειικού οξέος
και απόσταξη. Το απόσταγμα μπορεί να αφυδατωθεί με άνυδρο χλωριούχο ασβέστιο και
να φθάσει σε περιεκτικότητα 90% σε HN3. Η παρασκευή αυτή είναι
ιδιαίτερα επικίνδυνη λόγω της
αστάθειας (διασπάται με έκρηξη) και της μεγάλης τοξικότητας του υδραζωτικού οξέος.
Εμπορικά διαθέσιμο και πλέον συνηθισμένο άλας του υδραζωτικού
οξέος είναι το υδραζωτικό νάτριο ή αζίδιο του νατρίου, το οποίο συνήθως
αναφέρεται ως νατραζίδιο (NaN3,
sodium azide). Σε βιομηχανική κλίμακα παρασκευάζεται με διαβίβαση ξηρού αερίου
υποξειδίου του αζώτου (N2O)
μέσω τηγμένου νατραμιδίου (NaNH2)
στους 190ºC (αντίδραση 5). Το παραγόμενο Η2Ο απομακρύνεται με αντίδρασή του με μέρος του νατραμιδίου
(αντίδραση 6), οπότε συνολική αντιδρούν δύο μόρια NaNH2 με ένα μόριο Ν2Ο (αντίδραση 7).
Εναλλακτικά, αντί του αερίου Ν2Ο μπορεί να χρησιμοποιηθεί NaNO3, το οποίο αντιδρά με το NaNH2 παρέχοντας επί τόπου Ν2Ο (αντίδραση 8). Στην πράξη προστίθεται κονιοποιημένο NaNO3 σε τηγμένο NaNH2 στους 175ºC (μέθοδος Wislicenus,
αντίδραση 9) [Αναφ. 1].
Φυσικές και χημικές ιδιότητες του
υδραζωτικού οξέος και των αλάτων του
Ηλεκτρονιακή
δομή: Τόσο το υδραζωτικό οξύ (κατά IUPAC:
αζίδιο του υδρογόνου, άλλες ονομασίες:
αζωιμίδιο, διαζωιμίδιο, τριαζωικό οξύ)
όσο και τα άλατά
του (υδραζωτικά άλατα ή αζίδια) είναι δραστικές χημικές ενώσεις ισχυρά
ενδόθερμες, δηλ. με μεγάλο
"ενεργειακό" περιεχόμενο το οποίο αποδίδεται κατά τη διάσπασή τους. Η ενθαλπία
σχηματισμού του HN3, ΔΗf (σε
υγρή κατάσταση) είναι +264 kJ/mol. Η ηλεκτρονιακή δομή του υδραζωτικού οξέος (α)
και του υδραζωτικού ανιόντος (β) μπορεί να παρασταθεί με τις ακόλουθες
μεσομέρειες:
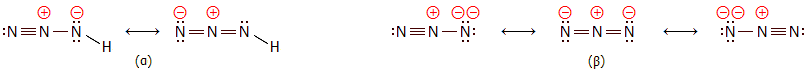
Το μόριο του υδραζωτικού οξέος είναι
επίπεδο. Οι δεσμοί N−N έχουν διαφορετικό μήκος: ο δεσμός Ν−Ν− έχει
μήκος 113 pm, ο δεσμός Ν−ΝΗ
124 pm και ο δεσμός
N−Η 101 pm. Η γωνία Η−Ν−Ν είναι 114º, η οποία είναι ενδιάμεση μεταξύ της γωνίας
που αναμένεται για υβριδισμούς sp³ (109,5º) και sp² (120º) [Αναφ. 2].
Αυτή ακριβώς η διαφορά στη δομή των ηλεκτρονιακών ζευγών του Ν που είναι ενωμένο
με το Η, έναντι των άλλων δύο ατόμων αζώτου του μορίου, οδηγεί και στην μικρή απόκλιση
από την ευθεία της γωνίας Ν−Ν−Ν, η οποία είναι 171º
[Αναφ. 2γ].
Σε αντίθεση με το μόριο του
υδραζωτικού οξέος, το
ανιόν του αζιδίου είναι γραμμικό και κεντροσυμμετρικό με μήκος δεσμού
Ν−Ν 118 pm
(όλα τα άζωτα έχουν υβριδισμό sp). Να σημειωθεί ότι τα υπολογιζόμενα μήκη των δεσμών Ν−Ν, Ν=Ν
και Ν≡Ν
είναι αντιστοίχως: 140, 120 και 110 pm
[Αναφ. 1β].
Το υδραζωτικό
οξύ ως οξύ: Το υδραζωτικό οξύ είναι ασθενές οξύ με ισχύ παραπλήσια
με εκείνη του οξικού οξέος. Οι τιμές pK που αναφέρονται
στη βιβλιογραφία καλύπτουν την περιοχή 4,7 έως 4,9, με πιο πιθανή τιμή περίπου
4,75. Αυτό συνεπάγεται σημαντική
υδρόλυση των διαλυμάτων των διαλυτών αλάτων του που σε συνδυασμό με τη μεγάλη
πτητικότητά του, καθιστά τα διαλύματα αυτά από μόνα τους πηγή τοξικών ατμών υδραζωτικού οξέος,
γεγονός που πρέπει να λαμβάνεται σοβαρά υπόψη κατά τη χρήση τους.
Παρασκευή και διαλυτότητα των αζιδίων: Τα άλατα του υδραζωτικού οξέος ή αζίδια θα πρέπει να
διακριθούν από τα νιτρίδια, ενώσεις μετάλλων με άζωτο.
Τα νιτρίδια μπορούν θεωρηθούν ως παράγωγα της αμμωνίας, της οποία τα άτομα
υδρογόνου έχουν αντικατασταθεί με ένα μέταλλο. 'Ετσι, π.χ. ενώ το αζίδιο του
λιθίου, LiN3, είναι ένα σχετικά σταθερό άλας
εξαιρετικά
ευδιάλυτο στο νερό, το νιτρίδιο του λιθίου Li3N
αντιδρά έντονα με το νερό με έκλυση αμμωνίας
(Li3N
+ 3H2O
 3LiOH
+ NH3).
'Ετσι τα αζίδια είναι άλατα μετάλλων με το ανιόν Ν3−,
ενώ τα νιτρίδια είναι άλατα μετάλλων με το (υποθετικό) ανιόν Ν3−.
3LiOH
+ NH3).
'Ετσι τα αζίδια είναι άλατα μετάλλων με το ανιόν Ν3−,
ενώ τα νιτρίδια είναι άλατα μετάλλων με το (υποθετικό) ανιόν Ν3−.
Τα αζίδια των διαφόρων μετάλλων παρασκευάζονται με άμεση αντίδραση των ίδιων των μετάλλων ή των
οξειδίων ή των υδροξειδίων τους με διάλυμα υδραζωτικού οξέος ή με αντίδραση αντικατάστασης με ένα εμπορικά διαθέσιμο αζίδιο όπως
το NaN3.
Τα δυσδιάλυτα αζίδια
παρασκευάζονται με αντίδραση υδατικών διαλυμάτων NaN3
και διαλυτών αλάτων του μετάλλων. 'Ετσι,
π.χ. το εκρηκτικό αζίδιο του μολύβδου
καθιζάνει κατά την αντίδραση: 2NaN3
+ Pb(NO3)2
 Pb(N3)2
+ 2NaNO3.
Pb(N3)2
+ 2NaNO3.
Αζίδια που υδρολύονται εύκολα,
παρασκευάζονται απουσία ύδατος με αντίδραση υδριδίων ή αλκυλοενώσεων των
μετάλλων με διάλυμα υδραζωτικού οξέος σε διαιθυλαιθέρα, π.χ.
MgH2
+ 2HN3
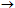 Mg(N3)2
+ H2,
SiH4
+ 4HN3
Mg(N3)2
+ H2,
SiH4
+ 4HN3
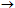 Si(N3)4,
Ga(CH3)3
+ 3HN3
Si(N3)4,
Ga(CH3)3
+ 3HN3
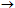 Ga(N3)3
+
3
Ga(N3)3
+
3
CH4.
Τα αζίδια των αλκαλίων, του αμμώνιου και
των γαιαλκαλίων είναι
πολύ έως και εξαιρετικά ευδιάλυτα στο νερό, ενώ τα άλατα με Ag, Cu(I),
Hg(I) και Pb είναι δυσδιάλυτα.
Τυπικές διαλυτότητες ορισμένων αζιδίων (σε g ανά
100 g ύδατος) είναι:
LiN3
66
(16ºC),
NaN3
39 (0ºC)
42 (17ºC),
55
(100ºC),
KN3
50 (17ºC),
106
(100ºC),
RbN3
107 (16ºC),
CsN3
224
(0ºC),
NH4N3
30 (30ºC), 27
(40ºC),
Ca(N3)2
38 (0ºC),
45
(16ºC),
Ba(N3)2
17,3
(16ºC),
Hg2(N3)2
0,025
(σε ψυχρό
νερό), CuN3
0,00075 (20ºC),
AgN3
0,01
(100ºC),
Pb(N3)2
0,023 (18ºC),
0,09
(70ºC) [Αναφ. 3].
Οργανικά αζίδια: Παρασκευάζονται εύκολα με
απλή αντίδραση αντικατάστασης του αλογόνου Χ (Χ: Cl, Br και κυρίως Ι) με το ιόν
του αζιδίου: RX
+ NaN3
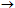 R-N3
+
NaX.
Απαιτείται ιδιαίτερη προσοχή κατά την
παρασκευή τους δεδομένου ότι τα
περισσότερα οργανικά αζίδια είναι εκρηκτικώς ασταθή.
R-N3
+
NaX.
Απαιτείται ιδιαίτερη προσοχή κατά την
παρασκευή τους δεδομένου ότι τα
περισσότερα οργανικά αζίδια είναι εκρηκτικώς ασταθή.
To ανιόν N3-
ως ψευδαλογονιόν:
Το ανιόν N3−
δρα παρόμοια με τα ανιόντα Cl−,
Br− και Ι−
και σχηματίζει αντίστοιχα σύμπλοκα, όπως π.χ. το [Cu(NH3)2(N3)2] και το Κ2[Cu(N3)4].
Η ιδιότητα αυτή σε συνδυασμό με τις
παρόμοιες
διαλυτότητες των αλάτων του (π.χ. δυσδιάλυτα άλατα με Ag(I), Hg(I), Tl(I)) το κατατάσσει στα
ψευδαλογονοϊόντα, όπως είναι τα ανιόντα CN−,
OCN−, SCN−
και SeCN−. Ακόμη, όπως υπάρχουν μικτές ενώσεις αλογόνων-ψευδαλογόνων,
όπως π.χ. ClCN, NC(NCS), έτσι έχουν απομονωθεί
ενώσεις όπως οι Cl(N3)
και NC(N3).
Μια
διαφορά του N3-
σε σχέση με τα άλλα ψευδαλογόνα είναι η αδυναμία μέχρι σήμερα παρασκευής του
διμερούς του, δηλαδή του ψευδαλογόνου (Ν3)2.
Απόπειρα παρασκευής του
με ηλεκτρόλυση άνυδρου υδραζωτικού οξέος (με ΚΝ3
για αύξηση της αγωγιμότητας) απέτυχε προφανώς λόγω της
μεγάλης ενέργειας του δεσμού Ν2, που
οδηγεί στην άμεση διάσπασή του: (Ν3)2
 3N2.
3N2.
|
Ψευδαλογονίδια - Ψευδαλογόνα
[Αναφ. 1β]
Μια σειρά πολυατομικών ανιόντων όπως τα:
CN−, CNO−, OCN−, SCN−,
SeCN−, N3−,
όπως και άλλα πιο σύνθετα ιόντα (π.χ.ορισμένα καρβονυλικά σύμπλοκα) παρουσιάζουν χημική
συμπεριφορά παρόμοια με εκείνη των ανιόντων των αλογόνων και ονομάστηκαν
ψευδαλογονιόντα (pseudohalides).
Ο όρος καθιερώθηκε από τους Birckenbach και
Kellemann το 1925.
Τα κυριότερα (σε μικρό ή μεγάλο βαθμό) κοινά χαρακτηριστικά των
ψευδαλογόνων (X) με τα αλογόνα συνοψίζονται
στα εξής:
1. 'Ολα σχηματίζουν
ενώσεις με υδρογόνο (υδροψευδαλογόνο, ΗΧ). Σε υδατικά διαλύματα
συμπεριφέρονται ως οξέα ποικίλου βαθμού ισχύος (το
HSCN είναι σχετικά ισχυρό οξύ, το HN3
είναι ασθενές, ενώ το
HCN είναι ασθενέστατο οξύ).
2. 'Ολα τα ψευδαλογονίδια παρέχουν δυσδιάλυτα άλατα με τα ιόντα
Ag+, Hg22+,
Pb2+
και Cu+.
3. Πολλά σχηματίζουν
σύμπλοκα ανιόντα του τύπου[
MX4]2− με
αρκετά δισθενή μεταλλικά κατιόντα (M:
Co, Ni, Cd,
Hg κ.α.) και του τύπου
[MX6]3−
με ορισμένα τρισθενή
μεταλλικά κατιόντα (Μ: Fe, Co).
4. Πολλά
ψευδαλογονίδια αντιδρούν με ήπια
οξειδωτικά μέσα και παρέχουν "ελεύθερα" ψευδαλογόνα Χ2,
όπως π.χ. τα (CN)2,
(SCN)2
και (SeCN)2.
5.
Σχηματίζουν αρκετά
πολυψευδαλογονίδια (ανάλογα π.χ. του γνωστού Ι3−) ή μικτά πολυψευδαλογονίδια, όπως π.χ. (SCN)3−,
(NC)2I−.
6.
Σχηματίζουν μικτές ενώσεις του τύπου ΥΧ3
και ΥΧ4
με αλογόνα, όπως και μεταξύ τους τα ίδια τα αλογόνα, π.χ. (NCS)Cl3,
(NCS)Br3,
I(NCS)3,
I(NCO)3.
7.
Πολλά ψευδαλογόνα Χ2
παρέχουν αντιδράσεις προσθήκης σε διπλούς δεσμούς,
π.χ.
CH2=CH2
+ (SCN)2
 NCSCH2CH2SCN
και ορισμένα αντιδρούν με βάσεις
παρέχοντας αντιδράσεις αυτοοξειδοαναγωγής,π.χ. (CN)2
+ 2 OH−
NCSCH2CH2SCN
και ορισμένα αντιδρούν με βάσεις
παρέχοντας αντιδράσεις αυτοοξειδοαναγωγής,π.χ. (CN)2
+ 2 OH−
 CNO− + CN− + H2O,
ανάλογες με εκείνες των αλογόνων.
CNO− + CN− + H2O,
ανάλογες με εκείνες των αλογόνων. |
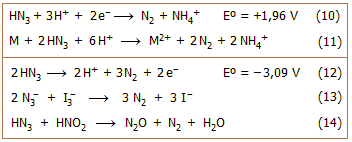 Οξειδοαναγωγικές ιδιότητες:
Το υδραζωτικό οξύ εμφανίζεται στις αντιδράσεις του και ως οξειδωτικό και ως
αναγωγικό αντιδραστρήριο.
Οξειδοαναγωγικές ιδιότητες:
Το υδραζωτικό οξύ εμφανίζεται στις αντιδράσεις του και ως οξειδωτικό και ως
αναγωγικό αντιδραστρήριο.
Δρα ως ισχυρό οξειδωτικό, σύμφωνα με την ημιαντίδραση 10.
'Οπως και το νιτρικό οξύ, αντιδρά με διάφορα μέταλλα (M: Zn, Fe, Mn και Cu) χωρίς
να εκλύεται υδρογόνο.
'Ετσι το πυκνό υδραζωτικό οξύ αντιδρά με
μέταλλα εκλύοντας αέριο άζωτο, σύμφωνα με την αντίδραση 11 [Αναφ. 1β].
Παρουσία οξειδωτικών
αντιδραστηρίων το υδραζωτικό οξύ και τα άλατά του δρουν ως
ισχυρά αναγωγικά,
σύμφωνα με την ημιαντίδραση 12. 'Ετσι, η αντίδραση οξείδωσης του αζιδίου με Ι2
(Ι3−)
(αντίδραση 13) χρησιμοποιείται και για τον ογκομετρικό ποσοτικό
προσδιορισμό των αλάτων του υδραζωτικού οξέος.
Μία τελείως χαρακτηριστική ιδιότητα της αντίδρασης
13 είναι ότι είναι εξαιρετικώς βραδεία, αλλά καταλύεται επιλεκτικά από ίχνη θειοθειικών, θειοκυανικών, θειούχων αλάτων ή θειούχων
οργανικών ενώσεων (R−SH, R−S−R', R−SS−R',
R−CS−R').
Η ιδιότητα αυτή έχει χρησιμοποιηθεί τόσο για την ανίχνευση, όσο και για τον καταλυτικό προσδιορισμό ιχνοποσοτήτων των ουσιών
αυτών. Η αντίδραση παρακολουθείται φωτομετρικά σε μήκος κύματος απορρόφησης του ιωδίου
ή αεριομετρικά με βάση την ταχύτητα έκλυσης του αερίου αζώτου. Αναφέρεται ότι η
ευαισθησία του προσδιορισμού φθάνει τα 0,01 μg
θειούχων /mL
[Αναφ. 4].
Η οξείδωση του υδραζωτικού οξέος από
νιτρώδες οξύ (αντίδραση 14) αποτελεί συνιστώμενο τρόπο εξουδετέρωσης και
καταστροφής διαλυμάτων αζιδίων και συσσωρευμένων δυσδιάλυτων αζιδίων
[Αναφ. 5].
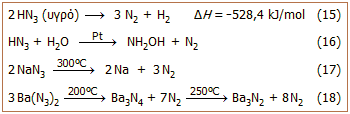 Θερμικά
χαρακτηριστικά - Σταθερότητα υδραζωτικού οξέος και των αλάτων του: Το
υδραζωτικό οξύ διασπάται κατά εκρηκτικό τρόπο προς άζωτο και υδρογόνο εκλύοντας
μεγάλα ποσά θερμότητας (αντίδραση 15). Η έκρηξη μπορεί
να προκληθεί με θέρμανση ή με μηχανικό ερέθισμα. Αναφέρεται ότι υδατικά διαλύματα ΗΝ3
μέχρι περιεκτικότητα 20% μπορούν να χρησιμοποιηθούν με ασφάλεια.
Στα διαλύματα αυτά, το ΗΝ3
διασπάται με βραδύ ρυθμό παρουσία λευκοχρύσου σε λεπτό διαμερισμό σύμφωνα με την
αντίδραση 16.
Θερμικά
χαρακτηριστικά - Σταθερότητα υδραζωτικού οξέος και των αλάτων του: Το
υδραζωτικό οξύ διασπάται κατά εκρηκτικό τρόπο προς άζωτο και υδρογόνο εκλύοντας
μεγάλα ποσά θερμότητας (αντίδραση 15). Η έκρηξη μπορεί
να προκληθεί με θέρμανση ή με μηχανικό ερέθισμα. Αναφέρεται ότι υδατικά διαλύματα ΗΝ3
μέχρι περιεκτικότητα 20% μπορούν να χρησιμοποιηθούν με ασφάλεια.
Στα διαλύματα αυτά, το ΗΝ3
διασπάται με βραδύ ρυθμό παρουσία λευκοχρύσου σε λεπτό διαμερισμό σύμφωνα με την
αντίδραση 16.
Τα άλατα του
υδραζωτικού οξέος με αλκάλια
ή γαιαλκάλια έχουν κυρίως ετεροπολικό χαρακτήρα και διασπώνται σε σχετικά υψηλές
θερμοκρασίες παρέχοντας ελεύθερα μέταλλα ή νιτρίδιά τους (αντιδράσεις 17-18).
Η διάσπαση γίνεται μάλλον με ελεγχόμενο ρυθμό πριν ακόμη τακούν. Μόνο το αζίδιο του καισίου (CsN3)
μπορεί να τακεί (σ.τ. 310ºC)
χωρίς να διασπαστεί. Η διάσπαση του NaN3 έχει
χρησιμοποιηθεί για την παρασκευή υπερκαθαρού μεταλλικού Na
και καθαρού Ν2.
Τα αζίδια των βαρέων μετάλλων, όπως
των
Pb, Hg(Ι) και Ag έχουν κυρίως
ομοιοπολικό χαρακτήρα και διασπώνται εκρηκτικά με θέρμανση ή με μηχανική
κρούση. Η ιδιότητά τους αυτή τα καθιστά κατάλληλα ως εμπυρεύματα σε καψύλια
και πυροκροτητές.
|
Ενώσεις αζώτου -
υδρογόνου με περίεργη στοιχειομετρία
[Αναφ. 1β]
Η πλέον γνωστή ένωση αζώτου -
υδρογόνου είναι η αμμωνία ΝΗ3
η οποία παρασκευάζεται ετησίως σε ποσότητες εκατοντάδων εκατομμυρίων τόννων
και αποτελεί πρώτη ύλη για την παραγωγή νιτρικού οξέος, γεωργικών
λιπασμάτων και πλήθους άλλων χημικών προϊόντων. Δεύτερη σε όγκο παραγωγής και σε ποσότητες της
τάξης μερικών δεκάδων χιλιάδων τόννων ετησίως, είναι η υδραζίνη Ν2Η4
(Η2Ν-ΝΗ2),
η οποία χρησιμοποιείται σε σημαντικές ποσότητες ως αντιοξειδωτικό και η
ίδια ή παράγωγά της ως
καύσιμο πυραύλων. Το υδραζωτικό οξύ ΗΝ3
, αν και όχι τόσο γνωστή όσο οι προηγούμενες δύο είναι η τρίτη
ένωση αζώτου - υδρογόνου, από άποψη
χρησιμότητας. Το HN3 δεν
αποτελεί
βιομηχανικό προϊόν, εύκολα όμως παρασκευάζεται στο εργαστήριο
από το NaN3,
το οποίο
παράγεται σε ποσότητες λίγων χιλιάδων τόννων ετησίως.
Χαρακτηριστικές είναι οι
ενώσεις με τους περίεργους μοριακούς τύπους
N4H4
και
N5H5.
Οι μοριακοί τύποι, ως έχουν, δεν
αποκαλύπτουν άμεσα ότι πρόκειται για τα υδραζωτικά άλατα του αμμωνίου
(ΝΗ4+Ν3−)
και του υδραζιδίου
(Η2ΝΝΗ3+Ν3−),
αντίστοιχα.
Και οι δύο ενώσεις είναι αρκετά σταθερές και παρασκευάζονται σχετικά εύκολα
στο εργαστήριο.
Ακολουθεί μια σειρά άλλων ενώσεων αζώτου - υδρογόνου γνωστές μόνο σε
ερευνητικούς κύκλους. Κοινό χαρακτηριστικό τους είναι η πολύ μικρή
σταθερότητά τους σε συνήθεις συνθήκες. Οργανικά παράγωγά τους, όπου κάποια άτομα Η έχουν αντικατασταθεί από οργανικές ομάδες, είναι
γνωστά και κατά κανόνα πολύ σταθερότερα.
|
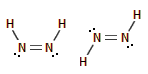
cis-
και trans-διαζένιο
|
'Εχει αποδειχθεί η
ύπαρξη υψηλότερων ομολόγων της υδραζίνης, που μαζί με αυτήν ανήκουν στα αζάνια
με τον γενικό
τύπο ΝnHn+2.
Το τριαζάνιο Ν3Η5
(Η2ΝΝΗΝΗ2) παρασκευάζεται με αντίδραση υδραζίνης - χλωραμίνης (Ν2Η4
+ Η2ΝCl
 H2NNHNΗ3+Cl−).
Το τετραζάνιο Ν4Η6
(Η2ΝΝΗ−ΝΗΝΗ2)
παρασκευάζεται με ήπια οξείδωση της υδραζίνης (Η2ΝΝΗ2
+ Ο
+ Η2ΝΝΗ2
H2NNHNΗ3+Cl−).
Το τετραζάνιο Ν4Η6
(Η2ΝΝΗ−ΝΗΝΗ2)
παρασκευάζεται με ήπια οξείδωση της υδραζίνης (Η2ΝΝΗ2
+ Ο
+ Η2ΝΝΗ2
 Η2ΝΝΗ−ΝΗΝΗ2
+ Η2Ο).
Η2ΝΝΗ−ΝΗΝΗ2
+ Η2Ο).
Τα αζάνια είναι κινητικώς ασταθή και διασπώνται
προς αζένια (π.χ. Η2ΝΝΗNH2
 Η2ΝN=NH
+ NH3),
τα οποία με τη σειρά τους διασπώνται προς αμμωνία και άζωτο (Η2ΝΝ=NH
Η2ΝN=NH
+ NH3),
τα οποία με τη σειρά τους διασπώνται προς αμμωνία και άζωτο (Η2ΝΝ=NH
 ΝΗ3 + Ν2).
Καμία από αυτές τις ενώσεις δεν έχει απομονωθεί σε καθαρή κατάσταση αφού
οι χρόνοι υποδιπλασιασμού τους (half-life)) είναι μικροί. Για το τετραζάνιο ο χρόνος
υποδιπλασιασμού
κυμαίνεται από 1 ms (σε
αλκαλικό μέσο) έως 100 ms
(σε ισχυρώς αλκαλικό μέσο) και σε θερμοκρασία δωματίου. Το
τριαζένιο N3H3
(H2NN=NH)
έχει χρόνο
υποδιπλασιασμού που κυμαίνεται από 0,1
s (σε όξινο μέσο) έως 100 s
(σε ασθενώς αλκαλικό μέσο).
ΝΗ3 + Ν2).
Καμία από αυτές τις ενώσεις δεν έχει απομονωθεί σε καθαρή κατάσταση αφού
οι χρόνοι υποδιπλασιασμού τους (half-life)) είναι μικροί. Για το τετραζάνιο ο χρόνος
υποδιπλασιασμού
κυμαίνεται από 1 ms (σε
αλκαλικό μέσο) έως 100 ms
(σε ισχυρώς αλκαλικό μέσο) και σε θερμοκρασία δωματίου. Το
τριαζένιο N3H3
(H2NN=NH)
έχει χρόνο
υποδιπλασιασμού που κυμαίνεται από 0,1
s (σε όξινο μέσο) έως 100 s
(σε ασθενώς αλκαλικό μέσο).
Ενδιαφέρον παρουσιάζει η ένωση
διαζένιο ή διιμίνη Ν2Η2
(ΝΗ=ΝΗ), που εμφανίζεται σε δύο γεωμετρικώς ισομερείς μορφές (cis- και
trans-). Αποτελεί βραχύβιο ενδιάμεσο
της διάσπασης της υδραζίνης με μικροκυματική εκκένωση ή προϊόν θερμικής διάσπασης
του μετά νατρίου (ή άλλων αλκαλίων) άλατος της τοζυλοϋδραζίνης (CH3C6H4SO2NHNHNa).
Η trans-μορφή του διαζενίου διασπάται σε θερμοκρασίες
μεγαλύτερες από
−180ºC
(διασπάται κυρίως μέσω της αντίδρασης: 2Ν2Η2
 Ν2Η4
+ Ν2).
Σε αέρια κατάσταση
μπορεί να διατηρηθεί για μεγάλα χρονικά διαστήματα σε πολύ χαμηλή πίεση
ακόμη και σε θερμοκρασία δωματίου. Ακόμη σταθεροποιείται κινητικά
παρουσία αμμωνίας. Το διαζένιο παρουσιάζεται ως ενδιάμεσο σε πολλές
αντιδράσεις οργανικής σύνθεσης, αλλά ακόμη και σε αντιδράσεις βιοχημικού
ενδιαφέροντος [Αναφ. 6]. Θεωρείται ως ένα από τα πλέον ισχυρά αναγωγικά αντιδραστήρια. Χαρακτηριστικά αναφέρεται ότι
σε αέρια κατάσταση, στους
−100ºC,
προκαλεί αναγωγή του H2SO4
προς SO2
και του
P2O5 προς
P4.
Ν2Η4
+ Ν2).
Σε αέρια κατάσταση
μπορεί να διατηρηθεί για μεγάλα χρονικά διαστήματα σε πολύ χαμηλή πίεση
ακόμη και σε θερμοκρασία δωματίου. Ακόμη σταθεροποιείται κινητικά
παρουσία αμμωνίας. Το διαζένιο παρουσιάζεται ως ενδιάμεσο σε πολλές
αντιδράσεις οργανικής σύνθεσης, αλλά ακόμη και σε αντιδράσεις βιοχημικού
ενδιαφέροντος [Αναφ. 6]. Θεωρείται ως ένα από τα πλέον ισχυρά αναγωγικά αντιδραστήρια. Χαρακτηριστικά αναφέρεται ότι
σε αέρια κατάσταση, στους
−100ºC,
προκαλεί αναγωγή του H2SO4
προς SO2
και του
P2O5 προς
P4.
|
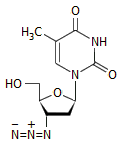
Εφαρμογές υδραζωτικών αλάτων
Το υδραζωτικό οξύ δεν αποτελεί
βιομηχανικό προϊόν δεδομένης της επικινδυνότητάς του. Αντίθετα, το νατραζίδιο (NaN3) παρασκευάζεται σε βιομηχανική κλίμακα
σε ποσότητες της τάξης των 5 χιλιάδων τόννων
ετησίως. 'Αλλο άλας του υδραζωτικού οξέος, που επίσης παρασκευάζεται
βιομηχανικά, αλλά σε μικρότερη κλίμακα, είναι το υδραζωτικό βάριο Ba(N3)2.
Η μεγαλύτερη ποσότητα των αλάτων αυτών διοχετεύεται στην αυτοκινητοβιομηχανία,
όπου χρησιμοποιείται στους μηχανισμούς ανάπτυξης αερόσακων ασφαλείας. Μικρότερες
ποσότητες υδραζωτικών αλάτων χρησιμοποιούνται ως εμπυρεύματα σε πυροκροτητές
και καψύλια.
Το NaN3
χρησιμοποιείται ευρύτατα και ως συντηρητικό και αντιμικροβιακό
αντιδραστηρίων που χρησιμοποιούνται ευρύτατα στη βιοχημική ανάλυση, όπως
π.χ. του ρυθμιστικού διαλύματος PBS (ρυθμιστικού διαλύματος φωσφορικών με NaCl,
όπου προλαμβάνει την ανάπτυξη μικροοργανισμών) και διαλυμάτων ορών.
Υδραζωτικά άλατα χρησιμοποιούνται στη
φαρμακευτική σύνθεση και γενικά
στην οργανική σύνθεση (βλ. π.χ. μεταθετική αντίδραση Curtus: "Χημική
ένωση του μήνα: Ισοκυανικό μεθύλιο (MIC)") και στην έρευνα. Πολλές
δραστικές φαρμακευτικές ουσίες περιέχουν στο μόριό τους την αζιδοομάδα. Η πλέον
χαρακτηριστική από αυτές είναι το AZT (Retrovir), ένα παράγωγο της θυμιδίνης,
που χορηγείται στους πάσχοντες από AIDS ως αντιρετροϊικό (antiretroviral)
φάρμακο.
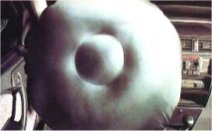
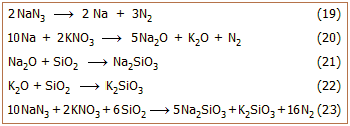 Αερόσακοι ασφαλείας
αυτοκινήτων:
Η εγκατάσταση αερόσακων στα αυτοκίνητα, ως σύστημα
παθητικής ασφάλειας (δηλ. αυτόματα ενεργοποιούμενο) γενικεύτηκε κατά τη δεκαετία
του 1990, αρχικά ως προσφερόμενο "έξτρα" και στη συνέχεια ως υποχρεωτικό σύστημα
σε κάθε αυτοκίνητο. Η ιδέα χρήσης του νατραζιδίου (σε μίγμα με μεταλλικά
οξείδια) για την ταχύτατη παραγωγή αερίου ανήκει στον Χημικό John Pietz, από το
1968
[Αναφ. 7].
Αερόσακοι ασφαλείας
αυτοκινήτων:
Η εγκατάσταση αερόσακων στα αυτοκίνητα, ως σύστημα
παθητικής ασφάλειας (δηλ. αυτόματα ενεργοποιούμενο) γενικεύτηκε κατά τη δεκαετία
του 1990, αρχικά ως προσφερόμενο "έξτρα" και στη συνέχεια ως υποχρεωτικό σύστημα
σε κάθε αυτοκίνητο. Η ιδέα χρήσης του νατραζιδίου (σε μίγμα με μεταλλικά
οξείδια) για την ταχύτατη παραγωγή αερίου ανήκει στον Χημικό John Pietz, από το
1968
[Αναφ. 7].
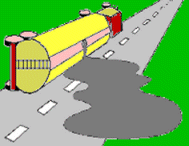
Μεγάλος όγκος αερίου αζώτου μπορεί να
παραχθεί με θερμική διάσπαση του NaN3
(αντίδραση 19). Η αντίδραση αυτή μόνη της δεν πραγματοποιείται με τον
απαιτούμενο βαθμό "εκρηκτικότητας", που απαιτεί η δεδομένη εφαρμογή. Επιπλέον παράγεται μεταλλικό
νάτριο που
ως χημικώς δραστικό μέταλλο είναι
επικίνδυνο αφού είναι βέβαιο πως θα οξειδωθεί με ανάφλεξη.
Κατά πολύ πιο αποτελεσματικό είναι ένα μίγμα NaN3
- KNO3 -
SiO2. To
KNO3
αξειδώνει αμέσως το Na προς Na2O
(αντίδραση 20). Η αντίδραση αυτή συνεισφέρει επιπλέον ποσά αζώτου και θερμότητας.
Η εκλυόμενη θερμότητα
αυξάνει τον όγκο του εκλυόμενου αερίου και καθιστά ουσιαστικά ακαριαία την
παραγωγή του. Το SiO2
δεσμεύει τα οξείδια των αλκαλίων (Na2O
και Κ2Ο), το οποία με υγρασία θα παρείχαν τα καυστικά NaOH και ΚΟΗ,
σχηματίζοντας αβλαβή υαλώδη πυριτικά άλατα (αντιδράσεις 21 και 22). Η συνολική αντίδραση αποδίδεται
από την αντίδραση 23. Μπορεί θεωρητικά να υπολογιστεί (με βάση την αντίδραση 23)
ότι από 1 g NaN3
θα προκύψουν περίπου 0,75 L αερίου αζώτου (ως μέση θερμοκρασία αερίου λαμβάνονται οι 100ºC). Εκτιμάται
ότι στα σύγχρονα αυτοκίνητα, με τέσσερα συστήματα αερόσακων, υπάρχουν περίπου
200 έως 300 g NaN3.
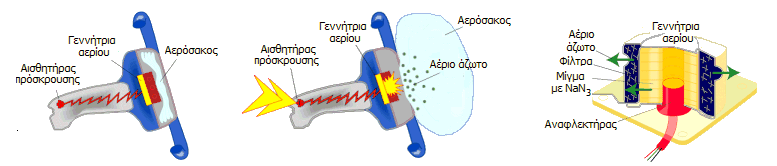
Η ανάπτυξη του αερόσακου ενεργοποιείται
από έναν αισθητήρα πρόσκρουσης, o οποίος ανιχνεύει επιβραδύνσεις που
αντιστοιχούν σε μετωπική πρόσκρουση του αυτοκινήτου σε ακλόνητο εμπόδιο με
ταχύτητα 15 έως 25 km/h. Στα αυτοκίνητα με πλευρικούς αερόσακους διαπιστώνεται με περισσότερους
αισθητήρες και η γωνία πρόσκρουσης, ώστε το ηλεκτρονικό σύστημα να "αποφασίσει"
αν θα αναπτυχθούν οι πρόσθιοι ή οι πλευρικοί αερόσακοι ή όλοι.
Το μίγμα (NaN3
- KNO3 -
SiO2)
βρίσκεται σφραγισμένο σε ένα κάνιστρο από αλουμίνιο (inflator, γεννήτρια αερίου) που αποκλείει τη τυχαία διαρροή
NaN3
προς τον
χώρο των επιβατών. Μπροστά του βρίσκεται διπλωμένος ο αερόσακος από πολυαμίδιο ή ανθεκτικό nylon,
πασπαλισμένος με τάλκη ή άμυλο, για να αποφευχθεί η συγκόλληση των τοιχωμάτων
του κατά τη μακρά παραμονή του και να βοηθηθεί έτσι η
ταχεία ανάπτυξή του. Για να αναπτυχθεί ο αερόσακος διαβιβάζεται ενός
σύντομος παλμός ηλεκτρικού ρεύματος (2-3 Α) μέσω ενός μεταλλικού νήματος
(αναφλεκτήρας, "ηλεκτρικό σπίρτο") που προκαλεί την αντίδραση.
Οι φάσεις ανάπτυξης του αερόσακου και η
τυπική διάρκειά τους έχουν ως εξής: (α) Ανίχνευση πρόσκρουσης - έναρξη της
αντίδρασης: 10-15 ms, (β)
φούσκωμα του αερόσακου: 40-45 ms,
(γ) ξεφούσκωμα του αερόσακου: 40 ms. H
τελευταία φάση είναι αυτή κατά την οποία το σώμα του επιβάτη βρίσκεται σε επαφή
με τον σάκο και επιβραδύνεται. Με το τέλος της ο αερόσακος έχει ξεφουσκώσει
τελείως, ενώ το σώμα κινείται προς τα πίσω. H όλη διαδικασία δεν διαρκεί
περισσότερο από 120 ms.
Καταβλήθηκαν και καταβάλλονται
προσπάθειες αντικατάστασης του νατραζιδίου (λόγω της επικινδυνότητάς του) στους
μηχανισμούς ανάπτυξης αερόσακων (και όχι μόνο) με άλλες λιγότερο τοξικές,
άφλογες και άκαπνες πλούσιες σε άζωτο ουσίες. Πολλά υπόσχονται στις εφαρμογές
αυτές οι τετραζίνες και τα παράγωγά τους [Αναφ.
7ζ]. Πολλές αυτοκινητοβιομηχανίες χρησιμοποιούν αυτά τα νέα
χημικά συστήματα για την ανάπτυξη των αεροσάκων. Οι ακριβείς συνθέσεις των νέων
συστημάτων προς το παρόν αποτελούν βιομηχανικά μυστικά.
|
  
Πυροκροτητές,
καψύλια (σε σφαίρες) και μεταλλικά δοκίμια με τα οποία εξετάζεται
και συγκρίνεται η εκρηκτική ισχύς πυροκροτητών με εμπυρεύματα
διαφορετικής
σύνθεσης. |
Τα αζίδια ως εμπυρεύματα: Τα άλατα του υδραζωτικού οξέος με βαριά
μέταλλα σε ξηρή κατάσταση μπορούν να εκραγούν με θέρμανση ή με μηχανική
δράση (π.χ. αν κτυπηθούν με σφυρί). Οι ιδιότητες αυτές τα καθιστά κατάλληλα
ως υλικά (εμπυρεύματα) για
πυροκροτητές (detonators) και καψύλια. Μικρή ποσότητα
τους εκρήγνυται προκαλώντας τη δευτερογενή έκρηξη
του κυρίως εκρηκτικού (π.χ. πυρίτιδες, δυναμίτης, ΤΝΤ ή άλλες νιτροενώσεις) [Αναφ. 8].
Το παλαιότερο υλικό
(και λιγότερο ασφαλές) ήταν ο ονομαζόμενος βροντώδης ή κροτικός υδράργυρος, άλας του
υδραργύρου με το κροτικό οξύ (mercury fulminate) (βλ. "Χημική
ένωση του μήνα: Ισοκυανικό μεθύλιο (MIC)").
Το αζίδιο του μολύβδου είναι σχετικά ασφαλέστερο, είναι ελάχιστα
υγροσκοπικό υλικό και αρκετά δυσδιάλυτο στο νερό, όπου και δεν περιορίζεται σημαντικά
η εκρηκτική ισχύς του. Επιπλέον δεν αντιδρά με αλουμίνιο, γεγονός που του
επιτρέπει να παραμείνει αναλλοίωτο σε καψύλια με περίβλημα από αυτό το μέταλλο.
Ασφαλέστερο σε μηχανική κρούση υλικό είναι ο στυφνικός μόλυβδος (lead
styphnate, στυφνικό
οξύ: 2,4,6-τρινιτρο-1,3-διυδροξυβενζόλιο ή τρινιτρορεσορκίνη).
Η σύγχρονη τάση είναι η αντικατάσταση των
προηγούμενων αλάτων του μολύβδου με καθαρά οργανικές ενώσεις πλούσιες σε άζωτο,
συνήθως εστέρες του υδραζωτικού οξέος. Επίσης χρησιμοποιούνται σε μίγματα μεταξύ τους ή με άλλες
εκρηκτικές ύλες
(βλ. "Χημική
ένωση του μήνα: Οκτανιτροκυβάνιο").
Ορισμένες χημικές ουσίες που έχουν χρησιμοποιηθεί ή χρησιμοποιούνται ως
εμπυρεύματα δείχνονται παρακάτω.
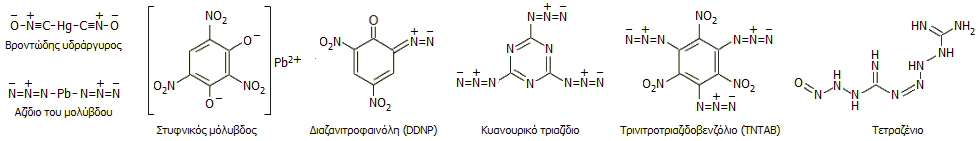
Μεταξύ των οργανικών εμπυρευμάτων ξεχωρίζει λόγω
του κάπως παράδοξου μοριακού τύπου (C3N12)
το κυανουρικό τριαζίδιο (cyanuric
triazide).
Η ένωση αυτή θα πρέπει να είναι η πλουσιότερη σε άζωτο σταθερή οργανική ένωση (%Ν =
82,3). Εντυπωσιακά εύκολη είναι και η παρασκευή της
ένωσης, που βασίζεται σε μια απλή αντίδραση αντικατάστασης: στην αντίδραση
κυανουρικού τριχλωρίδιου (C3N3Cl3:
τριχλωρίδιο του κυανουρικού οξέος, βλ. "Χημική
ένωση του μήνα: Μελαμίνη") με περίσσεια νατραζιδίου. 'Αλλο, επίσης
πλούσιο σε άζωτο, εμπύρευμα είναι το τετραζένιο ή τετρακένιο (C2H8N10O,
%N = 74,2%), που παρασκευάζεται με αντίδραση αμινογουανιδίνης (Η2Ν-ΝΗ-C(=NH)-NH2)
και νιτρώδους οξέος.
Βιοχημικές ιδιότητες και τοξικότητα του υδραζωτικού οξέος και των αζιδίων
Το υδραζωτικό και τα άλατά δρουν ως παρεμποδιστές
της κυτοχρωμικής οξειδάσης (cytochrome oxidade), του
ενζύμου που εμπλέκεται άμεσα στη δέσμευση του οξυγόνου μέσω της οξείδωσης του
σιδήρου(ΙΙ) προς σίδηρο(ΙΙΙ) σύμφωνα με τη γενική αντίδραση:
4 Fe2+-κυτόχρωμα c + 8 H+εισόδου
+ O2
 4 Fe3+-κυτόχρωμα c + 2
H2O + 4 H+εξόδου
4 Fe3+-κυτόχρωμα c + 2
H2O + 4 H+εξόδου
Το ιόν του αζιδίου
δεσμεύεται μη αντιστρεπτά από την αίμη, γεγονός που οδηγεί σε θάνατο από ασφυξία
και κατατάσσει το υδραζωτικό οξύ και τα άλατά του στα σφοδρά δηλητήρια.
Την ίδια παρεμπόδιση ασκούν τα κυανιούχα ιόντα, τα θειούχα ιόντα και το
μονοξείδιο του άνθρακα [Αναφ. 9].
Η ιδιότητα αυτή αξιοποιείται στην ευρύτατη χρησιμοποίηση του νατραζιδίου ως αντιμικροβιακής και βακτηριοστατικής
συντηρητικής ουσίας (preservative) σε πρωτεϊνούχα διαλύματα (όπως π.χ. δείγματα
ορού), όπου δρα ικανοποιητικά σε πολύ μικρές συγκεντρώσεις (0,05-0,1%). Αν
χρειαστεί, μπορεί να απομακρυνθεί εύκολα από τα διαλύματα αυτά με διαπίδυση
[Αναφ. 10].
'Εκθεση του ανθρώπου σε μικρές ποσότητες
νατραζιδίου ή υδραζωτικού οξέος (π.χ. με εισπνοή σκόνης NaN3
ή ατμών ΗΝ3
από διαλύματα NaN3
ή με απορρόφηση μέσω του δέρματος) προκαλεί τα ακόλουθα συμπτώματα: ταχεία
αναπνοή, ανησυχία, ζάλη, αδυναμία, πονοκέφαλο, ναυτία και έμετους, ταχυκαρδία,
κοκκίνισμα των ματιών, καταρροή, βήχα και εγκαύματα στο δέρμα
[Αναφ. 11].
Λήψη σχετικά μεγάλης ποσότητας νατραζιδίου
(>10 mg/kg) προκαλεί: Σπασμούς, πτώση της πίεσης, επιβράδυνση των καρδιακών παλμών,
απώλεια των αισθήσεων, πνευμονικό οίδημα και αναπνευστική καταστολή που οδηγεί
στο θάνατο. Ουσιαστικά, τα συμπτώματα είναι ίδια με εκείνα της δηλητηρίασης από
μονοξείδιο του άνθρακα. Ως τοξική δόση για το NaN3
έχει αναφερθεί η ποσότητα των 700 mg.
Ατυχήματα δηλητηρίασης από νατραζίδιο
έχουν συμβεί σε τεχνικούς εργαστηρίων, σε διαλυτήρια αυτοκινήτων (από τους
μηχανισμούς των αερόσακων), όπως επίσης και μετά την ανάπτυξη ενός προφανώς
ελαττωματικού αερόσακου
[Αναφ. 11β]. Μια λίστα
ατυχημάτων, που σχετίζονται με λήψη αζιδίων (ποσότητες, συμπτώματα, θεραπεία),
μπορεί να αναζητηθεί στην [Αναφ.
11δ].
Για το υδραζωτικό οξύ σε ποντίκια
οι τιμές LC50
και LD50
είναι αντίστοιχα 34 mg/m3 και 33 mg/kg. Το υδραζωτικό οξύ και τα αζίδια
δεν έχουν υπαχθεί στην
κατηγορία των μεταλλαξιγόνων και καρκινογόνων ουσιών
[Αναφ. 12].
 Αζίδια στο εργασιακό
περιβάλλον: Τα ανώτερα όρια υδραζωτικού οξέος και των αλάτων του στο
εισπνεόμενο αέρα του εργασιακού περιβάλλοντος έχουν
ορισθεί στα 0,11 ppm (για το HN3)
ή 0,29 mg/m3 (ως NaN3). Θα πρέπει να σημειωθεί ότι η οσμή των ατμών του υδραζωτικού οξέος σε μικρές συγκεντρώσεις
δεν είναι τόσο έντονη, όσο θα χρειαζόταν για να γίνει αντιληπτή η παρουσία του
σε επικίνδυνες συγκεντρώσεις στον εισπνεόμενο αέρα. Αυτό σε αντίθεση π.χ. με το
υδρόθειο,
το οποίο αν και είναι τοξικότερο (τοξικότερο ακόμη και από το υδροκυάνιο) θεωρείται
λιγότερο επικίνδυνο, επειδή η εντονότατη οσμή του δρα προειδοποιητικά και αποτρέπει την
εισπνοή του σε επικίνδυνες συγκεντρώσεις
[Αναφ. 12].
Αζίδια στο εργασιακό
περιβάλλον: Τα ανώτερα όρια υδραζωτικού οξέος και των αλάτων του στο
εισπνεόμενο αέρα του εργασιακού περιβάλλοντος έχουν
ορισθεί στα 0,11 ppm (για το HN3)
ή 0,29 mg/m3 (ως NaN3). Θα πρέπει να σημειωθεί ότι η οσμή των ατμών του υδραζωτικού οξέος σε μικρές συγκεντρώσεις
δεν είναι τόσο έντονη, όσο θα χρειαζόταν για να γίνει αντιληπτή η παρουσία του
σε επικίνδυνες συγκεντρώσεις στον εισπνεόμενο αέρα. Αυτό σε αντίθεση π.χ. με το
υδρόθειο,
το οποίο αν και είναι τοξικότερο (τοξικότερο ακόμη και από το υδροκυάνιο) θεωρείται
λιγότερο επικίνδυνο, επειδή η εντονότατη οσμή του δρα προειδοποιητικά και αποτρέπει την
εισπνοή του σε επικίνδυνες συγκεντρώσεις
[Αναφ. 12].
Επικινδυνότητα υδραζωτικών αλάτων -
Πιθανά περιβαλλοντικά προβλήματα
Οι μεγάλες ποσότητες
νατραζιδίου που χρησιμοποιούνται στην αυτοκινητοβιομηχανία στα συστήματα
ανάπτυξης των αεροσάκων δημιουργούν ανησυχίες πιθανής μόλυνσης του περιβάλλοντος
και ατυχημάτων κατά τη διάλυση μεταχειρισμένων ή κατεστραμμένων αυτοκινήτων.
Σε ορισμένες περιπτώσεις επιβάλλεται νομοθετικά επιβάλλεται η αφαίρεση των άθικτων συστημάτων ανάπτυξης αεροσάκων
πριν από τη διάλυση των αυτοκινήτων
[Αναφ. 13α].
Χαρακτηριστικά, ίσως όμως και κάπως δραματικά, αναφέρεται ότι σε ένα αυτοκίνητο περιέχεται αρκετή ποσότητα νατραζιδίου (250 g) για να φέρει σε κατάσταση κώματος 5.000 ανθρώπους
και ότι το άλας αυτό είναι "μια επαπειλούμενη καταστροφή"
[Αναφ. 13β].
Ιδιαίτερα έχει ασχοληθεί με το θέμα αυτό
ο Eric A. Betterton (του Πανεπιστημίου της Αριζόνας). Ο ίδιος φαίνεται πως είναι ιδιαίτερα
ευαισθητοποιημένος αφού ως μεταπτυχιακός φοιτητής είχε νοιώσει "από πρώτο χέρι" τα συμπτώματα της δηλητηρίασης από νατραζίδιο: "μετά από μια φευγαλέα εισπνοή ατμών
υδραζωτικού οξέος ζαλίστηκε, του έπεσε η πίεση, έπαθε ταχυκαρδία και τα μάτια
του κοκκίνισαν" [Αναφ. 13δ].
 Ο Betterton εκτιμά ότι στα
αυτοκίνητα που κυκλοφορούν στις ΗΠΑ βρίσκεται ποσότητα NaN3
που ξεπερνά τα 5 εκατομμύρια χιλιόγραμμα. Ακόμη, αναφέρεται σε μελέτες
του 1970 οι οποίες έδειξαν ότι συγκέντρωση NaN3
10 ppm στο έδαφος αλλοιώνει τους σπόρους πολλών φυτών, ενώ σε συγκεντρώσεις 200
ppm αποστειρώνει το χώμα σκοτώνοντας κάθε βακτηρίδιο και μύκητα
[Αναφ. 13γ, 13δ].
Ο Betterton εκτιμά ότι στα
αυτοκίνητα που κυκλοφορούν στις ΗΠΑ βρίσκεται ποσότητα NaN3
που ξεπερνά τα 5 εκατομμύρια χιλιόγραμμα. Ακόμη, αναφέρεται σε μελέτες
του 1970 οι οποίες έδειξαν ότι συγκέντρωση NaN3
10 ppm στο έδαφος αλλοιώνει τους σπόρους πολλών φυτών, ενώ σε συγκεντρώσεις 200
ppm αποστειρώνει το χώμα σκοτώνοντας κάθε βακτηρίδιο και μύκητα
[Αναφ. 13γ, 13δ].
 Ως
σημαντικότερο ατύχημα στο οποίο εμπλέκεται το νατραζίδιο
αναφέρεται η ανατροπή ενός φορτηγού με φορτίο του άλατος (σε 50 βαρέλια των 44
γαλονιών), το οποίο προοριζόταν για την αυτοκινητοβιομηχανία
[Αναφ. 13β]. Η
ανατροπή έγινε λίγο έξω από τη μικρή πόλη Mona της πολιτείας Utah των ΗΠΑ, στις 10
Δεκεμβρίου 1996. Το φορτηγό τυλίχθηκε στις φλόγες και η βροχή, που ακολούθησε το
ατύχημα, σε συνδυασμό με τις υψηλές θερμοκρασίες, δημιούργησαν τοξικούς ατμούς
υδραζωτικού οξέος. Αποτέλεσμα ήταν να δοθεί εντολή εκκένωσης της πόλης από τους 2000
περίπου κατοίκους της. Εκτός από έναν περαστικό οδηγό δεν αναφέρθηκε έκθεση
άλλων
ατόμων σε επικίνδυνες ποσότητες ατμών [Αναφ.
14].
Ως
σημαντικότερο ατύχημα στο οποίο εμπλέκεται το νατραζίδιο
αναφέρεται η ανατροπή ενός φορτηγού με φορτίο του άλατος (σε 50 βαρέλια των 44
γαλονιών), το οποίο προοριζόταν για την αυτοκινητοβιομηχανία
[Αναφ. 13β]. Η
ανατροπή έγινε λίγο έξω από τη μικρή πόλη Mona της πολιτείας Utah των ΗΠΑ, στις 10
Δεκεμβρίου 1996. Το φορτηγό τυλίχθηκε στις φλόγες και η βροχή, που ακολούθησε το
ατύχημα, σε συνδυασμό με τις υψηλές θερμοκρασίες, δημιούργησαν τοξικούς ατμούς
υδραζωτικού οξέος. Αποτέλεσμα ήταν να δοθεί εντολή εκκένωσης της πόλης από τους 2000
περίπου κατοίκους της. Εκτός από έναν περαστικό οδηγό δεν αναφέρθηκε έκθεση
άλλων
ατόμων σε επικίνδυνες ποσότητες ατμών [Αναφ.
14].
Ατυχήματα στα
εργαστήρια: 'Εχει αναφερθεί μια έκρηξη κατά την εκχύλιση
με διχλωρομεθάνιο διαλύματος
που περιείχε NaN3. Εικάζεται ότι σχηματίστηκε διαζιδομεθάνιο, CH2(N3)2
το οποίο είναι ασταθές σε μεγάλες συγκεντρώσεις. Οι ερευνητές που περιέγραψαν το
ατύχημα αυτό συνιστούν να αποφεύγεται η χρήση αζιδίων παρουσία αλογονούχων
διαλυτών [Αναφ. 15α]. 'Εχουν
επίσης αναφερθεί ασυμβατότητες του NaN3
με διάφορα άλλα αντιδραστήρια
[Αναφ. 15β].
Στα κλινικά
εργαστήρια: Ιδιαίτερη προσοχή επιβάλλεται στις αποχετεύσεις των εργαστηριακών
πάγκων κλινικών εργαστηρίων στα νοσοκομεία, όπου λειτουργούν αυτόματα συστήματα κλινικών αναλύσεων, στα οποία
χρησιμοποιούνται διαλύματα που περιέχουν νατραζίδιο ως συντηρητικό
(έως και 0,1%). Τα απόβλητα των αυτόματων αναλυτών περιέχουν πολύ μικρές
συγκεντρώσεις NaN3,
αλλά διοχετεύονται συνεχώς και για χρόνια στην αποχέτευση
[Αναφ. 5α]. Εκεί τα υδραζωτικά ανιόντα αντιδρούν με τον μόλυβδο
ή χαλκό των
σωληνώσεων με αποτέλεσμα τον σχηματισμό και τη σταδιακή συσσώρευση των
εκρηκτικών αζιδίων των μετάλλων.
Τα αζίδια αυτά μπορούν να εκραγούν αυθόρμητα ή κατά τη διάρκεια εργασιών συντήρησης του
συστήματος αποχέτευσης. Για τον λόγο αυτό συνιστάται: α) η σε τακτική βάση
έκπλυση των σωληνώσεων της αποχέτευσης και εξουδετέρωση των συσσωρευμένων
αζιδίων με διάλυμα NaNO2
και β) όπου είναι δυνατή, η αντικατάσταση μολύβδινων ή χάλκινων σωληνώσεων αποχέτευσης με πλαστικούς σωλήνες [Αναφ. 5β,
Αναφ. 16].
Βιβλιογραφία - Πηγές από το Διαδίκτυο
1. (α) Greenwood NN, Earnshaw Α:
"Chemistry of the Elements", Pergamon Press (1984), p. 496-497. (β)
Wiberg Ε, Wiberg Ν, Holleman AF: "Inorganic
Chemistry" Academic Press (2001) (Google
Books). (γ) Κατάκης Δ, Μεθενίτης Κ, Μητσοπούλου Χ,
Πνευματικάκης Γ: "Ανόργανη Χημεία Β': Τα στοιχεία", Εκδόσεις Παπαζήση (2002),
σελ. 124.
2. (α) Lee
TH, Colton RJ, White
MG, Rabalais JW: "Electronic structure of
hydrazoic acid and the azide ion from x-ray and
ultraviolet electron spectroscopy", J. Am. Chem. Soc.
97(17):4845-4851, 1975
(Abstract).
(β) Costa Cabrala
BJ, Costa ML: "Density
functional study of molecular properties of hydrazoic acid
and methyl azide", Journal of Molecular
Structure (Theochem) 343:31-41,
1995 (Abstract).
(γ) Gericke KH, Theinl R, Comes FJ: "Photofragment energy distribution and
rotational anisotropy from excitation of HN3
at 266 nm", Chemical Physics Letters, 164(6):605-611,
1989 (PDF,
663 KB).
3. "CRC Handbook of
Chemistry and Physics", CRC Press, 55th ed. 1974-75.
4. (α)
Yatsimirskii KB: "Kinetic methods of analysis", Pergammon
Press, London, 1966, σελ. 129-130.
(β)
Goto H,
Shiokawa T: "Catalytic
Analysis. V: Microdetermination of
sulphide, thiosulphate and thiocyanate
with the fluorescence indicator",
Science reports of the Research Institutes, Tokohu University (Ser. A, Physic,
chemistry and metallurgy) 1:179-181, 1949 (αρχείο
PDF, 263 KB). (γ)
Kiba N, Furusawa M: "Improved method for titrimetric determination of sulphide
by the iodine-azide reaction", Talanta
28(8):601-602, 1981 [PubMed].
(δ) Puacz W, Kurzawa Z,
Szahun W: "Application of the iodine-azide reaction to the catalytic
determination of divalent sulphur compounds in alcoholic medium: Determination
of ethylenethiourea in some biological materials",
Mikrochimica Acta 122(3-4):
301-310, 1996 (Abstract).
(ε) Zakrzewski R, Ciesielski W: "Application of improved iodine-azide
procedure for the detection of thiouracils in blood serum and urine with planar
chromatography",
J Chromatogr B Analyt Technol Biomed Life Sci. 784(2):283-290, 2003
(PubMed).
5. (α) Wear JO: "Azide hazards with
automatic blood cell counters", Journal of Chemical Education, 52(1): A23-A25,
1975. (β) Centers for Disease Control and Prevention
(CDC): "Explosive
azide hazard",
Current
Intelligence Bulletin 13 (August 16, 1976). (γ)
Hallman
DF: "Hydrazoic
acid controls and
risks when
processing plutonium
solutions in HB-Line Phase II",
U.S. Department of Energy,
Office of Scientific & Technical Information.
6. (α)
Wiberg N, Fischer G, Bachhnber H: "cis- and trans-diazene (diimine)", Angew.
Chem. Int. Ed. Engl. 16(11):780-781, 1977. (β) McKee ML: "Catalyzed cis/trans
isomerization of diazene. A computational study in the gas and aqueous phases",
J. Phys. Chem. 97:13608-13614, 1993 (Abstract).
(γ) McKenna CE, Simeonov AM, Eran H, Bravo-Leerabhandh
M: "Reduction
of cyclic and acyclic diazene derivates by Azotobacter vinelandii nitrogenase:
diazirine and trans-dimethyldiazene",
Biochemistry 35(14):4502-45014, 1996 (PubMed).
(δ) Barney BM,
McClead J, Lukoyanov D, Laryukhin M, Yang T-C, Dean DR, Hoffman BM, Seefeldt LC:
"Diazene
(HN=NH) is a substrate for nitrogenase: Insights into the pathway of N2
Reduction",
Biochemistry 46(23):
6784-6794,
2007.
7. (α) Casiday R, Frey R: "Gas
laws save lives: The chemistry behind airbags - stoichiometry and the
gasconstant experiment" (Department of Chemistry, Washington University in
St. Louis, October 2000). (β) Bell WL: "Chemistry of air
bags"
J. Chem. Ed.
67(1):61, 1990. (γ) Madlung A:
"The Chemistry behind the Air Bag: High Tech
in First-Year Chemistry"
J. Chem. Ed. 73(4):347, 1996, (δ) How Products are made: "Airbag".
(ε)
Brain M: "How
airbags work" (How stuff works). (στ)
4 Τροχοί : "Σύγχρονα
συστήματα αερόσακων" (Τεύχος 282, Μάρτιος 1994). (ζ) LoPresti V: "Versatile
explosives: Playing with fire" (Los Alamos Laboratories).
8. (α)
Wikipedia: "Detonator".
(β) Wikipedia: "Blasting
cap". (γ)
Ball B: "The
chemistry of detonators - what's behind the bang", Canadian Chemical News (July
1998). (δ) Mehta N et al: "Performance
testing of lead-free stab detonators", 05/11/2006, NDIA Fuze Conference (PDF,
2,11 MB).
9. (α) Wikipedia: "Cytochrome
c oxidase". (β) Crofts A: "Cytochrome
oxidase (Complex IV)" (Biophysics
354), University of Illinois at Urbana-Champaign, 1996.
10. (α) Sigma-Aldrich: "Sodium
azide". (β)
Russo I, Del Mese P, Viretto M, Doronzo G,
Mattiello L, Trovati M, Anfossi G:"Sodium
azide, a bacteriostatic preservative contained in commercially available
laboratory reagents, influences the responses of human platelets via the
cGMP/PKG/VASP pathway",
Clinical Biochemistry
41(4-5):
343-349, 2008.
11. (α) Centers for
Disease Control and Prevention (CDC):
Facts About Sodium Azide. (β)
Angelotti T, Mireles
S, McMahon D: "Anesthetic
implications of a near-lethal
sodium azide
exposure",
Anesth Analg 104:229-230, 2007. (γ) Chemical land: "Sodium
azide". (δ) National Institute of Health (NIH), Hazardous
Substances Data Bank (HSDB): "SODIUM
AZIDE: Human health
effects".
12. United States Department of Labor (Occupational
Safety & Health Administration): "Chemical
sampling information: Hydrazoic
acid".
13. (α) State of Oregon,
Department of Environmental Quality: "Air bag management information for vehicle
dismantlers (Fact sheet)" (PDF,
90 KB). (β) Macinnis P: "Poisons:
From Hemlock to Botox and the Killer Bean of Calabar", Arcade Publishing, 2005 (Google-Books). (γ) Betterton EA: "Environmental fate of sodium
azide derived from automobile airbags", Critical reviews in environmental
science and technology 33(4):423-458, 2003 (Abstract).
(δ) Betterton EA (University of
Arizona): "Sodium
azide in car airbags poses a growing environmental hazard" (San Diego,
Earth Times, Aug. 2000).
14. Lewis-Younger C (Utah
Area Health Education Center): "Hazardous
materials emergency response training pays off in rural community", Agency
for Toxic Substance and Disease Registry.
15. (α) Peet NP, Weintraub
PM: "Explosion with sodium azide in DMSO-CH2Cl2",
Chemical & Engineering News, 71(16):4, 1993. (β) Wireless Information
System for Emergency Responders: "Sodium
azide: Reactivities/Incompatibilities".
16. Northeastern
University (Office of Environmental Health & Safety): "Sodium
azide (Fact Sheet #3, March 2003)".
 Το
υδραζωτικό οξύ (ΗΝ3)
παρασκευάστηκε για πρώτη φορά το 1890 από τον Theodor Curtius (Berichte,
1890, 23, p. 3023). Η σύνθεσή του βασιζόταν στην οξείδωση της υδραζίνης (Ν2Η4)
με νιτρώδες οξύ (αντίδραση 1). Την υδραζίνη την είχε παρασκευάσει ο ίδιος επίσης
για πρώτη φορά το
1887. Ο κυριότερος τρόπος παραγωγής της υδραζίνης βασίζεται στην ελεγχόμενη οξείδωση
της αμμωνίας με υποχλωριώδη άλατα (αντιδράσεις 2 - 4).
Το
υδραζωτικό οξύ (ΗΝ3)
παρασκευάστηκε για πρώτη φορά το 1890 από τον Theodor Curtius (Berichte,
1890, 23, p. 3023). Η σύνθεσή του βασιζόταν στην οξείδωση της υδραζίνης (Ν2Η4)
με νιτρώδες οξύ (αντίδραση 1). Την υδραζίνη την είχε παρασκευάσει ο ίδιος επίσης
για πρώτη φορά το
1887. Ο κυριότερος τρόπος παραγωγής της υδραζίνης βασίζεται στην ελεγχόμενη οξείδωση
της αμμωνίας με υποχλωριώδη άλατα (αντιδράσεις 2 - 4). 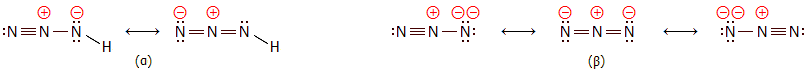



![]() 3LiOH
+ NH3).
'Ετσι τα αζίδια είναι άλατα μετάλλων με το ανιόν Ν3−,
ενώ τα νιτρίδια είναι άλατα μετάλλων με το (υποθετικό) ανιόν Ν3−.
3LiOH
+ NH3).
'Ετσι τα αζίδια είναι άλατα μετάλλων με το ανιόν Ν3−,
ενώ τα νιτρίδια είναι άλατα μετάλλων με το (υποθετικό) ανιόν Ν3−.![]() Pb(N3)2
+ 2NaNO3.
Pb(N3)2
+ 2NaNO3. ![]() Mg(N3)2
+ H2,
SiH4
+ 4HN3
Mg(N3)2
+ H2,
SiH4
+ 4HN3
![]() Si(N3)4,
Ga(CH3)3
+ 3HN3
Si(N3)4,
Ga(CH3)3
+ 3HN3
![]() Ga(N3)3
+
3
Ga(N3)3
+
3

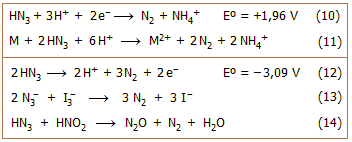 Οξειδοαναγωγικές ιδιότητες:
Το υδραζωτικό οξύ εμφανίζεται στις αντιδράσεις του και ως οξειδωτικό και ως
αναγωγικό αντιδραστρήριο.
Οξειδοαναγωγικές ιδιότητες:
Το υδραζωτικό οξύ εμφανίζεται στις αντιδράσεις του και ως οξειδωτικό και ως
αναγωγικό αντιδραστρήριο. Θερμικά
χαρακτηριστικά - Σταθερότητα υδραζωτικού οξέος και των αλάτων του: Το
υδραζωτικό οξύ διασπάται κατά εκρηκτικό τρόπο προς άζωτο και υδρογόνο εκλύοντας
μεγάλα ποσά θερμότητας (αντίδραση 15).
Θερμικά
χαρακτηριστικά - Σταθερότητα υδραζωτικού οξέος και των αλάτων του: Το
υδραζωτικό οξύ διασπάται κατά εκρηκτικό τρόπο προς άζωτο και υδρογόνο εκλύοντας
μεγάλα ποσά θερμότητας (αντίδραση 15).


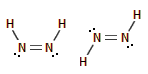
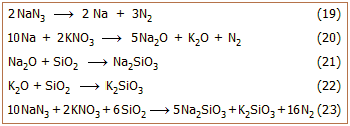 Αερόσακοι ασφαλείας
αυτοκινήτων:
Η εγκατάσταση αερόσακων στα αυτοκίνητα, ως σύστημα
παθητικής ασφάλειας (δηλ. αυτόματα ενεργοποιούμενο) γενικεύτηκε κατά τη δεκαετία
του 1990, αρχικά ως προσφερόμενο "έξτρα" και στη συνέχεια ως υποχρεωτικό σύστημα
σε κάθε αυτοκίνητο. Η ιδέα χρήσης του νατραζιδίου (σε μίγμα με μεταλλικά
οξείδια) για την ταχύτατη παραγωγή αερίου ανήκει στον Χημικό John Pietz, από το
1968
[
Αερόσακοι ασφαλείας
αυτοκινήτων:
Η εγκατάσταση αερόσακων στα αυτοκίνητα, ως σύστημα
παθητικής ασφάλειας (δηλ. αυτόματα ενεργοποιούμενο) γενικεύτηκε κατά τη δεκαετία
του 1990, αρχικά ως προσφερόμενο "έξτρα" και στη συνέχεια ως υποχρεωτικό σύστημα
σε κάθε αυτοκίνητο. Η ιδέα χρήσης του νατραζιδίου (σε μίγμα με μεταλλικά
οξείδια) για την ταχύτατη παραγωγή αερίου ανήκει στον Χημικό John Pietz, από το
1968
[





 Αζίδια στο εργασιακό
περιβάλλον: Τα ανώτερα όρια υδραζωτικού οξέος και των αλάτων του στο
εισπνεόμενο αέρα του εργασιακού περιβάλλοντος έχουν
ορισθεί στα 0,11 ppm (για το HN3)
ή 0,29 mg/m3 (ως NaN3). Θα πρέπει να σημειωθεί ότι η οσμή των ατμών του υδραζωτικού οξέος σε μικρές συγκεντρώσεις
δεν είναι τόσο έντονη, όσο θα χρειαζόταν για να γίνει αντιληπτή η παρουσία του
σε επικίνδυνες συγκεντρώσεις στον εισπνεόμενο αέρα. Αυτό σε αντίθεση π.χ. με το
υδρόθειο,
το οποίο αν και είναι τοξικότερο (τοξικότερο ακόμη και από το υδροκυάνιο) θεωρείται
λιγότερο επικίνδυνο, επειδή η εντονότατη οσμή του δρα προειδοποιητικά και αποτρέπει την
εισπνοή του σε επικίνδυνες συγκεντρώσεις
[
Αζίδια στο εργασιακό
περιβάλλον: Τα ανώτερα όρια υδραζωτικού οξέος και των αλάτων του στο
εισπνεόμενο αέρα του εργασιακού περιβάλλοντος έχουν
ορισθεί στα 0,11 ppm (για το HN3)
ή 0,29 mg/m3 (ως NaN3). Θα πρέπει να σημειωθεί ότι η οσμή των ατμών του υδραζωτικού οξέος σε μικρές συγκεντρώσεις
δεν είναι τόσο έντονη, όσο θα χρειαζόταν για να γίνει αντιληπτή η παρουσία του
σε επικίνδυνες συγκεντρώσεις στον εισπνεόμενο αέρα. Αυτό σε αντίθεση π.χ. με το
υδρόθειο,
το οποίο αν και είναι τοξικότερο (τοξικότερο ακόμη και από το υδροκυάνιο) θεωρείται
λιγότερο επικίνδυνο, επειδή η εντονότατη οσμή του δρα προειδοποιητικά και αποτρέπει την
εισπνοή του σε επικίνδυνες συγκεντρώσεις
[ Ο Betterton εκτιμά ότι στα
αυτοκίνητα που κυκλοφορούν στις ΗΠΑ βρίσκεται ποσότητα NaN3
που ξεπερνά τα 5 εκατομμύρια χιλιόγραμμα. Ακόμη, αναφέρεται σε μελέτες
του 1970 οι οποίες έδειξαν ότι συγκέντρωση NaN3
10 ppm στο έδαφος αλλοιώνει τους σπόρους πολλών φυτών, ενώ σε συγκεντρώσεις 200
ppm αποστειρώνει το χώμα σκοτώνοντας κάθε βακτηρίδιο και μύκητα
[
Ο Betterton εκτιμά ότι στα
αυτοκίνητα που κυκλοφορούν στις ΗΠΑ βρίσκεται ποσότητα NaN3
που ξεπερνά τα 5 εκατομμύρια χιλιόγραμμα. Ακόμη, αναφέρεται σε μελέτες
του 1970 οι οποίες έδειξαν ότι συγκέντρωση NaN3
10 ppm στο έδαφος αλλοιώνει τους σπόρους πολλών φυτών, ενώ σε συγκεντρώσεις 200
ppm αποστειρώνει το χώμα σκοτώνοντας κάθε βακτηρίδιο και μύκητα
[ Ως
σημαντικότερο ατύχημα στο οποίο εμπλέκεται το νατραζίδιο
αναφέρεται η ανατροπή ενός φορτηγού με φορτίο του άλατος (σε 50 βαρέλια των 44
γαλονιών), το οποίο προοριζόταν για την αυτοκινητοβιομηχανία
[
Ως
σημαντικότερο ατύχημα στο οποίο εμπλέκεται το νατραζίδιο
αναφέρεται η ανατροπή ενός φορτηγού με φορτίο του άλατος (σε 50 βαρέλια των 44
γαλονιών), το οποίο προοριζόταν για την αυτοκινητοβιομηχανία
[