Η χημική ένωση του μήνα
[Ιούνιος 2007]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής - Κωνσταντίνος Ευσταθίου, Καθηγητής
|
Φυσικoχημικές ιδιότητες: Εμφάνιση: λευκό στερεό σώμα Μοριακός τύπος: C8Ν8O16 Σχετική μοριακή μάζα: 464,13 Ειδικό βάρος (21ºC): 1,979* g/cm3 Σημείο τήξης (με εξάχνωση): 200ºC Σημείο αποσύνθεσης: >200ºC
* Πειραματική τιμή της μορφής που απομονώθηκε. Ωστόσο, η ένωση εμφανίζει πολυμορφισμό και εκτιμάται από κρυσταλλογραφικά δεδομένα ότι θα πρέπει να υπάρχει μορφή με πυκνότητα μεγαλύτερη από 2 g/cm3 [Αναφ. 13]. Η πυκνότητα έχει ιδιαίτερη σημασία στις εκρηκτικές ύλες, αφού όσο μεγαλύτερη είναι, τόσο μεγαλύτερη είναι η αποτελεσματικότητά τους. |
|
|
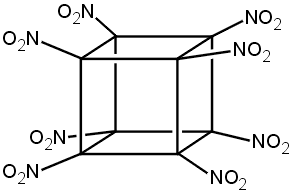
Οκτανιτροκυβάνιο
octanitrocubane (ONC) |
 Γενικά για το
οκτανιτροκυβάνιο
Γενικά για το
οκτανιτροκυβάνιο
Η σύνθεση του οκτανιτροκυβάνιου (octanitrocubane, ONC) στο Πανεπιστήμιο του Σικάγο από την ερευνητική ομάδα του Καθ. Philip Eaton θεωρήθηκε δικαιολογημένα σαν ένα από τα σημαντικότερα επιτεύγματα της Χημείας του έτους 2000. Ο λόγος είναι ότι η σύνθεση αυτή, επιστέγασμα επίμονων πολυετών ερευνών, αφορούσε ένωση για την οποία πολλοί πίστευαν ότι η σύνθεση ήταν θεωρητικά αδύνατη ή ότι, και αν ακόμη παρασκευαζόταν, θα ήταν μια εκρηκτική ουσία εξαιρετικά ασταθής και επομένως επικίνδυνη σε κάθε χειρισμό.
|
|
|
Ο Καθηγητής Philip Eaton (δεξιά) και ο ερευνητικός συνεργάτης του Mao-Xi Zhang (από την Αναφ. 12) |
Πράγματι η σύνθεση του ONC υπήρξε εξαιρετικά δύσκολη, πράγματι το ONC θεωρείται ως η ισχυρότερη μέχρι σήμερα γνωστή εκρηκτική ύλη, αλλά αντίθετα με τις προβλέψεις το ONC αποδείχθηκε εξαιρετικά σταθερό και ασφαλές και μάλιστα κατά πολύ ασφαλέστερο από τα σύγχρονα εκρηκτικά που ανήκουν στην οικογένεια των νιτραμινών, όπως είναι το RDX και το HMX.
Σημαντικός λόγος που συμβάλλει στην εξαιρετική εκρηκτική ισχύ του ONC είναι και το μεγάλο ενεργειακό περιεχόμενο του μητρικού υδρογονάνθρακα, του κυβανίου, λόγω της έντονης διάτασης των δεσμών άνθρακα, που βρίσκονται υπό γωνία C-C-C 90ο η οποία απέχει πολύ από την κανονικά προβλεπόμενη γωνία των 109,5ο.
Οργανικά μόρια με ισχυρότατη διάταση των δεσμών C-C
Για ένα πλήρη και κορεσμένο ανθρακικό δακτύλιο, με τον προβλεπόμενο υβριδισμό sp3, οι εσωτερικές γωνίες C-C-C θα έπρεπε να είναι 109,5ο (ιδανική κατάσταση). Ωστόσο, σε ένα επίπεδο δακτύλιο εκ των πραγμάτων οι εσωτερικές γωνίες C-C-C θα διαφέρουν από την ιδανική γωνία των 109,5ο, οπότε στο μόριο θα δημιουργηθεί διάταση ή παραμόρφωση (strain), δηλ. ένα "ζόρισμα".
'Oσο εντονότερη είναι η διάταση, τόσο μεγαλύτερη ενέργεια απαιτείται για τον σχηματισμό των αντίστοιχων δεσμών C-C και επομένως τόσο μεγαλύτερο θα είναι το ενεργειακό περιεχόμενο του μορίου. Η ενέργεια αυτή παραμένει αποθηκευμένη στο μόριο και θα αποδοθεί κατά την καθ'οιονδήποτε τρόπο ρήξη των δεσμών του (π.χ. κατά την καύση του).
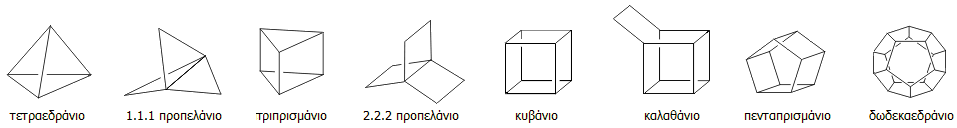
Ορισμένα τυπικά παραδείγματα οργανικών μορίων με ισχυρότατη διάταση (highly strained molecules) στις γωνίες C-C-C και οι χαρακτηριστικές (με βάση το σχήμα τους) ονομασίες τους δείχνονται παρακάτω. Πολλές από τις ενώσεις αυτές έχουν παρασκευαστεί και έχουν απομονωθεί ως έχουν ή ως παράγωγα.
Κυβάνιο: Ένα απλό αλλά απίθανο μόριο
Το κυβάνιο (cubane), με μοριακό τύπο C8H8, είναι το χαρακτηριστικότερο οργανικό μόριο με ισχυρότατη διάταση. Την πλήρη ισοτιμία των επιμέρους ατόμων C και Η επιβεβαιώνουν φασματοσκοπικά δεδομένα. Έτσι, το κυβάνιο παρουσιάζει απορρόφηση IR στα 3000 cm-1 που είναι η κλασική δόνηση του αλειφατικού δεσμού C-H, το φάσμα 1H-NMR παρουσιάζει μία μόνο κορυφή στα 4,0 ppm και το φάσμα 13C-NMR παρουσιάζει μία μόνο κορυφή στα 47,3 ppm. Τα χαρακτηριστικά αυτά δείχνουν ένα εξαιρετικά συμμετρικό μόριο, που είναι συγχρόνως και εξαιρετικά σταθερό παρά το γεγονός ότι όλοι οι δεσμοί του C-C υπόκεινται σε εξαιρετικά υψηλή διάταση. Φαίνεται ότι το κυβάνιο είναι ένα "αυτοπαγιδευμένο" μόριο ανίκανο να αναδιοργανώσει τους δεσμούς του με κάποιο συντονισμένο τρόπο [Αναφ. 1, 2].
Η ενέργεια διάτασης (strain energy) του κυβανίου έχει εκτιμηθεί στα 166 kcal/mol [Αναφ. 3α, 3β], επομένως η ενέργεια διάτασης ανά άτομο C είναι 20,8 kcal/mol, τιμή η οποία πρέπει να συγκριθεί με τις αντίστοιχες τιμές για το κυκλοπροπάνιο, κυκλοβουτάνιο και κυκλοπεντάνιο που είναι 9,2, 6,6 και 1,3 kcal/mol, αντίστοιχα [Αναφ. 3γ].
Η ύπαρξη του κυβανίου και επομένως η δυνατότητά του να παρασκευαστεί συνθετικά είχαν κατά το παρελθόν αμφισβητηθεί λόγω της θερμοδυναμικής αστάθειάς του. Ωστόσο, παρά τη θερμοδυναμική του αστάθεια, το κυβάνιο εμφανίζει κινητική σταθερότητα γεγονός το οποίο επέτρεψε την παρασκευή και την απομόνωσή του για πρώτη φορά από τους Philip E. Eaton [Αναφ. 4] και Thomas W. Cole ήδη από το 1964 στο Πανεπιστήμιο του Σικάγο [Αναφ. 5].
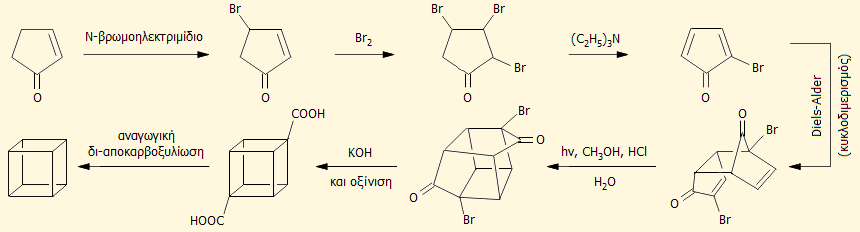
'Εχουν προταθεί αρκετές τροποποιήσεις της αρχικής συνθετικής μεθόδου και από αυτές μία από τις απλούστερες (με τα λιγότερα δυνατά ενδιάμεσα στάδια) αποδίδεται συνοπτικά από την παρακάτω αλληλουχία αντιδράσεων [Αναφ. 1]:
Το κυβάνιο είναι στερεός κρυσταλλικός υδρογονάνθρακας ειδικώς βαρύτερος από το νερό (γεγονός σπάνιο για τους υδρογονάνθρακες) και μάλιστα διαθέτει την υψηλότερη πυκνότητα (1,29 g/cm3) απ' όλους τους γνωστούς υδρογονάνθρακες, γεγονός το οποίο οφείλεται στο σχήμα του μορίου του που επιτρέπει ισχυρό "πακετάρισμα" σε συμπυκνωμένες φάσεις. Επίσης είναι χαρακτηριστικά περιορισμένη η περιοχή θερμοκρασιών που βρίσκεται σε υγρή φάση (σ.τ. 131οC, σ.β. 133οC), δηλ. ουσιαστικά δεν βράζει, αλλά εξαχνώνεται. Είναι ατοξική ουσία, σταθερή στο φως και στον αέρα και διασπάται σε θερμοκρασίες μεγαλύτερες από 220οC.
Το κυβάνιο, πέραν του ότι αποτελεί μόριο με μεγάλο ενεργειακό περιεχόμενο, διαπιστώθηκε ότι παρέχει παρέχει πολυμερείς αλυσίδες με ενδιαφέρουσες ηλεκτρικές και ηλεκτροοπτικές ιδιότητες και ενώσεις-παράγωγα με ισχυρή αντιική και γενικά φαρμακευτική δράση [Αναφ. 6-9]. Αναφέρεται ότι δύο εταιρείες, η Fluorochem (Καλιφόρνια) και η EniChem (Μιλάνο) παράγουν κυβάνιο και παράγωγά του (κυρίως το δικαρβοξυλικό του παράγωγο) σε ποσότητες χιλιογράμμων, παρ'όλα αυτά το κόστος του κυβανίου και των παραγώγων του είναι μεγάλο [Αναφ. 3β].
|
Πολλές πληροφορίες πάνω στη σύνθεση, δομή και χημικές ιδιότητες του κυβανίου και διάφορων παραγώγων του μπορούν να βρεθούν στο εξαιρετικά κατατοπιστικό άρθρο ανασκόπησης του Καθ. Philip Eaton με τίτλο: "Cubanes: Starting Materials for the Chemistry of the 1990s and the New Century", Angew. Chem. Int. Ed. Engl. 31: 1421 -1436, 1992 (PDF, 1,28 MB) |
Η σύνθεση του οκτανιτροκυβανίου μετά από προσπάθειες 20 χρόνων
Η σύνθεση του OCN παρουσίαζε μεγάλα τεχνικά προβλήματα. Οι πρώτες 4 νιτρο-ομάδες μπορούσαν να προστεθούν σχετικά εύκολα με επιδέξια αντικατάσταση άλλων ομάδων που ήδη είχαν προστεθεί στο κυβάνιο. Ωστόσο, η εισαγωγή κάθε επιπλέον νιτροομάδας προβλεπόταν ότι θα ήταν δύσκολη αφού θα έπρεπε να συνδεθεί με άνθρακα γειτονικό σε άλλο ήδη νιτρωμένο άνθρακα και επομένως θα έπρεπε να βρεθούν νέες μεθοδολογικές προσεγγίσεις και τακτικές.
Τελικά η σύνθεση επιτεύχθηκε από τον ίδιο ερευνητή που συνέθεσε το κυβάνιο, τον Καθ. Philip Eaton και τον συνεργάτη του Mao-Xi Zhang, ενώ ο Richard Gilardi πραγματοποίησε κρυσταλλογραφική μελέτη της δομής του. Η σχετική δημοσίευση έγινε το 2000 στο περιοδικό Angewandte Chemie International Edition [Αναφ. 10, 11].
Η παρακάτω αλληλουχία αντιδράσεων περιγράφει συνοπτικά τα στάδια παρασκευής του OCN ξεκινώντας από το τετρακαρβοξυλιωμένο παράγωγο του κυβανίου:
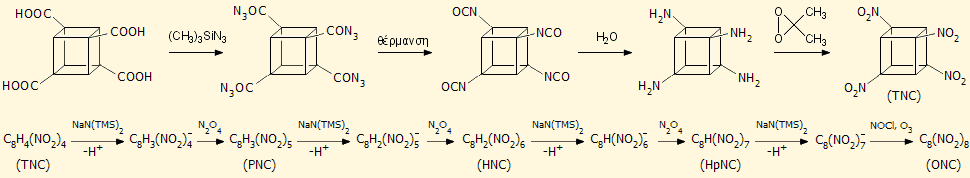
Οι καρβοξυλικές ομάδες αντικαθίστανται με νιτροομάδες και λαμβάνεται το τετρανιτροκυβάνιο (TNC). Στη συνέχεια ακολουθεί μια σειρά αντιδράσεων σε πολύ χαμηλές θερμοκρασίες πρώτα με την ισχυρή βάση NaN(TMS)2 [TMS: -Si(CH3)3] και Ν2Ο4, κατά τις οποίες το TNC παρέχει (στους -78οC) πεντανιτροκυβάνιο (PNC), στη συνέχεια (στους -125ºC) εξανιτροκυβάνιο (HNC), επτανιτροκυβάνιο (HpNC) και τελικά, με ένα ακόμη ισχυρότερο αντιδραστήριο νίτρωσης (NOCl + O3), το ζητούμενο οκτανιτροκυβάνιο (ONC). Ειδικά, η νίτρωση του HpNC προς το ONC υπήρξε το δυσκολότερο σημείο της σύνθεσης. Αξίζει να σημειωθεί ότι το HpNC θεωρείται ακόμη ισχυρότερο εκρηκτικό από το ONC.
Το ONC αποδείχθηκε ότι είναι ισχυρότατη εκρηκτική ύλη, έχει υψηλή πυκνότητα της τάξης των 2 g/cm3 και αποδείχθηκε εξαιρετικά ασφαλές στη μεταφορά και "αναίσθητο" στις κρούσεις (shock insensitive). Χαρακτηριστικά, ο Eaton αναφέρει ότι το ONC δεν εκρήγνυται ακόμη "και αν κτυπηθεί με σφυρί". Τήκεται περίπου στους 200ºC και συγχρόνως εξαχνώνεται χωρίς να εκραγεί [Αναφ. 12-14].
Με βάση θεωρητικούς υπολογισμούς εκτιμήθηκε ότι η διάσπαση ενός μορίου ONC σύμφωνα με την αντίδραση:
![]()
αποδίδει ενέργεια 761 kcal/mol [Αναφ. 5]. Ωστόσο, το ONC φαίνεται ότι είναι εξαιρετικά σταθερό και δεν υπόκειται σε αλλοιώσεις κατά την αποθήκευσή του, έτσι π.χ. δείγμα OCN σφραγισμένο σε γυάλινη αμπούλα παρέμεινε αναλλοίωτο για τουλάχιστον 14 μήνες. Τα τελευταία χρόνια έχουν γίνει διάφορες μελέτες των φυσικοχημικών χαρακτηριστικών και φασματοσκοπικών, θερμοδυναμικών και εκρηκτικών του ιδιοτήτων του οκτανιτροκυβανίου [Αναφ. 15-17].
|
"Το οκτανιτροκυβάνιο είναι ένα ωραίο μόριο λόγω της συμμετρίας της δομής του και της ενέργειας που περιέχει στους δεσμούς του. Επίσης, αποτελεί ένα θρίαμβο της συνθετικής χημείας, ο Phil Eaton και η ερευνητική του ομάδα ανέπτυξαν νέες μεθόδους σύνθεσης που θα είναι χρήσιμες για την παρασκευή νέων μορίων στο μέλλον" (David Oxtoby, Κοσμήτορας των Φυσικών Επιστημών, Πανεπιστήμιο του Σικάγο). |
Υπάρχει δυνατότητα παραγωγής οκτανιτροκυβανίου σε μεγάλη κλίμακα;
Η αλληλουχία των αντιδράσεων παρασκευής του κυβανίου και στη συνέχεια του ONC είναι αδύνατον να χρησιμοποιηθεί για την παραγωγή ONC σε μεγάλη κλίμακα. Για τον σκοπό αυτό θα πρέπει να αναζητηθούν άλλοι τρόποι σύνθεσης. Χαρακτηριστικά αναφέρεται ότι υπάρχει ένα ενδεχόμενο το ONC να μπορεί να παρασκευαστεί με πρώτη ύλη το ακετυλένιο. Με θεωρητικούς υπολογισμούς δείχθηκε ότι είναι θερμοδυναμικά εφικτός ο τετραμερισμός του δινιτροακετυλενίου προς οκτανιτροκυβάνιο σύμφωνα με την αντίδραση:
![]()
Ωστόσο, οι υπολογισμοί αυτοί δεν παρέχουν και πληροφορίες ως προς την κινητική του τετραμερισμού και επιπλέον το δινιτροακετυλένιο παραμένει μια άγνωστη ένωση, χωρίς όμως αυτό να σημαίνει ότι είναι αδύνατη η παρασκευή του [Αναφ. 13, 18].
Εκρηκτικές ύλες από την πυρίτιδα στο ΤΝΤ
 Από το 8ο αιώνα στην Κίνα
είχε εφευρεθεί η πυρίτιδα με ανάμιξη σκόνης νιτρικού καλίου, θείου και
ξυλάνθρακα. Από τότε όμως η χρήση εκρηκτικών ουσιών (για πολεμικούς σκοπούς),
αλλά κυρίως για την διάνοιξη σηράγγων, έργα οδοποιίας και
μεγάλης κλίμακας δομικά και τεχνικά έργα, έχει αλλάξει δραστικά. Οι νέες
εκρηκτικές ύλες είναι κυρίως ανακαλύψεις της χημείας και των ιδιοτήτων των
νιτρικών ενώσεων. Τα οξυγόνα που περιέχει η νιτρική ομάδα (ΝΟ2)
χρειάζονται για την πλήρη οξείδωση του άνθρακα και του υδρογόνου του μορίου προς
CO2 και
Η2Ο, ενώ το Ν ιδανικά μετατρέπεται Ν2. Στην πράξη (ανάλογα
με το περίσσευμα O) μπορεί να προκύψουν και μικρές
ποσότητες CO και οξειδίων του αζώτου. Σε κάθε περίπτωση
πραγματοποιείται μια ισχυρώς εξώθερμη ταχύτατη αντίδραση διάσπασης κατά την
οποία εκλύονται
θερμότατα αέρια σε εξαιρετικά μικρό χρονικό διάστημα. Στις
εκρήξεις, οι ταχύτητες των παραγόμενων αερίων και των προϊόντων καύσης
είναι 10.000 m/s, οι θερμοκρασίες φθάνουν και ίσως να ξεπερνούν τους
6.000ºC και οι
πιέσεις τα 300.000 bar με αποτέλεσμα να παράγεται ένα ισχυρότατο
ωστικό κύμα (shock wave).
Από το 8ο αιώνα στην Κίνα
είχε εφευρεθεί η πυρίτιδα με ανάμιξη σκόνης νιτρικού καλίου, θείου και
ξυλάνθρακα. Από τότε όμως η χρήση εκρηκτικών ουσιών (για πολεμικούς σκοπούς),
αλλά κυρίως για την διάνοιξη σηράγγων, έργα οδοποιίας και
μεγάλης κλίμακας δομικά και τεχνικά έργα, έχει αλλάξει δραστικά. Οι νέες
εκρηκτικές ύλες είναι κυρίως ανακαλύψεις της χημείας και των ιδιοτήτων των
νιτρικών ενώσεων. Τα οξυγόνα που περιέχει η νιτρική ομάδα (ΝΟ2)
χρειάζονται για την πλήρη οξείδωση του άνθρακα και του υδρογόνου του μορίου προς
CO2 και
Η2Ο, ενώ το Ν ιδανικά μετατρέπεται Ν2. Στην πράξη (ανάλογα
με το περίσσευμα O) μπορεί να προκύψουν και μικρές
ποσότητες CO και οξειδίων του αζώτου. Σε κάθε περίπτωση
πραγματοποιείται μια ισχυρώς εξώθερμη ταχύτατη αντίδραση διάσπασης κατά την
οποία εκλύονται
θερμότατα αέρια σε εξαιρετικά μικρό χρονικό διάστημα. Στις
εκρήξεις, οι ταχύτητες των παραγόμενων αερίων και των προϊόντων καύσης
είναι 10.000 m/s, οι θερμοκρασίες φθάνουν και ίσως να ξεπερνούν τους
6.000ºC και οι
πιέσεις τα 300.000 bar με αποτέλεσμα να παράγεται ένα ισχυρότατο
ωστικό κύμα (shock wave).
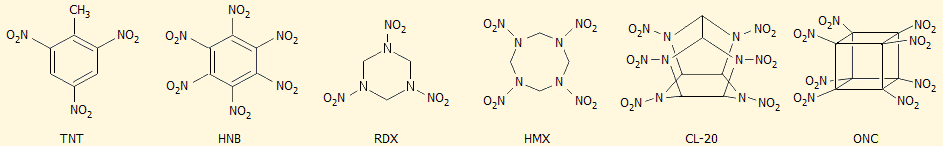
Το ΤΝΤ (τρινιτροτολουόλιο) υπήρξε μία από τις πρώτες επιτυχημένες εκρηκτικές ύλες με εξαιρετικές ιδιότητες κυρίως σε ό,τι αφορά την ασφαλή χρήση του. Από τότε έχουν παρασκευασθεί και άλλες νιτρο-ενώσεις που χρησιμοποιούνται ως εκρηκτικές ύλες, όπως τα RDX, HMX (octogen, state-of the-art military explosive), HNB, CL-20.
Ανάλογα με τον τρόπο σύνδεσης του αζώτου με το υπόλοιπο μόριο τα εκρηκτικά αυτά διακρίνονται στις ακόλουθες τέσσερις κατηγορίες κατά σειρά μειούμενης ενέργειας διάστασης δεσμού και επομένως μειούμενης σταθερότητας:
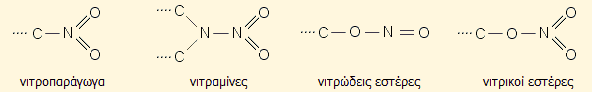
1) Νιτροπαράγωγα με κύριο εκπρόσωπο το TNT. Είναι τα ανθεκτικότερα σε κρούση εκρηκτικά και θεωρούνται "βράχοι" σταθερότητας σε σχέση με τους νιτρικούς εστέρες.
2) Νιτραμίνες, με κυριότερους εκπρόσωπους τα RDX (κυκλωνίτης) και HMX. Αποτελούν τα πλέον σύγχρονα εκρηκτικά.
3) Νιτρώδεις εστέρες. Η χρήση εκρηκτικών αυτής της κατηγορίας είναι περιορισμένη.
4) Νιτρικοί εστέρες, με κυριότερο εκπρόσωπο τη νιτρογλυκερίνη. Είναι τα πλέον ευαίσθητα και ασταθέστερα εκρηκτικά.
Τα χαρακτηριστικά των ορισμένων από τις σύγχρονες εκρηκτικές ύλες σε σχέση με εκείνα του ONC δίνονται στον επόμενο πίνακα.
Σύγκριση των χαρακτηριστικών των κυριότερων εκρηκτικών με το οκτανιτροκυβάνιο [κυρίως από την Αναφ. 3β]
|
Βραχυγραφία |
'Αλλες ονομασίες / Χημική ονομασία |
Πυκνότητα, g cm-3 (α) |
Ισοζύγιο οξυγόνου (β) |
Ταχύτητα έκρηξης, m s-1 (γ) |
Πίεση έκρηξης, kbar |
Σχετική αποτελεσματικότητα (δ) |
|---|---|---|---|---|---|---|
|
ΤΝΤ |
τρινιτροτολουόλιο, τροτύλη |
1,65 |
-74 |
7000 |
190 |
1 |
|
RDX |
κυκλωνίτης, εξαγόνο, Τ4 / κυκλοτριμεθυλενοτρινιτραμίνη |
1,82 |
-22 |
8800 |
338 |
1,60 |
|
HMX |
οκταγόνο / κυκλοτετραμεθυλενοτετρανιτραμίνη |
1,91 |
-22 |
9100 |
390 |
1,70 |
|
HNB |
1,2,3,4,5,6-εξανιτροβενζόλιο |
1,98 |
0 |
9340 |
406 |
- |
|
CL-20 |
HNIW / 2,4,6,8,10,12-εξανιτρο- 2,4,6,8,10,12-εξααζαϊσοβουρτσιτάνιο |
2,03 |
-11 |
9400 |
420 |
2,04 |
|
ONC |
οκτανιτροκυβάνιο |
2-2,1 |
0 |
10100 |
500 |
2,7 |
|
(α) Η πυκνότητα αποτελεί κρίσιμο χαρακτηριστικό για ένα εκρηκτικό. Ή αποτελεσματικότητα ενός εκρηκτικού αυξάνεται σημαντικά, όσο μεγαλύτερη είναι η πυκνότητά του. (β) Το ισοζύγιο οξυγόνου (oxygen balance, OB) είναι ενδεικτικό μέγεθος του κατά πόσο το οξυγόνο που περιέχει το μόριο ενός εκρηκτικού επαρκεί για την πλήρη οξείδωση του δικού του άνθρακα, υδρογόνου και τυχόν μετάλλων σε CO2, Η2Ο και μεταλλοξείδια (ΜΟ), αντίστοιχα. Εάν περιέχει όσο ακριβώς οξυγόνο χρειάζεται, τότε το εκρηκτικό έχει OB = 0, εάν έχει περισσότερο από το απαιτούμενο τότε θα είναι OB > 0, ενώ αν απαιτεί επιπλέον οξυγόνο για την πλήρη οξείδωση τότε θα είναι ΟΒ < 0. Παρέχεται από την εξίσωση: OB = -(1600/MB) ( 2Χ + Υ/2 + Μ - Ζ ), όπου ΜΒ: το μοριακό βάρος της ένωσης, Χ: αριθμός ατόμων C, Y: αριθμός ατόμων Η, Μ: αριθμός ατόμων μετάλλου και Ζ αριθμός ατόμων οξυγόνου ανά μόριο εκρηκτικού. (γ) Η ταχύτητα της έκρηξης (velocity of explosion, VOE) είναι η ταχύτητα με την οποία το κύμα της έκρηξης κινείται μέσω του εκρηκτικού και συνδέεται με την ταχύτητα της χημικής αντίδρασης. Τυπικές τιμές για αέρια εκρηκτικά μίγματα είναι 1800 έως 3000 m/s, ενώ για στερεά εκρηκτικά είναι από 6000 έως 10000 m/s. (δ) H σχετική αποτελεσματικότητα (relative effectiveness factor, RE factor) αποτελεί συγκριτικό μέτρο της ισχύος ενός εκρηκτικού σε σχέση με εκείνη του TNT σε όρους μάζας. Έτσι, π.χ. εάν το επιθυμητό αποτέλεσμα (π.χ. ένας εκβραχισμός) απαιτεί 1 kg ΤΝΤ, το ίδιο αποτέλεσμα θα παρείχε ποσότητα 1 kg/2,7 = 0,37 kg OCN. |
|
Χρήσιμες πληροφορίες από το Διαδίκτυο: Από την ιστοσελίδα αυτή της Royal Society of Chemistry μπορεί κάθε ενδιαφερόμενος να "κατεβάσει" το "Introduction to Explosives", ένα PDF αρχείο (1,18 ΜΒ), το οποίο περιέχει χρήσιμες πληροφορίες για την ιστορική εξέλιξη, την παραγωγή και τα κύρια χαρακτηριστικά των σπουδαιότερων εκρηκτικών υλών (από την πυρίτιδα μέχρι και το οκτανιτροκυβάνιο). Στην ιστοσελίδα αυτή (επίσης της Royal Society of Chemistry) μπορείτε να βρείτε μαθηματικές εξισώσεις που συνδέουν την πυκνότητα και διάφορα άλλα φυσικοχημικά χαρακτηριστικά μιας εκρηκτικής ουσίας με την ταχύτητα και την πίεση έκρηξης. |
Πηγές από τη βιβλιογραφία και το διαδίκτυο
1. Eaton PE, Cole TW Jr: "The cubane system", J. Am. Chem. Soc. 86: 962-963, 1964 (PDF, 389 KB).
2. Griffin GW, Marchand AP: "Synthesis and chemistry of cubanes", Chem. Rev. 89: 997-1010, 1989 (PDF, 2458 KB).
3. (α) University of Oxford, Department of Chemistry: "Highly strained molecules: Cubane". (β) University of Bristol: "Cubane: A highly strained ring system". (γ) Wiberg KW: "Cyclobutane - physical properties and theoretical studies", στο "The chemistry of cyclobutanes(Patai series: The chemistry of functional groups)", (Rapport Z, Liebman JF Eds.), John Wiley and Sons Ltd , 2005 (PDF 162 KB).
4. University of Chicago: Phillip E. Eaton (homepage).
5. Eaton PE, Cole TW: "Cubane", J. Am. Chem. Soc. 86(15): 3157-3158, 1964 (PDF, 228 KB).
6. Valencia F, Romero AH, Kiwi M, Ramírez R, Toro-Labbe A: "Polycubanes linked with C2, N2, NO, and NS: From insulating to metallic behavior", Phys. Rev. B71: 033410, 2005 (PDF, 296 KB).
7. Royal Society of Chemistry, 2004: "High energy derivatives of cubane: Application of cubane derivatives".
8. Borman S: "Military research on cubane explosives may also lead to new pharmaceuticals", Chem. Eng. News 72: 34 (Nov. 28), 1994.
9. Richardson SL, Martins: "Ab-initio studies of the structural and electronic properties of solid cubane", Physical Review B, 58:15307 - 15309, 1998. (Abstract)
10. (α) Zhang M-X, Eaton PE, Gilardi R: "Hepta- and Octanitrocubanes", Angewandte Chemie International Edition 39(2): 401-404, 2000 (Abstract). (β) Angewandte Chemie International Edition (Press-Releases, 2000): "Explosive Cube: Synthesis of octanitrocubane is successful/ Is a new class of explosives in sight?".
11. University of Chicago, News Office, Koppes S: "Octanitrocubane: Easier said than done".
12. The University of Chicago Chronicle, Koppes S: "Eaton's creation of octanitrocubane called 'a triumph of synthetic chemistry'".
13. Eaton PE, Zhang M-X, Gilardi R, Gelber N, Iyer S, Surapaneni R: "Octanitrocubane: A new nitrocarbon", Propellants, Explosives, Pyrotechnics, 27: 1-6, 2002 (PDF, 107 KB)
14. U.S. Naval Research Laboratory: "Analyzing the properties of the highly energetic molecule octanitrocubane".
15. Zhang Ji, Xiao H: "Computational studies on the infrared vibrational spectra, thermodynamic properties, detonation properties and pyrolysis mechanism of octanitrocubane", J. Chem. Phys. 11:10674-10677, 2002 [Abstract].
16. Gilardi R, Butcher RJ: "The structure of nitrocubane: the last in the series of nitrocubanes", J. Chem. Crystallography 33: 281-285, 2004 [Abstract].
17. Kortus J, et al.: "Density functional-based prediction of the electronic, structural, and vibrational properties of the energetic molecule: octanitrocubane", Chem. Phys. Lett. 322: 224-228, 2000.
18. Politzer P, Lane P, Wiener JJM in "Carbocyclic and heterocyclic cage compounds and their building blocks", Laali K (ed.), JAI Press, Stamford, CN, 1999 p.73-85.
|
Αποποίηση ευθυνών: Έχει καταβληθεί κάθε προσπάθεια για να εξασφαλισθεί η ορθότητα των πληροφοριών που περιλαμβάνονται σε αυτή τη σελίδα, ωστόσο ο έχων την επιμέλεια της σελίδας αυτής και το Τμήμα Χημείας δεν αναλαμβάνουν τη νομική ευθύνη για τυχόν σφάλματα, παραλείψεις ή ανακριβείς πληροφορίες. Επιπλέον, το Τμήμα Χημείας δεν εγγυάται την ορθότητα των αναφερόμενων σε εξωτερικές ιστοσελίδες, ούτε η αναφορά μέσω συνδέσμων (links) στις ιστοσελίδες αυτές, υποδηλώνει ότι το Τμήμα Χημείας επικυρώνει ή καθ' οιονδήποτε τρόπο αποδέχεται το περιεχόμενό τους. |