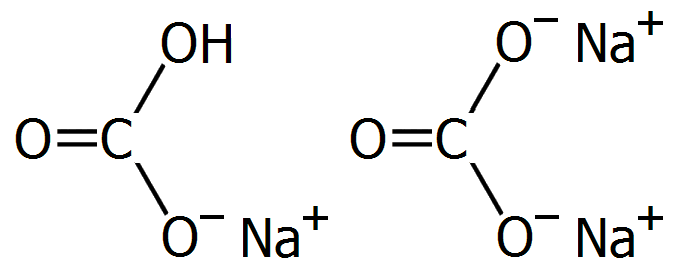Γενικά για το όξινο ανθρακικό νάτριο και το ανθρακικό νάτριο [Αναφ. 1]
|
Σύμβολα του ανθρακικού νατρίου (αριστερά) και του ανθρακικού καλίου (δεξιά) κατά τον Dalton. Δηλώνονται ως άμεση ένωση του μετάλλου (κάτω κύκλος) με το CO2 (πάνω τρεις κύκλοι) [πηγή]. |
Το όξινο ανθρακικό νάτριο (sodium hydrogen carbonate) και το ανθρακικό νάτριο (sodium carbonate) είναι άλατα του ανθρακικού οξέος με νάτριο και χημικές ουσίες. Διαλυόμενα στο νερό το πρώτο παρέχουν ασθενώς και ισχυρώς αλκαλικά διαλύματα, αντιστολιχως.
Το όξινο ανθρακικό νάτριο μπορεί να βρεθεί στην ελληνική βιβλιογραφία με την πλέον έγκυρη ονομασία (σύμφωνη με την IUPAC) υδρογονανθρακικό νάτριο ή με την παλαιά ονομασία διττανθρακικό νάτριο (sodium bicarbonate) ή ακόμη με τις ευρύτατα ακόμη χρησιμοποιούμενες εμπειρικές ονομασίες, όπως μαγειρική ή φαρμακευτική σόδα.
[Σημείωση: Το πρόθεμα διττ- (από το διττός: διπλός) (bi- ή bis- στις λατινογενείς ονομασίες) στο διττανθρακικό νάτριο προέρχεται από ένα απαρχαιωμένο σύστημα ονοματολογίας και βασίζεται στην παρατήρηση ότι στο NaHCO3 υπάρχει διπλάσια ποσότητα ανθρακικών ως προς την ίδια ποσότητα νατρίου σε σχέση με το Na2CO3. Για τους ίδιους λόγους το πρόθεμα αυτό συνηθίζεται ακόμη να αναφέρεται σε πολλά όξινα άλατα, π.χ. sodium bisulfite (NaHSO3), potassium bisulfate (KHSO4)]
 |
 |
|
Επεξεργασία του νάτρου και χρήση στη διαδικασία της ταρίχευσης των νεκρών στην αρχαία Αίγυπτο [πηγή1]. Σχεδόν 250 kg νάτρου χρειάζονταν για μια ταρίχευση [πηγή2]. |
|
Το ανθρακικό νάτριο συναντάται με τις εμπειρικές ονομασίες σόδα και ως σόδα πλύσης (washing soda). Διαλυόμενο στο νερό παρέχει ισχυρώς αλκαλικό διάλυμα ως άλας προερχόμενο από ισχυρή βάση (NaΟΗ) και ασθενές οξύ (Η2CΟ3). Στην αγγλική γλώσσα, η συνήθης εμπορική ονομασία του άνυδρου ανθρακικού νατρίου είναι soda ash (τέφρα σόδας), ονομασία προερχόμενη από τον παλαιό τρόπο παραγωγής του από την τέφρα φυτικών υλών.
Ως πρόσθετα τροφίμων τα ανθρακικά άλατα του νατρίου (όξινο, ουδέτερο, μίγμα τους) προσδιορίζονται με τον κωδικό Ε500 (ρυθμιστές οξύτητας, αντισυσσωματικοί παράγοντες).
Τα ανθρακικά άλατα του νατρίου ήταν γνωστά από τα αρχαία χρόνια, ως φυσικά υλικά που συναντούνται σε άφθονες ποσότητες σε ξηρές λίμνες σε ερημικές περιοχές. Τα χρησιμοποιούσαν ως καθαριστικό μέσα (ως διαλυτικό των λιπών), στην παρασκευή σαπώνων, στην επεξεργασία (καθαρισμός, βαφή) υφασμάτων, όπως και στην πρώιμη υαλουργία. Επιπλέον, οι αρχαίοι Αιγύπτιοι χρησιμοποιούσαν το ανθρακικό νάτριο στις διαδικασίες ταρίχευσης των νεκρών τους. Χαρακτηριστικά, αναφέρεται πως για μια τυπική διαδικασία ταρίχευσης χρειάζονταν μέχρι και 250 kg του αλκαλικού ορυκτού νάτρο (κυρίως Na2CO3·10H2O).
Σήμερα, η ετήσια παραγωγή και κατανάλωση όξινου ανθρακικού και ανθρακικού νατρίου ξεπερνάει τα 50 εκατομμύρια τόνων. Η κατανάλωση των αλάτων αυτών αποτελούσε και συνεχίζει να αποτελεί δείκτη ανάπτυξης της χημικής βιομηχανίας μιας χώρας, αφού αυτά χρησιμοποιούνται ως πρώτη ύλη σε πλήθος βιομηχανικών και άλλων διεργασιών (υαλουργία, υφαντουργία, σαπωνοποιία και βιομηχανία απορρυπαντικών, βιομηχανία τροφίμων, βιομηχανία πετρελαιοειδών, φαρμακευτική βιομηχανία κ.α.).
|
Λίμνη Natron στη βόρεια Τανζανία. Η περιεκτικότητά της σε Na2CO3 εξασφαλίζει μια αλκαλικότητα που μπορεί να φθάσει το pH 12. Η αλκαλικότητα αυτή σε συνδυασμό με τη μεγάλη περιεκτικότητα σε άλλα άλατα και την υψηλή θερμοκρασία των υδάτων της (60ºC) "απολιθώνουν" κάθε πτηνό που θα είχε την ατυχία να πέσει στη νερά της [πηγή]. |
Αν και τα ανθρακικά άλατα του νατρίου είναι ουσίες που απαντούν σε τεράστιες ποσότητες στη φύση ως ορυκτά (νάτρο, τρόνα), τα κοιτάσματά τους κατά κανόνα βρίσκονται σε δυσπρόσιτες και άνυδρες περιοχές του κόσμου. Το γεγονός αυτό έδωσε ώθηση στην αναζήτηση φθηνών βιομηχανικών μεθόδων παρασκευής τους, από κοινές χημικές ύλες, όπως το αλάτι (NaCl). Η ιστορία της ανάπτυξης και της εξέλιξης των μεθόδων παρασκευής ανθρακικού και όξινου ανθρακικού νατρίου είναι εξαιρετικώς ενδιαφέρουσα και αποτελεί σταθμό στην ιστορία της χημικής βιομηχανίας.
Ανθρακικά άλατα νατρίου στη φύση. Στη φύση υπάρχουν τεράστιες ποσότητες ανθρακικού και όξινου ανθρακικού νατρίου, κυρίως με τη μορφή των δύο συγγενών ορυκτών: του τρόνα και του νάτρου. Το τρόνα (trona) ως κύριο συστατικό έχει το μικτό ουδέτερο και όξινο ανθρακικό νάτριο, Na2CO3·NaHCO3·2H2O, ενώ το νάτρο (natron) ως κύριο συστατικό έχει το δεκαϋδρικό ανθρακικό νάτριο, Na2CO3·10H2O.
Εκτεταμένα κοιτάσματα τρόνα συναντώνται σε πολλές ερημικές και άνυδρες περιοχές του κόσμου. Τα άλατα αυτά βρίσκονται συνήθως σε μίγμα με αντίστοιχα θειικά, βορικά και αλογονούχα άλατα. Οι περιοχές αυτές αποτελούσαν κοίτες αρχέγονων αλκαλικών λιμνών (alkaline ή soda lakes), οι οποίες σταδιακά αποξηράνθηκαν αφήνοντας αυτά άλατα που συλλογικώς είναι γνωστά ως "εβαπορίτες".
Το νάτρο βρίσκεται συνήθως διαλυμένο σε αλκαλικές λίμνες και ως στερεό υπό τη μορφή εξανθήσεων στις όχθες τους. Από τις πλέον γνωστές αλκαλικές λίμνες είναι λίμνη Natron στη βόρεια Τανζανία στα σύνορα με την Κένυα, όπως και η λίμνη Mono στην Καλιφόρνια, το pH των οποίων κατά τόπους κυμαίνεται στην περιοχή 9 έως (ακόμη) και 12. Oι λίμνες αυτές συχνά χαρακτηρίζονται ως "νεκρές", ωστόσο αποτελούν τον βιότοπο ιδιότυπων οργανισμών (βακτήρια) οι οποίοι έχουν προσαρμοσθεί στις συνθήκες υψηλής αλατότητας και αλκαλικότητας, όπως και στη μικρή περιεκτικότητά τους σε οξυγόνο.
Περιοχές με άφθονες ποσότητες ορυκτών τρόνα και νάτρου σε ερημικές περιοχές των ΗΠΑ, στην κοιλάδα του Νείλου στην Αίγυπτο, στο Σουδάν, στις ερήμους της Ναμίμπια και της Κένυας, αλλά και σε ερήμους κοντά στην 'Αγκυρα της Τουρκίας. Ανάλογο, αλλά σχετικώς σπανιότερο ορυκτό αποτελούμενο από σχεδόν καθαρό NaHCO3, είναι ο ναχκολίτης (ή θερμοκαλίτης) που ακολουθεί το τρόνα, αλλά συναντάται και σε σχηματισμούς από λάβα (Βεζούβιος, Ιταλία). Μεγάλα κοιτάσματα ναχκολίτη αξιοποιούνται στις ΗΠΑ.
|
Προέλευση της ονομασίας των ορυκτών [Αναφ. 2α] Στη Βόρεια Αφρική, νότια της Τρίπολης υπάρχουν τεράστιες αποθέσεις του διπλού άλατος Na2CO3·NaHCO3·2H2O. Οι αρχαίοι Αιγύπτιοι, όπως και οι Ισραηλίτες τα γνώριζαν και τα αποκαλούσαν nether. Σύμφωνα με την Encyclopedia Biblica το υλικό αυτό οι Ακκάδιοι (γνωστοί και ως Ασσυριοβαβυλώνιοι, ένας αρχαίος σημιτικός λαός) το αποκαλούσαν neteru, οι Αιγύπτιοι nitri, οι Έλληνες νίτρον και οι Ρωμαίοι nitrum. Αργότερα, οι 'Aραβες το ονόμασαν natron, που συντομεύτηκε σε tron και αργότερα trona. 'Ολα τα διαφορετικά ονόματα είναι παραλλαγές του αιγυπτιακού ονόματος που σημαίνει "καθαρός", "πραγματικός". Να σημειωθεί ότι η απόδοση της ίδιας ονομασίας (νίτρον) στο νιτρικό νάτριο είναι κατά πολύ μεταγενέστερη [Αναφ. 2δ]. Είναι προφανές ότι από την ίδια ρίζα προέρχεται και η ονομασία του στοιχείου νατρίου. Οι αρχαίοι Αιγύπτιοι πραγματοποιούσαν εξαγωγές του υλικού αυτού σε πολλές χώρες. Οι πιστοί το χρησιμοποιούσαν για να καθαρίζουν το στόμα τους μασώντας το υγρό και ως συστατικό σε θυμιαμάτα και ως υλικό στις διαδικασίες μουμιοποίησης. Η λέξη nether εμφανίζεται δύο φορές στη Βίβλο σε σχέση με διαδικασίες κάθαρσης. |
 |
 |
|
Αριστερά Η περιοχή Wadi El Natrun (Κοιλάδα Νάτρου) στην επαρχία Beheira (Βόρεια Αίγυπτος). Μια περιοχή με οκτώ ξηρές λίμνες με τεράστιες ποσότητες νάτρου [πηγή]. Δεξιά: Πεδία με πυραμιδοειδείς σχηματισμούς τρόνα, κοντά στην περιοχή Trona (πυθμένας ξηρής λίμνης) και πάχος κοιτάσματος περίπου 1,5 m, στην έρημο Mojave στην Καλιφόρνια. Εκτός από ανθρακικά άλατα υπάρχει αφθονία άλλων αλάτων (θειικών, βορικών) του νατρίου, αλλά και καλίου [πηγή]). |
|
 |
 |
 |
 |
|
Από αριστερά προς τα δεξιά: (1) και (2) Δείγματα ακάθαρτου και καθαρού κρυσταλλικού τρόνα (μικτό ανθρακικό - όξινο ανθρακικό νάτριο με μέση σύνθεση Na2CO3·NaHCO3·2H2O). (3) Νάτρο (σχεδόν καθαρό Na2CO3·10H2O). (4) Ναχκολίτης (σπάνιο ορυκτό, σχεδόν καθαρό NaHCO3). |
|||
|
Ανθρακικά άλατα αλκαλίων από φυσικές πηγές [Αναφ. 2]
Με την έναρξη της βιομηχανικής επανάστασης, κατά τον 18ο αιώνα αυξήθηκε η ζήτηση των διαλυτών ανθρακικών αλάτων, αφού ήταν οι μόνες φθηνές ισχυρώς αλκαλικές ουσίες που διέθεταν εκείνη την εποχή. Οι ουσίες αυτές γνωστές με το γενικό όνομα "άλκαλι". Το αν τα άλατα αυτά ήταν άλατα νατρίου ή καλίου, στις περισσότερες περιπτώσεις δεν είχε ιδιαίτερη σημασία. Ιδιαίτερα μεγάλες ποσότητές διαλυτών ανθρακικών αλάτων απαιτούσαν βιομηχανίες όπως η σαπωνοποιία, η υφαντουργία και η υαλουργία. Ουσιαστικά, μόνη πηγή διαλυτών ανθρακικών αλάτων ήταν η τέφρα φυτικών υλικών (φυτική σόδα). Οι εισαγωγές τέφρας δέντρων γίνονταν κυρίως από τη Ρωσία, τις Σκανδιναβικές χώρες, τη Βόρεια Αμερική και την Ισπανία. Το καλύτερο "άλκαλι" ήταν το ορυκτό τρόνα που ερχόταν από την Αίγυπτο (ορυκτή σόδα), αλλά ήταν πανάκριβο. Η αξιοποίηση των τεράστιων αποθεμάτων ορυκτών ανθρακικών αλάτων του νατρίου (νάτρο, τρόνα) ήταν ουσιαστικά αδύνατη, λόγω του μεγάλου κόστους μεταφοράς τους από τις δυσπρόσιτες ερημικές περιοχές της Αφρικής και της Αμερικής. Η τέφρα από διάφορα δέντρα περιέχει περίπου 10% K2CO3, ενώ η τέφρα από διάφορα φύκια, αλλά και φυτά που φύονται σε αλμυρά παραθαλάσσια εδάφη (αλόφυτα: φυτά ανθεκτικά στο αλάτι) είναι ιδιαίτερα πλούσια σε Na2CO3. Υπενθυμίζεται ότι η ονομασία "ποτάσα" (κοινή ονομασία του K2CO3), προέρχεται από τον συνδυασμό των αγγλικών λέξεων pot + ash (πήλινο δοχείο + τέφρα).
Χαρακτηριστική είναι η περίπτωση της σαλικόρνιας (Salicornia europaea) ενός θαμνοειδούς αλόφυτου που αφθονεί στις παραλίες της Μεσογείου, το οποίο είναι γνωστό και ως "αλμυρίδι" ή "θαλασσόχορτο" . Η τέφρα της σαλικόρνιας περιέχει 25 έως 30% Na2CO3. Η κοινή αγγλική ονομασία της σαλικόρνιας είναι glasswort (ελληνική απόδοση: "γυαλόχορτο"), επειδή την τέφρα της χρησιμοποιούσαν ήδη από τον 16ο αιώνα για την παρασκευή γυαλιού. Ο μεγάλος Ρωμαίος φυσιοδίφης Πλίνιος ο Πρεσβύτερος (23-79 μ.Χ.) αναφέρει στο έργο του "Naturalis Historia" ότι Φοίνικες έμποροι και ναυτικοί ανακάλυψαν τυχαία την ύαλο όταν χρησιμοποίησαν όγκους από το φορτίο τρόνα που μετέφεραν, σαν στήριγμα για να ετοιμάσουν το φαγητό τους σε μια αμμώδη παραλία. Εκεί είδαν να σχηματίζονται ένα ρευστό διάφανο υλικό προϊόν της ισχυρής θέρμανσης μίγματος της άμμου και του ανθρακικού νατρίου (nitre). 'Αλλη εκδοχή είναι ότι χρησιμοποίησαν αλόφυτα για να ανάψουν τη φωτιά και αναμίχθηκε η πλούσια σε Na2CO3 τέφρα τους με την άμμο σχηματίζοντας υαλώματα στη θερμοκρασία της φωτιάς. Τα αρχαιότερα υάλινα αντικείμενα που έχουν βρεθεί χρονολογούνται περί το 2.500 π.Χ. (υάλινες χάντρες στην περιοχή της Μεσοποταμίας) [Αναφ. 2δ]. Μεγάλες ποσότητες αλκαλικής τέφρας σαλικόρνιας εισάγονταν κυρίως από την Ισπανία και τις Κανάριες νήσους. Το προϊόν αυτό ήταν γνωστό με το ισπανικό όνομα της σαλικόρνιας barilla, η χρήση του οποίου στην υαλουργία αναφέρεται ήδη από τον 12ο αιώνα. Χαρακτηριστικό είναι το ότι οι εξαγωγές barilla ήταν τόσο προσοδοφόρες για την οικονομία της Ισπανίας, ώστε η λαθραία εξαγωγή σπόρων αυτού του αλόφυτου συνιστούσε κακούργημα που επέσυρε την ποινή του θανάτου. Αναφέρεται ότι ήταν τόσο μεγάλη η ζήτηση σόδας τέφρας από τη βιομηχανία της Μ. Βρετανίας κατά τον 18ο αιώνα και τις αρχές του 19ου αιώνα, ώστε στις παραλίες της Σκωτίας και στα νησιά της κάθε καλοκαίρι περί τις εκατό χιλιάδες εργάτες συνέλεγαν μέχρι και 25.000 τόνους τέφρας φυκιών, αφήνοντας κατά μέρος άλλες λιγότερο επικερδείς αγροτικές εργασίες. Σήμερα, στις Ηνωμένες Πολιτείες, το μεγαλύτερο μέρος (90%) της ζήτησης ανθρακικού νατρίου καλύπτεται από το ορυκτό τρόνα, το οποίο κατά περίπου 90% αποτελείται από το μικτό ανθρακικό-όξινο ανθρακικό νάτριο με χημικό τύπο: Na3(HCO3)(CO3)·2H2O (ή Na2CO3·NaHCO3·2H2O). Μεγάλη εκμετάλλευση πραγματοποιείται στα κοιτάσματα τρόνα της περιοχής Green River στην πολιτεία Wyoming. Τα κοιτάσματα αυτά θεωρούνται ως τα μεγαλύτερα του κόσμου και η ποσότητά τους εκτιμάται στα 127 δισεκατομμύρια τόνους από τους οποίους τα 40 δισεκατομμύρια είναι εκμεταλλεύσιμα (επαρκή για τα επόμενα 2500 χρόνια!). Το ορυκτό εξορύσσεται, συντρίβεται και θερμαίνεται σε περιστροφικές καμίνους (kilns) οπότε διασπάται σύμφωνα με την αντίδραση:
Na3(HCO3)(CO3)·2H2O
Στη συνέχεια διαλύεται στο νερό, απαλλάσσεται από τα αδιάλυτα υλικά, όποτε κρυσταλλώνεται το ανθρακικό νάτριο ως μονοϋδρικό άλας (Na2CO3·H2O) το οποίο με θέρμανση παρέχει το καθαρό Na2CO3. Το 2006, η παραγωγή είχε φθάσει τους 16 εκατομμύρια τόνους, που αντιπροσώπευε στο 95% της παραγωγής των ΗΠΑ και το 36% της παγκόσμιας παραγωγής εκείνου του έτους. |
|||||
|
|
|
|
Αριστερά: Nicolas Leblanc (1742-1806). Δεξιά: Εργοστάσιο παρασκευής σόδας με τη μέθοδο Leblanc (Γλασκώβη, Σκωτία, περί το 1880) [πηγή]. |
|
Βιομηχανικές μέθοδοι παρασκευής ανθρακικού νατρίου
Κατά τα τέλη του 18ου αιώνα, οι Γαλλικές αρχές άρχισαν να ανησυχούν ως προς τη διαθεσιμότητα ανθρακικών αλάτων νατρίου ή καλίου (διαλυτά ανθρακικά άλατα). Οι ουσίες αυτές είχαν ιδιαίτερη σημασία για τη σαπωνοποιία, την υφαντουργία και την υαλουργία, βιομηχανίες που βρίσκονταν σε πλήρη άνθηση εκείνη την εποχή.
Η μόνη πηγή ανθρακικών αλάτων ήταν η τέφρα δέντρων και διαφόρων φυτών. Εισαγωγές τέφρας γίνονταν από τη Ρωσία, τις Σκανδιναβικές χώρες, την Ισπανία και τη Βόρεια Αμερική. Ωστόσο, η ουσιαστικά διαρκής εμπόλεμη κατάσταση της Γαλλίας με τη Μεγάλη Βρετανία, δημιουργούσε προβλήματα στις θαλάσσιες μεταφορές και ο εφοδιασμός της χώρας με αυτά τα πολύτιμα ανθρακικά άλατα ήταν ανεπαρκής.
Το 1783, για την αντιμετώπιση του προβλήματος, ο Βασιλέας της Γαλλίας Λουδοβίκος 16ος και η Γαλλική Ακαδημία Επιστημών προσέφεραν χρηματικό βραβείο 2400 λιρών σε όποιον θα παρασκεύαζε "σόδα τέφρας" (soda ash: η έννοια των ανθρακικών αλάτων δεν ήταν ακόμη γνωστή) από το κοινό αλάτι (NaCl).
Μέθοδος Leblanc [Αναφ. 3]. Το 1791, μετά από προσπάθειες πέντε ετών, ο ιατρός και χημικός Nicolas Leblanc (1742-1806) με τη βοήθεια ενός νέου χημικού, του J. J. M. Dizé, παρουσίασε μια σχετικώς οικονομική μέθοδο σύνθεσης σόδας (Na2CO3).
Για την ανακάλυψή του αυτή ο Leblanc χρηματοδοτήθηκε από τον Δούκα της Ορλεάνης (Λουδοβίκος Φίλιππος ο 2ος, αδελφός του Βασιλέα Λουδοβίκου 16ου), του οποίου υπήρξε προσωπικός ιατρός. Η μέθοδός του, από χημική άποψη ήταν απλή και χρησιμοποιούσε το NaCl ως μία από τις πρώτες ύλες. Η παραγωγή σόδας γινόταν σε δύο στάδια κατά παρτίδες:
|
Ανδριάντας του Nicolas Leblanc στο Παρίσι (Paris III). |
(α) Το χλωριούχο νάτριο αντιδρά με πυκνό θειικό οξύ παρέχοντας θειικό νάτριο. Η αντίδραση ξεκινάει αρχικά σε χαμηλή θερμοκρασία, η οποία στη συνέχεια αυξάνεται για τη συμπλήρωση της αντίδρασης και την απομάκρυνση του HCl. Την αντίδραση αυτή είχε περιγράψει το 1772 ο διάσημος Σουηδός χημικός Carl Wilhelm Scheele (1742-1786).
(β) Το παραγόμενο θειικό νάτριο αναμιγνύεται με ανθρακικό ασβέστιο (ασβεστόλιθο) και σκόνη άνθρακα σε αναλογία βαρών 2:2:1 και πυρακτώνεται στους 1000ºC. Στη θερμοκρασία αυτή, το θειικό νάτριο ανάγεται από τον άνθρακα προς θειούχο νάτριο, το οποίο με το ανθρακικό ασβέστιο παρέχει ανθρακικό νάτριο. Το μίγμα που λαμβανόταν μετά τη διαδικασία αυτή ήταν γνωστό ως "μαύρη τέφρα" (black ash). Η αντίδραση αυτή ήταν αποκλειστική ανακάλυψη του Leblanc. Η αλληλουχία των αντιδράσεων έχει ως εξής:
2NaCl + H2SO4
![]() Na2SO4 + 2HCl
Na2SO4
+ 2C
Na2SO4 + 2HCl
Na2SO4
+ 2C
![]() Na2S + CO2
Na2S + CaCO3
Na2S + CO2
Na2S + CaCO3
![]() Na2CO3 + CaS
Na2CO3 + CaS
Η μέθοδος Leblanc μπορεί να αποδοθεί από την ακόλουθη "συνολική" αντίδραση, που δείχνει σαφέστερα τις πρώτες ύλες, τις θεωρητικές αναλογίες τους και τα παραπροϊόντα:
|
Συνολική αντίδραση: 2NaCl + H2SO4
+ 2C + CaCO3
|
Με εκχύλιση της
μαύρης τέφρας με νερό λαμβανόταν η σόδα,
η οποία στη συνέχεια καθαριζόταν με ανακρυσταλλώσεις.
Το NaHCO3
λαμβανόταν με διαβίβαση CO2
μέσω πυκνού διαλύματος Na2CO3,
που προκαλούσε καταβύθιση του NaHCO3
ως λιγότερο διαλυτό άλας: Na2CO3
+ H2O
+ CO2
![]() 2 NaHCO3.
2 NaHCO3.
Το 1791, στο προάστιο του Παρισιού Saint Denis, με εντολή του Δούκα της Ορλεάνης κατασκευάστηκε εργοστάσιο σόδας για τον Leblanc και άρχισε την παραγωγή σόδας με δυνατότητα 320 τόνων τον χρόνο. Ωστόσο, η έναρξη της λειτουργίας του εργοστασίου συνέπεσε με τη Γαλλική επανάσταση. Το 1793, ο Δούκας της Ορλεάνης στάλθηκε στην γκιλοτίνα, η Γαλλική Ακαδημία Επιστημών διαλύθηκε, το εργοστάσιο σόδας εθνικοποιήθηκε από την επαναστατική κυβέρνηση και ουσιαστικά έπαψε να λειτουργεί, αφού ο εξοπλισμός του ξεπουλήθηκε, ενώ ο ίδιος ο Leblanc ποτέ δεν έλαβε το χρηματικό βραβείο.
Το 1802, o Ναπολέων επέστρεψε το εργοστάσιο στον Leblanc, ωστόσο η λειτουργία του εργοστασίου ήταν πλέον προβληματική. Το κόστος παραγωγής είχε ανέβει και ένας από τους λόγους ήταν ότι το απαραίτητο θειικό οξύ είχε γίνει δυσεύρετο. Εκείνη την εποχή το θειικό οξύ παρασκευαζόταν με οξείδωση του θείου με νίτρο (ΚΝΟ3), το οποίο όμως είχε δεσμευτεί για την παρασκευή πυρίτιδας για τις συνεχείς πολεμικές επιχειρήσεις. Ο άτυχος Leblanc δεν μπόρεσε ποτέ να ανταποκριθεί στα έξοδα της επιχείρησης, καταστράφηκε οικονομικά και το 1806 αυτοκτόνησε αυτοπυροβολούμενος.
Το 1818, η εταιρεία Saint Gobain Company ανέλαβε τη συνέχιση της παραγωγής σόδας, η οποία έφτασε τις 10-15.000 τόνους ετησίως. Αν και η παραγωγή σόδας με τη μέθοδο Leblanc ξεκίνησε από τη Γαλλία, άνθησε ιδιαίτερα στη Βρετανία. Εκεί, η ετήσια παραγωγή έφτασε τους 200 χιλιάδες τόνους (δεκαετίες 1860 και 1870) ξεπερνώντας τη συνολική παραγωγή σόδας όλων των άλλων χωρών. Το 1863 η παγκόσμια παραγωγή είχε φτάσει τους 150.000 τόνους, αποκλειστικά μέσω της μεθόδου Leblanc.
Ωστόσο, λόγω της εμφάνισης της οικονομικότερης μεθόδου Solvay (δεκαετία 1870), η παραγωγή σόδας με τη μέθοδο Leblanc άρχισε να μειώνεται. Το 1902 η παγκόσμια παραγωγή σόδας είχε φθάσει τους 1.760.000 τόνους, από τους οποίους περισσότερο από το 90% παραγόταν πλέον με τη μέθοδο Solvay [Αναφ. 5στ]. Πρέπει να σημειωθεί ότι η μέθοδος Leblanc ποτέ δεν χρησιμοποιήθηκε στις Ηνωμένες Πολιτείες, όπου κρίθηκε ότι οικονομικώς η εισαγωγή σόδας από την Ευρώπη ήταν πλέον συμφέρουσα.

|
Παλαιά σχέδια μονάδων βιομηχανίας παραγωγής Na2CO3 με τη μέθοδο Leblanc: Αριστερά: Κλίβανος πυράκτωσης μίγματος Na2SO4 - CaCO3 - C. Δεξιά επάνω: Θάλαμος παραγωγής Na2SO4. Δεξιά κάτω: Μονάδες παραλαβής και καθαρισμού του Na2CO3 από τη μαύρη τέφρα [πηγή]. |
Μέθοδος Leblanc: Μια περιβαλλοντικώς επιβλαβής μέθοδος [Αναφ. 4] Η μέθοδος Leblanc υπήρξε εξαιρετικώς ενεργοβόρα και ιδιαίτερα βλαπτική για το περιβάλλον, λόγω του τοξικού αέριου υδροχλωρίου που παράγονταν. Η πιο απλή μέθοδος για να περιοριστεί η εκπομπή του στον αέρα ήταν η δέσμευσή του σε νερό με σχηματισμό υδροχλωρικού οξέος, το οποίο όμως εκείνη την εποχή δεν είχε ακόμη σημαντική βιομηχανική αξία, δεν ήξεραν τι να το κάνουν και συχνά κατέληγε σε ποταμούς και τη θάλασσα με καταστροφικές συνέπειες για τους υδρόβιους οργανισμούς. Στην Αγγλία σε πολλές περιπτώσεις αξιοποιούσαν το υδροχλώριο σε κάποιο βαθμό, οξειδώνοντάς το σε χλώριο, με διαβίβασή του μαζί με αέρα μέσω θερμαινόμενου καταλύτη (Henry Deacon, 1822-1876). Το παραγόμενο χλώριο στη συνέχεια το αξιοποιούσαν για την παραγωγή λευκαντικών υλών (π.χ. χλωράσβεστο, βλ. Χημική ένωση του μήνα: Υποχλωριώδες οξύ και άλατά του), που ήταν χρήσιμες στην υφαντουργία και στη χαρτοποιία. Σοβαρότερο πρόβλημα αποτελούσε η διάθεση του αδιάλυτου παραπροϊόντος, που απέμενε μετά την παραλαβή της σόδας από τη μαύρη τέφρα. Αυτό ήταν ένα δυσώδες μαύρο υλικό, το οποίο είναι γνωστό με το όνομα galligu. Για κάθε τόνο σόδας, παράγονταν δύο τόνοι galligu. Το παραπροϊόν αυτό ήταν τελείως άχρηστο, τοξικό (με σχετικά μεγάλη περιεκτικότητα σε βαρέα μέταλλα) και σωρευόταν σε μεγάλες εκτάσεις. Το galligu ανέδιδε το τοξικό και δύσοσμο υδρόθειο εξαιτίας του κύριου συστατικού του, του θειούχου ασβεστίου (CaS) καθιστώντας μαρτυρική τη ζωή όσων κατοικούσαν κοντά στις περιοχές απόθεσης, η ποιότητα της ατμόσφαιρας των οποίων εξαρτιόταν από τη φορά των ανέμων. Το CaS σταδιακά μετατρέπεται σε θειικό ασβέστιο (γύψο) υπό την επίδραση του ατμοσφαιρικού οξυγόνου (αντίδραση 1), αλλά και σε ανθρακικό ασβέστιο με έκλυση υδροθείου, υπό την επίδραση του διοξειδίου του άνθρακα και της υγρασίας της ατμόσφαιρας (αντίδραση 2):
CaS + 2O2 Να σημειωθεί ότι ακόμη και σήμερα (μετά από 120-150 χρόνια) οι παλιές αποθέσεις τεράστιων ποσοτήτων galligu (εκατομμύρια τόνοι) παλαιών βιομηχανιών παραγωγής σόδας αποτελούν σημαντικότατο περιβαλλοντικό πρόβλημα. Το πρόβλημα αυτό είναι ιδιαίτερα έντονο σε διάφορες περιοχές της Αγγλίας, η οποία κατά τα τέλη του 19ου αιώνα διέθετε τη μεγαλύτερη στον κόσμο βιομηχανία παραγωγής σόδας με τη μέθοδο Leblanc. Στις περιοχές αυτές καταβάλλονται δαπανηρές και επίπονες προσπάθειες περιβαλλοντικής αποκατάστασης (environmental remediation). |
Μέθοδος Solvay [Αναφ. 5]. Το 1811, ο Γάλλος φυσικός Augustin Jean Fresnel, γνωστός κυρίως από τις μελέτες σε θέματα οπτικής φυσικής, είχε διαπιστώσει ότι με διαβίβαση περίσσειας διοξειδίου του άνθρακα μέσω πυκνού διαλύματος αμμωνίας και χλωριούχου νατρίου σχηματιζόταν ίζημα όξινου ανθρακικού νατρίου, βασίζεται στην ισορροπία-κλειδί:
Na+
+ NH3 + CO2 + H2O
![]() NH4+ + NaHCO3
NH4+ + NaHCO3
Η ισορροπία αυτή είναι μετατοπισμένη προς τα δεξιά λόγω της σχετικώς μικρής διαλυτότητας του NaHCO3 (0,82 Μ στους 0°C, σε σχέση με τα 1,5 Μ του NH4HCO3, 5,5 M του NH4Cl και 6,1 Μ του NaCl). Η διαλυτότητα του NaHCO3 περιορίζεται ακόμη περισσότερο ως αποτέλεσμα της επίδρασης κοινού ιόντος (Na+) από την περίσσεια του NaCl. Η παρατήρηση αυτή του Fresnel δεν δημοσιεύτηκε ποτέ, ωστόσο αποτέλεσε τη βάση της μεθόδου Solvay.
Το 1834, οι Βρετανοί H. G. Dyan και J. Henning επιχείρησαν να αξιοποιήσουν την παραπάνω αντίδραση για τη βιομηχανική παρασκευή σόδας. Το βήμα-κλειδί της όλης διαδικασίας που θα καθιστούσε τη μέθοδο οικονομικώς συμφέρουσα ήταν η ανακύκλωση της δαπανηρής αμμωνίας, κάτι που δεν το επέτυχαν στον επιθυμητό βαθμό. Επιπλέον πρόβλημα αποτελούσε η κατανάλωση μεγάλων ποσοτήτων χλωριούχου νατρίου. Και άλλοι επιχείρησαν να αξιοποιήσουν την ίδια αντίδραση χωρίς επιτυχία.
Το πρόβλημα της οικονομικής παραγωγής σόδας που βασιζόταν στη χρήση της αμμωνίας, έλυσε ο νεαρός Βέλγος χημικός Ernest Solvay (1838-1922), ο οποίος το 1861 έλαβε το σχετικό δίπλωμα ευρεσιτεχνίας. Το 1863, μαζί με τον αδελφό του, επίσης χημικό, τον Alfred Solvay ανήγειραν το πρώτο εργοστάσιο παρασκευής σόδας με τη νέα μέθοδο στο προάστιο Couillet της πόλης Charleroi νότια των Βρυξελών.
Από το 1870 και μετά άρχισε μια ταχύτατη διεθνής επέκταση της επιχείρησης με την επωνυμία "Solvay S. A." με ανέγερση εργοστασίων στην Μ. Βρετανία, στη Γερμανία, στη Ρωσία και στις Ηνωμένες Πολιτείες. Σήμερα, η πολυεθνική Solvay S. A. έχει εξελιχθεί σε μια από τις μεγαλύτερες χημικές βιομηχανίες του κόσμου με κύκλο εργασιών που φθάνει τα 13 δισεκατομμύρια ευρώ (2012) και 29000 υπαλλήλους σε 55 χώρες.
 |
 |
 |
 |
|
Από αριστερά προς τα δεξιά: (1) Ο Βέλγος χημικός Ernest Solvay (1838-1922). (2) ο ίδιος (αριστερά) με το αδελφό του Alfred την εποχή που ξεκίνησαν τις επιχειρήσεις τους [πηγή]. (3) Aργυρό μετάλλιο με την απεικόνιση των αδελφών Solvay (έκδοση 1913 για τα 50 χρόνια της επιχείρησης Solvay) [πηγή]. (4) Το πρώτο εργοστάσιο παραγωγής σόδας με τη μέθοδο Solvay, στο προάστιο Couillet της πόλης Charleroi (Βέλγιο) [πηγή]. |
|||
Σύμφωνα με τη μέθοδο Solvay (γνωστή και ως μέθοδος αμμωνίας-σόδας) ακολουθούνται τα ακόλουθα στάδια:
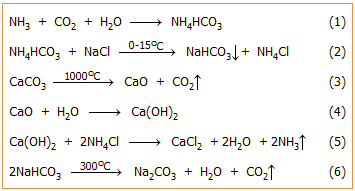 (α)
Παρασκευάζεται ένα σχεδόν κορεσμένο διάλυμα NaCl (άλμη),
συνήθως με διαβίβαση
ύδατος μέσω μιας δεξαμενής που τροφοδοτείται συνεχώς με στερεό χλωριούχο
νάτριο. Το πυκνό διάλυμα NaCl καταιονίζεται στον πύργο αμμωνίωσης
(ammoniation tower), ενώ από το κάτω μέρος του πύργου ανέρχεται ένα
ρεύμα αέριας αμμωνίας. Το διάλυμα NaCl πριν οδηγηθεί στον πύργο
αμμωνίωσης, υπόκειται σε "αποσκλήρυνση", δηλ. απαλλάσσεται από άλατα
ασβεστίου και μαγνησίου, συνήθως διερχόμενο μέσω ιοντοανταλλακτικών
στηλών.
(α)
Παρασκευάζεται ένα σχεδόν κορεσμένο διάλυμα NaCl (άλμη),
συνήθως με διαβίβαση
ύδατος μέσω μιας δεξαμενής που τροφοδοτείται συνεχώς με στερεό χλωριούχο
νάτριο. Το πυκνό διάλυμα NaCl καταιονίζεται στον πύργο αμμωνίωσης
(ammoniation tower), ενώ από το κάτω μέρος του πύργου ανέρχεται ένα
ρεύμα αέριας αμμωνίας. Το διάλυμα NaCl πριν οδηγηθεί στον πύργο
αμμωνίωσης, υπόκειται σε "αποσκλήρυνση", δηλ. απαλλάσσεται από άλατα
ασβεστίου και μαγνησίου, συνήθως διερχόμενο μέσω ιοντοανταλλακτικών
στηλών.
(β) Το προκύπτον διάλυμα NaCl-NH3 (η διάλυση αμμωνίας σε νερό συνοδεύεται από έκλυση θερμότητας) ψύχεται και εισέρχεται σε έναν δεύτερο πύργο, τον πύργο προενανθράκωσης (precarbonization tower), όπου εισέρχεται υπό πίεση ένα ρεύμα διοξειδίου του άνθρακα. Αρχίζουν οι αντιδράσεις 1 και 2. Το CO2 παράγεται σε κάμινο (kiln) συνεχώς τροφοδοτούμενο με ανθρακικό ασβέστιο (ασβεστόλιθο) (αντίδραση 3). Η κάμινος θερμαίνεται συνήθως με καύση κωκ.
(γ) Η προηγούμενη διεργασία επαναλαμβάνεται σε έναν δεύτερο πύργο, τον πύργο ενανθράκωσης (carbonization tower) με διαβίβαση επιπλέον διοξειδίου του άνθρακα προερχόμενο από τον χώρο θερμικής διάσπαση του όξινου ανθρακικού νατρίου (drier) και συμπληρώνονται οι αντιδράσεις 1 και 2. Στον πύργο αυτό ουσιαστικά καθιζάνει το στερεό NaHCO3 (με βάση την προηγούμενη αντίδραση), το οποίο διαχωρίζεται με φιλτράρισμα από το διάλυμα του σχηματιζόμενου NH4Cl. Συχνά αναφέρονται οι πύργοι προενανθρακωσης και ενανθράκωσης (και οι δύο από ανοξείδωτο χάλυβα) ως μία ενιαία μονάδα που δέχεται το σύνολο του παραγόμενου διοξειδίου του άνθρακα. Η καθίζηση διευκολύνεται από τις χαμηλές θερμοκρασίες που διατηρούνται οι πύργοι (0-15°C). Η κύρια συνεισφορά του Solvay ήταν η εφεύρεση των πύργων ενανθράκωσης, όπου η αμμωνιούχος άλμη αναμιγνύεται αποτελεσματικά με το διοξείδιο του άνθρακα.
(δ) Το CaO που παράγεται κατά την πυράκτωση του ασβεστόλιθου αντιδρά με το νερό που περιέχει το διάλυμα NH4Cl που προέρχεται από τα στάδια (β και (γ) και παρέχει υδροξείδιο του ασβεστίου (αντίδραση 4). Το τελευταίο, ως ισχυρή βάση, αντιδρά με το NH4Cl και απελευθερώνει αμμωνία (αντίδραση 5), η οποία έτσι ανακυκλώνεται και επανεισέρχεται, αφού προηγουμένως ψυχθεί, στον πύργο αμμωνίωσης (ammoniating tower) του σταδίου (α).
(ε) Το στερεό NaHCO3 που καθιζάνει στον πύργο ενανθράκωσης προωθείται στον χώρο ξήρανσης/θέρμανσης (300ºC), όπου διασπάται προς ανθρακικό νάτριο (τελικό προϊόν) και διοξείδιο του άνθρακα (αντίδραση 6). Το διοξείδιο του άνθρακα οδηγείται στον πύργο ενανθράκωσης (στάδιο γ).
 |
 |
|
Το μόνο παραπροϊόν της μεθόδου Solvay είναι το CaCl2. Αριστερά: Μεγάλες ποσότητες αυτού του άλατος χρησιμοποιούνται ως αντιπαγωτικό άλας των δρόμων (road salt). Δεξιά: Το άνυδρο CaCl2 χρησιμοποιείται ως εξαιρετικό και φθηνό ξηραντικό μέσο στη βιομηχανία και στο εργαστήριο. |
|
Η μέθοδος Solvay μπορεί να αποδοθεί από την ακόλουθη "συνολική" αντίδραση:
|
Συνολική αντίδραση: 2NaCl + CaCO3
|
η οποία όχι μόνο δεν μπορεί να συμβεί απευθείας, αλλά αντίθετα προχωρεί αυθόρμητα προς την αντίστροφη από την παραπάνω σημειούμενη φορά. Αν και θεωρητικά η αμμωνία ανακυκλώνεται και δεν μετέχει έτσι ως αντιδρών στη "συνολική" αντίδραση, αναπόφευκτα απώλειές της υπάρχουν και καλύπτονται με την εισαγωγή νέων ποσοτήτων της. 'Εχει εκτιμηθεί ότι με προσεκτικό σχεδιασμό και καλή συντήρηση, οι απώλειες της αμμωνίας μπορούν να περιοριστούν στο 1 kg για κάθε τόνο παραγόμενου ανθρακικού νατρίου.
Σε ανάλογες απώλειες υπόκειται και το διοξείδιο του άνθρακα, οι οποίες όμως δεν απασχολούν, αφού αναπληρώνονται από το διοξείδιο του άνθρακα, που διατίθεται άφθονο ούτως ή άλλως από την καύση του κωκ για την παραγωγή CaO από ασβεστόλιθο (αντίδραση 3).
Σε αντίθεση με τη μέθοδο Leblanc, όπου η παραγωγή σόδας γίνεται "κατά παρτίδες" (batch process), με τη μέθοδο Solvay η παραγωγή είναι "συνεχής" (continuous process). Επιπλέον, σε αντίθεση με τα τοξικά παραπροϊόντα HCl και galligu της μεθόδου Leblanc, το μόνο παραπροϊόν της μεθόδου Solvay είναι το χλωριούχο ασβέστιο. Το άλας αυτό δεν αποτελεί κίνδυνο για το περιβάλλον και χρησιμοποιείται ως ξηραντικό μέσο στη βιομηχανία και στα χημικά εργαστήρια, ενώ σε μεγάλες ποσότητες χρησιμοποιείται ως αντιπαγωτικό άλας (road salt, de-icer). Ωστόσο, η ζήτησή του δεν επαρκεί για την απορρόφηση της συνολικώς παραγόμενης ποσότητας. Το πλεονάζον χλωριούχο ασβέστιο μπορεί να απορριφθεί στη θάλασσα, όχι όμως σε ποταμούς και λίμνες για να αποφευχθεί η αύξηση της συγκέντρωσης των χλωριούχων σε επικίνδυνα επίπεδα.
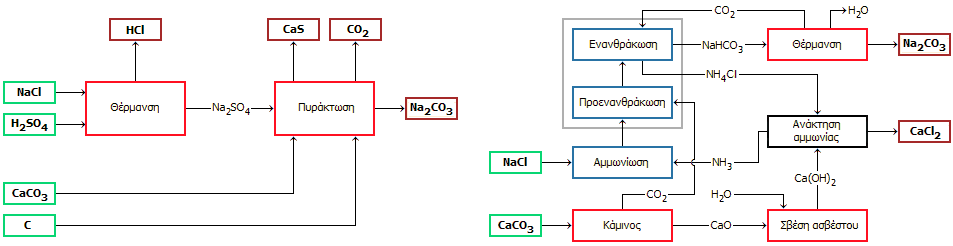
|
Μέθοδος Leblanc |
Μέθοδος Solvay |
Διαγραμματική παράσταση των μεθόδων Leblanc και Solvay παραγωγής Na2CO3.
|
Τα Ινστιτούτα Solvay και τα Διεθνή Επιστημονικά Συνέδρια Ο Solvey όπως ήταν φυσικό χάρις στη μέθοδο του για την παραγωγή τη σόδας απέκτησε τεράστια περιουσία. Ο ίδιος υπήρξε μια προσωπικότητα πολύ πιο μπροστά από την εποχή του με έντονες κοινωνικές ευαισθησίες. Είναι χαρακτηριστικό το ότι από εκείνη την εποχή και χωρίς να υποχρεώνεται από κάποια εργατική νομοθεσία, είχε καθιερώσει την 8-ωρη εργασία, όπως και το "δώρο διακοπών" για το προσωπικό των εργοστασίων του, πρωτόγνωρα για την εποχή εκείνη φιλεργατικά μέτρα. Αν και οι γενικότερες επιστημονικές γνώσεις του Solvay ήταν περιορισμένες και περισσότερο προσαρμοσμένες στις πρακτικές εφαρμογές, παρακολουθούσε και θαύμαζε τις γενικότερες εξελίξης στον χώρο της φυσικής και της χημείας. Πίστευε ότι υπήρχε μια σύνδεση μάζας και ενέργειας και είχε γοητευτεί από τις εργασίες του Albert Einstein (1879-1955). Ο διάσημος φυσικοχημικός Walther Nernst (1864-1941, Βραβείο Nobel Χημείας 1920) τον έπεισε να χρηματοδοτήσει ένα ειδικό συνέδριο, όπου διάσημοι φυσικοί και χημικοί θα συζητούσαν για τις τελευταίες ανακαλύψεις. Το 1911 ίδρυσε και χρηματοδότησε στις Βρυξέλες τα Διεθνή Ινστιτούτα Solvay για τη Φυσική και τη Χημεία (International Solvay Institutes for Physics and Chemistry). Την απόφαση αυτή την πήρε μετά από την ιστορική πρώτη διεξαγωγή του Συνεδρίου Solvay (Solvay Conference) το 1911, με την παρουσία πολλών διάσημων φυσικών και χημικών της εποχής. Το πρώτο αυτό διεθνές συνέδριο πραγματοποιήθηκε υπό την προεδρία του Ολλανδού φυσικού Hendrik Antoon Lorentz (1853-1928, Βραβείο Nobel Φυσικής 1902) και το θέμα του ήταν το επαναστατικό για την εποχή του "La Theorie de la Radiation et des Quanta" (Η θεωρία της ακτινοβολίας και των κβάντων) (30/10-3/11/1911) στο ξενοδοχείο Hôtel Métropole στις Βρυξέλες. 'Ετσι, έμμεσα, ένας καθαρά πρακτικός χημικός συνέβαλε με τον τρόπο του στην εξέλιξη της κβαντομηχανικής, ενώ συγχρόνως συνεισέφερε στη μείωση του κόστους πλήθους προϊόντων καθημερινής χρήσης, των οποίων η παραγωγή βασιζόταν στη χρήση της σόδας.
|
||||
|
Ο Κινέζος χημικός μηχανικός Hou Te-Pang ( 1890-1974). |
Μέθοδος Hou. Το 1930, ο διάσημος Κινέζος χημικός μηχανικός Hou Te-Pang (Debang Hou, 1890-1974) εισήγαγε μια παραλλαγή της μεθόδου Solvay, η οποία βασίζεται στην αντίδραση διοξειδίου του άνθρακα, αμμωνίας και χλωριούχου νατρίου που μπορεί συνοπτικά να αποδοθεί με τις αντιδράσεις:
NaCl + NH3 + CO2 + H2O
![]() NaHCO3 + NH4Cl
2NaHCO3
NaHCO3 + NH4Cl
2NaHCO3
![]() Na2CO3 + H2O + CO2
Na2CO3 + H2O + CO2
Η μέθοδος βασίζεται σε μια διαφοροποίηση της σχετικής διαλυτότητας των NaHCO3 και NH4Cl με τη θερμοκρασία. Αντί της επίδρασης Ca(OH)2 στο μητρικό διάλυμα μετά την απομάκρυνση του NaHCO3, διαβιβάζεται επιπλέον CO2 και ΝΗ3 και προστίθεται NaCl μέχρι κορεσμού στους 40ºC. Στη συνέχει το μίγμα ψύχεται στους 10ºC, οπότε καταβυθίζεται NH4Cl το οποίο απομακρύνεται με διήθηση. Στη συνέχεια το μητρικό ανακυκλώνεται για την παραγωγή επιπλέον NaHCO3, το οποίο με θέρμανση παρέχει άνυδρο Na2CO3 (soda ash).
Με τη μέθοδο Hou δεν σχηματίζεται χλωριούχο ασβέστιο ως παραπροϊόν, αλλά χλωριούχο αμμώνιο, το οποίο μπορεί να χρησιμοποιηθεί ως λίπασμα και γενικά έχει μεγαλύτερη χρησιμότητα και εμπορική αξία σε σχέση με το πρώτο.
Η μέθοδος Hou προϋποθέτει κατανάλωση αμμωνίας και για τον λόγο αυτό είναι "συζευγμένη" με τη μέθοδο Haber-Bosch παραγωγής αμμωνίας με υδρογόνο προερχόμενο από αναμόρφωση με ατμό (steam reforming) του μεθανίου, που εξασφαλίζει και το απαιτούμενο διοξείδιο του άνθρακα. 'Ετσι, ουσιαστικά η σόδα μπορεί να θεωρηθεί ως χημική ουσία παραγόμενη με πρώτες ύλες το αλάτι, το φυσικό αέριο και τον ατμοσφαιρικό αέρα (βλ. Χημική ένωση του μήνα: Αμμωνία) [Αναφ. 5θ].
Ο Hou Te-Pang θεωρείται ως ο θεμελιωτής της σύγχρονης Κινεζικής χημικής βιομηχανίας στην ανασυγκρότηση της οποίας συνέβαλε αποφασιστικά μετά τα καταστροφικά πλήγματα που δέχτηκαν τα βιομηχανικά συγκροτήματα από τους Ιάπωνες κατά τον 2ο Παγκόσμιο Πόλεμο. Σπούδασε Χημικός Μηχανικός στην Κίνα (Tsinghua University το 1912) και στάλθηκε με υποτροφία στις ΗΠΑ για μεταπτυχιακές σπουδές (MSc στο MIT το 1917 και PhD στο Coloumbia University το 1921).
|
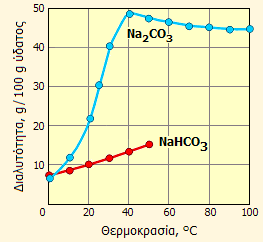
Διαλυτότητα των NaHCO3 και Na2CO3 στο νερό ως συνάρτηση της θερμοκρασίας. |
Χημικές ιδιότητες και χρήσεις όξινου ανθρακικού και ανθρακικού νατρίου
Το όξινο ανθρακικό και το ανθρακικό νάτριο είναι άλατα του ασθενούς ανθρακικού οξέος με αποτέλεσμα τα υδατικά διαλύματά τους να είναι από ασθενώς βασικά (NaHCO3) έως ισχυρώς βασικά (το Na2CO3). Υδατικά διαλύματα 0,10 Μ των αλάτων έχουν pH 8,6 και 11,6, αντιστοίχως.
Το όξινο ανθρακικό νάτριο σε στερεά
κατάσταση ή σε υδατικό διάλυμα, διασπάται προς ανθρακικό νάτριο σύμφωνα
με την αντίδραση: 2NaHCO3
![]() Na2CO3 + H2O + CO2.
Σε υδατικά διαλύματα η διάσπαση αρχίζει ήδη από τους 50ºC, ενώ σε
στερεά φάση ολοκληρώνεται ταχύτατα σε θερμοκρασίες μεγαλύτερες ή ίσες
από τους 200ºC.
Na2CO3 + H2O + CO2.
Σε υδατικά διαλύματα η διάσπαση αρχίζει ήδη από τους 50ºC, ενώ σε
στερεά φάση ολοκληρώνεται ταχύτατα σε θερμοκρασίες μεγαλύτερες ή ίσες
από τους 200ºC.
Η διαλυτότητα του Na2CO3 ως συνάρτηση της θερμοκρασίας είναι κάπως ασυνήθιστη κατά το ότι παρουσιάζει ένα μέγιστο γύρω στους 40°C. Αυτό οφείλεται στη σειρά υδριτών που σχηματίζει, οπότε στην πραγματικότητα η καμπύλη αυτή συντίθεται και από τα σημεία τήξης κάθε υδρίτη και τα μεταβατικά σημεία (transition points) των επιμέρους κρυσταλλικών μορφών και των μιγμάτων τους. Το NaHCO3 παρουσιάζει ομαλή αύξηση της διαλυτότητάς του κατά την αύξηση της θερμοκρασίας μέχρι περίπου τους 50°C. Σε υψηλότερες θερμοκρασίες αρχίζει η διάσπασή του προς ανθρακικό νάτριο και διοξείδιο του άνθρακα, οπότε δεν έχει νόημα η μέτρηση της διαλυτότητάς του στις θερμοκρασίες αυτές.
Λόγω επίδρασης κοινού ιόντος, η διαλυτότητα του ανθρακικού νατρίου είναι ελάχιστη σε πολύ πυκνά διαλύματα NaOH. Το γεγονός αυτό αξιοποιείται στην παρασκευή πρότυπων διαλυμάτων NaOH απαλλαγμένων από Na2CO3, με λήψη και αραίωση της απαραίτητης ποσότητας από την υπερκείμενη φάση πυκνού (50% w/w) διαλύματος NaOH. Η ποσότητα αυτή θα είναι πρακτικώς απαλλαγμένη από Na2CO3, το οποίο θα βρίσκεται ως ίζημα στον πυθμένα της φιάλης-περιέκτη του πυκνού διαλύματος.
Υδρίτες του ανθρακικού νατρίου [Αναφ. 6]. Το ανθρακικό νάτριο σχηματίζει τρεις σταθερούς υδρίτες με ένα (Na2CO3·Η2Ο), επτά (Na2CO3·7Η2Ο) και δέκα μόρια ύδατος (Na2CO3·10Η2Ο). 'Εχει αναφερθεί η ύπαρξη και άλλων, αλλά ασταθών, υδριτών, όπως το ημιπενταϋδρικό ανθρακικό νάτριο, Na2CO3·5/2Η2Ο. Το δεκαϋδρικό και το μονοϋδρικό ανθρακικό νάτριο απαντούν στη φύση ως ορυκτά (νάτρο και θερμονατρίτης). Για το όξινο ανθρακικό νάτριο δεν έχει διαπιστωθεί η ύπαρξη κάποιων σταθερών υδριτών. Κάποια χαρακτηριστικά των υδριτών αυτών αναφέρονται στη συνέχεια:
(α) Το μονοϋδρικό ανθρακικό νάτριο (monohydrate), Na2CO3·Η2Ο. Περιέχει 85,5% Na2CO3 και 14,5% Η2Ο κρυστάλλωσης. Αποτελεί τη σταθερότερη μορφή ένυδρου Na2CO3. Διαχωρίζεται ως μικροί κρύσταλλοι από κορεσμένα διαλύματα σε θερμοκρασίες υψηλότερες από 35,4ºC. Σχηματίζεται με ύγρανση του Na2CO3 σε θερμοκρασίες υψηλότερες από τη θερμοκρασία αυτή. Χάνει το ύδωρ κρυστάλλωσης κατά τη θέρμανση, ενώ η διαλυτότητά του μειώνεται ελαφρά με αύξηση της θερμοκρασίας. Είναι ο σταθερότερος από τους τρεις υδρίτες. Μετατρέπεται σε άνυδρο Na2CO3 και κατά την επαφή του με κορεσμένο διάλυμα Na2CO3 στους 109ºC.
(β) Το επταϋδρικό ανθρακικό νάτριο (heptahydrate), Na2CO3·7Η2Ο. Περιέχει 45,7% Na2CO3 και 54,3% Η2Ο κρυστάλλωσης. Είναι κατά πολύ ασταθέστερος από τους δυο άλλους υδρίτες και δεν διατίθεται στο εμπόριο, αφού σταθεροποιείται μόνο στη στενή περιοχή θερμοκρασιών 32,0°C έως 35,4°C.
(γ) Το δεκαϋδρικό ανθρακικό νάτριο (decahydrate), Na2CO3·10Η2Ο. Περιέχει 37,1% Na2CO3 και 62,9% Η2Ο. Είναι εμπορικώς διαθέσιμο ως άλας σόδας (sal soda) ή σόδα πλύσης (washing soda). Λαμβάνεται με κρυστάλλωση κορεσμένου διαλύματος Na2CO3 σε θερμοκρασίες από -2,1°C έως 32,0°C ή με εφυδάτωση του άνυδρου ανθρακικού νατρίου με τη στοιχειομετρικώς υπολογιζόμενη ποσότητα ύδατος στην ίδια περιοχή θερμοκρασιών. Τήκεται στους 34°C με απώλεια ύδατος. Οι κρύσταλλοί του υπόκεινται σε εξάνθηση (efflorescence), δηλ. χάνουν με βραδύ ρυθμό μόρια "κρυσταλλικού" ύδατος και μεταπίπτουν τελικά στο σταθερό Na2CO3·Η2Ο.
Κατά τη διάλυση του άνυδρου και του μονοϋδρικού ανθρακικού νατρίου στο νερό εκλύεται θερμότητα (εξώθερμη διαδικασία), ενώ κατά τη διάλυση του επταϋδρικού και του δεκαϋδρικού ανθρακικού νατρίου απορροφάται θερμότητα (ενδόθερμη διαδικασία). Κατά τη μακρόχρονη παραμονή στην ατμόσφαιρα το Na2CO3 (σε οποιαδήποτε μορφή του), σταδιακά απορροφά ατμοσφαιρικό CO2, δέχεται (το άνυδρο Na2CO3) ή αποβάλλει νερό (το Na2CO3·10Η2Ο) και στο τέλος σταθεροποιείται στη μορφή Na2CO3·NaHCO3·2H2O (τυπική σύνθεση του ορυκτού τρόνα).
Βασικές ιδιότητες. Ως άλατα ασθενών οξέων, διαλυόμενα στο νερό υπόκεινται σε σημαντική υδρόλυση που οδηγεί στο σχηματισμό υδροξυλίων. Λαμβάνοντας υπόψη τις συμβατικές σταθερές ιοντισμού του ανθρακικού οξέος Κa1 = 4,2x10-7 και Κa2 = 4,8x10-11. Να σημειωθεί ότι για τις συμβατικές σταθερές, θεωρείται ότι το σύνολο του διαλυμένου CO2 δεσμεύεται προς ανθρακικό οξύ, κάτι που δεν ισχύει, χωρίς όμως αυτό να επηρεάζει τα εξαγόμενα συμπεράσματα (βλ. Χημική ένωση του μήνα: Διοξείδιο του άνθρακα). Οι αντιδράσεις αυτές έχουν τις ακόλουθες σταθερές ισορροπίας:
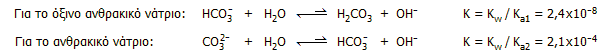
Από τις σταθερές ισορροπίας των αντιδράσεων προκύπτουν τα εξής συμπεράσματα: (α) Το όξινο ανθρακικό άλας δρα ως ασθενέστατη βάση, περίπου 20 φορές ισχυρότερη από την πυριδίνη (Κb = 1,4x10-9) και σχεδόν τρεις τάξεις μεγέθους ασθενέστερη από την αμμωνία (Κb = 1,8x10-5). (β) Το ουδέτερο ανθρακικό άλας δρα ως μετρίως ισχυρή βάση, περίπου 10 χιλιάδες φορές ισχυρότερη από το όξινο ανθρακικό άλας και περίπου 10 φορές ισχυρότερη από την αμμωνία.
To Na2CO3 ως πρωτογενές πρότυπο [Αναφ. 7]. Το άνυδρο Na2CO3 μπορεί να ληφθεί με εξαιρετικά μεγάλο βαθμό καθαρότητας (99,95-100,05%) και είναι ένα από τα συνιστώμενα πρωτογενή πρότυπα για την τιτλοδότηση πρότυπων διαλυμάτων ισχυρών οξέων. Σε αντίθεση με ανθρακικό νάτριο, το ανθρακικό κάλιο (K2CO3, potash) είναι τελείως ακατάλληλο ως πρωτογενές πρότυπο, λόγω της μεγάλης υγροσκοπικότητάς του. Το Na2CO3 έχει μια τάση να προσλαμβάνει υγρασία και διοξείδιο του άνθρακα από την ατμόσφαιρα σχηματίζοντας Na2CO3·H2O και NaHCO3, οπότε πριν από τη χρήση του το πρότυπο Na2CO3, στο φιαλίδιο ζύγισης, θα πρέπει να θερμαίνεται στους 140-160°C για τουλάχιστον δύο ώρες.
Δρα ως διπρωτική βάση παρέχοντας δύο ισοδύναμα σημεία, από τα οποία το δεύτερο είναι πιο "απότομο" και καταλληλότερο για τον προσδιορισμό του τελικού σημείου, με συνιστώμενο δείκτη το πορτοκαλόχρουν του μεθυλίου (methyl orange) με περιοχή pH αλλαγής χρώματος 3,2-4,4.
Αν η ογκομέτρηση πραγματοποιηθεί υπό βρασμό, το σχηματιζόμενο όξινο ανθρακικό ιόν διασπάται, το διοξείδιο του άνθρακα απομακρύνεται και το δεύτερο ισοδύναμο σημείο καθίσταται πιο απότομο, αφού αποτρέπεται έτσι ο σχηματισμός ρυθμιστικού όξινων ανθρακικών/ανθρακικού οξέος. Στην περίπτωση αυτή μπορούν να χρησιμοποιηθούν και οι δείκτες ερυθρό του μεθυλίου (methyl red, περιοχή αλλαγής χρώματος 4,2-6,2) και πράσινο βρωμοκρεζόλης (bromocresol green, περιοχή αλλαγής χρώματος 3,8-5,5).
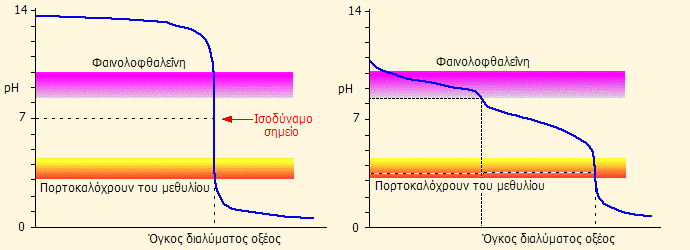 |
 |
|
Αριστερά. Καμπύλες ογκομέτρησης διαλύματος NaOH (αριστερά) και διαλύματος Na2CO3 (δεξιά) με διάλυμα ισχυρού οξέος (σε θερμοκρασία δωματίου). Είναι προφανές ότι στην περίπτωση της ισχυρής βάσης μπορεί να χρησιμοποιηθεί ως δείκτης εξ ίσου καλά και η φαινολοφθαλεΐνη και το πορτοκαλόχρουν του μεθυλίου. Αντίθετα, στην περίπτωση του διαλύματος Na2CO3 το πορτοκαλόχρουν του μεθυλίου παρέχει σαφέστερη χρωματική αλλαγή σε σχέση με τη φαινολοφθαλεΐνη [πηγή]. Είναι προφανές ότι για διαλύματα NaOH που περιέχουν Na2CO3 (π.χ. λόγω προσρόφησης CO2 από την ατμόσφαιρα) θα είναι αδύνατον να ληφθούν σαφή τελικά σημεία αν χρησιμοποιηθεί ως δείκτης η φαινολοφθαλεΐνη. Δεξιά: Το χρώμα που παρέχει το πορτοκαλόχρουν του μεθυλίου (methyl orange) σε αλκαλικό και όξινο διάλυμα [πηγή]. |
|
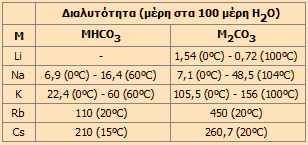
Το Na2CO3 ως αντιδραστήριο καθίζησης. 'Ολα τα ουδέτερα άλατα του ανθρακικού οξέος είναι δυσδιάλυτα με εξαίρεση τα ανθρακικά άλατα των αλκαλιμετάλλων, από τα οποία το Li2CO3 είναι το λιγότερο διαλυτό με διαλυτότητα 1,3 g/100 mL στους 20ºC. Πολλά ανθρακικά άλατα (ιδιαίτερα των πολυσθενών μετάλλων) δεν είναι απομονώσιμα και λαμβάνονται μόνο υπό τη μορφή βασικών μικτών αλάτων ποικίλης σύνθεσης.
|
Διαλυτότητες των όξινων και ουδέτερων ανθρακικών αλάτων των αλκαλιμετάλλων*
* Από το: Lange's Handbook of Chemistry, 1967 |
Κατά τον κλασικό συστηματικό διαχωρισμό των κατιόντων, τα κατιόντα της 4ης ομάδας (κατιόντα Ca, Sr, Ba), μετά την απομάκρυνση των κατιόντων των προηγούμενων ομάδων, διαχωρίζονται από τα κατιόντα της 5ης ομάδας (ιόντα αλκαλίων + Mg) καθιζάνουν ως δυσδιάλυτα ανθρακικά άλατα (στην πράξη χρησιμοποιείται ανθρακικό αμμώνιο για να αποτραπεί η καταβύθιση των ιόντων Mg). Εξαιρουμένων των μετάλλων των αλκαλίων, τα όξινα ανθρακικά άλατα των άλλων μετάλλων υφίστανται μόνο σε διάλυμα και κάθε απόπειρα απομόνωσης οδηγεί στη διάσπασή τους προς τα αντίστοιχα ανθρακικά και διοξείδιο του άνθρακα.
Καυστικοποίηση του Na2CO3 [Αναφ. 8]. Κατά το παρελθόν (μέχρι και τον 18ο αιώνα), ο μόνος τρόπος παρασκευής μικρών ποσοτήτων καθαρού NaOH ή πυκνών διαλυμάτων του, βασιζόταν στην ακόλουθη σειρά αντιδράσεων:
![]()
Η τελευταία αντίδραση χαρακτηριστικά αναφέρεται ως "καυστικοποίηση" (causticization) του ανθρακικού νατρίου. Tο Ca(OH)2 είναι βέβαια ισχυρή βάση, ωστόσο λόγω της περιορισμένης διαλυτότητάς του (0,173 g/100 mL ή 0,023 Μ στους 20°C) δεν μπορούσε να χρησιμοποιηθεί σε περιπτώσεις που χρειάζονταν πυκνά διαλύματα ισχυρής βάσης. Στις ΗΠΑ, όπου είναι διαθέσιμες άφθονες ποσότητες του ορυκτού τρόνα, η παραπάνω "καυστικοποίηση" του ανθρακικού νατρίου είναι οικονομικώς συμφέρουσα και πραγματοποιείται σε μεγάλη κλίμακα με ετήσια παραγωγή NaOH της τάξης αρκετών εκατοντάδων χιλιάδων τόνων. Να σημειωθεί ότι η κύρια μέθοδος παρασκευής NaOH είναι η διαδικασία Chloralkali (βλ. Χημική ένωση του μήνα: Χλωριούχο νάτριο).
Το NaΗCO3 ως πηγή CO2 [Αναφ. 9]. Το όξινο ανθρακικό νάτριο είναι μια ουσία που εύκολα μπορεί στα περισσότερα σπίτια ως "φαρμακευτική" ή "μαγειρική σόδα" (baking soda) και μπορεί να χαρακτηρισθεί ως ένα από τα σχετικώς ασφαλέστερα χημικά αντιδραστήρια για την εκτέλεση πειραμάτων από νεαρούς μαθητές. Αντίθετα, το ουδέτερο ανθρακικό νάτριο, αν και εύκολα μπορεί κανείς να το προμηθευθεί ή να το παρασκευάσει με θέρμανση του NaHCO3, λόγω της ισχυρής αλκαλικότητάς του δεν μπορεί να θεωρηθεί ως εξ ίσου ασφαλές.
Τυπικό παράδειγμα απλής χρήσης του NaHCO3 αποτελεί η αντίδρασή του με ασθενή οξέα (χυμό λεμονιού ή ξύδι) για τον σχηματισμό αέριου διοξειδίου του άνθρακα, π.χ.
![]()
η οποία κατά κανόνα αποτελεί ένα από τα πρώτα πειράματα γνωριμίας με τη χημεία μικρών μαθητών.
 |
 |
 |
 |
 |
|
|
Αριστερά: "Πειράματα στο σπίτι": Παραγωγή CO2 με αντίδραση μαγειρικής σόδας με ασθενή οξέα (π.χ. με ξύδι). Δεξιά: Η πιο κοινή χρήση του όξινου ανθρακικού νατρίου στο σπίτι, αλλά και στη βιομηχανία τροφίμων είναι ως διογκωτική ουσία στην παρασκευή αρτοσκευασμάτων. |
|||||
Μίγματα NaHCO3 και ενός ή περισσότερων στερεών όξινων συστατικών, όπως το όξινο τρυγικό κάλιο, δισόξινο φωσφορικό ασβέστιο κ.α., συνιστούν τους διογκωτικές σκόνες διαφόρων τύπων (baking powder), που σε επαφή με την υγρασία του υπό προετοιμασία τροφίμου (συνήθως αρτοσκευάσματα) αρχίζουν να εκλύουν με βραδύ ρυθμό αέριο CO2 κάνοντας το σκεύασμα πιο αφράτο.
Eυρύτατη είναι η χρήση του NaHCO3 σε διάφορους τύπους πυροσβεστήρων. Η ιδιότητα του NaHCO3 να εκλύει CO2 σε υψηλές θερμοκρασίες το καθιστούν κατάλληλο υλικό πυρόσβεσης, το οποίο στερεί το οξυγόνο από το φλεγόμενο υλικό με κάλυψη, αλλά και με το εκλυόμενο CO2. Σε κάποιους τύπους πυροσβεστήρων, στο εσωτερικό τους πυκνό διάλυμα NaHCO3 αντιδρά με διάλυμα H2SO4, ευρισκόμενο σε ξεχωριστή φιάλη μέσα στον πυροσβεστήρα. Κατά τη χρήση θραύεται η φιάλη με το H2SO4, οπότε το παραγόμενο CO2 αναπτύσσει την απαιτούμενη πίεση για την εκτόξευση του διαλύματος προς την εστία φωτιάς.
Αν αντί H2SO4 χρησιμοποιηθεί διάλυμα Al2(SO4)3 (τυπικές ποσότητες: 7,8 L διαλύματος 8% σε NaHCO3 + 1 L διαλύματος Al2(SO4)3 13%), τότε εκτοξεύεται ένα αφρώδες πηκτό υλικό απoτελούμενο από το ζελατινώδους υφής Al(OH)3 και αέριο CO2 [πηγή]. Προφανώς οι πυροσβεστήρες αυτοί απαιτούν αναγόμωση μετά από μία χρήση. Οι σχετικές αντιδράσεις έχουν ως εξής:
![]()
Οι πυροσβεστήρες του τελευταίου τύπου (πυροσβεστήρες "χημικού αφρού") είναι κατάλληλοι για κατάσβεση πυρκαγιών καυσίμων πετρελαιοειδών, αφού ο αφρός επιπλέει στο φλεγόμενο καύσιμο και αποκόπτει την επαφή του με το οξυγόνο.
Εμπορικές μορφές και χρήσεις του NaHCO3 και του Na2CO3 [Αναφ. 10]
Το όξινο και το ουδέτερο ανθρακικό νάτριο είναι χημικές ουσίες που παράγονται σε ποσότητες δεκάδων εκατομμυρίων τόνων ετησίως είτε συνθετικά (μέθοδοι Solvay και Hou), είτε εξάγονται από φυσικές ουσιαστικά αστείρευτες πηγές (π.χ. τα τεράστια κοιτάσματα τρόνα της πολιτείας Wyoming των ΗΠΑ). Η παγκόσμια παραγωγή της σόδας κατά το 2012 υπολογίστηκε στους 52,9 εκατομμύρια τόνους (περίπου 7,5 kg/άνθρωπο). Περίπου τα 3/4 της ποσότητας αυτής παράγονται με τη μέθοδο Solvay και το υπόλοιπο από φυσικές πηγές (ορυκτά τρόνα, νάτρο κ.α.).
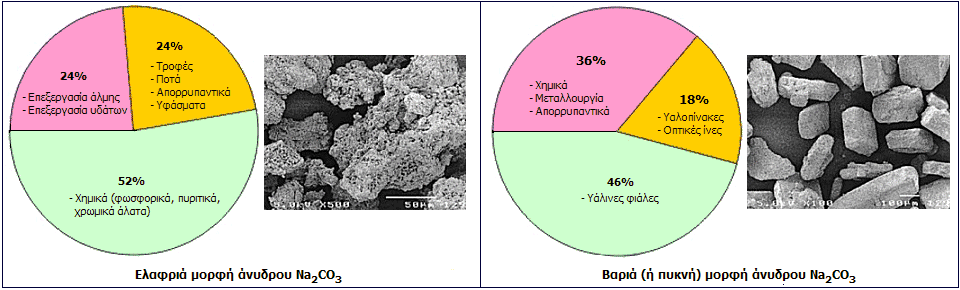
Αριστερά: Χρήσεις και μορφή κόκκων της ελαφριάς μορφής του άνυδρου Na2CO3 (διάμεση τιμή διαμέτρου (D50) =100 μm). Δεξιά: Χρήσεις και μορφή κόκκων της
βαριάς (ή πυκνής) μορφής του ανύδρου Na2CO3 (διάμεση τιμή διαμέτρου (D50) =300-500 μm).
Στο εμπόριο, το άνυδρο ανθρακικό νατρίου (soda ash) διατίθεται σε δύο μορφές: στην ελαφριά μορφή (light form) και στη βαριά (ή πυκνή) μορφή (heavy/dense).
Η ελαφριά μορφή άνυδρου ανθρακικού νατρίου είναι και η πρωτογενής μορφή που παρέχει απ' ευθείας η μέθοδος Solvay. Οι κόκκοι της είναι πορώδεις και έτσι η μακροσκοπική (ή φαινομενική) πυκνότητά της (bulk density) είναι περίπου 0,5 g/cm3. Είναι ο προτιμούμενος τύπος για τις περιπτώσεις που το Na2CO3 θα χρησιμοποιηθεί ως υδατικό διάλυμα (καθαρισμός ύδατος, απαλλαγή αέριων εκπομπών από όξινα αέρια, παρασκευή ποτών, απορρυπαντικά, βαφή υφασμάτων, πρώτη ύλη παρασκευής άλλων ανόργανων αλάτων).
 |
 |
Η βαριά (ή πυκνή) μορφή άνυδρου ανθρακικού νατρίου λαμβάνεται με μια αρχική ενυδάτωση της ελαφριάς μορφής προς σχηματισμό μονοϋδρίτη (Na2CO3·Η2Ο). Στη συνέχεια, ο μονοϋδρίτης αφυδατώνεται με θέρμανση παρέχοντας προϊόν με μεγαλύτερους κρυστάλλους και μεγαλύτερη μακροσκοπική πυκνότητα (περίπου 1 g/cm3). Μεταφέρεται εύκολα, δεν σχηματίζει σκόνη ούτε συσσωματώματα. Χρησιμοποιείται όποτε χρειάζεται το άλας στη στερεά του μορφή και κυρίως στην υαλουργία (το 50% της παραγωγής Na2CO3 κατευθύνεται στην υαλουργία), στην κατασκευή οπτικών ινών, στη μεταλλουργία, αλλά και ως συλλίπασμα (flux) για την σύντηξη πυριτίας και πυριτικών ορυκτών.
Σύνοψη κυριότερων χρήσεων του Na2CO3. To έχει αρκετές βιομηχανικές εφαρμογές της χημικής βιομηχανίας και άλλων σημαντικών βιομηχανιών. Σε ορισμένες περιπτώσεις η παραγωγή της χρησιμοποιείται ως δείκτης βιομηχανικής ανάπτυξης και οικονομικής προόδου των χωρών. Οι κύριες εφαρμογές είναι:
|
Μεγάλες ποσότητες Na2CO3 χρησιμοποιούνται για την παραγωγή της κοινής υάλου [πηγή]. |
- Παραγωγή υάλου (glass making). Η μίση περίπου παγκόσμια παραγωγή του ανθρακικού νατρίου χρησιμοποιείται στην παραγωγή υάλου. Να σημειωθεί ότι ενώ η καθαρή πυριτία (SiO2) τήκεται στους 1600-1700°C, διαλύεται σχετικά εύκολα σε τήγμα Na2CO3 (στους 850°C). Το προκύπτον μίγμα κατά τη ψύξη σχηματίζει υαλώματα. Η κοινή ύαλος (για φιάλες, υαλοπίνακες) παρασκευάζεται με σύντηξη SiO2 (άμμος), Na2CO3 (σόδα) και CaΟ (ασβέστη) και μικρότερων ποσοτήτων άλλων οξειδίων για χημική σταθερότητα, μεγαλύτερη διαύγεια και χρωματισμό. Μια τυπική σύνθεση κοινής υάλου (εκφράζεται σε % περιεκτικότητα στα επιμέρους οξείδια) είναι: SiO2 72%, Na2O 14,2%, CaO 10%, MgO 2,5% και Al2O3 0,6%.
- Στην υφαντουργία. Εξασφαλίζει το αλκαλικό περιβάλλον που απαιτείται για την επεξεργασία των υφαντικών ινών, όπως επίσης και για τη βαφή τους συμβάλλοντας στη σταθεροποίηση στην πρόσδεση του χρώματος με τις ίνες.
- Στη βιομηχανία τροφίμων. Το όξινο ανθρακικό νάτριο είναι η πλέον χρησιμοποιούμενη ουσία ως διογκωτικό πρόσθετο (rising agent) και συγχρόνως ρυθμιστικό της οξύτητας (acidity regulator) με κωδικό Ε500.
- Καθαρισμός υδάτων. Το ανθρακικό νάτριο χρησιμοποιείται ως αποσκληρυντικό του νερού (καταβυθίζει τα άλατα του νερού που δημιουργούν τη σκληρότητα του νερού ως ανθρακικά άλατα ασβεστίου και μαγνησίου. Η χρήση αυτή γίνεται σε βιομηχανική κλίμακα αλλά και για την οικιακή αποσκλήρυνση (χρησιμοποιείται σε ορισμένες σκόνες καθαρισμού).
 - Το
όξινο ανθρακικό νάτριο χρησιμοποιείται και την εξουδετέρωση της οξύτητας των
νερών σε κολυμβητήρια και πισίνες, π.χ. μετά από διαδικασίες καθαρισμού με
χλωρίωση.
- Το
όξινο ανθρακικό νάτριο χρησιμοποιείται και την εξουδετέρωση της οξύτητας των
νερών σε κολυμβητήρια και πισίνες, π.χ. μετά από διαδικασίες καθαρισμού με
χλωρίωση.
- Παραγωγή σαπώνων και απορρυπαντικών. Το ανθρακικό νάτριο είναι φθηνότερη χημική ουσία από το υδροξείδιο του νατρίου και συχνά το αντικαθιστά στην παρασκευή των σαπώνων. Ως πρόσθετο σε απορρυπαντικά χρησιμοποιείται για την αύξηση του pH και βελτίωση των απορρυπαντικών ιδιοτήτων τους. Με τη μορφή υπερανθρακικού νατρίου (sodium percarbonate, 2Na2CO3·3H2O2) στα απορρυπαντικά αυξάνει τη λευκαντική ικανότητά τους.
- Για την απομάκρυνση (scrubbing) του
διοξειδίου του θείου (SO2)
από καυσαέρια σε καμινάδες εργοστασίων και μονάδων παραγωγής ενέργειας με
βάση την αντίδραση Na2CO3
+ 2SO2
+ H2O
![]() 2NaHSO3
+ CO2.
Οι νέες νομοθεσίες προστασίας του περιβάλλοντος απαιτούν καυσαέρια που είναι
απαλλαγμένα από τον επικίνδυνο αέριο ρύπο διοξείδιο του θείου.
2NaHSO3
+ CO2.
Οι νέες νομοθεσίες προστασίας του περιβάλλοντος απαιτούν καυσαέρια που είναι
απαλλαγμένα από τον επικίνδυνο αέριο ρύπο διοξείδιο του θείου.
- Για την παραγωγή χάρτου. Το ανθρακικό νάτριο χρησιμοποιείται για την παρασκευή όξινου θειώδους νατρίου, το οποίο χρησιμοποιείται για τον διαχωρισμό λιγνίνης από την κυτταρίνη.
- Χρήση ως κοινού αλκάλεως στη χημική βιομηχανία ως φθηνότερο από το καυστικό νάτριο και ασφαλέστερο στη χρήση.
- Για την παραγωγή όξινου ανθρακικού νατρίου (μαγειρική σόδας) και ως υλικό πυροσβεστήρων.
- Μια παραδοσιακή φαρμακευτική χρήση του όξινου ανθρακικού νατρίου είναι η εξουδετέρωση της υπερβολικής οξύτητας του στομάχου (αντιόξινο φάρμακο). H χρήση του αυτή πλέον δεν ενδείκνυται, δεδομένου ότι υπάρχουν αποτελεσματικότερα αντιόξινα φάρμακα (εναιωρήματα υδροξειδίων μαγνησίου και αργιλίου) η δράση των οποίων διαρκεί περισσότερα και δεν επιβαρύνουν με νάτριο τον οργανισμό. Επίσης, ενέσεις διαλύματος NaHCO3 ενδείκνυνται για την αντιμετώπιση της μεταβολικής οξέωσης (metabolic acidosis) που μπορεί να προκληθεί ως αποτέλεσμα διαφόρων σοβαρών ασθενειών (νεφρικές νόσοι, σακχαρώδης διαβήτης, κυκλοφορικά προβλήματα) ή δηλητηριάσεων (από σαλικυλικά, βαρβιτουρικά, μεθανόλη).
 |
 |
 |
 |
 |
 |
|
Ορισμένα από τα βιβλία που αναφέρονται στην ιστορία, παραγωγή και χρήσεις των NaHCO3 και Na2CO3 (εξώφυλλα από την Amazon.com). |
|||||