Η χημική ένωση του μήνα
[Δεκέμβριος 2012]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής - Κωνσταντίνος Ευσταθίου, Καθηγητής
|
Εμφάνιση: Το υποχλωριώδες οξύ δεν έχει απομονωθεί σε καθαρή κατάσταση. Τα υδατικά του διαλύματα έχουν ένα ελαφρύ υποκίτρινο χρώμα και είναι ασταθή. Κάθε απόπειρα συμπύκνωσης των υδατικών διαλυμάτων του οδηγεί σε ταχεία αποσύνθεσή του. 'Εχει μια δυσάρεστη γλυκερή οσμή, που σε κάποιο βαθμό θυμίζει την οσμή του χλωρίου. Μοριακός τύπος:
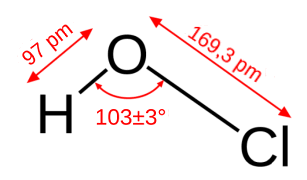
HClO Σχετική μοριακή μάζα: 52,46 pKa = 7,53 (ασθενές μονοπρωτικό οξύ) Τα άλατά του είναι ευδιάλυτα στο νερό, αλλά είναι εξίσου ασταθή και λίγα υποχλωριώδη άλατα έχουν απομονωθεί σε στερεή κατάσταση. 'Αλλα έχουν διατίθενται ως μίγματα με χλωριούχα άλατα, π.χ. η χλωράσβεστος με αναφερόμενο χημικό τύπο Ca(OCl)Cl ή Ca(OCl)2.CaCl2. 'Εχει απομονωθεί το άλας του με νάτριο ως πενταϋδρικό άλας NaΟCl.5H2O, με διαλυτότητα 29,3 g / 100 mL (0ºC). Τόσο το ελεύθερο οξύ, όσο και τα άλατά του είναι ισχυρά οξειδωτικά μέσα. |
|
|
Υποχλωριώδες οξύ και άλατά του Hypochlorous acid and hypochlorites |
Η ιστορία του υποχλωριώδους οξέος και των αλάτων του [Αναφ. 1, 2]
 |
 |
 |
|
Claude Louis Berthollet (1748-1822) |
Παλαιό εργοστάσιο παραγωγής διαλύματος υποχλωριώδους νατρίου (eau de Javel) στο προάστιο Ponthierry του Παρισιού (καρτ-ποστάλ του 1900) [πηγή]. |
Παλιά γαλλική διαφήμιση του νερού της Javel (eau de Javel) [πηγή]. |
Το υποχλωριώδες νάτριο (sodium hypochlorite, NaΟCl) είναι χημική ουσία που διατίθεται και χρησιμοποιείται αποκλειστικά σε υδατικό διάλυμα (από 3 έως 12%, με συνηθέστερη περιεκτικότητα περίπου 5%) ως λευκαντικό, απολυμαντικό και αποσμητικό υγρό για οικιακή χρήση, γνωστό στην Ελλάδα με τη γενική ονομασία χλωροκαθαριστικό ή χλωρίνη (η τελευταία ονομασία αποτελεί εμπορικό σήμα της εταιρίας ΕΛΑΪΣ - Unilever Hellas) και στις ΗΠΑ ως Clorox, Chlorox ή απλά bleach (λευκαντικό).
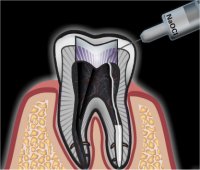
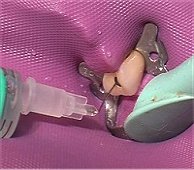
Διαλύματα υποχλωριώδους νατρίου χρησιμοποιούνται ευρύτατα για τον καθαρισμό και απολύμανση υδάτων, επιφανειών και χειρουργικών εργαλείων, επειδή σκοτώνει τους μικροοργανισμούς και τα βακτήρια. Επίσης, αραιά διαλύματα NaOCl χρησιμοποιούνται και στην οδοντιατρική (ενδοδοντία) ως αντιμικροβιακό για τον καθαρισμό και απολύμανση του ριζικού σωλήνα (root canal) κατά τις επεμβάσεις απονεύρωσης των δοντιών.
Το υποχλωριώδες νάτριο παρασκευάσθηκε για πρώτη φορά το 1789 από τον διάσημο χημικό Claude Louis Berthollet (1748-1822) στο εργαστήριό του στο Παρίσι. Για τη σύνθεση αυτή χρησιμοποίησε αέριο χλώριο που το διαβίβασε μέσω διαλύματος ανθρακικού νατρίου, οπότε πραγματοποιήθηκε η αντίδραση:
Na2CO3 + Cl2
![]() NaCl + NaΟCl + CO2
NaCl + NaΟCl + CO2
'Οταν ο Berthollet διαπίστωσε τις λευκαντικές ιδιότητες του προκύπτοντος διαλύματος και τις εμπορικές προοπτικές του, οργάνωσε μια μικρή βιομηχανία παραγωγής του και το διέθετε πλέον ως νερό της Javel ("Eau de Javel"), από το όνομα της συνοικίας του Παρισιού Javel (στο 15ο διαμέρισμα), όπου βρισκόταν το εργαστήριό του. Αρχικά το "νερό της Javel" χρησιμοποιήθηκε για τη λεύκανση του βάμβακα, σύντομα όμως διαπιστώθηκε η γενική απορρυπαντική, λευκαντική και απολυμαντική δράση του.
Στη συνέχεια, η αρχική μέθοδος του Bertholet αντικαταστάθηκε από μια άλλη φθηνότερη και αποτελεσματικότερη που βασιζόταν στην αντίδραση παρασκευής με διάλυμα ανθρακικού νατρίου. Η χλωράσβεστος παρασκευάζεται με διαβίβαση χλωρίου μέσω αιωρήματος εσβεσμένης ασβέστου σύμφωνα με την αντίδραση:
Ca(OCl)2 + Na2CO3
![]() CaCO3 + 2 NaOCl και παράλληλα: CaCl2 + Na2CO3
CaCO3 + 2 NaOCl και παράλληλα: CaCl2 + Na2CO3
![]() CaCO3 + 2 NaCl
CaCO3 + 2 NaCl
Ως εκ της μεθόδου παρασκευής, σε καμιά περίπτωση δεν λαμβάνεται καθαρό διάλυμα NaΟCl, αλλά πάντοτε λαμβάνεται ένα μικτό διάλυμα NaΟCl και NaCl. Η παρουσία χλωριούχων αλάτων δεν επηρεάζει καθόλου τις λευκαντικές και απολυμαντικές ιδιότητες του δραστικού υποχλωριώδους άλατος.
 |
 |
 |
|
Ο Σκώτος χημικός και βιομηχανος (εριουργία) Charles Tennant (1768-1838) που παρασκεύασε τη χλωράσβεστο (bleaching powder), μία από τις ελάχιστες εμπορικά διαθέσιμες στερεές μορφές υποχλωριώδους άλατος. Χρησιμοποιείται ακόμη ευρύτατα ως σκόνη αποχρωματισμού και κυρίως για απολυμάνσεις χώρων. |
||
Σε κάθε περίπτωση το διάλυμα NaΟCl είναι αρκετά αλκαλικό (pH περίπου 11) λόγω της υδρόλυσης του υποχλωριώδους ανιόντος, αφού το αντίστοιχο υποχλωριώδες οξύ είναι ασθενέστατο οξύ (pKa = 7,53), αλλά και της παρουσίας μικρής συγκέντρωσης ελεύθερου NaOH:
ΟCl- + H2O
![]() HΟCl + OH-
HΟCl + OH-
Η μέθοδος αυτή ήταν ιδιαίτερα διαδεδομένη για την παρασκευή διαλυμάτων υποχλωριώδους νατρίου διαφόρων συγκεντρώσεων και με διάφορες ονομασίες, όπως: "Eusol" (διάλυμα NaOCl 0,25%, εξουδετερωμένο με βορικό οξύ) και "Dakin's solution" (διάλυμα NaΟCl 0,5%). 'Aλλα εμπορικά ονόματα: Antiformin, Modified Dakin's solution, Surgical chlorinated soda solution, Carrel-Dakin solution.
Η ετήσια παγκόσμια παραγωγή υποχλωριώδους νατρίου εκτιμάται πως ξεπερνάει τα 4 εκατομμύρια τόννους.
Στερεά υποχλωριώδη άλατα
Η χλωράσβεστος (bleaching powder, λευκαντική σκόνη) αποτελεί μια "στερεή" μορφή υποχλωριώδους άλατος και παρασκευάσθηκε για πρώτη φορά από τον Σκώτο χημικό Charles Tennant (1768-1838) το 1799. Ο Tennant υπήρξε ιδρυτής μιας μεγάλης υφαντουργικής βιομηχανίας (εριουργίας), όπου η σημαντικό πρόβλημα αποτελούσε πάντοτε ο αποχρωματισμός του ερίου (μαλλιού). Λόγω της οσμής χλωρίου και υποχλωριώδους οξέος που ανέδιδε (διασπάται αργά από την υγρασία και το ατμοσφαιρικό CΟ2), στην Ελλάδα ήταν γνωστή και ως βρωμούσα.
Πρέπει να σημειωθεί ότι η χλωράσβεστος δεν είναι καθαρό υποχλωριώδες άλας. Συχνά, ως χημικός τύπος της χλωρασβέστου αναφέρεται ο τύπος CaOCl2, ο οποίος όμως δεν βοηθά στην αναγνώρισή της ως υποχλωριώδες άλας. Διευκρινιστικότερος είναι ο χημικός τύπος Ca(OCl)Cl που δηλώνει μικτό υποχλωριώδες-χλωριούχο άλας του ασβεστίου. Στην πραγματικότητα η χλωράσβεστος είναι μίγμα Ca(ΟCl)2, CaCl2, Ca(ΟΗ)2 και με βάση τις αναλογίες των επιμέρους συστατικών, ο χημικός τύπος που αποδίδει κάπως ακριβέστερα τη σύστασή της είναι ο ακόλουθος: Ca(OCl)2·CaCl2·Ca(OH)2·2H2O [Αναφ. 3].
 Η
χλωράσβεστος παρασκευάζεται με διαβίβαση χλωρίου σε πυκνό αιώρημα υδροξειδίου του
ασβεστίου (εσβεσμένη άσβεστος), γεγονός που εξασφαλίζει αποτελεσματικότερη
δέσμευση του χλωρίου, σύμφωνα με την αντίδραση:
Η
χλωράσβεστος παρασκευάζεται με διαβίβαση χλωρίου σε πυκνό αιώρημα υδροξειδίου του
ασβεστίου (εσβεσμένη άσβεστος), γεγονός που εξασφαλίζει αποτελεσματικότερη
δέσμευση του χλωρίου, σύμφωνα με την αντίδραση:
2 Ca(OH)2 + 2 Cl2
![]() Ca(OCl)2 + CaCl2 + H2O
Ca(OCl)2 + CaCl2 + H2O
Η χλωράσβεστος σπάνια χρησιμοποιείται πλέον ως σκόνη αποχρωματισμού. Κυρίως χρησιμοποιείται ως απολυμαντικό μεγάλων χώρων συναθροίσεων (σχολεία, στρατώνες) σε περιπτώσεις εμφάνισης κρουσμάτων λοιμωδών νόσων (π.χ. μηνιγγίτιδα, ηπατίτιδα). Μεγάλες ποσότητες χλωρασβέστου χρησιμοποιήθηκαν κατά το παρελθόν και χρησιμοποιούνται ακόμη για απολυμάνσεις χώρων σε εποχές σοβαρών επιδημιών (π.χ. χολέρας). Σήμερα, η χρήση της στερεής χλωρασβέστου είναι περιορισμένη, αφού έχει αντικατασταθεί από τα διάφορα υγρά διαλύματα χλωροκαθαριστικών.
'Αλλα στερεά υποχλωριώδη άλατα. Σταθερά υποχλωριώδη άλατα που έχουν απομονωθεί καθαρά σε στερεή κατάσταση είναι εκείνα των Li, Ca, Sr και Ba. Από αυτά σε σχετικά μεγάλες ποσότητες παρασκευάζεται και είναι εμπορικώς διαθέσιμο το υποχλωριώδες λίθιο (lithium hypochlorite, LiOCl).
Το LiOCl χρησιμοποιείται κυρίως για την απολύμανση του νερού σε πισίνες και κολυμβητήρια. Τα στερεά χλωροκαθαριστικά που βασίζονται στο LiOCl πλεονεκτούν ως προς τη χλωράσβεστο, κατά το ότι είναι πλήρως διαλυτά και δεν αυξάνουν τη "σκληρότητα" του ύδατος, δηλαδή την περιεκτικότητά του σε άλατα ασβεστίου. Τα διάφορα εμπορικά σκευάσματα υποχλωριώδους λιθίου περιέχουν μόνο 25-30% LiOCl, 36% NaCl, 13% Na2SO4 και μικρότερες ποσότητες άλλων αλάτων, όπως επίσης και μικρή ποσότητα LiOH. Το άνυδρο Na2SO4 δρα ως δεσμευτικό της υγρασίας αυξάνοντας τον χρόνο ζωής των εμπορικών προϊόντων [Αναφ. 2δ].
Σε στερεά κατάσταση έχει απομονωθεί και το NaOCl, αλλά όχι σε καθαρή κατάσταση, ενώ το KOCl είναι γνωστό μόνο σε διάλυμα.
"Διαθέσιμο χλώριο, %" [Αναφ. 3, 4] Τα διάφορα υγρά ή στερεά σκευάσματα εμπορικών υποχλωριωδών αλάτων χαρακτηρίζονται από τον βαθμό % διαθέσιμου χλωρίου (available chlorine), ο οποίος ορίζεται ως τα g Cl2 που εκλύεται από 100 g του στερεού ή υγρού σκευάσματος κατά την οξύνιση. Το % διαθέσιμο χλώριο προσδιορίζεται εύκολα με ιωδιομετρική ογκομέτρηση: Ποσότητα δείγματος αναμιγνύεται με περίσσεια KI και εξουδετερώνεται με την προσθήκη οξικού οξέος. Το επιθυμητό pH πρέπει να είναι μικρότερο από 8, όχι όμως ισχυρώς όξινο για να αποφευχθεί η συνογκομέτρηση των χλωρικών αλάτων, τα οποία δρουν ως ισχυρά οξειδωτικά μόνο σε ισχυρώς όξινα διαλύματα. Το παραγόμενο κατά την αντίδραση ιώδιο ογκομετρείται με πρότυπο διάλυμα Na2S2O3 (θειοθειικό νάτριο). Ως δείκτης χρησιμοποιείται άμυλο, το οποίο, όπως ισχύει σε όλες τις ιωδομετρικές ογκομετρήσεις, πρέπει να προστίθεται προς το τέλος της ογκομέτρησης και χρωματίζεται έντονα κυανούν από μόλις ορατά ίχνη ελεύθερου ιωδίου. Οι αντιδράσεις έχουν ως εξής:
Στάδιο 1ο (Παραγωγή Ι2):
HClO + H+ +
2 I-
Στάδιο 2ο (Ογκομέτρηση Ι2):
I2 +
S2O32-
Από τις παραπάνω αντιδράσεις είναι προφανές ότι 1 mol HClO απελευθερώνει 1 mol Ι2 και επειδή 1 mol Cl2 απελευθερώνει 1 mol Ι2, 1 mol HClO ισοδυναμεί προς 1 mol Cl2. Επομένως: 1 mol καθαρού NaOCl (74,5 g) παρέχει 1 mol Cl2 (71 g) και έτσι το "διαθέσιμο χλώριο, %" του καθαρού NaOCl είναι 95,3% και επομένως το διαθέσιμο χλώριο ενός τυπικού χλωροκαθαριστικού διαλύματος με 5,25% NaOCl είναι 95,3 x (5,25/100) = 5%. Με ανάλογους υπολογισμούς βρίσκουμε ότι το διαθέσιμο χλώριο του καθαρού LiOCl είναι 121%, επομένως το εμπορικό προϊόν με περιεκτικότητα 30% σε LiOCl θα έχει διαθέσιμο χλώριο 121x(30/100) = 36,3%. Για τη χλωράσβεστο, αν θεωρηθεί ότι ο τύπος Ca(OCl)2·CaCl2·Ca(OH)2·2H2O αποδίδει τη σύνθεση του εμπορικού προϊόντος, το διαθέσιμο χλώριο είναι 38,7%. Ο ιωδιομετρικός προσδιορισμός του % διαθέσιμου χλωρίου διάφορων διαλυμάτων NaOCl αποτελεί μια τυπική και απλή άσκηση ιωδιομετρικής τιτλοδότησης για τα Εργαστήρια Ποσοτικής Ανάλυσης πολλών Τμημάτων Χημείας. |
 |
 |
 |
|
Εμπορικά διαλύματα NaΟCl για βιομηχανική, επαγγελματική και οικιακή χρήση. Τα διαλύματα αυτά πάντοτε περιέχουν NaCl και μικροποσότητες NaOH. |
Μονάδα επιτόπιας παραγωγής και αποθήκευσης NaΟCl. Τα πυκνά διαλύματα NaOCl δεν είναι ιδιαίτερα σταθερά και διασπώνται σταδιακά με σχηματισμό χλωρικών αλάτων ή οξυγόνου, ανάλογα με τη θερμοκρασία αποθήκευσης και την παρουσία ιχνοποσοτήτων μεταλλικών ακαθαρσιών [πηγή]. |
|
Παρασκευή υποχλωριώδους οξέος και των αλάτων του [Αναφ. 3]
Βιομηχανική παρασκευή. Προς το τέλος του 19ου αιώνα ο E. S. Smith καθιέρωσε και έλαβε σχετικό δίπλωμα ευρεσιτεχνίας, την παρασκευή του NaOCl με την ηλεκτρόλυση άλμης (συμπυκνωμένου θαλασσινού νερού). Η μέθοδος αυτή αποτελεί σήμερα ουσιαστικώς την αποκλειστική μέθοδο βιομηχανικής παρασκευής υδροξειδίου του νατρίου (NaOH) και αερίου χλωρίου (Cl2) και είναι γνωστή ως διεργασία Chloralkali (Chloralkali process). Στα χρησιμοποιούμενα ηλεκτρολυτικά στοιχεία η κάθοδος (όπου παράγεται το NaOH) διαχωρίζεται από την άνοδο (όπου παράγεται Cl2) παλαιότερα με τη βοήθεια ρέοντος υδραργύρου, που δρούσε ως κάθοδος, σήμερα με τη βοήθεια μεμβρανών για να αποφευχθεί έτσι η ανάμιξη των προϊόντων (βλέπε: Χημική ένωση του μήνα: Χλωριούχο νάτριο).
Στην περίπτωση που το επιθυμητό προϊόν είναι τo υποχλωριώδες νάτριο (NaΟCl) ή το χλωρικό νάτριο (NaClO3), η διαδικασία απλουστεύεται αφού ο διαχωρισμός καθόδου - ανόδου δεν είναι πλέον απαραίτητος. Σε θερμοκρασίες κάτω από 40ºC το κύριο προϊόν της ανάμιξης χλωρίου και υδροξειδίου του νατρίου είναι το υποχλωριώδες νάτριο, ενώ σε υψηλότερες (>60ºC) είναι το χλωρικό νάτριο. Οι συνολικές ηλεκτρολυτικές αντιδράσεις μπορούν να γραφούν ως εξής:
NaCl + H2O + ηλεκτρική ενέργεια
![]() NaΟCl + H2
NaCl + 3 H2O + ηλεκτρική
ενέργεια
NaΟCl + H2
NaCl + 3 H2O + ηλεκτρική
ενέργεια
![]() NaClO3 + 3 H2
NaClO3 + 3 H2
 |
|
|
Αριστερά: Μονάδα επιτόπιας παραγωγής υποχλωριώδους νατρίου με ηλεκτρόλυση άλμης [πηγή]. Δεξιά: Μονάδα παραγωγής διαλύματος NaOCl με πρώτες ύλες Cl2 και NaOH (Bleach Plant). Η εικονιζόμενη μονάδα παράγει διάλυμα NaOCl συγκέντρωσης 20-200 g/L με ρυθμό 25-150 γαλονιών/min [πηγή]. |
|
Σήμερα υπάρχει μια βελτιωμένη μέθοδος, γνωστή ως Hooker process, η οποία χρησιμοποιείται για την παραγωγή NaOCl σε βιομηχανική κλίμακα. Κατά τη μέθοδο αυτή, αέριο χλώριο διοχετεύεται μέσω ψυχρού και αραιού διαλύματος υδροξειδίου του νατρίου, οπότε σχηματίζεται μίγμα NaΟCl και NaCl. Οι πραγματοποιούμενες αντιδράσεις αποτελούν τυπικά παραδείγματα αντιδράσεων αυτοοξειδοαναγωγής (ή ανισοκατανομής, disproportionation reactions).
Σε συνθήκες που ευνοούν τον σχηματισμό NaOCl (χαμηλές θερμοκρασίες) κατά το ήμισυ το Cl(0) ανάγεται προς Cl(-1), δηλ. προς χλωριούχα ανιόντα και κατά το υπόλοιπο ήμισυ οξειδώνεται προς Cl(+1), δηλ. προς υποχλωριώδη ανιόντα (αντίδραση 1). Σε συνθήκες που ευνοούν τον σχηματισμό NaClO3 (υψηλές θερμοκρασίες) πραγματοποιείται μια άλλη αντίδραση αυτοοξειδοαναγωγής, όπου κατά τα 5/6 το Cl(0) ανάγεται προς Cl(-1) και κατά το υπόλοιπο 1/6 οξειδώνεται προς Cl(+5), δηλ. προς χλωρικά ανιόντα (αντίδραση 2):
Χαμηλή θερμοκρασία: Cl2 + 2
OH-
![]() ClO- + Cl- + H2O (1)
ClO- + Cl- + H2O (1)
Υψηλή
θερμοκρασία: 3 Cl2 + 6 OH-
![]() ClO3- + 5 Cl- + H2O (2)
ClO3- + 5 Cl- + H2O (2)
Τα πολύ πυκνά διαλύματα NaΟCl (>15%) λόγω της περιορισμένης σταθερότητάς τους συνήθως παρασκευάζονται επιτόπου, δηλαδή εκεί όπου και θα χρησιμοποιηθούν (π.χ. σε εγκαταστάσεις απολύμανσης και καθαρισμού υδάτων). Τυπικές συνθέσεις των εμπορικών διαλυμάτων NaOCl είναι: 5-15% NaOCl, 0,5-1,5% NaCl και 0,25-0,35% NaOH [Αναφ. 2β]. Σε άλλα διαλύματα NaOCl ειδικής χρήσης οι συγκεντρώσεις NaOH μπορεί να είναι πολύ μεγαλύτερες. Τα κοινά διαλύματα υποχλωριώδους νατρίου για οικιακή χρήση (χλωροκαθαριστικά) περιέχουν NaOCl 3 έως 6%. Η πυκνότητα ενός διαλύματος NaOCl 5% είναι περίπου 1,1 g/mL.
Καθαρό HOCl και διαλύματά του. Σε βιομηχανική κλίμακα, διάλυμα υποχλωριώδους οξέος (με συγκέντρωση μέχρι και 5 Μ) απαλλαγμένο από την παρουσία χλωριούχων παρασκευάζεται με αντίδραση εφυδάτωσης του οξειδίου του διχλωρίου (dichlorine monoxide, Cl2O, ασταθές καφε-κίτρινο αέριο, σ.τ. -120,6ºC, σ.ζ. 2,2ºC), που αποτελεί τον ανυδρίτη του υποχλωριώδους οξέος (αντίδραση 3). Το Cl2O λαμβάνεται σε βιομηχανική κλίμακα με διαβίβαση αερίου Cl2 μέσω αντιδραστήρα που περιέχει υγραμένο Na2CO3 (αντίδραση 4)
Cl2O + H2O
![]() 2 HOCl (3)
2 Cl2 + 2 Na2CO3 + H2O
2 HOCl (3)
2 Cl2 + 2 Na2CO3 + H2O
![]() 2 NaHCO3 + 2 NaCl + Cl2O (4)
2 NaHCO3 + 2 NaCl + Cl2O (4)
Η αντίδραση εφυδάτωσης του Cl2O (αντίδραση 3) είναι σε κάποιο βαθμό αντιστρεπτή (Κ = 280 mol/L, 0ºC), με αποτέλεσμα σε πυκνά διαλύματα HOCl μέρος του Cl(+1) να βρίσκεται στη μορφή Cl2O, το οποίο μάλιστα μπορεί να διαχωριστεί ως ξεχωριστή στιβάδα και στο οποίο οφείλεται πιθανώς το κίτρινο χρώμα τους.
Πρέπει να τονισθεί ότι το υποχλωριώδες οξύ λόγω της αστάθειάς του δεν αποτελεί εμπορικώς διαθέσιμη χημική ουσία, αλλά όπου χρειάζεται ως αντιδραστήριο παρασκευάζεται και χρησιμοποιείται επί τόπου.
Εργαστηριακή παρασκευή. Λόγω της ευρύτατης εμπορικής διαθεσιμότητας διαλυμάτων NaOCl σε πολύ χαμηλό κόστος, σπάνια απαιτείται η εργαστηριακή παρασκευή τους, η οποία βασίζεται στην αντίδραση (1), δηλαδή στη διαβίβαση καθαρού χλωρίου μέσω ψυχόμενου υδατικού διαλύματος NaOH. Συνήθως, στο εργαστήριο παρασκευάζεται NaOCl σε περιπτώσεις που απαιτούνται πυκνά διαλύματά του (>15%), τα οποία δεν είναι ιδιαίτερα σταθερά και δεν διατίθενται στο εμπόριο ή διαλύματα απαλλαγμένα από ιχνοποσότητες μεταλλοϊόντων που πιθανώς συναντούνται στα εμπορικά διαλύματα.
Διάλυμα HOCl 25% έχει ληφθεί με αντίδραση στερεού υδρίτη χλωρίου (λαμβάνεται με διαβίβαση αερίου χλωρίου μέσω μίγματος πάγου-ύδατος) με οξείδιο υδραργύρου, η οποία ακολουθείται με απόσταξη υπό χαμηλή πίεση [Αναφ. 1α]:
2 Cl2·6H2O
+ HgΟ
![]() 2 HOCl + HgCl2 + 11 H2O
2 HOCl + HgCl2 + 11 H2O
Διαλύματα υποχλωριώδους οξέος σε οργανικούς διαλύτες (κετόνες, νιτρίλια, εστέρες) απαλλαγμένα από χλωριούχα, μπορούν να ληφθούν με απλή εκχύλιση διαλύματος NaΟCl προσεκτικά εξουδετερωμένου με αραιό διάλυμα οξέος [Αναφ. 3α].
Επιπλέον, υπάρχει δυνατότητα απλής παρασκευής καθαρού υδατικού διαλύματος HOCl για άμεση χρήση με απόσταξη υπό κενό εμπορικού διαλύματος NaOCl (Clorox) μετά από ρύθμιση του pH του στην περιοχή 7 έως 8 με αραιό θειικό οξύ. Η περιεκτικότητα του λαμβανόμενου διαλύματος σε HClO προσδιορίζεται φασματοφωτομετρικά (ε235 nm = 100) ή ιωδιομετρικά [Αναφ. 3γ].
|
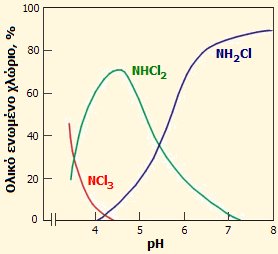
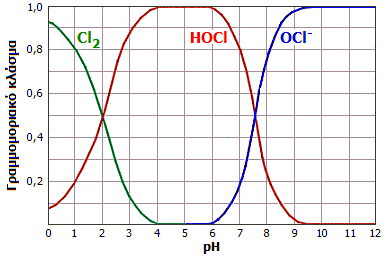
Σωματιδιακή κατανομή διαλύματος υποχλωριώδους οξέος ως συνάρτηση του pH: Για pH>4 η κατανομή είναι η τυπική ενός ασθενούς οξέος. Σε πιο όξινα διαλύματα το HOCl διασπάται παρέχοντας Cl2 [πηγή]. |
Χημικές ιδιότητες υποχλωριώδους οξέος και των αλάτων του
Το υποχλωριώδες οξύ (hypochlorous acid, ΗOCl) και τα υποχλωριώδη άλατα είναι οι τυπικές ενώσεις του χλωρίου σε οξειδωτική κατάσταση +1. Πρόκειται για ισχυρές οξειδωτικές ενώσεις, των οποίων η οξειδωτική δράση μπορεί να εμφανισθεί σε πολύ αραιά διαλύματα, σε κάθε pH και σε θερμοκρασία δωματίου, σε αντίθεση με το υπερχλωρικό οξύ (perchloric acid, HClO4) και τα υπερχλωρικά άλατα, τυπικές ενώσεις του χλωρίου σε οξειδωτική κατάσταση +7, η οξειδωτική δράση των οποίων εμφανίζεται αποκλειστικώς σε πυκνά, θερμά και όξινα διαλύματα (βλέπε: Χημική ένωση του μήνα: Υπερχλωρικό οξύ και άλατά του).
Ως οξύ το HOCl είναι ασθενέστατο οξύ με pKa = 7,53, ισχυρότερο από το βορικό οξύ (pKa = 9,22) και ασθενέστερο από το ανθρακικό οξύ (pKa,1 = 6,38). Το γεγονός ότι είναι ασθενέστερο από το ανθρακικό οξύ σημαίνει ότι διαλύματα υποχλωριωδών αλάτων προσβάλλονται από το διοξείδιο του άνθρακα της ατμόσφαιρας απελευθερώνοντας υποχλωριώδες οξύ σύμφωνα με την ισορροπία:
ClO- + CO2
+ H2O
![]() HOCl + HCO3-
HOCl + HCO3-
Η σωματιδιακή κατανομή του υποχλωριώδους οξέος απεικονίζεται στο διπλανό διάγραμμα. Σε τιμές pH > 4, η κατανομή αδιάστατου οξέος και ανιόντος είναι η τυπική ενός ασθενούς μονοπρωτικού οξέος. 'Ετσι π.χ., σε pH ίσο προς το pKa



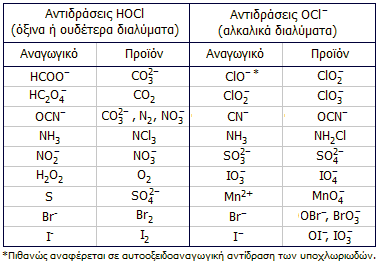 Το
υποχλωριώδες οξύ και τα άλατά του ως οξειδωτικά μέσα.
Το υποχλωριώδες οξύ και τα άλατά του
περιλαμβάνονται στα ισχυρότερα κοινά οξειδωτικά αντιδραστήρια. Ως οξειδωτικό δρα
τόσο το αδιάστατο οξύ (σε ουδέτερα ή όξινα διαλύματα), όσο και το ανιόν του (σε
αλκαλικά διαλύματα). Τυπικά παραδείγματα οξειδώσεων (αντιδρώντα, προϊόντα)
δίνονται στον παραπλεύρως πίνακα [
Το
υποχλωριώδες οξύ και τα άλατά του ως οξειδωτικά μέσα.
Το υποχλωριώδες οξύ και τα άλατά του
περιλαμβάνονται στα ισχυρότερα κοινά οξειδωτικά αντιδραστήρια. Ως οξειδωτικό δρα
τόσο το αδιάστατο οξύ (σε ουδέτερα ή όξινα διαλύματα), όσο και το ανιόν του (σε
αλκαλικά διαλύματα). Τυπικά παραδείγματα οξειδώσεων (αντιδρώντα, προϊόντα)
δίνονται στον παραπλεύρως πίνακα [