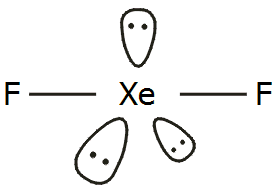Η χημική ένωση του μήνα
[Μάιος 2011]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής - Κωνσταντίνος Ευσταθίου, Καθηγητής
|
Φυσικoχημικές ιδιότητες [Αναφ. 1]: Εμφάνιση: 'Αχρωμο ή λευκό κρυσταλλικό στερεό με δυσάρεστη οσμή που θυμίζει την οσμή όζοντος ή του χλωρίου. Μοριακός τύπος: XeF2 Σχετική μοριακή μάζα: 169,29 Σημείο τήξης: 128,6ºC (εξαχνώνεται σε χαμηλότερη θερμοκρασία) Σημείο ζέσεως: 114ºC (εξάχνωση) Πυκνότητα: 4,32 g/cm3 Τάση ατμών (στους 25ºC): 6,0x102 Pa (ή 4,5 Torr) Διαλυτότητα: 'Αφθονα διαλυτό σε άνυδρο HF (167 g στα 100 g HF στους 30ºC), όπως και στα BrF5, BrF3, IF5 χωρίς κάποια αντίδραση. Διαλυτό στα CCl4 και CCl3F (με βραδεία ανταλλαγή του Cl με F). Διαλυτό σε CHCl3, CH2Cl2 και CH2Br2 (με ταχύτερη ανταλλαγή του Η με F). Διαλυτό στο CH3CN (αντιδρά πολύ αργά). Διαλυτό και στο νερό (25 g/L στους 5ºC) ως προς το οποίο εμφανίζεται κινητικά σταθερό (υδρολύεται αργά) και από το οποίο μπορεί να εκχυλιστεί (π.χ. με CCl4) ή να αποσταχθεί. Τοξικότητα: τοξικό, καυστικό, δημιουργεί HF και φθοριούχα όταν έρθει σε επαφή με σωματικά υγρά. Επικινδυνότητα: Ισχυρό οξειδωτικό. Εκρήγνυται σε επαφή με οξειδώσιμες ουσίες |
|
|
Διφθοριούχο Ξένο Xenon Difluoride |
Το διφθοριούχο ξένο είναι μια από τις σταθερότερες χημικές ενώσεις των ευγενών αερίων και συγχρόνως ένα ήπιο μέσο φθορίωσης
για την οργανική σύνθεση. Μπορεί να θεωρηθεί ως φθόριο σε μια πιο εύχρηστη και λιγότερο επικίνδυνη μορφή.
 Γενικά για το διφθοριούχο ξένο
Γενικά για το διφθοριούχο ξένο
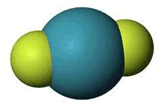
Το διφθοριούχο ξένο (XeF2) είναι ίσως η σταθερότερη ένωση στοιχείου της ομάδας των ευγενών αερίων. Πρόκειται για ένα σταθερό λευκό κρυσταλλικό σώμα το οποίο τήκεται χωρίς διάσπαση στους 128,6ºC, πριν όμως τηχθεί αρχίζει να εξαχνώνεται, όπως συμβαίνει με πολλές ουσίες (π.χ. το ναφθαλίνιο, το κρυσταλλικό ιώδιο).
Το XeF2 παρασκευάζεται εύκολα με άμεση αντίδραση των συστατικών του (με περίσσεια ξένου). 'Εχει δριμεία οσμή που θυμίζει σε μεγάλη αραίωση το όζον ή το χλώριο, αν και σε ορισμένες περιπτώσεις αναφέρεται ως σχεδόν άοσμο. Το βέβαιο είναι ότι έκθεσή του στην υγρασία του αέρα οδηγεί στον σταδιακό σχηματισμό HF. Αντιδρά με το νερό αλλά με αρκετά αργό ρυθμό και έτσι αναφέρεται ως σχετικά ευδιάλυτο σε αυτό (25 g/L στους 5ºC). Σε όξινα υδατικά διαλύματα εμφανίζεται ως σταθερότερο, ενώ σε αλκαλικά διαλύματα υδρολύεται σχεδόν αμέσως.
Σε κάθε περίπτωση το XeF2 μπορεί να θεωρηθεί ως μια σταθερή ένωση, που μπορεί να αποθηκευθεί επ' αόριστο σε φιάλες από νικέλιο (παθητικοποιημένες με επιφανειακό στρώμα NiF2) ή από πολυφθοροαιθυλένιο (Teflon) και η εμπορική διάθεσή του είναι η ασφαλής. Το XeF2 χρησιμοποιείται ως μια ασφαλής πηγή φθορίου, σε αντίθεση με άλλες, όπως π.χ. το ClF3 (βλ. Χημική ένωση του μήνα: Τριφθοριούχο χλώριο) ως προς τις οποίες βέβαια υστερεί μόνο ως προς το μεγάλο κόστος του. Το XeF2 χρησιμοποιείται κατά κύριο λόγο στη βιομηχανία κατασκευής μικρο-ηλεκτρομηχανικών συστημάτων (micro electro mechanical systems, MEMS), ως εξαιρετικό διαβρωτικό αντιδραστήριο πρακτικά τελείως επιλεκτικό ως προς το πυρίτιο. Ακόμη, αποτελεί ένα εξαιρετικά ήπιο και εύχρηστο αντιδραστήριο φθορίωσης οργανικών ενώσεων.
Ιστορική αναδρομή στην ανακάλυψη των ευγενών αερίων
Το 1894, ο 'Αγγλος
φυσικός John William Strutt, γνωστότερος ως
Λόρδος Rayleigh
(1842-1919)
διαπίστωσε μια μικρή διαφορά στην πυκνότητα μεταξύ του αζώτου
που ελάμβανε ως προϊόν χημικής αντίδρασης, σε σχέση με την πυκνότητα του
αζώτου ελάμβανε από τον ατμοσφαιρικό αέρα. Το πρώτο
το παρασκεύαζε με διαβίβαση καθαρού Ν2Ο πάνω από ερυθροπυρακτωμένο σίδηρο (
Fe + N2O
![]() FeO + N2
) ή με θερμική διάσπαση του νιτρώδους αμμωνίου
( ΝΗ4ΝΟ2
FeO + N2
) ή με θερμική διάσπαση του νιτρώδους αμμωνίου
( ΝΗ4ΝΟ2
![]() Ν2
+ 2Η2Ο
).
Το δεύτερο το ελάμβανε με χημική δέσμευση του Ο2
από τον αέρα με ερυθροπυρακτωμένο σίδηρο (π.χ. 2Fe + O2
Ν2
+ 2Η2Ο
).
Το δεύτερο το ελάμβανε με χημική δέσμευση του Ο2
από τον αέρα με ερυθροπυρακτωμένο σίδηρο (π.χ. 2Fe + O2
![]() 2FeO) ή μέσω αντίδρασής του με
υδροξείδιο του σιδήρου(ΙΙ) ( 4Fe(OH)2
+ O2 + 2H2O
2FeO) ή μέσω αντίδρασής του με
υδροξείδιο του σιδήρου(ΙΙ) ( 4Fe(OH)2
+ O2 + 2H2O
![]() 4Fe(OH)3 ).
Το άζωτο που λαμβανόταν από τον ατμοσφαιρικό αέρα ήταν πάντοτε κατά 0,5% ειδικώς
βαρύτερο από το άζωτο, που λαμβανόταν ως προϊόν χημικής αντίδρασης.
Απόσπασμα της σχετικής δημοσίευσης του Rayleigh δείχνεται
παρακάτω
[Αναφ. 2α].
4Fe(OH)3 ).
Το άζωτο που λαμβανόταν από τον ατμοσφαιρικό αέρα ήταν πάντοτε κατά 0,5% ειδικώς
βαρύτερο από το άζωτο, που λαμβανόταν ως προϊόν χημικής αντίδρασης.
Απόσπασμα της σχετικής δημοσίευσης του Rayleigh δείχνεται
παρακάτω
[Αναφ. 2α].
Το 1895, ο Σκότος χημικός William Ramsay (1852-1916), σε συνεργασία με τον Λόρδο Rayleigh, επανέλαβε τα πειράματα, χρησιμοποιώντας και επιπλέον μεθόδους παρασκευής "ατμοσφαιρικού" και "χημικού" αζώτου. Οι δύο επιστήμονες διαπίστωσαν ότι σε όλες τις περιπτώσεις τα επίπονα πειράματά τους οδηγούσαν στο συμπέρασμα ότι η διαφορά αυτή δεν ήταν τυχαία, αλλά συστηματική. Αυτήν τη διαφορά απέδωσαν σε κάποιο άλλο, άγνωστο μέχρι τότε, συστατικό της ατμόσφαιρας, γεγονός που τους οδήγησε στην ανακάλυψη του αέριου στοιχείου αργό [Αναφ. 2β]. Θα πρέπει να σημειωθεί ότι ήδη από το 1785, ο διάσημος χημικός Henry Cavendish υποπτευόταν την παρουσία ενός αδρανούς αερίου στην ατμόσφαιρα, το οποίο όμως ποτέ δεν είχε απομονώσει.
|
|
(1842-1919) |
(1852-1916) |
(1872-1961) |
Τα επόμενα 4-5 χρόνια ο Ramsey σε συνεργασία με τον Morris Travers, με κλασματική απόσταξη του υγροποιημένου αέρα ανακάλυψε και τα υπόλοιπα ευγενή αέρια, δηλ. το νέον, το κρυπτόν, το ξένον, όπως και το ελαφρύτερο απ' όλα, το ήλιο, που ήταν ήδη γνωστή η παρουσία του στον ήλιο από φασματοσκοπικά δεδομένα. Ο Ramsey διαπίστωσε ότι τα αέρια αυτά ήταν χημικώς αδρανή και τα ονόμασε ευγενή αέρια. Αρκετά αργότερα, το 1910, απομόνωσε ως προϊόν ραδιενεργού διάσπασης του ραδίου το βραχύβιο ραδιενεργό ευγενές αέριο, το ραδόνιο (χρόνος υποδιπλασιασμού για το κύριο ισότοπό του, το Rn-222: 3,8 d).
Το 1904, ο Rayleigh τιμήθηκε με το Nobel Φυσικής για τις μελέτες του πάνω στην πυκνότητα των αερίων και την ανακάλυψη του αργού και με το Nobel Χημείας ο Ramsey για την ανακάλυψη των ευγενών αερίων και την κατάταξή τους στον περιοδικό πίνακα. Η περιεκτικότητα της ατμόσφαιρας σε ευγενή αέρια και ορισμένες ιδιότητές του δίνονται συγκριτικά στον επόμενο πίνακα. Σήμερα, τα ευγενή αέρια Ne, Ar, Kr και Xe παράγονται με κλασματική απόσταξη του υγροποιημένου αέρα, ενώ το He λαμβάνεται από το φυσικό αέριο ορισμένων περιοχών, που μπορεί να περιέχει He και μέχρι 7%.
|
Ευγενές αέριο: |
He |
Ne |
Ar |
Kr |
Xe |
Rn |
| Περιεκτικότητα στην ατμόσφαιρα (ppmv) | 5,20 | 18,2 | 9340 | 1,10 | 0,086 | (0,06-18)x10-19 |
| Σημείο ζέσεως (ºC )* | -268,9 | -246,1 | -185,9 | -153,2 | -108,1 | -61,7 |
| Σημείο τήξεως (ºC ) | -272,2 (2,5 MPa) | -248,6 | -189,4 | -157,4 | -111,7 | -71 |
| Πυκνότητα (g/mL στο σ.ζ.) | 0,145 | 1,207 | 1,40 | 2,41 | 3,06 | 4,4 |
| Ενέργεια 1ου ιοντισμού (kJ/mol) | 2372,3 | 2080,7 | 1520,6 | 1350,8 | 1170,4 | 1037 |
|
* σ.ζ. Ο2 = -183ºC, Ν2 = -195,8ºC
Εκπεμπόμενο φως κατά την τοποθέτηση του αερίου σε ισχυρό ηλεκτρικό φορτίου |
 |
 |
 |
 |
 |
 |
|
Τυπικό στροβοσκόπιο με λυχνία ξένου (τύπου φλας) |
Τυπική λυχνία τόξου ξένου |
Χρήσεις του ξένου
Το ξένο είναι το μικρότερο σε αναλογία ευγενές αέριο στην ατμόσφαιρα. Ανακαλύφθηκε από τον William Ramsay and Morris Travers τον Ιούλιο του 1898 αμέσως μετά την ανακάλυψη από τους ίδιους του κρυπτού και του νέου. Παρά την ελάχιστη περιεκτικότητα της ατμόσφαιρας σε ξένο, λόγω το σχετικά μεγάλου σημείου ζέσεως (-108,1ºC), εμφανίζεται σε πολύ μεγαλύτερη συγκέντρωση σε υγροποιημένο αέρα που έχει αφεθεί να εξατμισθεί με βραδύ ρυθμό.
|
|
|
|
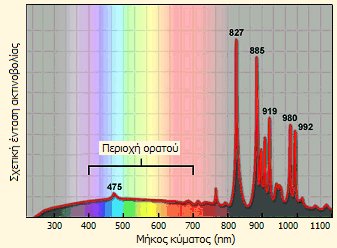
| Τυπική λυχνία τόξου ξένου και το φάσμα του εκπεμπόμενου φωτός. |
Για την απομόνωση ενός λίτρου ξένου από την ατμόσφαιρα απαιτούνται περίπου 220 βατώρες ενέργειας. Ειδικά για την απομόνωση του κρυπτού και του ξένου, για να εξοικονομηθεί ενέργεια, υγροποιείται μόνο το 1/10 της ποσότητας του αέρα. Ο υπόλοιπος αέρας διαβιβάζεται μέσω του υγροποιημένου κλάσματος, οπότε κατακρατούνται αυτά τα δύο λιγότερο πτητικά ευγενή αέρια και έτσι το υγροποιημένο κλάσμα εμπλουτίζεται σε κρυπτό και ξένο [Αναφ. 7στ].
Η παγκόσμια παράγωγη ξένου κατά το 1998 είχε εκτιμηθεί περίπου στα 5.000 έως 7.000 κυβικά μέτρα (27 έως 37 τόννοι), ενώ το κόστος του (σε μικρές ποσότητες) ήταν περίπου 10 ευρώ/L (1 L ξένου = 5,9 g), ενώ για το κρυπτό και το νέο ήταν αντίστοιχα 1,0 και 0,20 ευρώ/L. Υπάρχει μια έντονη αυξητική τάση του κόστους του ξένου, λόγω της συνεχώς αυξανόμενης ζήτησης του αερίου εξαιτίας του πλήθους των σύγχρονων τεχνολογικών εφαρμογών του και όπου είναι δυνατόν επιδιώκεται η ανακύκλωσή του. Η σύγχρονη ετήσια παραγωγή ξένου εκτιμάται στους περίπου 40 τόννους.
Λυχνίες ξένου. Ως πρώτη εφαρμογή του ξένου αναφέρεται η χρήση του σε στροβοσκοπικού τύπου λυχνία κατά τη δεκαετία του 1930. Με εφαρμογή στιγμιαία υψηλής τάσης σε ηλεκτρόδια σε υάλινο σωλήνα, που περιέχει ένα ευγενές αέριο (λυχνίες εκκένωσης), παράγεται ισχυρό φώς το οποίο μπορεί να έχει πολύ μικρή διάρκεια. Ειδικά με το ξένο μπόρεσαν να επιτευχθούν παλμοί φωτός ουσιαστικά λευκού χρώματος διάρκειας λίγων μικροδευτερολέπτων. Οι στροβοσκοπικές λυχνίες ξένου χρησιμοποιούνται σε συστήματα φλας σε φωτογραφίσεις υψηλής ταχύτητας, όπως και στους διάφορους τύπους στροβοσκόπιων. Τα στροβοσκόπια χρησιμοποιούνται για την παρακολούθηση της λειτουργίας ταχύτατα περιστρεφόμενων ή κινούμενων κατά περιοδικό τρόπο τμημάτων μηχανών (π.χ. έμβολα μηχανών), τα οποία με στροβοσκοπικό φωτισμό εμφανίζονται να κινούνται αργά ή ακόμη και ακίνητα (π.χ. όταν η συχνότητα αναλαμπών συμπέσει με εκείνη της περιοδικής κίνησης). Με στροβοσκοπικό φωτισμό αποκαλύπτονται τυχόν ελαττώματα και αίτια φθοράς κατά τη λειτουργία τους τα οποία δεν είναι δυνατόν να γίνουν εμφανή όταν η μηχανή δεν λειτουργεί.
|
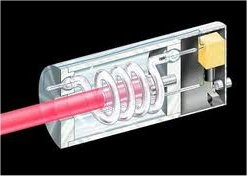
Πρώιμος τύπος λέιζερ ρουμπινίου, όπου η αντλούμενη ενέργεια προέρχεται από λυχνία εκκένωσης ξένου (σπειροειδής σωλήνα που περιβάλλει τον κύλινδρο ρουμπινίου). |
|
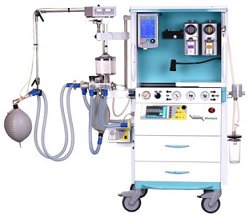
Σύστημα χορήγησης αναισθησίας με ξένο. |
Οι μεγαλύτερες ποσότητες ξένου χρησιμοποιούνται σήμερα στις λυχνίες τόξου ξένου (xenon arc lamps). Οι λυχνίες αυτές από χαλαζία περιέχουν ξένον σε υψηλή πίεση (τυπικά 30 atm), η οποία αυξάνει ακόμη περισσότερο κατά τη λειτουργία λόγω της ισχυρής θέρμανσης και σύστημα δύο ηλεκτροδίων. Στην αρχή εφαρμόζεται μια ισχυρή τάση (20-50 kV) που προκαλεί έναρξη του ιοντισμού του ξένου και στη συνέχεια η τάση υποβιβάζεται σε χαμηλές τιμές (μερικές δεκάδες volt) και το ηλεκτρικό τόξο συντηρείται με διέλευση μεγάλου ρεύματος (δεκάδες ampere ανάλογα με την ισχύ της λυχνίας).
Το φάσμα του εκπεμπόμενου φωτός στην περιοχή του ορατού (400-700 nm) από τις λυχνίες ξένου ουσιαστικά είναι συνεχές (ως αποτέλεσμα της υψηλής πίεσης του αερίου) και είναι εξαιρετικά λαμπρό, λευκό και παρόμοιο με το ηλιακό φως. Λυχνίες τόξου ξένου ισχύος πολλών kW ή και δεκάδων kW χρησιμοποιούνται ευρύτατα για τον φωτισμό γηπέδων, ενώ λυχνίες ξένου μικρότερης ισχύος χρησιμοποιούνται στους προβολείς των σύγχρονων αυτοκινήτων. Η προσθήκη μικρής ποσότητας υδραργύρου εμπλουτίζει σημαντικά την ακτινοβολία της λυχνίας σε υπεριώδη ακτινοβολία [Αναφ. 3].
Λυχνίες εκκένωσης ξένου (φλας) χρησιμοποιήθηκαν και στα πρώτα λέιζερ (π.χ. στα λέιζερ ρουμπινίου) ως πηγή αντλούμενης ενέργειας (laser pumping lamp).
Το ξένο ως αναισθητικό αέριο. Το ξένο παρουσιάζει έντονες αναισθητικές ιδιότητες και μελέτες έδειξαν ότι είναι πολύ αποτελεσματικότερο και εξίσου ασφαλές (ή και ασφαλέστερο σε ορισμένες παθολογικές καταστάσεις) ως γενικό αναισθητικό σε σχέση με το υποξείδιο του αζώτου (Ν2Ο). 'Εχουν προταθεί δύο φυσιολογικοί μηχανισμοί που ερμηνεύουν τις αναισθητικές ιδιότητες του ξένου. Ο πρώτος αποδίδει τη δράση του στην παρεμπόδιση της αντλίας ιόντων ασβεστίου μέσω της ATP-άσης στις κυτταρικές μεμβράνες των νευρικών συνάψεων λόγω της μεταβολής της χωροδιάταξης του ενζύμου κατά τη μη-πολική σύνδεση του με το ξένο. Ο δεύτερος αναφέρεται στις μη-ειδικές αλληλεπιδράσεις του ξένου με τις λιπιδικές μεμβράνες [Αναφ. 4].
Ως πλεονέκτημα του ξένου αναφέρεται το ότι δεν αποτελεί "αέριο θερμοκηπίου", όπως το υποξείδιο του αζώτου και άλλα αναισθητικά αέρια (βλ. χημική ένωση του μήνα: Χλωροφόρμιο). Πράγματι, είναι περιβαλλοντικά φιλικότερο, αφού αποτελεί φυσικό συστατικό της ατμόσφαιρας και στην ατμόσφαιρα επιστρέφει μετά τη χρήση. Ωστόσο, η ενέργεια που απαιτείται για την απομόνωση του ξένου από τον αέρα αντισταθμίζει σημαντικό μέρος του προηγούμενου πλεονεκτήματος. Οι 220 βατώρες που απαιτούνται για την παραγωγή ενός λίτρου ξένου είναι ενέργεια κατά ένα εκατομμύριο φορές μεγαλύτερη από την ενέργεια που απαιτείται για την παραγωγή ενός λίτρου υποξειδίου του αζώτου [Αναφ. 4δ]. Πάντως, το κυριότερο μειονέκτημα της αναισθησίας με ξένο είναι το μεγάλο κόστος του αερίου. 'Εχουν κατασκευαστεί διατάξεις χορήγησης αναισθησίας με ξένο, που επιτρέπουν την ανακύκλωση του αερίου ώστε να ελαχιστοποιείται η απαιτούμενη ποσότητα ξένου.
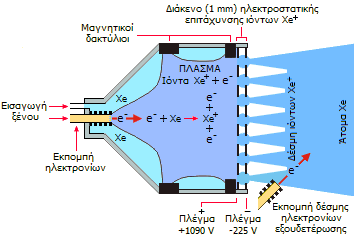
Το ξένο ως υλικό πρόωσης διαστημικών οχημάτων. Μια ενδιαφέρουσα εφαρμογή του ξένου για τη διαστημική τεχνολογία βρίσκεται στους ιοντικούς προωθητές διαστημοπλοίων, όπου χρησιμοποιείται ως προωθητικό υλικό (propellant). Οι ιοντικοί προωθητές (ion thrusters) αποτελούν ένα είδος ηλεκτρικών προωθητών που δημιουργούν ώση με εκτόξευση ιόντων τα οποία έχουν αποκτήσεις μεγάλες ταχύτητες με εφαρμογή ηλεκτρικού ή ηλεκτρομαγνητικού πεδίου. Διακρίνονται σε ηλεκτροστατικούς ιοντικούς προωθητές οι οποίοι βασίζονται στις κουλομβικές δυνάμεις που ασκούνται σε ιόντα υπό την επίδραση ηλεκτρικού πεδίου και στους ηλεκτρομαγνητικούς ιοντικούς προωθητές οι οποίοι βασίζονται στις δυνάμεις Lorentz που ασκούνται υπό την επίδραση ηλεκτρομαγνητικού πεδίου. Στην ουσία οι κινητήρες αυτοί καταναλίσκουν ηλεκτρική ενέργεια, πρόκειται δηλαδή για ηλεκτρικούς κινητήρες και το ξένο (ή άλλα υλικά) δεν είναι καύσιμο, αλλά αποτελεί την εκτοξευόμενη στο διάστημα μάζα.
Και οι δύο τύποι ιοντικών προωθητών βασίζονται στην ώση που δημιουργούνται από ταχύτατα κινούμενα θετικά ιόντα. Η δέσμη των θετικών ιόντων διευθετείται με κατάλληλα συστήματα "ιοντικής οπτικής", μόνιμους μαγνήτες και πλέγματα σε κατάλληλες τιμές δυναμικού. Η απαιτούμενη ηλεκτρική ενέργεια συνήθως προέρχεται από φωτοβολταϊκούς συλλέκτες. Τα ιόντα εξέρχονται από τα ακροφύσια των προωθητών, αφού προηγουμένως αποφορτιστούν με δέσμες ηλεκτρονίων, έτσι ώστε το εξερχόμενο υλικό να είναι ηλεκτρικά ουδέτερο, όπως και το διαστημικό όχημα.
|
|
 |
 |
| Αριστερά: Αρχή λειτουργίας ιοντικού προωθητή. Μια κάθοδος εκπέμπει ηλεκτρόνια τα οποία συγκρούονται με άτομα ξένου τα οποία χάνουν ηλεκτρόνια και μετατρέπονται θετικά ιόντα ξένου. Τα ιόντα αυτά υπό την πίεση του αερίου διέρχονται μέσω πλέγματος που βρίσκεται σε θετικό δυναμικό. Το πλέγμα με αρνητικό δυναμικό επιταχύνει τα θετικά ιόντα τα οποία και τα εξακοντίζει προς το διάστημα. Μια δέσμη ηλεκτρονίων τα εξουδετερώνει μετατρέποντάς τα σε άτομα, διαφορετικά θα έλκονταν από το αρνητικό ηλεκτρόδιο και δεν θα υπήρχε ώση. Μέσο και Δεξιά: Φωτογραφίες του ιοντικού προωθητή και διαστημικό όχηματος που κινείται με ιοντικό προωθητή. | ||
Η ώση των ιοντικών προωθητών είναι ελάχιστη σε σχέση με την ώση των χημικών προωθητών (π.χ. Η2/Ο2 ή υδραζίνης/Ν2Ο4) και επομένως οι ιοντικοί προωθητές δεν μπορούν σε καμία περίπτωση να χρησιμοποιηθούν για την εκτόξευση πυραύλων από τη Γη. Επιπλέον, η λειτουργία τους κατά κανόνα είναι εφικτή μόνο στις συνθήκες κενού του διαστήματος. Ωστόσο, οι ιοντικοί προωθητές χαρακτηρίζονται από εξαιρετικά υψηλή ειδική ώση (specific impulse), δηλ. ώση ανά μονάδα μάζας εκτοξευόμενου υλικού, ακριβώς λόγω των υψηλότατων ταχυτήτων εκτόξευσης των παραγόμενων ιόντων (ταχύτητα που φθάνει τα 140.000 km/h). Επομένως, οι ιοντικοί προωθητές είναι κατάλληλοι για την πρόωση διαστημοπλοίων που ήδη βρίσκονται στο διάστημα. Οι ιοντικοί προωθητές είναι ιδιαίτερα απλοί στην κατασκευή τους και αξιόπιστοι στη λειτουργία τους. Mε συνεχή λειτουργία τους μπορούν να προσδώσουν στα διαστημικά οχήματα ταχύτητες που φτάνουν τα 80 έως 90 χιλιάδες km/h.
 |
 |
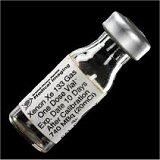
|
Αριστερά: Φιαλίδιο (μιας δόσης) ραδιενεργού ξένου (Xe-133). Δεξιά: Κάνιστρα μολύβδου όπου φυλάσσονται τα φιαλίδια με ραδιενεργό ξένο. |
|
Στους ιοντικούς προωθητές το ξένο είναι μια από τις προτιμούμενες ουσίες ως προωθητικό υλικό λόγω του εύκολου ιοντισμού του και της μεγάλης μάζας των ιόντων του. Τα επιταχυνόμενα σωματίδια είναι τα θετικά ιόντα ξένου. Ως προωθητικά υλικά έχουν δοκιμασθεί διάφορα στοιχεία όπως τα: καίσιο, βισμούθιο, υδράργυρος και υδρογόνο. Εκτιμάται ότι οι ιοντικοί προωθητές απαιτούν μάζα προωθητικού υλικού ίση προς το 1/5 της μάζας των καυσίμων που θα χρειαζόταν ένας χημικός προωθητής για διαπλανητικό ταξίδι. Το κύριο όφελος βρίσκεται στη μείωση της μάζας, η οποία θα πρέπει να συνοδεύει το διαστημικό όχημα κατά την εκτόξευσή του από το έδαφος (με ώση που απαιτεί τόννους χημικών καυσίμων, βλ. χημική ένωση του μήνα: Υπερχλωρικό οξύ και άλατά του), που είναι και το δαπανηρότερο στάδιο μιας διαστημικής αποστολής [Αναφ. 5].
Ραδιενεργά ισότοπα ξένου. Το φυσικό ξένο αποτελείται από τα ακόλουθα 9 σταθερά ισότοπα: Xe-128 (1,9%), Xe-129 (26,4%), Xe-130 (40,7%), Xe-131 (21,2%), Xe-132 (26,9%), Xe-134 (10,4%) και Xe-136 (8,9%). Περισσότερα από 40 ραδιενεργά ισότοπα του ξένου είναι γνωστά, πολλά από τα οποία είναι προϊόντα της πυρηνικής σχάσης του ουρανίου (U-235) [Αναφ. 4στ]. Τα ραδιενεργά ισότοπα Xe-127 και κυρίως το Xe-133, με χρόνους υποδιπλασιασμού 36,3 και 5,2 ημέρες αντιστοίχως, χρησιμοποιούνται στην ιατρική για τη μελέτη της ροής του αίματος στον εγκέφαλο και του αέρα στους πνεύμονες. Συνήθως, ο ασθενής εισπνέει το ραδιενεργό αέριο μέσω μιας μάσκας. Το ξένο ακολουθεί το οξυγόνο στην κυκλοφορία του αίματος και εξαιτίας της ραδιενέργειας (γ-ραδιενεργό) που εκπέμπει, παρέχει τη δυνατότητα μιας καλής ραδιογραφικής απεικόνισης της καρδιάς, των πνευμόνων και του εγκεφάλου.
Η έναρξη της χημείας των ευγενών αερίων
|
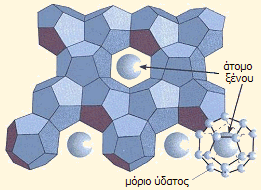
Υδρίτης ξένου: Τα μόρια ύδατος σχηματίζουν μια στερεά δομή από κανονικά δωδεκάεδρα, καθένα από τα οποία στο κέντρο παγιδεύει ένα άτομο ξένου. |
Από την ανακάλυψή τους και για πολλές δεκαετίες, τα ευγενή αέρια θεωρήθηκαν ως χημικώς αδρανή. 'Ολες οι απόπειρες σχηματισμού ενώσεών τους απετύγχαναν. Η σταθερότητά τους αποδόθηκε στη δομή της εξωτερικής ηλεκτρονιακής στιβάδας τους που ήταν συμπληρωμένη με 8 ηλεκτρόνια (2 για το ήλιο). Ωστόσο, το 1933 ο Linus Pauling προέβλεψε ότι τα βαρύτερα ευγενή αέρια (Kr, Xe) θα μπορούσαν να σχηματίσουν ενώσεις με το φθόριο (όπως: KrF6, XeF6) και με το οξυγόνο (όπως: H2XeO4, H4XeO6).
Η πρόβλεψη του Pauling επαληθεύτηκε το 1962 από τον 'Αγγλο χημικό Neil Bartlett (1932-2008), ειδικό στη χημεία του φθορίου, τότε λέκτορα στο Πανεπιστήμιο της British Columbia (στο Vancouver) και μετέπειτα καθηγητή των Πανεπιστημίων Princeton και Berkeley [Αναφ. 6].
Μέχρι το 1962, οι μόνες γνωστές "ενώσεις" των ευγενών αερίων ήταν ενώσεις εγκλεισμού (clathrates, cage compounds, inclusion compounds) με οργανικά μόρια και το νερό (υδρίτες ευγενών αερίων). Αυτές οι ενώσεις στην πραγματικότητα είναι μίγματα καθορισμένης αναλογίας, στα οποία μικρά μόρια μιας ένωσης, δηλ. τα φιλοξενούμενα μόρια (guest molecules) παγιδεύονται σε κοιλότητες του κρυσταλλικού πλέγματος μιας άλλης ουσίας, του μορίου-ξενιστή (host molecule). Στην ουσία δεν πρόκειται για πραγματικές ενώσεις, αφού δεν υπάρχουν χημικοί δεσμοί, αλλά ένα είδος παγίδευσης του φιλοξενούμενου μορίου (ή ατόμου στην περίπτωση των ευγενών αερίων) μέσω "χαλαρών" δυνάμεων van der Waals και London.
Οι ενώσεις εγκλεισμού είναι σταθερές μέχρι μια θερμοκρασία και κατά την τήξη τους ή διάλυσή τους αποδεσμεύεται το φιλοξενούμενο μόριο. Η πιο γνωστή ένωση εγκλεισμού είναι οι υδρίτες του μεθανίου, τεράστιες ποσότητες των οποίων βρίσκονται στα βάθη των ωκεανών και στα μόνιμα παγωμένα εδάφη των αρκτικών περιοχών (βλ. ένωση του μήνα: Μεθάνιο).
Τυπικές ενώσεις εγκλεισμού των ευγενών αερίων είναι εκείνες με την κινόλη (1,4-διυδροξυ-βενζόλιο) και παρασκευάζονται όταν διαλύματα κινόλης σε νερό ή βενζόλιο έρθουν σε επαφή με τα αέρια υπό υψηλή πίεση (10-40 atm). Η αναλογία μορίων κινόλης προς άτομα ευγενών αερίων συνήθως είναι 3:1, δηλ. έχουν τον γενικό τύπο [G(p-HOC6H4OH)3], όπου G: Ar, Kr, Xe. Τα ίδια αέρια σχηματίζουν υδρίτες κατά τη ψύξη του ύδατος παρουσία ευγενούς αερίου υπό πίεση, με γενικό τύπο [G8(H2O)46].
|
|
|
| Ο 'Αγγλος χημικός Neil Bartlett (1932-2008), ο πρώτος χημικός που παρασκεύασε χημική ένωση ευγενούς αερίου [Αναφ. 6ε]. |
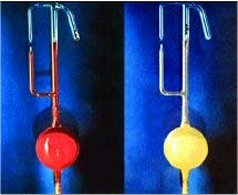
Όταν ο εξαφθοριούχος λευκόχρυσος (το κόκκινο πτητικό υγρό αριστερά) αναμιχθεί με περίσσεια χένου, σχηματίζεται αμέσως το κίτρινο στερεό εξαφθορολευκοχρυσικό ξένο [Αναφ. 6β]. |
To 1962, o Bartlett εξέταζε τις ιδιότητες μιας αρκετά περίεργης ένωσης, του εξαφθοριούχου λευκοχρύσου (PtF6), της μόνης σταθερής ένωσης του εξασθενούς λευκοχρύσου. Ο PtF6 λαμβάνεται με άμεση ένωση του λευκοχρύσου με φθόριο και είναι ένα εύτηκτο (σ.τ. 61,3ºC) κρυσταλλικό στερεό με βαθύ κόκκινο χρώμα και σημείο ζέσεως μόλις 69,1ºC. Ο PtF6 είναι ισχυρότατο οξειδωτικό σώμα, σε σημείο που αποσπά ηλεκτρόνιο (οξειδώνει) από το διοξυγόνο (μοριακό οξυγόνο), παρέχοντας εξαφθορολευκοχρυσικό διοξυγόνο σύμφωνα με την αντίδραση:
![]()
Ο Bartlett θεώρησε ότι αφού ο PtF6 μπορούσε να αποσπάσει ηλεκτρόνιο από διοξυγόνο, το οποίο έχει ενέργεια 1ου ιοντισμού 1175 kJ/mol, θερμοδυναμικά αναμένεται πως θα μπορούσε να αποσπάσει ηλεκτρόνιο και από το ξένο με ενέργεια 1ου ιοντισμού 1170 kJ/mol. Πράγματι, όταν ανέμειξε ατμούς (κόκκινου χρώματος) του PtF6 με αέριο ξένο, παρατήρησε έναν άμεσο αποχρωματισμό και σχηματισμό ενός κολλώδους κίτρινου στερεού, το οποίο αρχικά υπέθεσε ότι πρόκειται για εξαφθορολευκοχρυσικό ξένο, παραγόμενο σύμφωνα με την αντίδραση:
![]()
Αργότερα διαπιστώθηκε ότι η στοιχειομετρία της αντίδρασης δεν ήταν απλή. Για κάθε μόριο ξένου δεσμεύονταν 1,2 έως 1,9 μόρια PtF6. Νεότερες μελέτες έδειξαν πως στην πραγματικότητα το προϊόν της αντίδρασης είναι μίγμα ενώσεων όπως των:
[XeF+][PtF6]−, [XeF+][Pt2F11]− και [Xe2F3+][PtF6−]
Σε κάθε περίπτωση η αντίδραση αυτή αποδείκνυε ότι είναι εφικτή η σύνθεση χημικών ενώσεων των ευγενών αερίων και το έτος 1962 σηματοδοτεί την έναρξη της χημείας των ευγενών αερίων. Είναι προφανές βέβαια ότι όσο μεγαλύτερο είναι το άτομο του ευγενούς αερίου, τόσο πιο εύκολα μπορεί να αποσπασθεί από αυτό ηλεκτρόνιο και έτσι, τα μόνα ευγενή αέρια που παρέχουν σταθερές ενώσεις είναι το ξένο (κυρίως) και το κρυπτό (δευτερευόντως). Ακόμη σταθερότερες ενώσεις παρέχει το ραδόνιο, αλλά επειδή πρόκειται για βραχύβιο ραδιενεργό στοιχείο οι ενώσεις του δεν έχουν χαρακτηρισθεί διεξοδικά. Σχετικά πρόσφατα αναφέρθηκε και μια ένωση του αργού με χημικό τύπο HArF, που είναι σταθερή σε εξαιρετικά χαμηλές θερμοκρασίες (κάτω από -256ºC).
|
Μια περιγραφή του πειράματος του Bartlett [Αναφ. 6δ-ε]
Με ένα απλό πείραμα ο Bartlett ανέτρεψε μια πεποίθηση σχεδόν 75 ετών ως προς τη δραστικότητα των ευγενών αερίων. Εκείνη τη στιγμή ήταν ο μόνος άνθρωπος στη Γη, που ήξερε πως τα ευγενή αέρια μπορούν να αντιδράσουν με άλλες ενώσεις. Βγήκε βιαστικά έξω από το εργαστήριό του για να πει για την ανακάλυψή τους σε κάποιον συνάδελφό του, αλλά το κτήριο ήταν τελείως άδειο. |
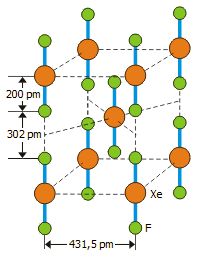
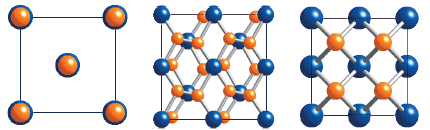
Σύνθεση και δομή του διφθοριούχου ξένου
|
Μοναδιαία κυψελίδα (unit cell) του XeF2 |
Το διφθοριούχο ξένο αποτελεί τυπικό παράδειγμα σταθερής ένωσης ευγενούς αερίου, που είναι τόσο σταθερή ώστε να αποτελεί ένα ακίνδυνα διακινούμενο στο εμπόριο χημικό προϊόν, το οποίο μπορεί να αποθηκευτεί σαν ένα κοινό αντιδραστήριο και για απεριόριστο χρονικό διάστημα σε συνήθεις θερμοκρασίες και σε περιέκτες από νικέλιο, αλουμίνιο ή Teflon. Παρασκευάζεται από αέριο μίγμα ξένου και φθορίου στο οποίο παρέχεται μια μορφή ενέργειας (θερμότητα, υπεριώδης ακτινοβολία, ηλιακό φώς, ακτινοβολία γ, ηλεκτρικοί σπινθήρες).
Το 1962, δηλ. την ίδια χρονιά που ανακοινώθηκε από τον Bartlett η σύνθεση του εξαφθοριολευκοχρυσικού ξένου, παρασκευάσθηκε στο Argonne National Laboratory (ANL) η πρώτη δυαδική ένωση του ξένου, το τετραφθοριούχο ξένο και αμέσως μετά ανακοινώθηκε και η ανίχνευση και τέλος η παρασκευή του διφοριούχου ξένου [Αναφ. 7].
 |
 |
|
Αριστερά: Φιάλες από ύαλο Pyrex εκτεθειμένες στο φως του ήλιου, στα τοιχώματα των οποίων φαίνονται οι σχηματισθέντες κρύσταλλοι XeF2. Δεξιά: Κρύσταλλοι XeF2 σε μεγέθυνση. |
|
Ο πιο απλός τρόπος σύνθεσης του XeF2 , ακόμη και σε ποσότητες χιλιογράμμου, είναι με επίδραση ηλιακού φωτός ή υπεριώδους ακτινοβολίας (από λυχνία υδραργύρου) σε μίγμα των δύο αερίων συστατικών με το Xe σε περίσσεια (ενδεικτικά Xe:F = 2:1), σε τελείως ξηρά φιάλη Pyrex. Αναφέρεται ότι παρουσία 1% HF (σε γραμμομοριακή βάση) καταλύει την αντίδραση. Σε άμεσο ηλιακό φως εμφανίζονται κρύσταλλοι XeF2 μέσα σε δύο ώρες, ενώ σε διάχυτο φως κρύσταλλοι εμφανίζονται μετά από δύο ημέρες.
Αν και πριν από την ανακάλυψη από τον Bartlett της πρώτης σταθερής ένωσης του ξένου, είχε δοκιμασθεί η αντίδραση μεταξύ φθορίου και ξένου, δεν αναφέρθηκε η παραγωγή XeF2. Προφανώς οι ερευνητές δεν σκέφτηκαν να εκθέσουν το μίγμα των αερίων σε άμεσο ηλιακό φως.
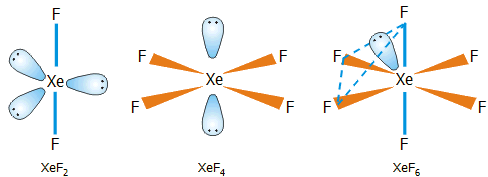
Πρέπει να σημειωθεί ότι με απ' ευθείας αντίδραση ξένου - φθορίου παράγονται και τα τρία γνωστά και σταθερά φθορίδια του ξένου: XeF2, XeF4 και XeF6. Φθορίδια με περιττό αριθμό ατόμων φθορίου δεν είναι γνωστά. Το ποιο από τα τρία φθορίδια θα αποτελέσει το κύριο προϊόν μπορεί να ρυθμιστεί με έλεγχο της θερμοκρασίας, πίεσης και της γραμμομοριακής αναλογίας του αντιδρώντος μίγματος.
Η αντίδραση πραγματοποιείται σε δοχεία από νικέλιο, η επιφάνεια των οποίων πρέπει να έχει αδρανοποιηθεί με προηγούμενη επίδραση αερίου φθορίου ("παθητικοποίηση" της επιφάνειας), οπότε σχηματίζεται προστατευτικό στρώμα NiF2. Ενδεικτικά, οι συνθήκες που οδηγούν στην καθεμία από τις τρεις φθοριούχες ενώσεις του ξένου περιγράφονται στις επόμενες τρεις χημικές εξισώσεις [Αναφ. 7στ].
|
Η γεωμετρία των τριών δυαδικών ενώσεων ξένου - φθορίου. |
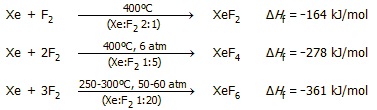
Σε καμιά περίπτωση δεν λαμβάνονται απολύτως καθαρές οι φθοριούχες ενώσεις. 'Ετσι, στην περίπτωση του XeF2 κύριο παραπροϊόν είναι το XeF4, το οποίο είναι μεν σταθερό αλλά αποτελεί ανεπιθύμητη πρόσμιξη ως εξαιρετικά δραστικότερο φθοριωτικό μέσο και (κυρίως) ως πρόδρομη ένωση του εξαιρετικά επικίνδυνου XeO3, το οποίο παρέχει παρουσία ύδατος. Εξίσου επικίνδυνο και για τους ίδιους λόγους είναι το XeF6 (βλ. παρακάτω).
Ο καθαρισμός του XeF2 συνήθως πραγματοποιείται με απόσταξη, αν και έχουν προταθεί και άλλες μέθοδοι παρασκευής του, ώστε να περιοριστεί στο ελάχιστο η παρουσία του XeF4 στο τελικό προϊόν (περιεκτικότητα σε XeF2 >99,9%) [Αναφ. 8].
Η γεωμετρία των τριών φθοριούχων ενώσεων του ξένου δείχνεται στο παραπλεύρως σχήμα. Η δομή του XeF2 (γραμμική) και του XeF4 (επίπεδη τετραγωνική) είναι προβλέψιμη από τη θεωρία VSEPR (για ένα άτομο ξένου με 5 και 6 ζεύγη ηλεκτρονίων, υβριδισμοί sp3d και sp3d2 αντιστοίχως). Πρόβλημα υπήρξε με τον προσδιορισμό της δομής του XeF6. 'Ενας λόγος ήταν η δυσκολία εφαρμογής φασματομετρικών τεχνικών λόγω της μεγάλης χημικής δραστικότητας της ένωσης, η οποία μπορούσε να προσβάλλει τις κυψελίδες των χρησιμοποιούμενων οργάνων. Τελικά, έγινε δεκτό ότι το μόριο του XeF6 έχει δομή ενός ελαφρά παραμορφωμένου οκταέδρου, αφού περισσεύει ένα ζεύγος ηλεκτρονίων (υβριδισμός sp3d3). Ωστόσο, το ζεύγος αυτό κινείται εύκολα ("ρέει") από τη μια τρίεδρη γωνία στην άλλη, με αποτέλεσμα η "μέση" γεωμετρία του μορίου να είναι εκείνη του κανονικού οκταέδρου.
|
|
|
|
Αριστερά: Κρύσταλλοι διφθοριούχου ξένου. Δεξιά: Εμπορικές συσκευασίες διφθοριούχου ξένου. Σε φιάλες από νικέλιο, κράμα Monel (κράμα Ni-Cu) ή και αλουμίνιο από τις οποίες εξέρχεται ως αέριο σε ελεγχόμενο ρυθμό με ελαφριά θέρμανσή τους ή ως στερεό αντιδραστήριο σε φιάλες από Teflon. Οι μεταλλικές φιάλες υπόκεινται σε ένα είδος παθητικοποίησης λόγω σχηματισμού προστατευτικού στρώματος φθοριδίων. |
|
Αντιδράσεις του διφθοριούχου ξένου [Αναφ. 1β, 9β]
Το XeF2 είναι ένα εμπορικό προϊόν, σχετικά δαπανηρό όχι όμως και σε απαγορευτικό βαθμό [Αναφ. 9β]. Πολλές από τις αντιδράσεις που παρέχει το XeF2 τις δίνει και το αέριο φθόριο. Ωστόσο, ο χειρισμός του αερίου φθορίου είναι ιδιαίτερα επικίνδυνος, προϋποθέτει ειδικό εργαστηριακό εξοπλισμό και μεγάλη πείρα από τον χειριστή. 'Ετσι, αν σε ένα εργαστήριο θα απαιτηθεί η περιπτωσιακή χρήση μικρών ποσοτήτων φθορίου για κάποιες φθοριώσεις ή οξειδώσεις (γενικότερα), αντί αερίου φθορίου μπορεί να χρησιμοποιηθεί το XeF2, που εύκολα μπορεί να ζυγιστεί και να μεταφερθεί σε ανοικτά δοχεία. Ακόμη, οι περισσότερες αντιδράσεις του μπορούν να πραγματοποιηθούν σε υάλινα σκεύη χωρίς να υπάρξει κάποια μείωση στις αποδόσεις. Το XeF2 δεν αντιδρά με το SiO2 ή πυριτικά άλατα.
'Ετσι, το XeF2 μπορεί να θεωρηθεί σαν μια τιθασευμένη και εύχρηστη μορφή φθορίου (tamed fluorine). Σε κάθε περίπτωση πάντως πρόκειται για μια εξαιρετικά δραστική οξειδωτική ουσία και απαιτείται ιδιαίτερη προσοχή κατά τη χρήση της και η αποφυγή της επαφής της με το δέρμα και με κάθε οργανικό υλικό.
Ο ιδανικότερος, αν και δύσχρηστος, διαλύτης του XeF2 είναι το άνυδρο HF, όπου διαλύεται άφθονα (167 g στα 100 g άνυδρου HF στους 30ºC) και τα διαλύματά του αυτά είναι σταθερά για απεριόριστο χρόνο. Τα διαλύματα του διφθοριούχου ξένου στο HF δεν άγουν το ηλεκτρικό ρεύμα, γεγονός που υποδηλώνει ότι η ουσία δεν υπόκειται σε κάποιο είδος διάστασης σε ιόντα. Πιο πρακτικά (π.χ. για την οργανική σύνθεση) διαλυτικά μέσα είναι οι χλωριωμένοι διαλύτες CH2Cl2, CHCl3 και CCl4. Ωστόσο, τα διαλύματα αυτά δεν είναι σταθερά για μεγάλο χρονικό διάστημα λόγω της ανταλλαγής των ατόμων H (σχετικώς ταχεία ανταλλαγή) και Cl (βραδύτερη) με F με σχηματισμό μίγματος χλωροφθορανθράκων. Για παράδειγμα, αναφέρεται ότι διαλύματα XeF2 σε CH2Cl2 και CHCl3 και σε θερμοκρασία δωματίου, μέσα σε δύο ημέρες διασπάται ποσοτικά δίνοντας τα ακόλουθα προϊόντα (σε mol %) [Αναφ. 9δ]:
|
XeF2 σε CH2Cl2 (93 g / kg διαλύτη): |
CH2FCl (24,4%) + CHFCl2 (25,6%) + HF (37%) + άλλα προϊόντα (1%) |
| XeF2 σε CHCl3 (33 g / kg διαλύτη): | CΗFCl2 (67,1%) + CFCl3 (13,9%) + HF (17,8%) + CHF2Cl (1,2%) |
Η παρουσία HF επιταχύνει τις παραπάνω αντιδράσεις, έτσι προσθήκη XeF2 στους ίδιους, αλλά ακάθαρτους και ατελώς ξηρούς διαλύτες, μπορεί να οδηγήσει σε εκρηκτική αντίδραση. Στην περίπτωση διαλυμάτων XeF2 σε CH3CN διαπιστώθηκε διάσπασή του μόλις κατά 4% (με προϊόντα: CFH2CN + HF) μετά από 6 εβδομάδες.
Υδρόλυση:
Αντιδρά σχετικά αργά με το νερό το οποίο οξειδώνει σύμφωνα με την αντίδραση: 2XeF2
+ 2H2O
![]() 2Xe + 4HF + O2
2Xe + 4HF + O2
Η διαλυτότητα του XeF2 στο νερό στους 0ºC είναι 25 g/L. Το υδατικό διάλυμά του είναι σχετικά σταθερό με χρόνο υποδιπλασιασμού περίπου 7 ώρες (στους 0ºC), ενώ σε αλκαλικά διαλύματα το διφθοριούχο ξένο υδρολύεται ταχύτατα.
Αντιδράσεις οξείδωσης: Το διφθοριούχο ξένο είναι ισχυρό οξειδωτικό σώμα και παρέχει ουσιαστικά τις ίδιες αντιδράσεις που παρέχει το στοιχειακό φθόριο, αλλά με πιο ήπιο τρόπο. Τυπικά παραδείγματα οξειδώσεων:
Μέταλλα: Προς τα αντίστοιχα φθοριούχα άλατα ή και προς ενώσεις προσθήκης τους, π.χ.
Ni + XeF2
![]() NiF2 + Xe,
Hg + XeF2
NiF2 + Xe,
Hg + XeF2
![]() HgF2 + Xe, 2Ta +
7XeF2
HgF2 + Xe, 2Ta +
7XeF2
![]() 2 [XeF]+[TaF6]- + 5Xe
2 [XeF]+[TaF6]- + 5Xe
Φθοριούχα άλατα: Οξειδώνονται προς φθοριούχα άλατα με τα κατιόντα σε υψηλότερες και κατά κανόνα "ασυνήθιστες" βαθμίδες οξείδωσης. Τα άλατα που προκύτπουν κατά κανόνα είναι ασταθή σε υδατικά διαλύματα (υδρολύονται ή/και οξειδώνουν το νερό). Οι οξειδώσεις αυτές πραγματοποιούνται απουσία ύδατος και συνήθως σε διαλύματα σε άνυδρο HF. Τυπικά παραδείγματα:
2AgF + XeF2
![]() 2AgF2 + Xe
2MnF2 +
XeF2
2AgF2 + Xe
2MnF2 +
XeF2
![]() 2MnF3 + Xe
SnF2 + XeF2
2MnF3 + Xe
SnF2 + XeF2
![]() SnF4 + Xe
2CrF3 + XeF2
SnF4 + Xe
2CrF3 + XeF2
![]() 2CrF4 + Xe
2CrF4 + Xe
Αλογονικά άλατα: Αντιδρά με άλατα του χλωρικού, βρωμικού και ιωδικού οξέος παρέχοντας τα αντίστοιχα άλατα των υπεραλογονικών οξέων σύμφωνα με τη γενική αντίδραση:
XO3-
+ XeF2 + H2O
![]() XO4- + Xe +
2 HF (X: Cl, Br, I)
XO4- + Xe +
2 HF (X: Cl, Br, I)
|
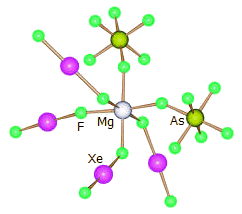
Δομή του [Mg(XeF2)4] (AsF6)2 |
Η αντίδραση αυτή ήταν μια από αυτές που χρησιμοποίησε το 1968 ο Appelman για την παρασκευή του υπερβρωμικού οξέος (HBrO4) και διάφορων αλάτων του, των μοναδικών γνωστών ενώσεων του Br(VII). Είναι χαρακτηριστικό ότι μέχρι τότε η παρασκευή υπερβρωμικών αλάτων είχε θεωρηθεί ως αδύνατη [Αναφ. 9γ].
Αντιδράσεις με υποδοχείς ιόντων φθορίου: Το διφθοριούχο ξένο εμφανίζει ιδιότητες ασθενούς βάσης κατά Lewis, έτσι αντιδρά με πενταφθοριούχες ενώσεις (MF5, όπου Μ: P, As, Sb, I, και πεντασθενή μέταλλα, π.χ. Ta, Nb), ισχυρά οξέα κατά Lewis, σύμφωνα με τις αντιδράσεις:
![]()
Αντιδράσεις
αντικατάστασης: Αντιδρά με άνυδρα οξέα Η-L σύμφωνα με τη γενική
αντίδραση: XeF2
+ H-L
![]() F-Xe-L + HF
F-Xe-L + HF
όπου H-L οξέα όπως: H-OSO2F (φθοροθειικό οξύ), Η-ΟClO3 (υπερχλωρικό οξύ), Η-OOCCF3 (τριφθοροξικό οξύ). Πολλές από τις ενώσεις αυτές είναι θερμοδυναμικώς ασταθείς και μπορούν να διατηρηθούν μόνο σε χαμηλές θερμοκρασίες. Το υπερχλωρικό ξενοφθορίδιο, FXeOClO3 με σ.τ. 16,5ºC είναι ιδιαίτερα επικίνδυνη εκρηκτική ένωση.
Ως υποκαταστάτης: Το διφθοριούχο ξένο μπορεί να δράσει ως υποκαταστάτης, όταν ως διαλύτης χρησιμοποιείται άνυδρο HF, π.χ.:
Mg(AsF6)2
+ 4 XeF2
![]() [Mg(XeF2)4] (AsF6)2
[Mg(XeF2)4] (AsF6)2
Κρυσταλλογραφική ανάλυση έδειξε ότι το άτομο του μαγνησίου συνδέεται με έξι άτομα φθορίου. Τα τέσσερα από αυτά προέρχονται από τα μόρια του XeF2 και τα άλλα δύο από ένα ζεύγος υποκαταστατών cis-AsF (βλ. σχήμα δομής αριστερά).
Ως φθοριωτικό μέσο στην οργανική σύνθεση: Το στοιχειακό φθόριο είναι εξαιρετικά δραστικό και αντιδρά εκρηκτικά και ανεξέλεγκτα σχεδόν με το σύνολο των οργανικών ενώσεων, έτσι π.χ. σε αντίθεση με το χλώριο και το βρώμιο, δεν μπορεί να χρησιμοποιηθεί για να δώσει αντιδράσεις προσθήκης ή αντικατάστασης. Το XeF2 σε διάλυμα συμβατού οργανικού διαλύτη (π.χ CH2Cl2, CHCl3) μπορεί να χρησιμοποιηθεί για να δώσει ανάλογες αντιδράσεις. Τυπικά παραδείγματα αντιδράσεων προσθήκης είναι τα ακόλουθα [Αναφ. 1β, 9β, 10]:

Τυπικά παραδείγματα αντιδράσεων αντικατάστασης:
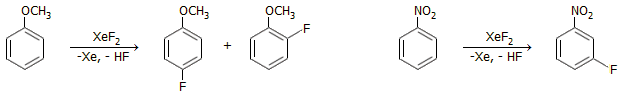
'Αλλη χαρακτηριστική αντίδραση του διφθοριούχου ξένου είναι η οξειδωτική αποκαρβοξυλίωση αλειφατικών οξέων και σχηματισμός των αντίστοιχων φθοροαλκανίων με βάση τη γενική αντίδραση [Αναφ. 10ε]:
R-COOH + XeF2
![]() R-F + CO2 + Xe + HF
R-F + CO2 + Xe + HF
Το διφθοριούχο ξένο έχει χρησιμοποιηθεί για την παρασκευή φθοριωμένων ουσιών με φαρμακευτική δράση (π.χ. φθοροουρακίλη, L-6-φθορο-DOPA). Θα πρέπει να τονισθεί βέβαια ότι πέραν της χρήσης διφθοριούχου ξένου για την ελεγχόμενη εισαγωγή φθορίου σε οργανικές ενώσεις, υπάρχει μια σειρά μεθόδων και ειδικών αντιδραστηρίων που παρέχουν την ίδια δυνατότητα. Μια κλασική μέθοδος εισαγωγής φθορίου σε αρωματικές ενώσεις βασίζεται στη θερμική διάσπαση των τετραφθοροβορικών διαζωνιακών αλάτων, π.χ.
![]()
Ωστόσο, το διφθοριούχο ξένο έχει το πλεονέκτημα ότι ως παραπροϊόν παρέχει μόνο ξένο, το οποίο απομακρύνεται αμέσως. Το βασικό μειονέκτημά του βέβαια είναι το μεγάλο κόστος (ενδεικτικές τιμές από τον on-line τιμοκατάλογο της εταιρείας Sigma-Aldrich: XeF2 (99,99%) 191 ευρώ / 1 g, 651 ευρώ / 5 g) .
|
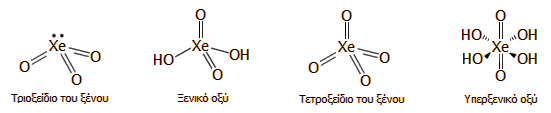
Μερικές ακόμη από τις κυριότερες ενώσεις του ξένου [Αναφ. 11]
Έχουν παρασκευασθεί και μελετηθεί εκατοντάδες σταθερές ενώσεις του ξένου. Σε όλες τις περιπτώσεις το οι υφιστάμενοι δεσμοί σε όλες τις ενώσεις αυτές είναι Xe-O και Xe-F. Στη συνέχεια περιγράφονται συνοπτικά κάποιες από τις σημαντικότερες ενώσεις αυτές. Τετραφθοριούχο ξένο (XeF4): Το XeF4 υπήρξε η πρώτη απλή ένωση ευγενούς αερίου που παρασκευάσθηκε (1962). Κρυσταλλικό στερεό (σ.τ. 117ºC, υπό εξάχνωση) είναι κατά πολύ δραστικότερο οξειδωτικό σώμα σε σχέση με το XeF2. Αντιδρά αμέσως με το νερό παρέχοντας τριοξείδιο του ξένου σύμφωνα με την αυτοοξειδοαναγωγική αντίδραση:
XeF4
+ 2 H2O
Το τριοξείδιο του ξένου είναι ιδιαίτερα εκρηκτική ένωση γι αυτό πρέπει να αποφεύγεται η χρήση XeF4 παρουσία ύδατος ή υγρασίας. Για τον ίδιο λόγο το XeF2 θα πρέπει να είναι απαλλαγμένο από μικροποσότητες XeF4. Το XeF4 είναι πολύ δραστικότερο μέσο φθορίωση και προσβάλλει άμεσα τις υάλινες φιάλες σε αντίθεση με το XeF2. 'Εχει χρησιμοποιηθεί για τον αναλυτικό προσδιορισμό μικροποσοτήτων μετάλλων σε πολυμερή σιλικόνης. Το δείγμα του πολυμερούς αντιδρά με περίσσεια XeF4 και τα πάντα αεριοποιούνται (ακόμη και το πυρίτιο ως SiF4) αφήνοντας υπόλειμμα από οξείδια και φθοριούχα άλατα των υπό προσδιορισμό μετάλλων. Εξαφθοριούχο ξένο (ΧeF6): Στερεό λευκό σώμα (σ.τ. 49,2ºC, σ.ζ. 75,6ºC), οι ατμοί του έχουν ένα έντονο κίτρινο χρώμα. Το XeF6 είναι σταθερή χημική ένωση σε συνήθεις συνθήκες κατά πολύ δραστικότερο φθοριωτικό μέσο σε σχέση με το XeF2 και το XeF4. Αντιδρά αμέσως με το νερό κατά στάδια, παρέχοντας οξυφθορίδια τα οποία καταλήγουν σε τριοξείδιο του ξένου σύμφωνα με τις αντιδράσεις:
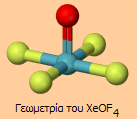
Από τις οξυφθοριούχες ενώσεις του ξένου, η πιο σταθερή είναι η XeOF4 (άχρωμο, πτητικό, σχετικά σταθερό υγρό που αντιδρά εκρηκτικά με το νερό). Αντίστοιχα, σε αντίθεση με το XeF2 αντιδρά με το SiO2 (π.χ. της υάλου), γεγονός που δυσκόλεψε τον προσδιορισμό της δομής με φασματοφωτομετρικές τεχνικές:
2XeF6
+ SiO2
Το XeF6
δρα ως ισχυρό οξύ Lewis παρέχοντας επτα- και οκτα-φθοριούχα ανιόντα:
XeF6
+ F-
Απ' ευθείας αντίδραση του με φθοριούχα άλατα των αλκαλίων παρέχει τα αντίστοιχα επτα- και οκτα-φθοριοξενικά άλατα (MXeF7, M2XeF8). Ιδιαίτερα σταθερά είναι τα άλατα με Μ = Rb, Cs. Τα άλατα αυτά υδρολύονται ακαριαία από το νερό. Επίσης, με θέρμανση αποδίδουν το XeF6 και αυτό αποτελεί τρόπο καθαρισμού του και απαλλαγής από τα άλλα φθορίδια.
Με αποδέκτες ιόντων φθορίου το
XeF6
σχηματίζει πενταφθοροξενικό κατιόν, π.χ. XeF6
+ RuF5
Τριοξείδιο του ξένου (XeO3): Λευκή, κρυσταλλική ουσία. Είναι η πλέον επικίνδυνη ένωση του ξένου λόγω της εξαιρετικής εκρηκτικότητάς της. Μπορεί να εκραγεί αν έρθει σε επαφή με οργανική ύλη, αλλά και με μηχανική κρούση ή τριβή. Παράγεται κατά την υδρόλυση των XeF4 και XeF6 (βλ. αντιδράσεις παραπάνω). Είναι ισχυρά ενδόθερμη ένωση (ΔΗf = +402 kJ/mol).Όταν διαλυθεί στο νερό, εφυδατώνεται εν μέρει παρέχοντας ξενικό οξύ.
Ξενικό οξύ (H2XeO4):
Παράγεται κατά τη διάλυση του XeO3
στο νερό:
XeO3
+ Η2Ο
Ασθενέστατο οξύ αλλά πανίσχυρο οξειδωτικό σώμα. Όλα τα γνωστά άλατά του περιέχουν το όξινο ξενικό ανιόν HXeO4- (ουσιαστικά συμπεριφέρεται ως μονοπρωτικό οξύ). Σε αλκαλικά διαλύματα υπόκειται σε αντίδραση αυτοοξειδοαναγωγής παρέχοντας ξένο και υπερξενικό οξύ. Τετροξείδιο του ξένου (XeO4): Κίτρινο κρυσταλλικό στερεό, σταθερό σε θερμοκρασίες κάτω από το σημείο τήξεώς του, εύκολα διασπώμενο σε μεγαλύτερες (σ.τ. = -39,5ºC, σ.ζ. = -39,5ºC). Είναι ισχυρά ενδόθερμη ένωση (ΔΗf = +643 kJ/mol). Παρασκευάζεται με επίδραση θειικού οξέος στο άλας με βάριο του υπερξενικού οξέος και αφυδάτωση του υπερξενικού οξέος με θειικό οξύ:
Ba2XeO6
+ 2 H2SO4
Υπερξενικό οξύ (Η4XeO6): Παρασκευάζεται με διάλυση του τριοξειδίου του ξένου σε διαλύματα ισχυρής βάσης, οπότε πραγματοποιείται η αυτοοξειδοναγωγική αντίδραση:
2
XeO3
+ 4 OH-
Το υπερξενικό οξύ είναι ισχυρό
οξύ (pK1
<0, pK2
= 4,3, pK3
= 10,8,
pK4>14)
[Αναφ.
10δ].
Τα υπερξενικά ανιόντα έχουν
κίτρινο χρώμα και σχηματίζουν άλατα επίσης κίτρινου χρώματος. Τα άλατά του
είναι σχετικώς σταθερά με εξαίρεση το άλας με άργυρο που διασπάται
εκρηκτικά. Σε όξινα διαλύματα διασπάται προς ξενικό οξύ:
H4XeO6
Πρέπει να σημειωθεί ότι το ξένον φθάνει σε βαθμό οξείδωσης +8 μόνο με δεσμούς Xe-O και είναι παράδοξο το ότι δεν έχει απομονωθεί κάποια ένωσή του σε αυτήν την οξειδωτική κατάσταση με δεσμούς Xe-F (π.χ. ως XeF8 ή κάποια οξυφθοριούχο ένωση). |
 |
 |
|
Ποια σχέση μπορεί να έχουν οι διάφορες "παιχνιδομηχανές" με το διφθοριούχο ξένο; Οι διάφορες παιχνιδομηχανές, όπως η εικονιζόμενη Wii της Nintendo, βασίζεται στην τεχνολογία των MEMS. Η κυριότερη σημερινή εφαρμογή του XeF2 εντοπίζεται στην κατασκευή των MEMS. |
|
Εφαρμογές του διφθοριούχου ξένου στη σύγχρονη τεχνολογία
Η κυριότερη εφαρμογή του διφθοριούχου ξένου στη σύγχρονη τεχνολογία είναι η χρήση του στην κατασκευή μικρο-ηλεκτρομηχανικών συστημάτων (micro electro mechanical systems, MEMS) [Αναφ. 12].
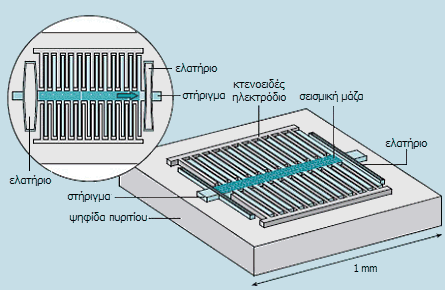
Ως MEMS χαρακτηρίζονται τα ηλεκτρομηχανικά εξαρτήματα μεγέθους λίγων mm που συντίθενται από επιμέρους εξαρτήματα με μεγέθη 1-100 μm. Τα MEMS μοιάζουν με τα ολοκληρωμένα κυκλώματα, αυτό που τα ξεχωρίζει αυτά είναι το ότι περιέχουν κινητά τμήματα (ελατήρια, ελάσματα, κτενοειδή ηλεκτρόδια, παλόμενες επιφάνειες, ρότορες, βραχίονες, γρανάζια κ.α.). 'Ολα τα κινητά και σταθερά μηχανικά εξαρτήματα, αλλά και τα συνοδευτικά ηλεκτρονικά κυκλώματα (ενισχυτές σημάτων, αναλογικοψηφιακοί μετατροπείς κ.α.), συναρμολογούνται σε ένα υπόστρωμα πυριτίου.
Σε μορφή MEMS έχουν κατασκευασθεί επιταχυνσιόμετρα, γυροσκόπια, ηλεκτρονικές πυξίδες, μικρόφωνα, αισθητήρες πίεσης, μετρητές ροής αερίων, μικροαντλίες, μικροβαλβίδες κ.ά., που με τη σειρά τους χρησιμοποιούνται σε πλήθος σύγχρονων εφαρμογών. Μερικές μόνο από τις εφαρμογές αυτές είναι: αναλυτική οργανολογία (lab-on-the-chip), βιοϊατρικές συσκευές (φορητές συσκευές χορήγησης ινσουλίνης), στην αυτοκινητοβιομηχανία ως αισθητήρες σύγκρουσης για ενεργοποίηση αερόσακων και ανιχνευτές κλίσης δρόμου (αυτόματη ενεργοποίηση φρένων σε περίπτωση κίνησης του αυτοκινήτου προς τα πίσω λόγω κλίσης δρόμου), παρακολούθηση της κίνησης στις τρεις διαστάσεις στις διάφορες "παιχνιδομηχανές", στα διάφορα tablet-PC (iPhone, iPad), στον κινηματογράφο (ψηφιακά κινηματογραφικά εφέ).
|
|
|
| Συσκευές - θάλαμοι κατασκευής MEMS με ελεγχόμενη επίδραση XeF2 σε ψηφίδες πυριτίου. |
Τα MEMS κατασκευάζονται σε ψηφίδες (chips) πυριτίου και η μικρομηχανουργική κατασκευή των διαφόρων κινητών τμημάτων πραγματοποιείται με επιλεκτική διάβρωση (etching) του πυριτίου. Χρησιμοποιούνται μικρολιθογραφικές τεχνικές παρόμοιες με εκείνες που χρησιμοποιούνται για την κατασκευή των ολοκληρωμένων κυκλωμάτων. Τα σημεία που δεν πρέπει να διαβρωθούν καλύπτονται συνήθως με προστατευτικά στρώματα ("μάσκες") όπως: SiO2, Si3N4, Al, Cr, TiN. H διάβρωση μπορεί να γίνει με διάφορες τεχνικές (υγρά διαβρωτικά διαλύματα, με τεχνικές πλάσματος ή ιοντικού βομβαρδισμού) [Αναφ. 13]. Το διφθοριούχο ξένο αντιδρά επιλεκτικά με το πυρίτιο σύμφωνα με την αντίδραση:
Si + 2 XeF2
![]() SiF4 + 2 Xe
SiF4 + 2 Xe
Τα SiO2 και Si3N4 διαβρώνονται 10.000 και 100 φορές πιο αργά από το Si, έτσι το διφθοριούχο ξένο έχει το πλεονέκτημα της ταχείας επιλεκτικής διάβρωσης μόνο του ακάλυπτου πυριτίου. Ως αέριο διεισδύει σε μικροσχισμές και δαιδαλώδη τμήματα της μικροκατασκευής πολύ ευκολότερα από όσο τα διάφορα υγρά διαβρωτικά μέσα. Επίσης, βασικό πλεονέκτημά του είναι ότι τα προϊόντα της διάβρωσης είναι επίσης αέρια και απομακρύνονται με διάχυση εύκολα. Για τους λόγους αυτούς χαρακτηρίζεται ως ισοτροπικό διαβρωτικό μέσον (isotropic etchant).
Η όλη διαδικασία πραγματοποιείται αυτοματοποιημένα σε ειδικούς θαλάμους, όπου πραγματοποιείται ελεγχόμενη (προγραμματιζόμενη) απελευθέρωση XeF2 από μεταλλικές φιάλες τροφοδοσίας, όπως επίσης και ακριβής έλεγχος της θερμοκρασίας. Λόγω του μεγάλου κόστους του XeF2 (και του Xe γενικότερα), το παραγόμενο Xe μπορεί να συλλεχθεί και να επαναχρησιμοποιηθεί για τη σύνθεση XeF2.
Τυπικό παράδειγμα MEMS είναι τα επιταχυνσιόμετρα (accelerometers), η αρχή λειτουργίας των οποίων βασίζεται στη μεταβολή της ηλεκτρικής χωρητικότητας μεταξύ κτενοειδών ηλεκτροδίων λόγω μικρής αλλαγής της απόστασης μεταξύ τους εξαιτίας της ασκούμενης δύναμης στη "σεισμική μάζα". Τα παραγόμενα σήματα παρέχουν τις τιμές επιτάχυνσης και προς τις τρεις διαστάσεις, ψηφιοποιούνται και διαβιβάζονται ως ψηφιακά σήματα προς τον μικροελεγκτή της όλης διάταξης. Παράδειγμα επιταχυνσιομετρικού MEMS (τριών διαστάσεων) είναι το ADXL330 της Analog Devices.
|
Αρχή λειτουργίας επιταχυνσιομετρικού MEMS (περισσότερα) |
Τμήμα επιταχυνσιομέτρου (g-sensor) MEMS |
|
|
Μικροαντλία MEMS για χορήγηση ινσουλίνης |
|

Τμήματα διάφορων MEMS (αντιπροσωπεύουν τμήματα μήκους 0,1-0,2 mm).
 |
 |
 |
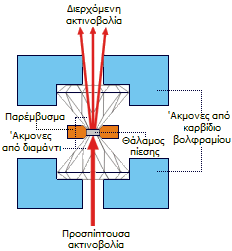
| Πρέσα με άκμονες από διαμάντι (diamond-anvil cell, DAC). Η διαφάνεια του διαμαντιού επιτρέπει την παρακολούθηση των μεταβολών του χρώματος του πιεζόμενου κρυστάλλου. Για περισσότερα πάνω στην τεχνολογία των υψηλών πιέσεων βλέπε εδώ. | ||
Το διφθοριούχο ξένο ως "υπερσυσσωρευτής" ενέργειας
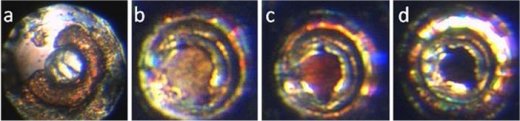
Μια νέα ιδιότητα του διφθοριούχου ξένου διαπιστώθηκε από μια πρόσφατη έρευνα του Choong-Shik Yoo του Πολιτειακού Πανεπιστημίου της Washington. Χρησιμοποιώντας μια ειδικής κατασκευής πιεστική μηχανή (πρέσα) με άκμονες από διαμάντι (diamond-anvil cell) εφάρμοσε εξαιρετικά μεγάλη πίεση (μέχρι 1 εκατομμύριο atm) σε κρυστάλλους XeF2 και έλαβε μια μεταλλική μορφή της ένωσης, όπου όλα τα άτομα έχουν πλησιάσει περισσότερο μεταξύ τους.
Με πίεση περίπου 500 χιλιάδες atm, το διφθοριούχο ξένο μετασχηματίζεται σε ένα κοκκινωπό δισδιάστατο ημιαγώγιμο υλικό με δομή στιβάδων εξαγωνικών πλεγμάτων ανάλογη με εκείνη του γραφίτη. Με πιέσεις πάνω από 700 χιλιάδες atm μετασχηματίζεται σε ένα μαύρο μεταλλικό υλικό με τρισδιάστατη δομή φθορίτη.
'Ολη η μηχανική ενέργεια που χρειάστηκε για να γίνει αυτή η μετατροπή αποθηκεύτηκε στην ίδια την ένωση ως ένα είδος χημικής ενέργειας. 'Οπως ανέφερε ο Yoo, το νέο αυτό υλικό βρίσκεται σε μια μετασταθή κατάσταση και δεν χρειάζεται παρά μόνο η διατάραξη ενός ατόμου για να "εκλυθεί" η ενέργεια αυτή κατά εκρηκτικό τρόπο υπό μορφή θερμότητας. Σε κάθε γραμμάριο αυτής της μορφής της ουσίας βρίσκεται αποθηκευμένη ενέργεια περίπου 1 kilojoule, που αντιστοιχεί στο 20% της ενέργειας που που εκλύεται κατά την έκρηξη 1 γραμμαρίου από το ισχυρότερο εκρηκτικό (HMX). Να σημειωθεί ότι και το ξένον, σε πίεση 2 εκατομμυρίων atm μεταπίπτει σε μεταλλικό στερεό κυανού χρώματος [Αναφ. 14].
 |
 |
|
Κρυσταλλική δομή του XeF2 σε κανονική πίεση, στις 520 χιλιάδες και στις 980 χιλιάδες atm. |
Οι αλλαγές του χρώματος του XeF2 (από διαυγές σε κόκκινο και στη συνέχεια σε μαύρο) καθώς αλλάζει η κρυσταλλική δομή με αύξηση της εφαρμοζόμενης πίεσης. |
1. (α) Merck Index, 12th ed, σελ. 1721. (β) Wikipedia: "Xenon Difluoride". (γ) SpectraGases (SG): "Material Data Safety Sheet: Xenon Difluoride" (αρχείο PDF, 77 KB). (δ) PelChem (South Africa): "Xenon Difluoride". (ε) Praxair Technologie Inc.: "Material Data Safety Sheet: Xenon Difluoride" (αρχείο PDF, 52 KB).
2. (α) Lord Rayleigh: "On an Anomaly Encountered in Determinations of the Density of Nitrogen Gas", Proceedings of the Royal Society of London, 55:340-344, 1894 (αρχείο PDF, 341 KB). (β) Lord Rayleigh, Ramsay W: "Argon, A New Constituent of the Atmosphere", Philosophical Transactions of the Royal Society of London. A, 186:187-241, 1895 (Abstract). (γ) Wikipedia: "Atmosphere of Earth".
3. (α) Wikipedia "Xenon arc lamp". (β) Carl Zeiss Co.: "Fundamentals of Xenon Arc Lamps".
4. (α) AnaesthesiaUK: "Xenon". (β) www.anaesthetist.com: "Xenon". (γ) Franks JJ, Horn JL, Janicki PK, Singh G: "Halothane, isoflurane, xenon, and nitrous oxide inhibit calcium ATPase pump activity in rat brain synaptic plasma membranes", Anesthesiology 82(1):108-117, 1995 (PubMed). (δ) Goto T, Yoshinori N, Shigeho M: "Will Xenon Be a Stranger or a Friend?: The Cost, Benefit, and Future of Xenon Anesthesia", Anesthesiology 98(1):1-2, 2003. (ε) Marx T, Schmidt M, Schirmer U, Reinelt H: "Xenon anesthesia", Journal of the Royal Society of Medicine 93(10):513-517, 2000 (αρχείο PDF, 107 KB). (στ) Wikipedia: "Isotopes of xenon".
5. (α) NASA, Glenn Research Center: "Ion propulsion". (β) Wikipedia: "Ion thruster". (γ) Wikipedia: "http://en.wikipedia.org/wiki/Electrostatic_ion_thruster". (δ) University of Michigan: "The Past and Future of Rocket Engine Propulsion".
6. (α) Wikipedia: "Xenon hexafluoroplatinate". (β) Bartlett N: "The Noble Gases", Chemical & Engeeniring News, American Chemical Society, 2003. (γ) Grahama L, Graudejusa O, Jhab NK, Bartlett N: "Concerning the nature of XePtF6", Coordination Chemistry Reviews 197(1):321-334, 2000 (Abstract). (δ) smellslikescience.com (Scientific Discovery): "Not so noble". (ε) Sampson M : "Neil Bartlett and Reactive Noble Gases", American Chemical Society, 2006. (στ) Holloway JH, Hope EG: "Recent Advances in Noble-Gas Chemistry", Advances in Inorganic Chemistry, 46:51-100, 1998 (Abstract).
7. (α) Chernick CL, Claassen HH, Fields PR, Hyman HH, Malm JG, Manning WM, Matheson MS, Quarterman LA, Schreiner F, Selig HH, Sheft I, Siegel S, Sloth EN, Stein L, Studier MH, Weeks JL, Zirin MH: "Fluorine Compounds of Xenon and Radon", Science 138(3537):136-138, 1962 (Abstract). (β) Weeks JL, Chernick CL, Matheson MS: "Photochemical Preparation of Xenon Difluoride", J. Am. Chem. Soc. 84(23):46124613, 1962. (γ) Holloway JH: "Noble-Gas Chemistry", Methuen & Co. Ltd. and Science Paperbacks, 1968. (δ) Greenwood NN, Earnshaw A: "Chemistry of the Elements", Pergamon Press, 1st ed. 1984, σελ. 1051. (ε) Κατάκης Δ, Μεθενίτης Κ, Μητσοπούλου Χ, Πνευματικάκης Γ: "Ανόργανη Χημεία Β': Τα στοιχεία", Εκδόσεις Παπαζήση 2002, σελ. 32-35. (στ) Holleman - Wiberg: "Inorganic Chemistry", Academic Press, 2001 (Google Book).
8. (α) Korobtsev VP, Marinenko EP, Matyukha SV, Sokolov VB, Chaivanov BB: "Purification of xenon difluoride from xenon tetrafluoride", Journal of Fluorine Chemistry,54(1-3): 338, 1991 (Abstract). (β) World Intellectual Property Organization (WIPO): Aleinikov NN: "(WO/2000/064807) Method for producing xenon difluoride and method for purifying the same", 2000.
9. (α) Tius MA: "Xenon Difluoride in Synthesis", Tetrahedron 51(24):6605-6634, 1995. (β) Tramšek M, Žemva B: "Synthesis, Properties and Chemistry of Xenon(II) Fluoride", Acta Chim. Slov. 53(2):105-116, 2006 (αρχείο PDF, 875 KB). (γ) Appelman EH: "The Synthesis of Perbromates", J. Am. Chem. Soc. 90(7):1900-1901, 1968 (Abstract). (δ) Dukat WW, Holloway JH, Hope EG, Townson PJ, Powell RL: "The reactions of xenon difluoride with 'inert' solvents", Journal of Fluorine Chemistry, 62(2-3):293-296, 1993 (Abstract).
10. (α) "Aromatic and Heteroaromatic Chemistry, Volume 7", The Chemical Society, 1979 (Google Book). (β) Firnau G, Chirakal R, Sood S, Garnett S: "Aromatic fluorination with xenon difluoride: L-3,4-dihydroxy-6-fluoro-phenylalanine", Canadian Journal of Chemistry, 58:1449-1450, 1980. (γ) Hronowski LJJ, Szarek WA: "Synthesis of cyclopentane analogs of 5-fluorouracil nucleosides", Canadian Journal of Chemistry, 70:1162-1169, 1992. (δ) Wakefield B: "Fluorinated pharmaceuticals", Innovation in Pharmaceutical Technology, 75-78, 2000 (αρχείο PDF, 220 KB) (ε) Patrick TB, Kamalesh JK, White DH, Bertrand WS, Mokhtar R, Kilbourn MR, Welch MJ: "Replacement of the carboxylic acid function with fluorine", Canadian Journal of Chemistry 64: 138-141, 1986 (αρχείο PDF, 266 KB).
11. (α) Wikipedia: "Xenon tetrafluoride". (β) Wikipedia: "Xenon hexafluoride". (γ) Wikipedia: "Xenon trioxide". (δ) Wikipedia: "Perxenate". (δ) Klaning UK, Appelman EH: "Protolytic Properties of Perxenic Acid", Inorg. Chem., 27:3760-3762, 1988.
12. (α) Wikipedia: "Microelectromechanical systems". (β) mems-exchange.org: "What is MEMS Technology?". (γ) Bernstein J: "An overview of MEMS Inertial Sensing Technology", Sensors, Feb. 2003. (δ) Compliant Mechanism Research Group (CMR): "Introduction to Microelectromechanical Systems (MEMS)".
13. (α) XACTIC, Inc (USA): "Xenon Difluoride". (β) XACTIC, Inc (USA): "CVE Etch Module for XeF2" (αρχείο PDF, 53 KB). (γ) Karwacki EJ Jr, Wu D, Mallikarjunan A, Johnson AD: "Patent application title: Selective Etching and Formation of Xenon Difluoride".
14. (α) Kim M,Debessai M, Yoo C-S: "Two- and three-dimensional extended solids and metallization of compressed XeF2", Nature Chemistry, 2:784-788, 2010 (Abstract). (β) Mims C: "New 'Ultra-Battery' as Energy-Dense as High Explosives Metallized xenon difluoride heralds a new class of solid fuels", Technology Review, Aug. 2010. (γ) Wikipedia: "Xenon".
|
Αποποίηση ευθυνών: Έχει καταβληθεί κάθε προσπάθεια για να εξασφαλισθεί η ορθότητα των πληροφοριών που περιλαμβάνονται σε αυτή τη σελίδα, ωστόσο ο έχων την επιμέλεια της σελίδας αυτής και το Τμήμα Χημείας δεν αναλαμβάνουν τη νομική ευθύνη για τυχόν σφάλματα, παραλείψεις ή ανακριβείς πληροφορίες. Επιπλέον, το Τμήμα Χημείας δεν εγγυάται την ορθότητα των αναφερόμενων σε εξωτερικές ιστοσελίδες, ούτε η αναφορά μέσω συνδέσμων (links) στις ιστοσελίδες αυτές, υποδηλώνει ότι το Τμήμα Χημείας επικυρώνει ή καθ' οιονδήποτε τρόπο αποδέχεται το περιεχόμενό τους. |