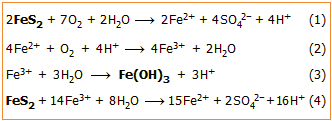 Γενικά
για το θειικό οξύ [Αναφ. 1,
2]
Γενικά
για το θειικό οξύ [Αναφ. 1,
2]
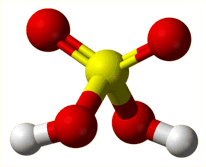
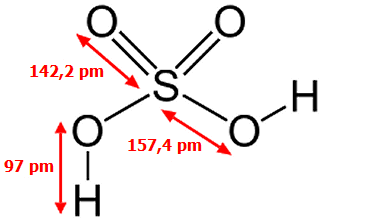
Το θειικό οξύ (sulfuric acid ή sulphuric acid) είναι ένα άχρωμο, ειδικώς βαρύ (πυκνότητα 1,84 g/cm3) και σχετικά ιξώδες ελαιώδες υγρό με μοριακό τύπο H2SO4 . Πρόκειται για τη χημική ουσία που παράγεται σε μεγαλύτερη ποσότητα από οποιαδήποτε άλλη και είναι το φθηνότερο οξύ βιομηχανικής χρήσης.
Το θειικό οξύ είναι ισχυρότατα διαβρωτικό και καυστικό οξύ, όπως και οξειδωτικό σε μεγάλες συγκεντρώσεις και υψηλές θερμοκρασίες. Επιπλέον, το πυκνό θειικό οξύ διαθέτει εντονότατη αφυδατική δράση και όταν έρθει σε επαφή με οργανική ύλη (π.χ. ξύλο, χαρτί) την απανθρακώνει αφαιρώντας μόρια ύδατος. Αναμιγνύεται με το νερό σε οποιαδήποτε αναλογία με έκλυση μεγάλων ποσών θερμότητας. 'Αλλη ιστορική και ευρύτερα γνωστή και "δυσώνυμη" (για τον περισσότερο κόσμο) ονομασία του είναι βιτριόλι (oil of vitriol), από την οποία προέρχεται και το επίθετο (εκ μεταφοράς) "βιτριολικός": κακός, κακότροπος, αιχμηρός, καυστικός.
|
Sulph- ή Sulf-; Σύμφωνα με αποφάσεις της IUPAC (1990) και της Επιτροπής Ονοματολογίας της Royal Society of Chemistry (1992) το θείο στα επιστημονικά κείμενα γράφεται ως sulfur και όχι ως sulphur, τρόπος γραφής που διατηρείται σε μη επιστημονικά κείμενα. |
Η ονομασία βιτριόλι είναι αποτέλεσμα μιας μεθόδου παρασκευής θειικού οξέος που χρησιμοποιούσαν οι αλχημιστές κατά την οποία πραγματοποιούσαν ξηρή απόσταξη στο ονομαζόμενο πράσινο βιτριόλι (δισθενής θειικός σίδηρος, FeSO4·7Η2Ο). Κατά την έντονη θέρμανσή το άλας διασπάται παρέχοντας ατμούς θεικού οξέος. Οι ατμοί όταν ψυχθούν, συμπυκνώνονται και παρέχουν το υγρό οξύ, το οποίο έχει μια ελαιώδη υφή. 'Ετσι ονομάστηκε έλαιο του βιτριολίου ή απλά βιτριόλι.
Να σημειωθεί ότι από την αρχαιότητα βιτριόλια ονόμαζαν τα κρυσταλλικά, συχνά διαφανή, έγχρωμα και εντυπωσιακά από άποψη μεγέθους και ομορφιά κρυστάλλων, θειικά άλατα ορισμένων μετάλλων. Η ονομασία αυτή έχει Λατινική προέλευση: vitriolium, από τα vitrum: ύαλος, vitriolus: υαλώδης.
Ο χειρισμός του θειικού οξέος και ειδικότερα των πυκνών διαλυμάτων του απαιτεί γνώση των ιδιοτήτων του μεγάλες προφυλάξεις, διότι μπορεί να προκαλέσει σοβαρότατα εγκαύματα στο δέρμα και να κάψει τα ρούχα. Το θειικό οξύ είναι η πρώτη χημική ένωση από άποψη ποσότητας ετήσιας παραγωγής από τη χημική βιομηχανία και σχεδόν όλες οι χώρες του κόσμου διαθέτουν μονάδες παραγωγής θειικού οξέος. Σήμερα, η παγκόσμια παραγωγή του θειικού οξέος έχει ξεπεράσει τα 250 εκατομμύρια μετρικών τόνων και συνεχίζει να αυξάνεται με ρυθμό 3% κατά τα τελευταία χρόνια. Η ετήσια ποσότητα θειικού οξέος που καταναλώνει μια χώρα αποτελεί αψευδές μέτρο της δυναμικότητας της χημικής βιομηχανίας της.
Στο εμπόριο το θειικό οξύ διατίθεται κυρίως με περιεκτικότητα 96-98%. Αν και είναι εύκολη η παρασκευή του σε καθαρή μορφή (100%), η διάθεσή του στη μορφή αυτή αποφεύγεται, επειδή το καθαρό H2SO4 στερεοποιείται σε σχετικά συνήθεις θερμοκρασίες (σ.τ. = 10,5ºC), γεγονός που καθιστά δύσκολη τη μετάγγισή του από δεξαμενές ή άλλους περιέκτες.
 |
 |
 |
 |
|
Τα πιο γνωστά "βιτριόλια", δηλ. κρυσταλλικά, ένυδρα θειικά άλατα (από αριστερά προς τα δεξιά): (1) "Πράσινο βιτριόλιο" (Copperas, FeSO4·7H2O). (2) "Γαλάζιο βιτριόλιο" (γαλαζόπετρα, χάλκανθος, "βιτριόλι του χαλκού", CuSO4·5H2O). (3) "Ερυθρό βιτριόλιο" (CοSO4·7H2O). (4) "Λευκό βιτριόλιο" (ZnSO4·7H2O) |
|||
 |
 |
 |
 |
|
Φυσικά ορυκτά "βιτριόλια" και θειούχα ορυκτά (πυρίτες) από τα οποία προκύπτουν με φυσική οξείδωση (από αριστερά προς τα δεξιά): (1) Μελαντερίτης (FeSO4·7H2O). (2) Χαλκανθίτης (CuSO4·5H2O). (3) Σιδηροπυρίτης (FeS2). (4) Χαλκοπυρίτης (CuFeS2) |
|||
Ανακάλυψη και ιστορία του θειικού οξέος
|
Σύμβολα του θειικού οξέος. Αριστερά: Αλχημιστικό σύμβολο [πηγή]. Δεξιά: Σύμβολο κατά Dalton. Χαρακτηριστικό είναι το ότι o Dalton θεωρεί το θειικό οξύ ως υδατικό διάλυμα SO3 [πηγή]. |
Τα θειικά άλατα πολλών μετάλλων, τα "βιτριόλια", ήταν γνωστά από την αρχαιότητα, αφού αρκετά από αυτά βρίσκονταν ως ορυκτά, τα οποία συνήθως συνοδεύουν τα αντίστοιχα θειούχα ορυκτά. Τα βιτριόλια ήταν ήδη γνωστά από εποχή των Σουμερίων (3.800 π.Χ.) και κατατάσσονταν ανάλογα με το χρώμα τους. Αναφορές στα βιτριόλια κάνουν στα έργα τους ο ιατρός και φαρμακολόγος Διοσκουρίδης (40-90 μ.Χ) και ο Ρωμαίος φυσιοδίφης Πλήνιος ο Πρεσβύτερος (Pliny the Elder, 23-79 μ.X.), ενώ ο διασημότερος ιατρός της αρχαιότητας, ο Γαληνός (Galen, 129-216 μ.Χ.) αναφέρει κάποιες ιατρικές χρήσεις τους.
|
|
|
|
|
Albertus Magnus (13ος αιώνας) |
Basilius Valentinus (15ος αιώνας) |
Johann Van Helmont (1580-1644) |
Ορισμένες χρήσεις των "βιτριολικών ουσιών" στη μεταλλουργία κατά τις ελληνιστικές περιόδους, αναφέρονται στην επιστημονική πραγματεία Phisica et Mystica (Φυσικά και Μυστικά) του Βώλου του Μενδήσιου (2ος αιώνας π.Χ., Bolus of Mendes), στον πάπυρο Leyden papyrus X., όπως και από τον πλέον διάσημο αλχημιστή εκείνης της εποχής, τον Ζώσιμο τον Πανωπολίτη (3ος-4ος αιώνας μ.Χ., Zosimos of Panopolis).
Οι Πέρσες αλχημιστές Jābir ibn Hayyān (721-815, γνωστός στην Ευρώπη ως Geber) και Ibn Zakariya al-Razi (865-925, γνωστός ως Rhazes) περιγράφουν τα βιτριόλια, ενώ ο διάσημος ιατροφιλόσοφος Ibn Sina (980-1037, γνωστός ως Avicenna) και επικέντρωσε την περιγραφή του στις ιατρικές χρήσεις τους.
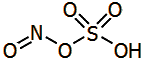
Ο Ibn Zakariya al-Razi πειραματίσθηκε με την ξηρή απόσταξη σε κεραμικό άμβυκα ορυκτών θειικών αλάτων, όπως ο ένυδρος θειικός σίδηρος (FeSO4·7H2O) και ο ένυδρος θειικός χαλκός (CuSO4·5H2O), τα οποία σε αλχημιστικά κείμενα αναφέρονται αντιστοίχως ως copperas και χάλκανθος. Με τον τρόπο αυτό παρέλαβε μίγμα ύδατος (H2O) και τριοξειδίου του θείου (SO3), τα οποία με ανάμιξη δίνουν διάλυμα θειικού οξέος:
2FeSO4
![]() Fe2O3 + SO3 + SO2
CuSO4
Fe2O3 + SO3 + SO2
CuSO4
![]() CuO
+ SO3 SO3 + H2O
CuO
+ SO3 SO3 + H2O
![]() H2SO4
H2SO4
|
Η μυστικιστική ονομασία του ένυδρου θειικού σιδήρου(ΙΙ) (ως πηγής του "θαυματουργού ελαίου του βιτριολίου" ) ήταν "Πράσινος λέων" [πηγή] |
Αυτή η μέθοδος διαδόθηκε στην Ευρώπη από μεταφράσεις αραβικών και περσικών εγχειριδίων που καταγράφηκαν σε βιβλία διάσημων αλχημιστών και ιατροφιλόσοφων, όπως του Γερμανού Albertus Magnus (13ος αιώνας).
Το βιτριόλι (θειικό οξύ) αρχίζει να εμφανίζεται στα εργαστήρια των αλχημιστών της Ευρώπης κατά τον 13ο αιώνα και μάλιστα θεωρήθηκε αλχημιστική ουσία πρώτιστης σημασίας, ιδιαίτερα για τη χρήση της στην αναζήτηση της φιλοσοφικής λίθου. Οι αλχημιστές είχαν εντυπωσιαστεί από το γεγονός ότι το βιτριόλι κατέτρωγε (διέλυε) όλα τα μέταλλα εκτός από τον χρυσό, η παρασκευή του οποίου ήταν ο στόχος των περισσότερων αλχημιστών.
Η σημασία του βιτριολιού για την αλχημεία τονίζεται στην αλχημιστική (και μάλλον ακατανόητη) συμβουλή: "Visita Interiora Terrae Rectificando Invenies Occultum Lapidem (V.I.T.R.I.O.L.)", που σήμαινε: "Επισκέψου τα έγκατα της Γης και καθαρίζοντας θα ανακαλύψεις τη μυστική (φιλοσοφική) λίθο". Το κείμενο αυτό αποδίδεται στον Γερμανό αλχημιστή του 15ου αιώνα τον Basilius Valentinus, στο σύγγραμμά του "L' Azoth des Philosophes". Πολλές πηγές αναφέρουν τον Valentinus ως τον πρώτο που εισήγαγε το θειικό οξύ στα αλχημιστικά εργαστήρια της Ευρώπης, αν και τόσο η ταυτότητα του ίδιου, όσο και η αυθεντικότητα των αναφερόμενων ως συγγραμμάτων του αμφισβητούνται από πολλούς ερευνητές.
Γενικά, λίγα πράγματα ήταν γνωστά για το θειικό οξύ πριν από τον 16ο αιώνα. Σε κάποιες ποσότητες παρασκευάστηκε, γύρω στο 1600, από τον διάσημο για τις μελέτες του στα αέρια Φλαμανδό ιατροχημικό Johann Van Helmont (1580-1644), με ξηρή απόσταξη του ένυδρου θειικού σιδήρου(ΙΙ), όπως επίσης και με οξείδωση του θείου.
Το 1787, ο διάσημος Antoine Lavoisier (1743-1793) διαπίστωσε ότι το θειικό οξύ ήταν ένωση υδρογόνου, οξυγόνου και θείου και αντικατέστησε τη μέχρι τότε κοινή ονομασία του βιτριολικό οξύ (vitriolic acid) με τη σύγχρονη ονομασία θειικό οξύ (sulfuric acid), με βάση το σύστημα ονοματολογίας των οξέων και των αλάτων τους που ο ίδιος εισήγαγε.
 |
 |
 |
 |
|
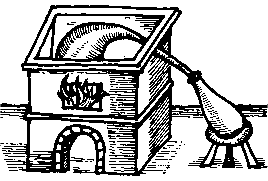
Αλχημιστικά σκεύη απόσταξης (άμβυκες). Το πρώτο (αριστερά) αναφέρεται σε μέθοδο παρασκευής θειικού οξέος με ξηρή απόσταξη FeSO4·7H2O [πηγή]. Γενικά, φαίνεται πως οι αλχημιστές αντιμετώπιζαν το θειικό οξύ με δέος λόγω της μεγάλης του διαβρωτικής του ισχύος, στην οποία μόνο η ύαλος μπορούσε να σντισταθεί. |
|||
Βιομηχανικές μέθοδοι παρασκευή θειικού οξέος [Αναφ. 3, 4]
|
Μονάδα παρασκευής θειικού οξέος Nordhausen [πηγή]. |
Το θειικό οξύ άρχισε να παρασκευάζεται σε εμπορική κλίμακα κατά τα μέσα του 18ου αιώνα. Οι αρχικές μέθοδοι παρασκευής του δεν διέφεραν ουσιαστικά από εκείνες των αλχημιστών και βασίζονταν στη διάσπαση ένυδρων θειικών αλάτων (κυρίως του FeSO4·7H2O), όπως και στην οξείδωση του στοιχειακού θείου με νίτρο (KNO3). Οι μέθοδοι αυτές περιγράφονται συνοπτικά στη συνέχεια.
Μέθοδος Nordhausen. Στη γερμανική πόλη Nordhausen υπήρξε η πρώτη βιομηχανική μονάδα παρασκευής θειικού οξέος. Η μέθοδος βασιζόταν στην καταστροφική απόσταξη του ένυδρου θειικού σιδήρου(ΙΙ). Το ένυδρο άλας θερμαινόταν στον αέρα, οπότε απομακρυνόταν το ύδωρ κρυστάλλωσης και υφίστατο μερική οξείδωση ο Fe(II) προς Fe(III). Στη συνέχεια το μίγμα των θειικών αλάτων των Fe(II) και Fe(III) θερμαινόταν σε συστοιχίες από μικρούς σιδερένιους άμβυκες. Οι εκλυόμενοι ατμοί που αποτελούνταν από SO2 και SO3 παραλαμβάνονταν σε πυκνό H2SO4.
Το οξύ περιείχε επιπλέον ποσότητες SO3 και ήταν γνωστό ως οξύ Nordhausen. 'Ηταν ένα ελαιώδες σκουρόχρωμο λόγω ακαθαρσιών (ή σκόπιμα για να υπενθυμίζεται η επικινδυνότητά του) ατμίζον υγρό, γνωστό ως oleum ή ατμίζον θειικό οξύ (fuming sulfuric acid), που στην ουσία είναι διάλυμα SO3 σε (τελείως άνυδρο) θειικό οξύ, κύριο συστατικό του οποίου είναι το πυροθειικό οξύ Η2S2O7 (επίσημη ονομασία κατά IUPAC: διθειικό οξύ):
Fe2(SO4)3·2FeSO4
![]() 2Fe2O3 + 4SO3 + SO2
SO3 + H2SO4
2Fe2O3 + 4SO3 + SO2
SO3 + H2SO4
![]() H2S2O7
H2S2O7
 |
 |
|
Johann Glauber (1604-1670) |
Joshua Ward (1685-1761) |
To oleum αραιώνεται με πυκνό διάλυμα θειικού οξέος, οπότε δεσμεύονται ποσότητες ύδατος από το δεύτερο δίνοντας ακόμη πυκνότερο διάλυμα H2SO4:
H2S2O7 + H2O
![]() 2H2SO4
2H2SO4
Η μέθοδος Nordhausen παρέμεινε σε χρήση μέχρι τα τέλη του 19ου αιώνα, διότι ήταν η μόνη που παρείχε απ' ευθείας oleum και δεν είχε ακόμη εξελιχθεί η "μέθοδος επαφής" (βλ. παρακάτω).
Αν και η μέθοδος φαίνεται κάπως πρωτόγονη σε σχέση με τις νεότερες μεθόδους, αναφέρεται ότι εξακολουθεί να χρησιμοποιείται σε περιοχές της Γερμανίας και της Τσεχίας όπου αφθονούν σχιστολιθικοί πυρίτες του σιδήρου (FeS2), η οποίοι οξειδούμενοι από το ατμοσφαιρικό οξυγόνο παρέχουν φθηνή πρώτη ύλη (ένυδρο θειικό σίδηρο(ΙΙ)).
Μέθοδος Glauber. Κατά τον 17ο αιώνα ο Γερμανός αλχημιστής - χημικός και φαρμακοποιός Johann Glauber (1604-1670) παρασκεύασε θειικό οξύ με θέρμανση μίγματος θείου και νιτρικού καλίου υπό διοχέτευση ατμών ύδατος. Η διάσπαση του νιτρικού καλίου οξειδώνει το θείο σε αέριο τριοξείδιο του θείου (SO3), το οποίο διοχετευόμενο στο νερό παράγει θειικό οξύ. Με αντίδραση του θειικού οξέος με χλωριούχο νάτριο, ο Glauber παρασκεύαζε θειικό νάτριο (Na2SO4·10H2O), το οποίο διέθετε ως θαυματουργό καθαρτικό με την ονομασία "θαυματουργό άλας" (sal mirabilis, άλας Glauber).
Η σύνθεση του θειικού οξέος θα μπορούσε να περιγραφεί απλά από την ακόλουθη σειρά αντιδράσεων, με την πρώτη να αποτελεί την κύρια από τις πολλές αντιδράσεις οξείδωσης του θείου από το νιτρικό άλας:
6KNO3 + 7S
![]() 3K2S + 6NO + 4SO3
SO3 + H2O
3K2S + 6NO + 4SO3
SO3 + H2O
![]() H2SO4
H2SO4
Το 1736, ένας φαρμακοποιός από το Λονδίνο, ο Joshua Ward (1685-1761), χρησιμοποίησε τη μέθοδο του Glauber για την πρώτη παραγωγή θειικού οξέος σε μεγάλη κλίμακα ιδρύοντας μια βιομηχανική μονάδα με την ονομασία "Great Vitriol Works" στο Twickenham μια μικρή πόλη κοντά στο Λονδίνο.
 |
 |
 |
|
John Roebuck (1718-1794) |
Joseph Gay-Lussac (1778-1850) |
John Glover (1817-1902) [πηγή]. |
Μέθοδος των μολύβδινων θαλάμων. Το 1746, στην αγγλική πόλη Birmingham, ο εφευρέτης και βιομήχανος John Roebuck (1718-1794) παρήγαγε θειικό οξύ με βάση τις ίδιες αντιδράσεις, αλλά χρησιμοποιώντας θαλάμους επενδυμένους εσωτερικά με φύλλα μολύβδου. Τα μολύβδινα φύλλα μπορούσαν εύκολα να συγκολληθούν μεταξύ τους στεγανοποιώντας τους θαλάμους.
Οι "μολύβδινοι θάλαμοι" ήταν ανθεκτικότεροι, φθηνότεροι και κατά πολύ μεγαλύτεροι από τους εύθραυστους υάλινους κώδωνες που χρησιμοποιήθηκαν αρχικά από τον Ward. 'Ετσι, η παραγωγή του θειικού οξέος σχεδόν δεκαπλασιάστηκε, το κόστος του μειώθηκε και η ιδέα του Roebuck συνέβαλε αποφασιστικά στην ανάπτυξη της μεθόδου των μολύβδινων θαλάμων (lead-chamber process), η οποία υπέστη συνεχείς βελτιώσεις κατά τα επόμενα 100 χρόνια.
Η αρχική μέθοδος προέβλεπε την ανάφλεξη μίγματος ενός νιτρικού άλατος (αρχικά KNO3) με θείο στον μολύβδινο θάλαμο, του οποίου το πάτωμα ήταν καλυμμένο με νερό, που απορροφούσε το παραγόμενο SO3. 'Ετσι λαμβανόταν διάλυμα H2SO4 35-45%, που μπορούσε να συμπυκνωθεί με βρασμό. Το KNO3 αντικαταστάθηκε από το NaNO3 ("νίτρο της Χιλής"), αφού το πρώτο συχνά δεσμευόταν για την παρασκευή πυρίτιδας, μια εποχή συνεχών πολέμων.
Το 1793, οι Γάλλοι φυσικοχημικοί Nicolas Clément (1779-1842) και Charles Bernard Desormes (1771-1862) (πεθερός του προηγούμενου) διαπίστωσαν ότι η ποσότητα του νιτρικού άλατος μπορούσε να μειωθεί δραστικά, εάν κατά την καύση του θείου διαβιβαζόταν στον θάλαμο καύσης ατμοσφαιρικός αέρας. 'Ετσι, ουσιαστικά αρκούσε το ατμοσφαιρικό οξυγόνο ως το μόνο οξειδωτικό. Το 1806, οι Clément - Desormes είχαν κατανοήσει ακριβώς τον ρόλο του νιτρικού άλατος και των οξειδίων του αζώτου και ανέφεραν: "...το νιτρικό οξύ είναι μόνο το μέσον για την πλήρη οξυγόνωση του θείου: είναι η βάση, το νιτρικό οξείδιο, εκείνο που παραλαμβάνει το οξυγόνο από τον ατμοσφαιρικό αέρα και το προσφέρει στο θειώδες οξύ στην κατάσταση που του ταιριάζει καλύτερα...".
Το 1835, ο διάσημος Γάλλος χημικός Joseph Gay-Lussac (1778-1850) βελτίωσε δραστικά τη μέθοδο του Roebuck. Ο Gay-Lussac εισήγαγε την ανακύκλωση των οξειδίων του αζώτου μέσω του ονομαζόμενου "πύργου Gay-Lussac". Τα οξείδια αυτά δρούσαν ως μεταφορέας του ατμοσφαιρικού οξυγόνου για την οξείδωση του SO2 προς SO3. Η βελτίωση αυτή υποδεκαπλασίασε το κόστος του παραγόμενου θειικού οξέος.
Το 1858, ο Βρετανός χημικός John Glover (1817-1902) έλυσε το πρόβλημα της αποτελεσματικής ανάκτησης των οξειδίων του αζώτου με την εισαγωγή της μονάδας "απονίτρωσης", γνωστότερης ως "πύργος Glover". 'Ετσι, χρειάζονταν πλέον μόνο πολύ μικρές ποσότητες νίτρου για την κάλυψη των απωλειών των οξειδίων του αζώτου κατά την ανακύκλωσή τους. Το SO2 προερχόταν είτε από την άμεση καύση θείου ή από τη φρύξη θειούχων μεταλλευμάτων (σιδηροπυρίτη, σφαλερίτη, χαλκοπυρίτη).
Συνοπτικά, η μέθοδος των μολύβδινων θαλάμων βασίζεται στον ακόλουθο κύκλο αντιδράσεων:
![]()
Αρχικά, οι χρήσεις του θειικού οξέος ήταν περιορισμένες. Ουσιαστικά, χρησίμευε μόνο για τον καθαρισμό σιδερένιων αντικειμένων από τη σκουριά και την επεξεργασία υφασμάτων. Μετά την ανακάλυψη από τον Leblanc (1791) της μεθόδου παρασκευής της σόδας (Na2CO3), όπου το θειικό οξύ αποτελούσε πλέον μια από τις πρώτες ύλες (βλ. Χημική ένωση του μήνα: "'Οξινο και ουδέτερο ανθρακικό νάτριο"), η ζήτηση θειικού οξέος σε χαμηλές τιμές αυξήθηκε αλματωδώς. Εξαιτίας της σχετικά δύσκολης και επικίνδυνης μεταφοράς των απαιτούμενων μεγάλων ποσοτήτων θειικού οξέος με τα μέσα εκείνης της εποχής, πολλά εργοστάσια σόδας περιελάμβαναν και μια μονάδα επιτόπιας παραγωγής του.
Από τις αρχές του 20ου αιώνα, η μέθοδος των μολύβδινων θαλάμων άρχισε σταδιακά να αντικαθίσταται από τη μέθοδο επαφής που περιγράφεται στη συνέχεια. Εκτιμάται ότι μετά το 1950 δεν κατασκευάστηκε στην Ευρώπη και Αμερική καμία βιομηχανική μονάδα παρασκευής θειικού οξέος με τη μέθοδο των μολύβδινων θαλάμων.
 |
 |
|
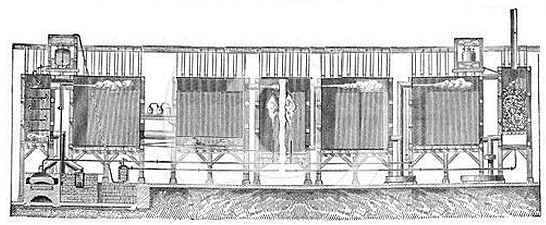
Σχηματικές απεικονίσεις μονάδας παραγωγής θειικού οξέος (του 19ου αιώνα) με τη μέθοδο των μολύβδινων θαλάμων, μετά την τροποποίηση που επέφερε ο Gay-Lussac (1835) στην αρχική μέθοδο του Roebuck. Στον τελευταίο θάλαμο (δεξιά), που έμεινε γνωστός ως "πύργος Gay-Lussac", συλλέγονταν τα οξείδια του αζώτου ως διάλυμα σε θειικό οξύ και επέστρεφαν στον πρώτο θάλαμο στη σειρά [πηγή]. |
|
|
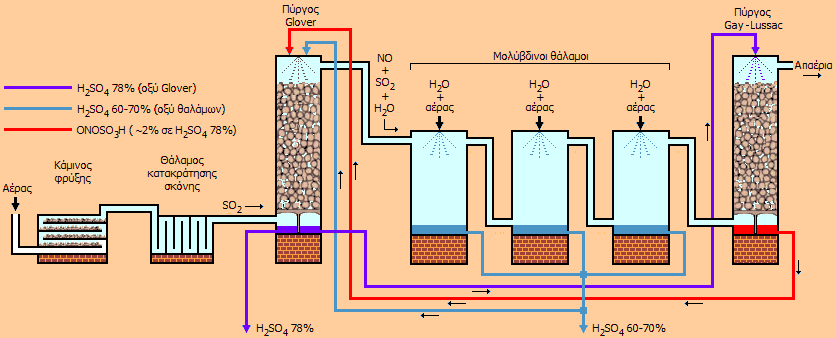
Σύντομη περιγραφή της μεθόδου των μολύβδινων θαλάμων [Αναφ. 3] Σήμερα η μέθοδος των μολύβδινων θαλάμων (lead-chamber process) δεν χρησιμοποιείται πλέον, ωστόσο η μέθοδος παρουσιάζει μεγάλο ιστορικό ενδιαφέρον, αφού αποτελούσε ουσιαστικά τη μοναδική μέθοδο βιομηχανικής παραγωγής του θειικού οξέος κατά τον 19ο αιώνα έως και τα μέσα ίσως του 20ου. Με τη μέθοδο αυτή παρασκευάστηκαν εκατοντάδες εκατομμύρια τόνοι θειικού οξέος και επομένως η μέθοδος αυτή συνέβαλε στην ανάπτυξη της χημικής βιομηχανίας σε παγκόσμια κλίμακα. Η μέθοδος των μολύβδινων θαλάμων μπορεί να χαρακτηρισθεί ως μία από τις πρώτες χημικές βιομηχανικές διεργασίες συνεχούς παραγωγής, όπου γίνεται χρήση ενός ανακυκλούμενου χημικού αντιδραστηρίου (οξείδια αζώτου). Στο επόμενο σχήμα δείχνεται μια απλουστευμένη διάταξη μιας εγκατάστασης παραγωγής θειικού οξέος με τη μέθοδο αυτή.
Σχηματική παρουσίαση μιας τυπικής βιομηχανικής εγκατάστασης παραγωγής θειικού οξέος με τη μέθοδο των μολύβδινων θαλάμων Στη συνέχεια περιγράφονται οι κύριες μονάδες μιας τυπικής βιομηχανικής μονάδας παραγωγής θειικού οξέος με τη μέθοδο των μολύβδινων θαλάμων, όπως και οι πραγματοποιούμενες χημικές αντιδράσεις. Να σημειωθεί ότι στην πραγματικότητα είναι πολλές οι επιμέρους στοιχειώδεις χημικές αντιδράσεις και ισορροπίες που συνθέτουν τις παρακάτω αναγραφόμενες συνολικές αντιδράσεις. Η μέθοδος βασίζεται στο ότι η φορά πολλών από τις αναγραφόμενες αντιδράσεις εξαρτάται από τη θερμοκρασία και την περιεκτικότητα των διαλυμάτων σε H2SO4. (α) Κάμινος φρύξης. Στη μονάδα αυτή παράγεται το SO2 με καύση στοιχειακού θείου ή με φρύξη κοινών θειούχων ορυκτών όπως ο σιδηροπυρίτης (FeS2), χαλκοπυρίτης (CuFeS2) και ο σφαλερίτης (ZnS), που συνήθως εξορύσσονται επί τόπου ή σε κοντινές αποστάσεις. Τυπικές αντιδράσεις:
S +
O2
(β) Θάλαμος κατακράτησης σκόνης. Τα αέρια από την κάμινο φρύξης (τυπική σύνθεση: 7% SO2, 10% O2, 83% N2 κατ' όγκο) διέρχονται από τον θάλαμο αυτό για να απαλλαγούν από τη σκόνη και από εύκολα εξαχνούμενες ενώσεις, όπως είναι το As2O3.
(γ) Πύργος Glover. 'Εχει ύψος 7-10 m και διάμετρο 4-5 m. Αναφέρεται και ως "πύργος απονίτρωσης". Φέρει εσωτερική επένδυση από φύλλα μολύβδου και είναι γεμάτος με κομμάτια από οξύμαχο υλικό (π.χ. κεραμικό υλικό). Στον πυθμένα του πύργου εισέρχεται το θερμό αέριο μίγμα SO2-O2-N2, ενώ από την κορυφή του καταιονίζεται διάλυμα νιτροσυλοθειικού οξέος (ONOSO3H) σε θειικό οξύ 78% προερχόμενο από τον πύργο Gay-Lussac μαζί με διάλυμα θειικού οξέος 60-70% από τους μολύβδινους θαλάμους. Στον πύργο Glover επιτυγχάνονται: (1) η ψύξη του εισερχόμενου μίγματος αερίων στους 50-80ºC, (2) η σύνθεση σημαντικής ποσότητας H2SO4 και (3) η ανάκτηση των οξειδίων του αζώτου με την υδρόλυση του νιτροσυλοθειικού οξέος λόγω της αραίωσης που επιφέρει η προσθήκη του σχετικά αραιότερου θειικού οξέος που προέρχεται από τους θαλάμους και της σχετικά μεγάλης θερμοκρασίας:
2
ONOSO3H + H2O
2 ONOSO3H +
SO2 + 2 H2O
Στον πύργο Glover παράγεται θειικό οξύ 78% (γνωστό ως "οξύ Glover") μέρος του οποίου διαβιβάζεται προς τον πύργο Gay-Lussac, ενώ τα αέρια (SO2, NO και υδρατμοί εισέρχονται στον πρώτο μολύβδινο θάλαμο). (δ) Μολύβδινοι θάλαμοι. 2 ή 3 (μέχρι και 12 σε κάποιες βιομηχανικές ομάδες) θάλαμοι κενοί με εσωτερική επένδυση από φύλλα μολύβδου. Ο όγκος τους εξαρτάται από την ανά 24ωρο εισαγόμενη ποσότητα SO2 (τυπικά: 0,5 κυβικά μέτρα ανά kg καιόμενου FeS2 το 24ωρο). Από την κορυφή τους ψεκάζεται νερό και αέρας υπό πίεση. Το NO οξειδώνεται από το ατμοσφαιρικό οξυγόνο προς NO2 το οποίο οξειδώνει το SO2 προς H2SO4, το παραγόμενο NO επανοξειδώνεται προς NO2 κ.ο.κ.:
Οι μεγάλες μολύβδινες επιφάνειες των εσωτερικών τοιχωμάτων των θαλάμων εξυπηρετούν στην απαγωγή των μεγάλων ποσών θερμότητας που εκλύεται κατά τις αντιδράσεις, οι οποίες ουσιαστικά πραγματοποιούνται πάνω στις επιφάνειες αυτές. Να σημειωθεί ότι η χωρητικότητα των θαλάμων αυτων σε ορισμένες μονάδες έφθανε τα 1600 κυβικά μέτρα. Τα λαμβανόμενα διαλύματα από τον πυθμένα κάθε θαλάμου αναμιγνύονται σε ελεγχόμενες αναλογίες και προκύπτει τελικά διάλυμα θειικού οξέος με περιεκτικότητα 60-70% (γνωστό ως "οξύ των θαλάμων" ή "οξύ λιπασμάτων"). Περίπου, το 1/10 της παραγόμενης ποσότητας εισάγεται στον πύργο Glover. (ε) Πύργος Gay-Lussac. Τα αέρια που εξέρχονται από τον τελευταίο μολύβδινο θάλαμο (Ν2, Ο2, ΝΟ και ΝΟ2) εισέρχονται στη βάση του πύργου (ανάλογης κατασκευής με εκείνη του πύργου Glover). Εκεί καταιονίζεται μέρος του σχετικά πυκνού διαλύματος H2SO4 που προέρχεται από τον πύργο Glover, η θερμοκρασία στον πύργο είναι σχετικά χαμηλή και ευνοείται έτσι ο σχηματισμός νιτροσυλοθειικού οξέος (αντιστροφή της φοράς της αντίδρασης που συμβαίνει στο πύργο Glover):
2H2SO4 + NO2
+ NO
'Ετσι προκύπτει διάλυμα (περίπου 2%) νιτροσυλοθειικού οξέος σε πυκνό θειικό οξύ, το οποίο διαβιβάζεται στον πύργο Glover και έτσι ανακτώνται και ανακυκλώνονται τα οξείδια του αζώτου. Θεωρητικά, με δεδομένη ποσότητα οξειδίων του αζώτου μπορούν να συντεθούν άπειρες ποσότητες θειικού οξέος. Ωστόσο, μικρό ποσοστό των οξειδίων ανάγεται προς Ν2Ο και Ν2, οπότε σε τακτά χρονικά διαστήματα εισάγονται μικρές ποσότητες οξειδίων αζώτου (από διάσπαση ΗΝΟ3, νίτρου ή από καταλυτική οξείδωση αμμωνίας) σε αναπλήρωση αυτών των απωλειών. Τα διαλύματα θειικού οξέος (78% από τον πύργο Glover ή 60-70% από τους μολύβδινους θαλάμους χρησιμοποιούνται ως έχουν σε βιομηχανικές εφαρμογές (π.χ. παρασκευή λιπασμάτων) ή συμπυκνούνται προς τη συνήθη εμπορική μορφή θειικού οξέος 97-98%. |
Μέθοδος επαφής [Αναφ. 4]. Η μέθοδος επαφής (contact process) προτάθηκε αρχικά γύρω στο 1830 στην Αγγλία, από τον παραγωγό όξους Peregrine Phillips για τον οποίο ελάχιστα πράγματα είναι γνωστά. Το πλεονέκτημα της μεθόδου επαφής είναι η απλότητά της, το χαμηλό κόστος και κυρίως η δυνατότητά της να παράσχει απευθείας πυκνό θειικό οξύ και oleum.
 Ο Phillips
κατοχύρωσε τη μέθοδό του με δίπλωμα ευρεσιτεχνίας, αλλά ποτέ
δεν είχε κάποιο οικονομικό όφελος από την ανακάλυψή του. Τότε δεν υπήρχε μεγάλη ανάγκη για
πυκνό θειικό οξύ και oleum και οι μικρές ποσότητες που περιπτωσιακά χρειάζονταν,
καλύπτονταν από το οξύ που παρασκευαζόταν με τη μέθοδο Nordhausen. Μεγάλη
ζήτηση για oleum
άρχισε να εμφανίζεται μόνο προς τα τέλη του 19ου αιώνα. 'Ηταν πλέον
απαραίτητο σε μεγάλες ποσότητες για τη βιομηχανία συνθετικών οργανικών
χρωμάτων. Τότε μόνο στράφηκε το ενδιαφέρον των χημικών στη σχεδόν
ξεχασμένη μέθοδο επαφής, η οποία έμελλε σταδιακά να αντικαταστήσει
ολοκληρωτικά τη μέθοδο των μολύβδινων θαλάμων.
Ο Phillips
κατοχύρωσε τη μέθοδό του με δίπλωμα ευρεσιτεχνίας, αλλά ποτέ
δεν είχε κάποιο οικονομικό όφελος από την ανακάλυψή του. Τότε δεν υπήρχε μεγάλη ανάγκη για
πυκνό θειικό οξύ και oleum και οι μικρές ποσότητες που περιπτωσιακά χρειάζονταν,
καλύπτονταν από το οξύ που παρασκευαζόταν με τη μέθοδο Nordhausen. Μεγάλη
ζήτηση για oleum
άρχισε να εμφανίζεται μόνο προς τα τέλη του 19ου αιώνα. 'Ηταν πλέον
απαραίτητο σε μεγάλες ποσότητες για τη βιομηχανία συνθετικών οργανικών
χρωμάτων. Τότε μόνο στράφηκε το ενδιαφέρον των χημικών στη σχεδόν
ξεχασμένη μέθοδο επαφής, η οποία έμελλε σταδιακά να αντικαταστήσει
ολοκληρωτικά τη μέθοδο των μολύβδινων θαλάμων.
Η μέθοδος επαφής βασίζεται στην οξείδωση του
αέριου SO2
προς
SO3.
Η οξείδωση αυτή προϋποθέτει τελείως ξηρό και καθαρό SO2,
την παρουσία καταλύτη και υψηλή θερμοκρασία
(400-450ºC). Η αντίδραση οξείδωσης του
SO2
από το Ο2
είναι ισχυρώς εξώθερμη (ΔΗº
= -98 J/mol) και αντιστρεπτή. Με βάση τη
στοιχειομετρία της αντίδρασης και σύμφωνα με την
αρχή του Le Chatelier, η αντίδραση προς την
επιθυμητή φορά (2SO2
+ O2
![]() 2SO3)
ευνοείται με αύξηση της πίεσης και βέβαια με την περίσσεια οξυγόνου.
Ωστόσο, η αύξηση της θερμοκρασίας
ενώ αυξάνει την ταχύτητα της αντίδρασης, δεν ευνοεί την επιθυμητή θέση
ισορροπίας, γεγονός που επιβάλλει τη συνεχή απομάκρυνση του προϊόντος από τον κύκλο της
αντίδρασης.
2SO3)
ευνοείται με αύξηση της πίεσης και βέβαια με την περίσσεια οξυγόνου.
Ωστόσο, η αύξηση της θερμοκρασίας
ενώ αυξάνει την ταχύτητα της αντίδρασης, δεν ευνοεί την επιθυμητή θέση
ισορροπίας, γεγονός που επιβάλλει τη συνεχή απομάκρυνση του προϊόντος από τον κύκλο της
αντίδρασης.
Ως καταλύτης αρχικά χρησιμοποιήθηκε λευκόχρυσος σε λεπτό διαμερισμό (ως "λευκοχρυσούχος αμίαντος") και η αντίδραση πραγματοποιούταν σε υψηλές θερμοκρασίες (πυρακτωμένος λευκόχρυσος). Οι αντιδράσεις μπορούν να παρασταθούν από το ακόλουθο απλό σχήμα:
![]()
|
Τυπική μορφή καταλύτη V2O5 για τη μέθοδο επαφής [πηγή]. |
Το παραγόμενο κατά την καταλυόμενη αντίδραση SO3 στον πύργο απορρόφησης υπόκειται σε καταιονισμό με πυκνό θειικό οξύ (98% κ.β.), στο οποίο διαλύεται ήπια σχηματίζοντας πυροθειικό οξύ (H2S2O7). Στη συνέχεια, με ελεγχόμενο τρόπο και υπό ψύξη, το πυροθειικό οξύ προστίθεται σε υπολογισμένη ποσότητα ύδατος παρέχοντας διάλυμα θειικού οξέος με την επιθυμητή συγκέντρωση (συνήθως 96-98% κ.β.).
Πρέπει να σημειωθεί ότι η απευθείας διάλυση του SO3 στο νερό δεν είναι εύκολη, επειδή πρόκειται για μια ισχυρώς εξώθερμη αντίδραση, η οποία οδηγεί στον σχηματισμό αερολύματος SO3 ("ομίχλη SO3", SO3 mist), το οποίο είναι οξειδωτικό, ισχυρώς διαβρωτικό και πολύ δύσκολο να συμπυκνωθεί σε υγρό.
Μια δραστική βελτίωση της μεθόδου επαφής ήταν η αντικατάσταση του ακριβού λευκόχρυσου, που ήταν και ιδιαίτερα ευαίσθητος σε ίχνη πτητικών ακαθαρσιών στο SO2 (κυρίως αρσενικού), με το φθηνότερο και εξίσου αποτελεσματικό πεντοξείδιο του βαναδίου (γνωστό και ως "βαναδία", V2O5), το οποίο προτάθηκε το 1899 από τον R. Meyers. Οι σύγχρονες μορφές καταλύτη αποτελούνται από πορώδη πυριτία (π.χ. γη διατόμων), η επιφάνεια της οποίας έχει καλυφθεί από τήγμα πυροθειικών αλάτων βαναδίου και αλκαλιμετάλλων (K, Na, Cs). Ο καταλυτικός κύκλος του βαναδίου, του οποίου η οξειδωτική κατάσταση εναλλάσσεται μεταξύ των +4 και +5, μπορεί να περιγραφεί απλά από τον ακόλουθο κύκλο αντιδράσεων:
![]()
Σήμερα, ουσιαστικά στο σύνολό του, το θειικό οξύ παράγεται πλέον με τη μέθοδο επαφής. Το απαιτούμενο SO2 προέρχεται (περίπου κατά τα 2/3) από την καύση θείου και H2S που διατίθενται σε μεγάλες ποσότητες και μικρό κόστος, από τα διυλιστήρια πετρελαίου (από τις διαδικασίες αποθείωσης). Το υπόλοιπο SO2 προέρχεται από τη φρύξη θειούχων ορυκτών. Oι μονάδες παραγωγής θειικού οξέος περιλαμβάνονται στα συγκροτήματα διυλιστηρίων πετρελαίου και σε μεταλλευτικές βιομηχανίες, συμβάλλοντας σε κάποιο βαθμό στη μείωση της ρύπανσης της ατμόσφαιρας από εκπομπές SO2.
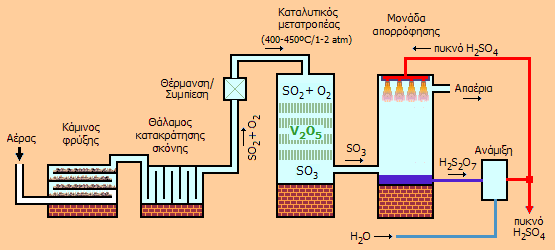 |
 |
|
Αριστερά: Σχηματική παρουσίαση μονάδας παραγωγής θειικού οξέος με τη μέθοδο επαφής. Απαιτείται σχολαστικός καθαρισμός και ξήρανση του SO2 πριν από την εισαγωγή του στον καταλυτικό μετατροπέα (στους 400-450ºC και πίεση 1-2 atm) για να αποφευχθεί η πρόωρη αχρήστευση του καταλύτη. Δεξιά: Σύγχρονη βιομηχανική μονάδα παραγωγής θειικού οξέος (4.100 τόνοι/ημέρα) από θείο με τη μέθοδο επαφής (PCS Phosphate Company Inc., Aurora, Βόρεια Καρολίνα, ΗΠΑ). Ο πύργος του καταλυτικού μετατροπέα έχει διάμετρο 16,5 μέτρα. Στους πύργους απορρόφησης γίνεται ο καταιονισμός του αερίου SO3 με πυκνό θειικό οξύ [πηγή]. |
|
|
Το τριοξείδιο του θείου: Μια πολύμορφη χημική ένωση [Αναφ. 5]
Η μέθοδος επαφής, ουσιαστικά είναι μέθοδος παρασκευής τριοξειδίου του θείου (SO3), που αποτελεί τον ανυδρίτη του θειικού οξέος. Είναι εξαιρετικά απίθανο να χρειαστεί κανείς να χρησιμοποιήσει στο εργαστήριο καθαρό SO3. Ωστόσο, SO3 σε μικρές ποσότητες μπορεί να παρασκευασθεί με σχετική ευκολία -αλλά και με πολύ μεγάλη προσοχή- με θερμική διάσπαση/απόσταξη του πυκνού θειικού οξέος, συνήθως παρουσία μικρής ποσότητας KMnO4 για να οξειδωθούν μικροπoσότητες SO2. Η απόσταξη απαιτεί υψηλές θερμοκρασίες (340ºC) και πρέπει να πραγματοποιείται με πλήρως υάλινη αποστακτική συσκευή και φυσικά στον απαγωγό. Καταλληλότερη συσκευή είναι ο παραδοσιακός άμβυκας, σκεύος το οποίο σπάνια πλέον βρίσκει κανείς σε χημικό εργαστήριο. Το οξύ διασπάται, εκλύοντας άφθονους λευκούς ατμούς από SO3, ποσότητες των οποίων μπορούν να συλλεγούν, υπό τη μορφή ινών σε ψυχόμενο υάλινο αποδέκτη. Τριοξείδιο του θείου μπορεί να ληφθεί και με θερμική διάσπαση του NaHSO4:
NaHSO4
Το SO3 απαντάται σε διάφορες αλλοτροπικές μορφές, πολυμερικού χαρακτήρα, που εύκολα η μία μετατρέπεται στην άλλη. Ως μονομερές το SO3 υφίσταται μόνο σε αέρια φάση. Το μόριο του SO3 είναι τριγωνικό επίπεδο με γωνίες Ο-S-O 120º και επομένως μηδενικής διπολικής ροπής. Αρχίζει να διασπάται προς SO2 και Ο2 στους 430ºC, ενώ στους 1000ºC η διάσπαση αυτή είναι πλήρης. Οι τρεις δεσμοί είναι ισοδύναμοι και αυτό μπορεί να παρασταθεί με τη μεσομέρεια:
Το γ-SO3 βρίσκεται σε ισορροπία με το αέριο SO3 και παρουσιάζει σχετικά μεγάλη τάση ατμών στις συνήθεις θερμοκρασίες. Αυτό σημαίνει ότι στις φιάλες του αναπτύσσεται μεγάλη πίεση και απαιτείται προσοχή κατά το άνοιγμά τους (χειρισμός πάντοτε στον απαγωγό και με γάντια καουτσούκ). Επειδή έχει μια τάση πολυμερισμού παρουσία ιχνών υγρασίας προς τις άλλες στερεές αλλοτροπικές μορφές, στο αντιδραστήριο προστίθεται μικρή ποσότητα αναστολέα πολυμερισμού σε αναλογίες 0,03-1,5% (βορικό οξύ ή άλλες ενώσεις βορίου, πυριτία, σιλοξάνια κ.α.).
'Ιχνη υγρασίας προκαλούν πολυμερισμό του γ-SO3 προς το γραμμικό πολυμερές β-SO3 του τύπου [-S(=O)2-O-]x, σ.τ. = 32,5ºC, το οποίο στην πραγματικότητα είναι μίγμα πολυθειικών οξέων στερεάς βελονοειδούς μορφής, του τύπου ΗΟ(SO2O)xOH (με τιμή x της τάξης των 100 χιλιάδων). Κατά την απόσταξη του πυκνού θειικού οξέος και ψύξη των εκλυόμενων ατμών SO3 σε θερμοκρασίες μεγαλύτερες από τους 27ºC λαμβάνονται βελονοειδείς κρύσταλλοι α-SO3 με σ.τ. 62,3ºC. Πρόκειται για γραμμικό πολυμερές ανάλογο του β-SO3, αλλά με κάποιο βαθμό σταυροδεσμών (cross links) και τερματικές ομάδες πάλι -ΟΗ. Το α-SO3 αποτελεί τη σταθερότερη μορφή του SO3 στην οποία μεταπίπτουν το β- και το γ-SO3 κατά την παραμονή. Θέρμανση του α-SO3 στην περιοχή του σημείου τήξεώς του έχει ως αποτέλεσμα τη μετατροπή του σε γ-SO3 το οποίο θα βράσει ακαριαία (σ.ζ. = 44,6ºC). Αν η θέρμανση πραγματοποιηθεί σε κλειστή φιάλη θα ακολουθήσει έκρηξη ως αποτέλεσμα αυτής της μετατροπής. Οι βελονοειδείς κρύσταλλοι α- ή β-SO3 μπορούν να παρατηρηθούν μόνο σε σφραγισμένους υάλινους περιέκτες (π.χ. αμπούλες), αφού μόλις εκτεθούν στην ατμόσφαιρα απορροφούν ταχύτατα υγρασία και καταρρέουν σχηματίζοντας υγρό θειικό οξύ.
Κύρια χημική ιδιότητα του SO3 είναι η μεγάλη αφυδατική του ισχύς (χαρακτηρίζεται ως "επιθετικά" υγροσκοπικό αντιδραστήριο). Αντιδρά σχεδόν εκρηκτικά με το ύδωρ παρέχοντας θειικό οξύ με έκλυση μεγάλων ποσών θερμότητας (ΔΗº = -130 kJ/mol). Χαρακτηριστικά, αν έρθει σε επαφή SO3 με ξύλο, χαρτί ή βαμβάκι, όπως και άλλα ανάλογα οργανικά υλικά τα απανθρακώνει (αποσπώντας μόρια ύδατος), η δε εκλυόμενη θερμότητα μπορεί να προκαλέσει ακόμη και ανάφλεξή τους. Γενικά, ο χειρισμός του SO3 σε οποιαδήποτε μορφή, αλλά και του oleum (διάλυμα SO3 σε H2SO4), απαιτεί ΙΔΙΑΙΤΕΡΕΣ ΠΡΟΦΥΛΑΞΕΙΣ και σε καμιά περίπτωση δεν πρέπει οι αυτές ουσίες να έρθουν σε επαφή με γυμνό δέρμα. Ατμοί SO3 στα μάτια μπορούν να προκαλέσουν άμεση τύφλωση. Το SO3 ως οξύ κατά Lewis. Το SO3 είναι πανίσχυρο οξύ κατά Lewis και αντιδρά με βάσεις κατά Lewis παρέχοντας τα αντίστοιχα άλατα. Η αντίδραση εφυδάτωσής του μπορεί να θεωρηθεί ως αντίδραση της βάσης Η2Ο με το οξύ SO3:
Η2Ο:
+ SO3
Ομοίως, η αντίδραση του SO3 με H2SO4 μπορεί να θεωρηθεί ως αντίδραση της βάσης(!) H2SO4 με το οξύ SO3:
(HO)2S(O)O:
+ SO3
Η διαφορά μεταξύ των δύο παραπάνω αντιδράσεων είναι ότι η πρώτη είναι βίαιη, ενώ η δεύτερη είναι ήπια για τον λόγο αυτό είναι εκείνη που χρησιμοποιείται στη βιομηχανική παρασκευή θειικού οξέος με τη μέθοδο επαφής για τη δέσμευση του παραγόμενου SO3.
Το κατά
Lewis άλας
που σχηματίζει το SO3
με πυριδίνη
(C5H5N:
+
SO3
Oleum. Σε μεγάλες ποσότητες το SO3 διακινείται μόνο ως διάλυμα (20-65% κ.β.) σε H2SO4 (μίγμα H2SO4 - H2S2O7), το οποίο είναι γνωστό ως oleum ή ατμίζον θειικό οξύ (fuming sulfuric acid).
Το oleum είναι διάλυμα διαφόρων συγκεντρώσεων SO3 σε H2SO4. Προφανώς στο διάλυμα αυτό δεν υπάρχει το παραμικρό ίχνος ύδατος αφού θα δεσμευόταν ακαριαία από το SO3. Τα διάφορα oleum περιγράφονται συνήθως από την επί τοις εκατό κ.β. περιεκτικότητά τους σε SO3 (% SO3). Οι συνηθέστεροι εμπορικοί τύποι oleum περιέχουν 20%, 40% και 65% SO3. Ως ισομοριακό μίγμα H2SO4 και SO3 (δηλ. oleum με 81,6% SO3) μπορεί να θεωρηθεί το διθειικό οξύ (γνωστότερο ως πυροθειικό οξύ) Η2S2O7, το οποίο είναι στερεό σε συνήθεις θερμοκρασίες (σ.τ. 36ºC) και ως εκ τούτου δεν αποτελεί προτιμούμενη μορφή διακίνησης του θειικού οξέος. Είναι προφανές ότι ένα μίγμα a mol Η2SO4 και b mol SO3 μπορεί να περιγραφεί: (α) αν a=b, ως H2S2O7, (β) αν a>b, ως μίγμα (a-b) mol H2SO4 και b mol H2S2O7, (γ) αν a<b, ως μίγμα a mol H2S2O7 και (b-a) mol SO3. Το θειικό οξύ σε μεγάλες ποσότητες είναι οικονομικότερο να διακινείται ως oleum, αφού η μορφή αυτή μπορεί να θεωρηθεί ως ένα είδος "συμπυκνωμένου" θειικού οξέος. Για τον σκοπό αυτό χρησιμοποιούνται βαγόνια με ειδικά κατασκευασμένες χαλύβδινες δεξαμενές που δεν προσβάλλονται από αυτό. Επειδή ορισμένα oleum έχουν σχετικά υψηλό σ.τ. (π.χ. το 30% oleum, έχει σ.τ. 19ºC), αλλά και για τη μείωση του ιξώδους του φορτίου, συχνά τα βαγόνια αυτά κατά τη φόρτωση-εκφόρτωση θερμαίνονται εξωτερικά με υπέρθερμο ατμό. Χαρακτηριστικοί είναι οι πνιγηροί λευκοί ατμοί που εκλύονται από ανοικτές φιάλες του αντιδραστηρίου, που οφείλονται στα μικροσταγονίδια Η2SO4 που σχηματίζονται με απoρρόφηση υγρασίας της ατμόσφαιρας από τους ατμούς του SO3. Τα διάφορα oleum χρησιμοποιούνται στη βιομηχανία οργανικών χρωμάτων και απορρυπαντικών, ως πανίσχυρα μέσα σουλφούρωσης οργανικών ενώσεων. Χρησιμοποιούνται ευρύτατα επίσης στη βιομηχανία εκρηκτικών υλών. Σε αντίθεση με το θειικό οξύ 95-98% και τα αραιότερα διαλύματά του τα οποία μπορεί κανείς να βρει εύκολα στο εμπόριο (π.χ. για υγρά μπαταρίας), για την αγορά διάφορων τύπων oleum κατά κανόνα απαιτείται κάποιο είδος άδειας ή δήλωσης χρήσης.
|
||||||||||||
|
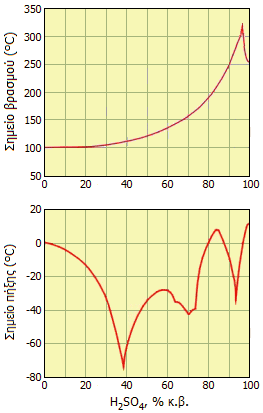
Σημεία βρασμού και πήξης διαλυμάτων Η2SO4 ως συνάρτηση της περιεκτικότητάς τους [πηγή]. |
Χημικές ιδιότητες θειικού οξέος [Αναφ. 6]
Γενικές ιδιότητες. Το θειικό οξύ καθαρό ή σε αραιά ή πυκνά υδατικά διαλύματα ή όταν περιέχει επιπλέον ποσότητες SO3 (oleum, πυροθειικό οξύ), είναι απεριορίστως σταθερό σε συνήθεις θερμοκρασίες και όταν φυλάσσεται σε υάλινα δοχεία. Ανάλογα με την περιεκτικότητα των υδατικών διαλυμάτων του και τη θερμοκρασία, μπορεί να δράσει ως ισχυρό οξύ, ως οξειδωτικό και ως αφυδατικό μέσο ή ως μέσο που συνδυάζει με οποιοδήποτε τρόπο τις ιδιότητες αυτές.
Το καθαρό (100%) θειικό οξύ όταν θερμανθεί διασπάται χάνοντας SO3 μέχρις ότου σχηματιστεί το αζεοτροπικό του μίγμα (98,5% κ.β.) το οποίο ζέει στους 337οC. Αντίστοιχα, κατά τον βρασμό υδατικών διαλυμάτων H2SO4 χάνεται ύδωρ μέχρις ότου το διάλυμα αποκτήσει τη σύνθεση του αζεοτροπικού μίγματος, ενώ το σημείο βρασμού του συνεχώς αυξάνεται καθώς αυτό συμπυκνώνεται (βλ. διάγραμμα).
|
Κατά τον βρασμό υδατικών διαλυμάτων θειικού οξέος αρχικά εξατμίζεται το νερό. Μετά την εξάτμιση της μεγαλύτερης ποσότητας ύδατος, αρχίζει η εμφάνιση των λευκών ατμών ("ομίχλη SO3") μέχρις ότου το διάλυμα αποκτήσει τη σύνθεση του αζεοτροπικού μίγματος [πηγή]. |
Η απομάκρυνση του ύδατος με βρασμό από υδατικά διαλύματα H2SO4 καθίσταται συνεχώς και δυσκολότερη καθώς αυτά συμπυκνώνονται, λόγω της μεγάλης συγγένειας του θειικού οξέος με το ύδωρ και απαιτούνται συνεχώς μεγαλύτερα ποσά θερμότητας. Τη θερμότητα αυτή το πυκνό θειικό οξύ την αποδίδει κατά την αραίωσή του με ύδωρ.
Πιθανολογείται η ύπαρξη εννέα υδριτών του θειικού οξέος, από τους οποίους έχουν επιβεβαιωθεί οι ακόλουθοι: H2SO4·4H2O (57,6% H2SO4), H2SO4·6,5H2O (45,6% H2SO4) και H2SO4·8H2O (40,5% H2SO4). Η ύπαρξη πολλών υδριτών του θειικού οξέος καταφαίνεται από την αρκετά σύνθετη εξάρτηση του σημείου πήξης των διαλυμάτων του από την περιεκτικότητά τους σε θειικό οξύ (βλ. διάγραμμα).
Το καθαρό θειικό οξύ έχει μεγάλη πολικότητα παρουσιάζοντας διηλεκτρική σταθερά 100 (έναντι 80 του ύδατος). Σε αντίθεση με τα υδατικά διαλύματα του, το καθαρό οξύ είναι ένας μέτριος ηλεκτρολύτης, αφού υπόκειται σε αυτοπρωτόλυση σύμφωνα με την ισορροπία:
H2SO4
![]() H3SO4+ + HSO4-
K = 2,7
x
10-4 (25°C)
H3SO4+ + HSO4-
K = 2,7
x
10-4 (25°C)
Σε σχέση με την αυτοπρωτόλυση του ύδατος (2Η2Ο
![]() Η3Ο+
+ ΟΗ-, Κw
= 10-14), η αυτοδιάσταση του H2SO4
είναι μεγαλύτερη κατά 10 περίπου τάξεις μεγέθους.
Η3Ο+
+ ΟΗ-, Κw
= 10-14), η αυτοδιάσταση του H2SO4
είναι μεγαλύτερη κατά 10 περίπου τάξεις μεγέθους.
Το θειικό οξύ ως ισχυρό οξύ. Το θειικό οξύ είναι ένα από τα συνηθέστερα οξέα που χρησιμοποιούνται στο εργαστήριο. Σε υδατικά διαλύματα, το θειικό οξύ δρα ως ένα ισχυρό διβασικό οξύ το οποίο διίσταται σε δύο στάδια (πλήρως κατά το πρώτο, μερικώς κατά το δεύτερο).
H2SO4 + H2O
![]() H3O+ + HSO4- (K1
= 2,4 x 106)
HSO4- + H2O
H3O+ + HSO4- (K1
= 2,4 x 106)
HSO4- + H2O
![]() H3O+ + SO42- (K2
= 0,01)
H3O+ + SO42- (K2
= 0,01)
'Ετσι, το σχετικώς αραιό (ενδεικτικά: 5-20% κ.β.) και ψυχρό θειικό οξύ παρέχει το σύνολο των τυπικών αντιδράσεων που παρέχουν τα ισχυρά οξέα: Αντιδρά με ισχυρές και ασθενείς βάσεις, με άλατα ασθενών οξέων, με μέταλλα ηλεκτροθετικότερα από το Η2, παρέχοντας τα αντίστοιχα θειικά άλατα, π.χ.
2KOH + H2SO4
![]() K2SO4 + 2H2O
2ΝΗ3 + Η2SO4
K2SO4 + 2H2O
2ΝΗ3 + Η2SO4
![]() (ΝΗ4)2SO4
(ΝΗ4)2SO4
Na2CO3 + H2SO4
![]() Na2SO4
+ H2O + CO2
Fe + H2SO4
Na2SO4
+ H2O + CO2
Fe + H2SO4
![]() FeSO4 + H2
FeSO4 + H2
Το πυκνό θειικό οξύ θεωρείται ως το "πρωταρχικό οξύ", δεδομένου ότι από αυτό μπορούν να παραχθούν εύκολα τα άλλα οξέα. Λόγω του υψηλού σημείου ζέσεως μπορεί να αντιδράσει σε υψηλές θερμοκρασίες με άλατα περισσότερο πτητικών οξέων, τα οποία οξέα θα μπορούν να απομακρυνθούν ως αέρια ή με απόσταξη. Τυπικά παραδείγματα αποτελούν οι αντιδράσεις του με αλογονούχα και νιτρικά άλατα, που αποτελούν τρόπους παρασκευής πυκνού νιτρικού οξέος και αερίων υδραλογόνων ή διαλυμάτων τους (με εξαίρεση τα ιωδιούχα, λόγω οξείδωσής τους προς Ι2) , π.χ.
NaNO3 + H2SO4 ![]() NaHSO4
+ HNO3
CaF2 + H2SO4
NaHSO4
+ HNO3
CaF2 + H2SO4 ![]() CaSO4 + 2HF NaCl
+ H2SO4
CaSO4 + 2HF NaCl
+ H2SO4 ![]() NaHSO4
+ HCl
NaHSO4
+ HCl
Τα θειικά άλατα των μετάλλων είναι διαλυτά με εξαίρεση τα δυσδιάλυτα άλατα με βάριο (0,000285 g/100 mL, 30ºC) και μόλυβδο (0,0056 g/100 mL, 40ºC) και τα σχετικώς δυσδιάλυτα άλατα με ασβέστιο (0,30 g/100 mL, 20ºC) και στρόντιο (0,0114 g/100 mL, 32ºC) [διαλυτότητες από το "Langes's Handbook of Chemistry, 1967"].
Το θειικό οξύ ως οξειδωτικό μέσο. Το πυκνό θειικό οξύ κατά κανόνα δεν αντιδρά με μέταλλα (με εξαίρεση τα πολύ δραστικά: αλκάλια, Mg), συμπεριφερόμενο ως ασθενές οξύ. Τα μέταλλα "παθητικοποιούνται" ταχύτατα λόγω σχηματισμού ενός προστατευτικού στρώματος θειικού άλατος. Δοχεία και βυτία από ανοξείδωτο χάλυβα (με αυξημένη περιεκτικότητα σε Si) μπορούν να χρησιμοποιηθούν με ασφάλεια για την αποθήκευση και μεταφορά πυκνού θειικού οξέος. Ωστόσο, αν το πυκνό θειικό οξύ θερμανθεί δρα ως οξειδωτικό αναγόμενο κατά κανόνα προς SO2. 'Ετσι αντιδρά με μέταλλα ακόμη και ηλεκτροαρνητικότερα από το Η2, αλλά και με αμέταλλα, π.χ.
2Cu + 2H2SO4
![]() 2CuSO4 + SO2 + H2O C + 2H2SO4
2CuSO4 + SO2 + H2O C + 2H2SO4 ![]() CO2 + 2SO2 + 2Η2Ο 2P + 3H2SO4
CO2 + 2SO2 + 2Η2Ο 2P + 3H2SO4 ![]() 2H3PO3 + 3SO2 S + 2H2SO4
2H3PO3 + 3SO2 S + 2H2SO4 ![]() 3SO2 + 2H2O
3SO2 + 2H2O
Από τα λίγα μέταλλα που ανθίστανται στην οξειδωτική δύναμη του θειικού οξέος (πέραν των ευγενών μετάλλων) είναι ο μόλυβδος. Ανάλογα με τις συνθήκες (συγκέντρωση, θερμοκρασία και το αναγωγικό μέσον) η αναγωγή του Η2SO4 μπορεί να οδηγήσει σε ακόμη χαμηλότερες οξειδωτικές καταστάσεις του θείου, π.χ.
4Zn
+ 5H2SO4 ![]() 4ZnSO4
+ H2S
+ 4H2O
3Zn + 4H2SO4
4ZnSO4
+ H2S
+ 4H2O
3Zn + 4H2SO4 ![]() 3ZnSO4
+ S + 4H2O
3ZnSO4
+ S + 4H2O
|
Διάλυμα πιράνχα Μίγμα πυκνού θειικού οξέος (98%) - υπεροξειδίου του υδρογόνου (30%) 3:1 είναι γνωστό με το χαρακτηριστικό όνομα διάλυμα πιράνχα (Piranha solution). Το μίγμα αυτό δρα ως ισχυρότατο διαβρωτικό και οξειδωτικό και χρησιμοποιείται για την πλήρη απαλλαγή των υάλινων σκευών και από το τελευταίο ίχνος οργανικής ουσίας (π.χ. από λιπαρές ουσίες). Παρασκευάζεται με σταδιακή προσθήκη και υπό ψύξη του Η2Ο2 στο H2SO4 και ποτέ αντίστροφα και πρέπει να χρησιμοποιείται πάντοτε φρέσκο και σε σχετικά μικρές ποσότητες (λίγα mL).
H2SO4
+
H2O2 |
Το θειικό οξύ ως αφυδατικό μέσο. Η εντονότατη αφυδατική δράση του θειικού οξέος ίσως είναι περισσότερο χαρακτηριστική ιδιότητα του, η οποία καθιστά το πυκνό θειικό οξύ (τυπικά 96-98% κ.β.) ένα ιδιαίτερα επικίνδυνο αντιδραστήριο. 'Ετσι, το πυκνό θειικό οξύ χρησιμοποιείται συχνά για τη δέσμευση των υδρατμών από μίγματα αερίων ή από διάφορες ουσίες. Ακόμη, συχνά χρησιμοποιείται ως υγρό ξηραντικό μέσο σε ξηραντήρες στη θέση άλλων στερεών υγροσκοπικών ουσιών, όπως τα CaCl2, Mg(ClO4)2, P2O5 κ.α.
Ωστόσο, το κοινό πυκνό θειικό οξύ δεν περιορίζεται στην απόσπαση της υγρασίας, από τις διάφορες ουσίες ή του κρυσταλλικού ύδατος από ένυδρα άλατα, αλλά προκαλεί και χημική αφυδάτωση, δηλ. αποσπά "επιθετικά" από τις ουσίες υδρογόνο και οξυγόνο σε ατομική αναλογία ύδατος (2 προς 1).
Χαρακτηριστικότερο παράδειγμα ολοκληρωτικής καταστροφής της μοριακής δομής έχουμε στην περίπτωση της δράσης του θειικού οξέος πάνω στους υδατάνθρακες (απλούς ή και πολυσακχαρίτες), από τους οποίους αποσπά μόρια ύδατος αφήνοντας μόνο τον άνθρακα, π.χ.
![]()
Αξίζει να σημειωθεί ότι η αφυδατική δράση του θειικού οξέος δεν είναι ιδιότητα που αφορά μόνο το καθαρό οξύ ή τα πολύ πυκνά διαλύματά του. Χαρακτηριστικά αναφέρεται ότι και ένα διάλυμα θειικού οξέος 10% κ.β. (!) μπορεί να προκαλέσει απανθράκωση οργανικών υλικών (π.χ. χαρτιού), αν αφεθεί να δράσει πάνω τους για μεγάλο χρονικό διάστημα [πηγή].
 |
 |
 |
|
Επίδραση πυκνού θειικού οξέος σε διάφορα οργανικά υλικά: Αριστερά: Απανθράκωση καλαμοσάκχαρου (ζάχαρης). Το αρχικό σκούρο καφέ χρώμα γίνεται στη συνέχεια μαύρο καθώς το καλαμοσάκχαρο μετατρέπεται σε άνθρακα και συγχρόνως διογκώνεται λόγω του ατμού που σχηματίζεται κατά την εξώθερμη αντίδραση αφυδάτωσης [πηγή]. Κέντρο: Καταστροφή βαμβακερού υφάσματος [πηγή]. Δεξιά: Απανθράκωση πλαστικού σπόγγου (από αφρώδη πολυουρεθάνη) [πηγή]. |
||
Η αφυδατική δράση του πυκνού θειικού οξέος αξιοποιείται πλήρως στην οργανική σύνθεση. Τυπικά απλά και κλασσικά παραδείγματα αποτελούν η αφυδάτωση του μυρμηκικού και οξαλικού οξέος (εργαστηριακή μέθοδος παρασκευής μονοξειδίου του άνθρακα, βλ. Χημική ένωση του μήνα: "Μονοξείδιο του άνθρακα"), αλκοολών προς σχηματισμό ολεφινών και αιθέρων, π.χ.
![]()
ή πιο σύνθετων αντιδράσεων συμπύκνωσης όπως π.χ. η αντίδραση συμπύκνωσης της ακετόνης προς μεσιτυλένιο (1,3,5-τριμεθυλο-βενζόλιο) ή η σύνθεση DDT με συμπύκνωση χλωροβενζολίου με χλωράλη:
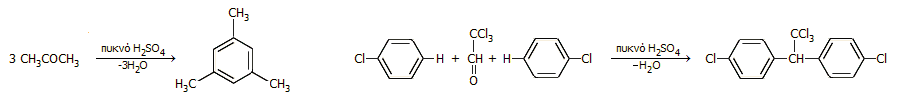
Η χαρακτηριστική αφυδατική δράση του πυκνού θειικού οξέος αξιοποιείται στο εργαστήριο για την παραγωγή αερίου HCl με απλή προσθήκη πυκνού H2SO4 σε πυκνό υδροχλωρικό οξύ (30-33%) ή την παρασκευή του ονομαζόμενου "ατμίζοντος" νιτρικού οξέος νιτρικού ΗΝΟ3 (>90%, σ.ζ. 120,5°C ) με απόσταξη μίγματος ίσων όγκων του αζεοτροπικού πυκνού διαλύματος HNO3 του εμπορίου (70% κ.β.) και πυκνού θειικού οξέος.
Στην οργανική σύνθεση οι αρωματικοί υδρογονάνθρακες μπορούν εύκολα υποστούν σουλφούρωση (εισαγωγή της σουλφονικής ομάδας -SO3H) ή νίτρωση (εισαγωγή της νιτροομάδας -NO2) με oleum ή πυκνό θειικό οξύ ή μπορούν να νιτρωθούν με απευθείας αντίδραση μίγματος πυκνού νιτρικού και πυκνού θειικού οξέος (γνωστό ως "οξύ νίτρωσης"), π.χ.
![]()
Αντιδράσεις σουλφούρωσης ήταν κυρίως εκείνες που κατέστησαν αναγκαία την παραγωγή μεγάλων ποσοτήτων πυκνού θειικού οξέος και oleum, κατά τα τέλη του 19ου αιώνα, που έδωσαν ώθηση στη μέθοδο επαφής. Με εισαγωγή της σουλφονικής ομάδας στον αρωματικό δακτύλιο συνθετικών χρωμάτων, καθίστανται αυτά υδατοδιαλυτά.
Επίσης, ενώ για την απλή νίτρωση του βενζολίου αρκεί η χρήση μίγματος νιτρικού και πυκνού θειικού οξέος, η εισαγωγή της πρώτης νιτροομάδας δυσχεραίνει την εισαγωγή και δεύτερης, η οποία απαιτεί τη χρήση oleum και όχι απλού πυκνού θειικού οξέος. 'Ετσι μια από τις βασικές χρήσεις του oleum είναι στην παραγωγή εκρηκτικών υλών.
 |
 |
 |
|
Φωτογραφίες ενδεικτικές των αποτελεσμάτων της όξινης βροχής στα δάση [πηγή], σε λίμνες [πηγή] και σε μνημεία. Χαρακτηριστική είναι η σχεδόν ολοκληρωτική καταστροφή που έχει υποστεί ένα άγαλμα από αμμόλιθο σε κάστρο της Βεστφαλίας, στη βιομηχανική περιοχή Ρουρ της Γερμανίας. Η πρώτη φωτογραφία πάρθηκε το 1908 και η δεύτερη το 1968 [πηγή]. |
||
Το θειικό οξύ στη φύση [Αναφ. 7]
Το θειικό οξύ δεν εμφανίζεται σε καθαρή μορφή στη φύση λόγω της μεγάλης του συγγένειας με το νερό και της ταχύτατης εξουδετέρωσής από διάφορα ορυκτά (π.χ. ασβεστολιθικά) με σχηματισμό θειικών αλάτων. Ιχνοποσότητες θειικού οξέος συναντώνται στην ατμόσφαιρα κάτω από ορισμένες συνθήκες και δεν αποτελεί κανονικό συστατικό της. Το θειικό οξύ προέρχεται από το SO2 που εκπέμπεται από διάφορες πηγές στην ατμόσφαιρα και είναι αποτέλεσμα ανθρώπινων δραστηριοτήτων (ανθρωπογενής προέλευση).
Εκτιμάται ότι σε ετήσια βάση εκπέμπονται στην ατμόσφαιρα (ως SO2) οι ακόλουθες ποσότητες θείου (σε εκατομμύρια τόνους): 70 από την καύση ορυκτών καυσίμων, 2,8 από δασικές πυρκαγιές και 7 έως 8 από τα ηφαίστεια. Μέρος του εκπεμπόμενου SO2 μέσω μηχανισμού ελεύθερων ριζών οξειδώνεται προς SO3 που τελικά παρέχει H2SO4:
SO2 + OH· ![]() HOSO2·
HOSO2· + O2
HOSO2·
HOSO2· + O2
![]() HO2· + SO3
SO3
(αέριο)
+ H2O (υγρό)
HO2· + SO3
SO3
(αέριο)
+ H2O (υγρό) ![]() H2SO4
(υδατ.
διάλυμα)
H2SO4
(υδατ.
διάλυμα)
|
|
|
| Αριστερά: Ο ποταμός Rio Tinto (Χρωματισμένος ποταμός) κοντά στην πόλη Nerva της Ισπανίας. Το pH του ποταμού είναι περίπου 2 και το χρώμα του οφείλεται σε προϊόντα υδρόλυσης του Fe(III) [πηγή]. Δεξιά: Οι αντιδράσεις οξείδωσης του σιδηροπυρίτη που δημιουργούν τα όξινα από θειικό οξύ στραγγίσματα, τα οποία τρο-φοδοτούν τον ποταμό. |
Η οξείδωση του SO2 προς SO3 πραγματοποιείται επίσης με το ατμοσφαιρικό όζον, αλλά και με το ίδιο το οξυγόνο με αντίδραση που καταλύεται από την παρουσία ιχνών σιδήρου και μαγγανίου στα σταγονίδια που συνθέτουν τα νέφη.
To παραγόμενο κατά το τρόπο αυτό θειικό οξύ αποτελεί το κύριο συστατικό της ονομαζόμενης "όξινης βροχής". Το δεύτερο συστατικό είναι το νιτρικό οξύ που προέρχεται από τις (κατά πολύ μικρότερες) εκπομπές οξειδίων αζώτου. Τα καταστρεπτικά αποτελέσματα της όξινης βροχής στα δάση και στις λίμνες, αλλά και στα μνημεία, οδήγησαν σε αυστηρές νομοθεσίες σταδιακού περιορισμού των εκπομπών οξειδίων του θείου και του αζώτου.
Θειικό οξύ παράγεται κατά φυσικό τρόπο κατά την οξείδωση από το ατμοσφαιρικό οξυγόνο θειούχων ορυκτών και κυρίως του άφθονου στη φύση σιδηροπυρίτη (FeS2) με μηχανισμό στον οποίο μετέχει ο ίδιος ο σίδηρος του ορυκτού. Τα στραγγίσματα που προκύπτουν από τη διαδικασία αυτή μπορεί να είναι ισχυρότατα όξινα από το H2SO4 που περιέχουν. Η συνολική αντίδραση αποδίδεται από την αντίδραση (1).
Ο παραγόμενος Fe(II) οξειδώνεται περαιτέρω από το οξυγόνο του αέρα (αντίδραση 2) και ο παραγόμενος Fe(III) (διαλυτός μόνο σε ισχυρά όξινα διαλύματα) υδρολυόμενος καθιζάνει ως ερυθρό υδροξείδιο ή ένυδρο οξείδιο (αντίδραση 3) χρωματίζοντας τα στραγγίσματα ερυθρά. Επιπλέον, βοηθά στη διάλυση πρόσθετων ποσοτήτων σιδηροπυρίτη (αντίδραση 4).
|
Desmarestia ligulata [πηγή]. |
Θειικό οξύ συνθέτουν ορισμένα φύκη και το συγκεντρώνουν στα κενοτόπιά τους (vacuoles) ως αμυντικό μέσο. Χαρακτηριστική περίπτωση είναι εκείνη του φύκους Desmarestia ligulata στο οποίο το pH του περιεχομένου των κενοτοπίων του κυμαίνεται από 0,8 έως 1,8. 'Οταν το φύκος υποβληθεί σε στρες (π.χ. με έκθεση στον αέρα) "εξαπολύει" το θειικό οξύ υποβιβάζοντας το pH του θαλάσσιου ύδατος στην περιοχή του (μέχρι και pH 1) και συγχρόνως αλλάζει χρώμα. Με το θειικό οξύ η Desmarestia αμύνεται κατά των αχινών, διαλύοντας τα "δόντια" τους, που αποτελούνται από ανθρακικό ασβέστιο.
Θειικό οξύ στο ηλιακό σύστημα. Θειικό οξύ έχει παρατηρηθεί φασματοσκοπικά στην ανώτερη ατμόσφαιρα της Αφροδίτης. Η ύπαρξη του στην ατμόσφαιρα είναι αποτέλεσμα αντιδράσεων με την επίδραση της ακτινοβολίας του Ήλιου στα αέρια (κυρίως) CO2 και SO2 (που βρίσκονται σε ίχνη) και τους ατμούς ύδατος. Τα φωτόνια της υπεριώδους περιοχής της ηλιακής ακτινοβολίας σε μήκη κύματος κάτω των 169 nm και επιτυγχάνουν τη φωτοδιάσπαση του CO2 προς CO και ατομικό οξυγόνο. Το τελευταίο είναι εξαιρετικά δραστικό και οξειδώνει το SO2 προς SO3, το οποίο με τους ατμούς ύδατος σχηματίζει σταγονίδια H2SO4:
CO2
+ hν (λ<169 nm) ![]() CO + [O]
SO2
+ [O]
CO + [O]
SO2
+ [O] ![]() SO3
SO3
+ H2O
SO3
SO3
+ H2O ![]() H2SO4
H2SO4
Πάντως, σε σχέση με το CO2, το κύριο συστατικό της ατμόσφαιρας της Αφροδίτης, οι ποσότητες H2SO4 μπορούν να θεωρηθούν ως ίχνη.
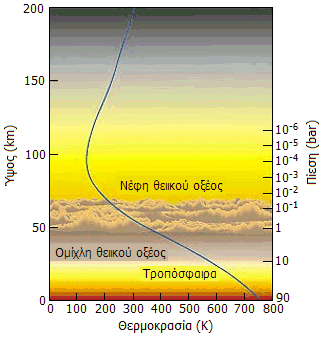
Τα σύννεφα θειικού οξέος στα ανώτερα στρώματα της ατμόσφαιρας (45-70 km), όπου επικρατούν χαμηλότερες θερμοκρασίες, θολώνουν την ατμόσφαιρα του πλανήτη όταν παρατηρείται από την Γη. Βροχή θειικού οξέος πάντως δεν υπάρχει στην Αφροδίτη, όπως συχνά λανθασμένα αναφέρεται. Μόλις τα σταγονίδια φθάσουν γύρω στα 25 km, η πολύ μεγαλύτερη θερμοκρασία τα επανεξατμίζει και τα επαναφέρει στα ανώτερα στρώματα. Στα χαμηλά στρώματα επικρατεί το CO2 σε μεγάλη πυκνότητα και πίεση, συνθήκες που το φέρουν σε κατάσταση υπερκρίσιμου ρευστού (βλ. Χημική ένωση του μήνα: "Διοξείδιο του άνθρακα").
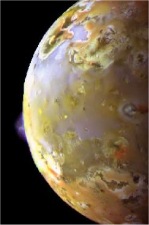
Θειικό οξύ έχει βρεθεί και αλλού στο ηλιακό σύστημα. Το 1996, φασματοσκοπικές παρατηρήσεις από το διαστημόπλοιο Galileo υποδεικνύουν την παρουσία παγωμένων υδριτών θειικού οξέος σε μεγάλες περιοχές της επιφάνειας της Ευρώπης δορυφόρου του πλανήτη Δία, δεύτερου σε απόσταση από τον πλανήτη μετά τον δορυφόρο Ιώ [Σημείωση: Ο Δίας διαθέτει τέσσερις μεγάλους δορυφόρους, τους ονομαζόμενους "Γαλιλαιικούς" και πολλούς μικρότερους. Οι δορυφόροι αυτοί κατά σειρά απόστασης από τον πλανήτη είναι οι: Ιώ, Ευρώπη, Γανυμήδης και Καλλιστώ]. Επειδή αυξημένες ποσότητες θείου βρίσκονται στην πλευρά του δορυφόρου που είναι στραμμένη προς τον δορυφόρο Ιώ, εικάζεται ότι προέρχεται από τις συχνές ηφαιστειακές εκρήξεις κατά τις οποίες εκτοξεύονται τεράστιες ποσότητες ιοντισμένου θείου από την Ιώ προς το διάστημα. Πάντως, έχουν εκφρασθεί αμφιβολίες ως προς την ερμηνεία των φασματοσκοπικών παρατηρήσεων.
|
|
|
|
|
|
Από αριστερά προς τα δεξιά: (1) Υψομετρική εξάρτηση θερμοκρασίας και πίεσης στην Αφροδίτη [πηγή] (2) Ο πλανήτης Αφροδίτη όπου τα νέφη θειικού οξέος αυξάνουν τη λευκαύγεια (albedo) του πλανήτη και συνεισφέρουν στη λαμπρότητα του πλανήτη [πηγή]. (3): Ο δορυφόρος του Δία Ευρώπη, όπως φαίνεται με φωτογράφιση ευαίσθητη στο εγγύς υπερύθρο (NIR) (ψευδής χρωματισμός). Στο επάνω αριστερά τμήμα φαίνονται οι πλουσιότερες περιοχές σε θειικό οξύ [πηγή]. (4): Τμήμα της επιφάνειας της Ιούς, όπου διακρίνεται ηφαιστειακή έκρηξη που συνοδεύεται με εκπομπή ιόντων θείου [πηγή]. |
|||
Μια ρηξικέλευθη και τολμηρή πρόταση για την καταπολέμηση της υπερθέρμανσης της ατμόσφαιρας [Αναφ. 8]. Τα νέφη θειικού οξέος αυξάνουν κατά πολύ τη λευκαύγεια (albedo), δηλαδή την ανακλαστικότητα, της Αφροδίτης. Περίπου το 90% της προσπίπτουσας ηλιακής ακτινοβολίας ανακλάται. Η λευκαύγεια αυτή οφείλεται στο νέφος σταγονιδίων H2SO4 και αυτό έδωσε την ιδέα για μια ιδιαίτερα "τολμηρή" πρόταση για την αντιμετώπιση της θερμοκρασιακής αύξησης της ατμόσφαιρας της Γης στον Περιβαλλοντολόγο - Μηχανικό περιβάλλοντος David Keith,του Πανεπιστημίου Harvard. Στην ίδια ιδέα συνέβαλαν και τα αποτελέσματα της έκρηξης του ηφαιστείου Pinatubo (Φιλιππίνες, 1991) κατά την οποία πραγματοποιήθηκε έκλυση είκοσι εκατομμυρίων τόνων SO2, που ως αποτέλεσμα είχε τη μείωση της μέσης παγκόσμιας θερμοκρασίας κατά 0,5ºC για τουλάχιστον ένα έτος. Σύμφωνα με την πρόταση του Keith, αν ψεκασθούν σε υψόμετρο 20 km (περίπου το διπλάσιο ύψος από το μέγιστο ύψος των εμπορικών πτήσεων) ποσότητες δεκάδων χιλιάδων τόνων H2SO4 θα αυξηθεί η ανακλαστική ικανότητα της ατμόσφαιρας της Γης με αποτέλεσμα την αντιστάθμιση των αποτελεσμάτων των αυξημένων ποσοτήτων αερίων του θερμοκηπίου (και κυρίως του CO2). Εκτιμάται ότι ποσότητα θειικού οξέος λίγων γραμμαρίων αντισταθμίζει την επιδείνωση του φαινομένου θερμοκηπίου που προκαλείται από ένα τόνο διοξειδίου του άνθρακα. 'Οσο για τις ποσότητες θειικού οξέος που ο Keith προτείνει σκόπιμα να ψεκασθούν (δεκάδες έως εκατοντάδες χιλιάδες τόνοι σε ετήσια βάση), θα πρέπει αυτές να συγκριθούν με τις κατά πολύ μεγαλύτερες ετησίως παραγόμενες ποσότητες θειικού οξέος που δημιουργούνται στην τροπόσφαιρα από τις εκπομπές δεκάδων εκατομμυρίων τόνων διοξειδίου του θείου, οι οποίες προέρχονται από τις καύσεις ορυκτών καυσίμων και τις ηφαιστειακές εκρήξεις. Το κόστος του "ετήσιου ψεκάσματος" αποτελεί μικρό μόνο κλάσμα του συνολικού κόστους των ζημιών από τα ακραία μετεωρολογικά φαινόμενα, που αποδίδονται στην αύξηση της μέσης θερμοκρασίας της γήινης ατμόσφαιρας. |
Παραγωγή και χρήσεις θειικού οξέος [Αναφ. 9]
|
Μια ενδεικτική επί τοις εκατό κατανομή των χρήσεων του θειικού οξέος [πηγή]. |
Η ετήσια παραγωγή θειικού οξέος πρέπει πλέον να έχει ξεπεράσει τα 250 εκατομμύρια τόνων και παρουσιάζει ετήσιο ρυθμό αύξησης 3%. Αυτή η παραγωγή καθιστά το θειικό οξύ την πρώτη σε ποσότητα παραγόμενη βιομηχανική χημική ουσία. Συχνά αναφέρεται ότι η ετήσια ποσότητα θειικού οξέος που καταναλώνει μια χώρα αποτελεί αψευδές μέτρο του μεγέθους της χημικής βιομηχανίας της.
Στην Ασία παράγεται περίπου το 50% του θειικού οξέος, ενώ οι πρώτες σε παραγωγή θειικού οξέος είναι η Κίνα, οι ΗΠΑ, η Ινδία, η Ρωσία και το Μαρόκο (το 61,5% κατά το 2012). Να σημειωθεί ότι η παραγωγή στις ΗΠΑ αλλά και στην Ευρώπη μειώθηκε δραστικά κατά τα τελευταία 20 έτη, λόγω του πολύ φθηνού θειικού οξέος που εισάγεται κυρίως από την Κίνα.
Το θειικό οξύ παράγεται πλέον στο σύνολό του με τη μέθοδο επαφής και τις διάφορες παραλλαγές της, ενώ κύρια πηγή (το 70%) του απαιτούμενου θείου είναι το ίδιο το στοιχειακό θείο (ορυκτό ή ως προϊόν αποθείωσης πετρελαίου), τα θειούχα αέρα από διυλιστήρια πετρελαίου και θειούχα ορυκτά (πυρίτες). 'Ετσι, η παραγωγή θειικού οξέος αποτελεί και έναν τρόπο δέσμευσης των ανεπιθύμητων θειούχων εκπομπών βιομηχανικών δραστηριοτήτων μεγάλης κλίμακας.
Οι κυριότερες χρήσεις του θειικού οξέος είναι στην παραγωγή λιπασμάτων (πρώτη και με διαφορά σε σχέση με άλλες χρήσεις του), στην παραγωγή απορρυπαντικών, στη διύλιση του πετρελαίου, στην κατεργασία χάλυβα, στην παραγωγή και στον καθαρισμό μετάλλων, στην παραγωγή μπαταριών (μπαταρίες μολύβδου), στην παραγωγή εκρηκτικών υλών (βλ. Χημική ένωση του μήνα: Νιτρογλυκερίνη), στην παραγωγή συνθετικών ινών, πλαστικών, στην κατεργασία αποβλήτων και σε μεγάλες ποσότητες χρησιμοποιείται στη χημική βιομηχανία για πλήθος οργανικών συνθέσεων, στην παραγωγή TiO2 (βασική πρώτη ύλη για βαφές), στα χημικά και βιοχημικά εργαστήρια ως αντιδραστήριο.
Στην Ελλάδα, θειικό οξύ παράγεται από την "Ελληνικά Λιπάσματα ELFE" στην περιοχή της Νέας Καρβάλης στην Καβάλα από το 1965 με την μέθοδο επαφής και πρώτη ύλη θείο. Στη μεγαλύτερη ποσότητά του χρησιμοποιείται για την παραγωγή φωσφορικού οξέος, φωσφορικών αλάτων και θειικού αμμωνίου.
Στη συνέχεια γίνεται αναφορά σε δύο από τις κυριότερες εφαρμογές του θειικού οξέος.
|
Δεκάδες εκατομμύρια τόνων θειικού οξέος μετατρέπονται ετησίως σε αντίστοιχες ποσότητες φωσφογύψου κατά την παραγωγή φωσφορικών λιπασμάτων. Οι ποσότητες αυτές σωρεύονται σε σωρούς όπως ο εικονιζόμενος [πηγή]. |
Παραγωγή φωσφορικού οξέος. Η αντίδραση για την οποία καταναλίσκονται οι μεγαλύτερες ποσότητες θειικού οξέος (μέχρι και το 50%) είναι εκείνη με φωσφορικά ορυκτά για την παρασκευή φωσφορικού οξέος, το οποίο στη συνέχεια μετατρέπεται σε φωσφορικά άλατα για τα λιπάσματα:
![]()
Τα κυριότερα φωσφορικά ορυκτά είναι οι διάφοροι τύποι απατίτη, Ca5(PO4)3X (X: F, Cl, OH). Το παραπροϊόν της παραπάνω αντίδρασης είναι ο γύψος που απομακρύνεται εύκολα λόγω της περιορισμένης διαλυτότητάς του. Ο γύψος που παράγεται κατά την αντίδραση παρασκευής φωσφορικού οξέος και φωσφορικών λιπασμάτων είναι γνωστός ως φωσφογύψος (phosphogypsum).
Αν και γενικά ο γύψος είναι ένα χρήσιμο οικοδομικό υλικό, ειδικά ο φωσφογύψος δεν μπορεί να χρησιμοποιηθεί για τον σκοπό αυτό, επειδή είναι ασθενώς ραδιενεργός. Η ραδιενέργεια αυτή οφείλεται σε ίχνη ουρανίου, θορίου και ραδίου-226 (που παρέχει κατά τη διάσπασή του το επικίνδυνο ραδιενεργό αέριο ραδόνιο-222), τα οποία κατά κανόνα συνοδεύουν τον απατίτη. 'Ετσι, σε ετήσια βάση παράγονται δεκάδες εκατομμύρια τόνοι ουσιαστικά άχρηστου φωσφογύψου, η συσσώρευση του οποίου αποτελεί σοβαρό περιβαλλοντικό πρόβλημα.
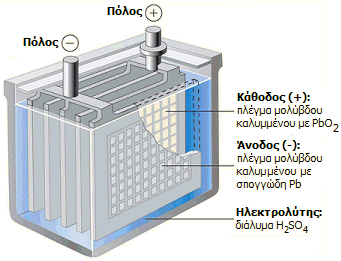 Μπαταρίες
μολύβδου - θειικού οξέος. Μεγάλες ποσότητες θειικού
οξέος χρησιμοποιούνται για την κατασκευή των επαναφορτιζόμενων μπαταριών
μολύβδου-θειικού οξέος, που αποτελούν τον κυριότερο τύπο μπαταριών που
χρησιμοποιούνται στα αυτοκίνητα και στα υποβρύχια, όπως και στα συστήματα
αποθήκευσης ηλεκτρικής ενέργειας (π.χ. φωτοβολταϊκών πάρκων) και στα
συστήματα
αδιάλειπτης τροφοδοσίας
(UPS) υπολογιστών και άλλων συσκευών.
Μπαταρίες
μολύβδου - θειικού οξέος. Μεγάλες ποσότητες θειικού
οξέος χρησιμοποιούνται για την κατασκευή των επαναφορτιζόμενων μπαταριών
μολύβδου-θειικού οξέος, που αποτελούν τον κυριότερο τύπο μπαταριών που
χρησιμοποιούνται στα αυτοκίνητα και στα υποβρύχια, όπως και στα συστήματα
αποθήκευσης ηλεκτρικής ενέργειας (π.χ. φωτοβολταϊκών πάρκων) και στα
συστήματα
αδιάλειπτης τροφοδοσίας
(UPS) υπολογιστών και άλλων συσκευών.
Από ιστορική άποψη, οι μπαταρίες μολύβδου - θειικού οξέος υπήρξαν οι πρώτες μπαταρίες που μπορούσαν να απαναφορτιστούν με διαβίβαση ρεύματος αντιστρόφου φοράς (1859, Gaston Planté). Εκτιμάται ότι οι πωλήσεις μπαταριών μολύβδου - θειικού οξέος κατέχουν μερίδιο ίσο προς το 40-45% των πωλήσεων μπαταριών κάθε είδους σε παγκόσμια κλίμακα.
Κατά τη φάση εκφόρτισης (δηλ. όταν δρουν οι μπαταρίες ως γαλβανικά στοιχεία), πραγματοποιούνται ακόλουθες ηλεκτροδιακές αντιδράσεις:
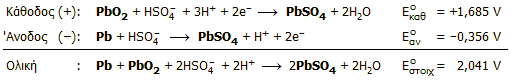
Κατά τη φάση της φόρτισης (δηλ. όταν μετατρέπονται οι μπαταρίες σε ηλεκτρολυτικά στοιχεία) οι φορές των παραπάνω αντιδράσεων αντιστρέφονται, όπως επίσης και ο ρόλος των ηλεκτροδίων (η κάθοδος γίνεται άνοδος και αντιστρόφως).
Από τις αντιδράσεις είναι προφανές ότι ο ηλεκτρολύτης είναι μόνο διάλυμα θειικού οξέος, αφού τα προϊόντα αναγωγής και οξείδωσης είναι στερεά που παραμένουν πάνω στα ηλεκτρόδια (φύλλα μολύβδου). Ακόμη, είναι προφανές ότι κατά την εκφόρτιση της μπαταρίας η συγκέντρωση θειικού οξέος μειώνεται, ενώ κατά τη φόρτιση αυξάνεται. Επομένως με παρακολούθηση της πυκνότητας του ηλεκτρολύτη μπορεί να κριθεί η κατάσταση φόρτισης της μπαταρίας (ενδεικτικές τιμές για φορτισμένη μπαταρία: H2SO4 34% κ.β., d=1,25 g/mL, τυπικές τιμές για εξαντλημένη μπαταρία: Η2SO4 24% κ.β., d=1,17 g/mL).
 |
ΠΡΟΣΟΧΗ: Το θειικό οξύ ίσως είναι μια από τις πλέον επικίνδυνες ουσίες με τις οποίες έρχεται νωρίς σε επαφή κάθε σπουδαστής/σπουδάστρια της χημείας, για τις ιδιότητες και τους κινδύνους του οποίου οφείλει να είναι πλήρως ενημερωμένος/ενημερωμένη. Πέραν του ότι πρόκειται για ένα πανίσχυρο οξύ, ένας ιδιαίτερος παράγοντας επικινδυνότητάς του είναι η εξαιρετικά μεγάλη τάση του πρόσληψης ύδατος. Το πρώτο πράγμα που μαθαίνει κάποιος που πρόκειται να χρησιμοποιήσει πυκνό θειικό οξύ είναι το εξής: Το πυκνό θειικό οξύ αραιώνεται με προσθήκη του ίδιου σε μικρές δόσεις στο νερό και υπό συνεχή ψύξη και ΠΟΤΕ ΑΝΤΙΣΤΡΟΦΑ. Τα μεγάλα ποσά θερμότητας που εκλύονται κατά την εφυδάτωση του θειικού οξέος, προκαλούν σχεδόν εκρηκτικό βρασμό του ύδατος και εκτίναξή του με ποσότητες καυτού θειικού οξέος. |
 |
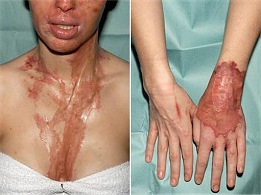
|
Τα εγκαύματα από θειικό οξύ ακόμη και μετά την ίασή τους αφήνουν μόνιμα την παρουσία τους στο ανθρώπινο δέρμα [πηγή]. |
Μέτρα υγιεινής και ασφάλειας κατά την εργασία με θειικό οξύ [Αναφ. 10]
Το θειικό οξύ έχει ιδιότητες που μπορούν να προκαλέσουν σοβαρές βλάβες στην υγεία. Σε επαφή με το δέρμα δρα ως ερεθιστικό, διαβρωτικό, διεισδύει εύκολα σ' αυτό και προκαλεί εγκαύματα. Είναι καταστροφικά επικίνδυνο για τους οφθαλμούς, όπως και μετά από κατάποση ή εισπνοή των ατμών του.
Οι ατμοί του θειικού οξέος μπορούν να προκαλέσουν βλάβες σε ιστούς στη ρινική κοιλότητα, το στόμα και το αναπνευστικό σύστημα. Προκαλούν ερεθισμό, εγκαύματα, βήχα, μείωση της αναπνευστικής ικανότητας και σε σοβαρές εκθέσεις τον θάνατο. Στους οφθαλμούς προκαλούν φλεγμονές, κοκκίνισμα, δάκρυα, φαγούρα, φουσκάλες. Οι εξατμίσεις διαλυμάτων θειικού οξέος πρέπει οπωσδήποτε να εκτελούνται στον απαγωγό.
Το θειικό οξύ θεωρείται ότι είναι καρκινογόνος ένωση της κατηγορίας 1, δηλαδή θεωρείται ως ικανό για καρκινογόνο δράση στον άνθρωπο (International Agency for Research on Cancer, IARC, Occupational Safety and Health Administration, OSHA και American Conference of Govermental Industrial Hygienists *ACGIH), κατηγορία Α2 (ύποπτο καρκινογόνο). Δεν υπάρχουν δεδομένα για μεταλλαξιγόνο και τερατογόνο δράση. Ακριβείς διατυπώσεις: (α) IARC: Group 1 carcinogen, (β) OSHA: Select carcinogen, (γ) ACGIH: A2 - Suspected Human Carcinogen (contained in strong inorganic acid mists),
|
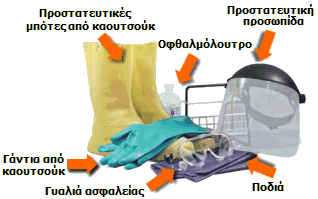
Απαραίτητα προστατευτικά είδη για τους εργαζόμενους με τα διάφορα oleum και SO3. |
Μελέτες σε άτομα που επαγγελματικά εκτίθενται σε ατμούς θειικού οξέος έδειξαν μια αύξηση στους καρκίνους του λάρυγγα. Ωστόσο, οι περισσότεροι καρκίνοι αφορούσαν καπνιστές που ήσαν εκτεθειμένοι και σε άλλα οξέα και χημικές ουσίες.
Τοξικότητα: η ουσία είναι τοξική στα νεφρά, το ανώτερο αναπνευστικό σύστημα, τους πνεύμονες και την καρδιά.
Ο χειρισμός του θειικού οξέος απαιτεί χρήση μακριών γαντιών και ποδιάς (industrial apron) από καουτσούκ και καλύπτρα προσώπου. Αν πέσει θειικό οξύ στο δέρμα, η περιοχή θα πρέπει να ξεπλυθεί με άφθονες ποσότητες χλιαρού ύδατος υπό συνεχή ροή για τουλάχιστον 30 λεπτά.
ΑΤΥΧΗΜΑΤΑ ΚΑΙ ΔΙΑΡΡΟΗ ΜΙΚΡΗΣ ή ΜΕΓΑΛΗΣ ΠΟΣΟΤΗΤΑΣ ΑΝΤΙΔΡΑΣΤΗΡΙΟΥ: Για περιορισμένο ατύχημα, προσθέστε νερό για να αραιώσει το H2SO4, προσθέστε άμμο, χώμα ή ροκανίδια ή υλικό που θα το προσροφήσει. Η εξουδετέρωση του πραγματοποιείται εύκολα με αραιό διάλυμα όξινου ανθρακικού ή ανθρακικού νατρίου. Σκόπιμο είναι το θειικό οξύ να κατανέμεται σε φιάλες μικρής χωρητικότητας (<1 L).
Σε περιπτώσεις διαρροών θειικού οξέος μεγάλης κλίμακας, προσθέστε άμμο, χώμα ή ροκανίδια για να επιτευχθεί μερική προσρόφησή του. Ψεκασμός με νερό περιορίζει και δεσμεύει τους ατμούς SO3. Προφυλάξτε ή παρεμποδίστε την είσοδο σε αποχέτευση ή σε αγωγούς υγρών αποβλήτων. Εξουδετερώστε με αραιό διάλυμα όξινου ανθρακικού ή ανθρακικού νατρίου.
Διαρροές μεγάλων ποσοτήτων θειικού οξέος σε ποταμούς εξουδετερώθηκαν με ρίψη στα κατάντη τους αντίστοιχα μεγάλων ποσοτήτων σκόνης ασβεστολίθων και μαρμαρόσκονης. 'Ετσι αντιμετωπίστηκαν κατά το παρελθόν περιστατικά ρύπανσης του Αξιού ποταμού με ποσότητες θειικού οξέος από διαρροές φθαρμένων δεξαμενών που περιείχαν εκατοντάδες τόνους θειικού οξέος παραποτάμιων βιομηχανιών της πόλης Βέλες της πΓΔΜ.
Στο διαδίκτυο υπάρχει μια συνεχώς επικαιροποιούμενη ιστοσελίδα όπου περιγράφονται τα ατυχήματα που έχουν συμβεί κατά τη διαχείριση και διακίνηση μεγάλων ποσοτήτων πυκνού θειικού οξέος και oleum [Αναφ. 10στ].

|
Στη Δραπετσώνα, στην είσοδο του λιμανιού του Πειραιά και δίπλα στον αρχαιολογικό χώρο της Ηετιώνειας Πύλης, τα Λιπάσματα Δραπετσώνας, το εργοστάσιο δηλαδή της Ανώνυμης Ελληνικής Εταιρείας Χημικών Προϊόντων, ύστερα από έναν αιώνα ζωής κατεδαφίστηκε πριν από μερικά χρόνια. Ιδρύθηκε το 1909 και για πολλές δεκαετίες υπήρξε η "ναυαρχίδα" της ελληνικής χημικής βιομηχανίας. Η εταιρεία μονοπώλησε την παραγωγή λιπασμάτων (θειικό οξύ, θειικός χαλκός, θειικός σίδηρος, υδροχλωρικό οξύ, νιτρικό οξύ, λιπάσματα) και λίγο αργότερα υαλουργικών ειδών για μισό αιώνα. Σε 245 στρέμματα ανερχόταν η έκταση την οποία κατελάμβανε το εργοστάσιο, το οποίο στην τελευταία φάση της λειτουργίας του περιελάμβανε 109 μονάδες συνολικά δομημένης επιφάνειας 146.000 τ.μ. Το 1993, το εργοστάσιο τίθεται σε εκκαθάριση εν λειτουργία και περιέρχεται στον πλήρη έλεγχο της Εθνικής Τράπεζας. Το εργοστάσιο συνεχίζει να λειτουργεί υποτονικά και κλείνει οριστικά τον Σεπτέμβριο του 1999. Θειικό οξύ παράγεται σήμερα από την "Ελληνικά Λιπάσματα ELFE" στην περιοχή της Νέας Καρβάλης στην Καβάλα από το 1965. Αριστερά: Γενική άποψη του εργοστασίου της Δραπετσώνας στην πρώτη φάση της λειτουργίας του (σε πρώτο πλάνο το συγκρότημα του υαλουργείου). Δεξιά: Γενική άποψη του χώρου κατά τη δεκαετία του 1980 [πηγή]. Σήμερα έχει απομείνει -ως κτήριο μόνο- το συγκρότημα του υαλουργείου (κέντρο, στο βάθος). |
Πηγή: http://frapress.gr
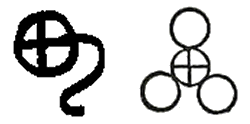






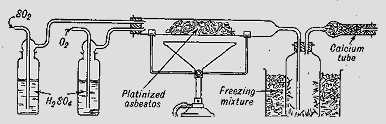
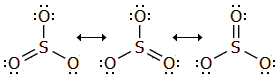 Με απόσταξη του πυκνού
θειικού οξέος και ψύξη των εκλυόμενων ατμών
Με απόσταξη του πυκνού
θειικού οξέος και ψύξη των εκλυόμενων ατμών 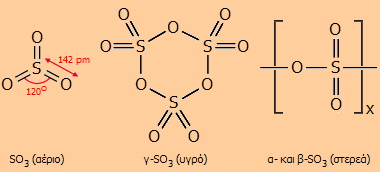







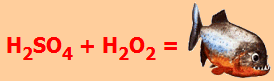 Λόγω της
επικινδυνότητας του αντιδραστηρίου η χρήση του αποθαρρύνεται ή ακόμη και απαγορεύεται σε πολλά πανεπιστημιακά εργαστήρια.
Χαρακτηριστικά, μια ξύλινη οδοντογλυφίδα καθώς εισάγεται σε διάλυμα πιράνχα
εξαφανίζεται ("κατατρώγεται"). Η οξειδωτική ισχύς
του μίγματος οφείλεται στο σχηματιζόμενο υπεροξομονοθειικό οξύ, γνωστό και ως
Λόγω της
επικινδυνότητας του αντιδραστηρίου η χρήση του αποθαρρύνεται ή ακόμη και απαγορεύεται σε πολλά πανεπιστημιακά εργαστήρια.
Χαρακτηριστικά, μια ξύλινη οδοντογλυφίδα καθώς εισάγεται σε διάλυμα πιράνχα
εξαφανίζεται ("κατατρώγεται"). Η οξειδωτική ισχύς
του μίγματος οφείλεται στο σχηματιζόμενο υπεροξομονοθειικό οξύ, γνωστό και ως