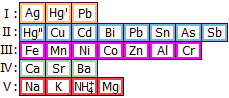 |
Αμμώνιο (ΝΗ4+)
|
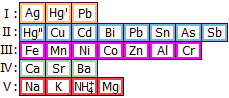 |
Αμμώνιο (ΝΗ4+)
|
|
• Το αμμώνιο είναι το συζυγές κατιοντικό οξύ της αμμωνίας, είναι ιόν (κατιόν) και δεν υφίσταται σε ελεύθερη κατάσταση. Η ονομασία αμμωνία - αμμώνιο χρησιμοποιείται από την εποχή των αλχημιστών. Ο Geber (900 μ.Χ.) περιγράφει παρασκευή του "spiritus salis urinae", δηλ. του NH4Cl, με θέρμανση ούρων και χλωριούχου νατρίου. Η ονομασία προέρχεται από τον 'Αμμωνα Ρα ('Αμμωνα Δία για τους 'Ελληνες), στην περιοχή του ναού του οποίου (στην αρχαία Αίγυπτο) συγκέντρωναν μεγάλες ποσότητες κόπρου καμηλών με θέρμανση της οποίας παρασκεύαζαν αμμωνιακά άλατα. • Η τοξικότητα των αλάτων του αμμωνίου είναι γενικά πολύ μικρή (εκτός αν το ανιόν είναι τοξικό). • Ορυκτά αμμωνίου δεν υπάρχουν κανονικά στη φύση εκτός από μικρές ποσότητες αμμωνιακών αλάτων, όπως το χλωριούχο αμμώνιο ( sal ammoniac) σε περιοχές ενεργών ηφαιστείων καθαρό (προϊόν εξάχνωσης) [F01] ή ως κρύσταλλοι πάνω σε άλλα γαιώδη υλικά [F02].•
Κατά το 2022 παρήχθησαν περίπου 150 εκατομ. τόνοι αμμωνίας με απευθείας ένωση
αζώτου - υδρογόνου (μέθοδος Haber - Bosch).
Ειδικά χαρακτηριστικά • Tα ιόντα NH4+, σε αντίθεση με τα άλλα κατιόντα της ομάδας V υδρολύονται σε σημαντικό βαθμό και τα διαλύματα των αλάτων του αμμωνίου με ισχυρά οξέα είναι ασθενώς όξινα: ΝΗ4+
• Απουσία οξειδωτικών αντιδραστηρίων, τα διαλύματα των αλάτων του ΝΗ4+ είναι σταθερά. Παρουσία οξειδωτικών αντιδραστηρίων είναι δυνατή η οξείδωσή τους, π.χ. με υποχλωριώδη ιόντα οξειδώνονται κυρίως προς N2: 2ΝΗ4+ + ClO-
• Με διαλύματα ισχυρών βάσεων παρέχουν αμμωνία. Η παραγόμενη αμμωνία ως πτητική ουσία, μπορεί να ανιχνευθεί είτε από τη χαρακτηριστική οσμή, είτε από τον χρωματισμό που προκαλεί σε υγρανθέντα πεχαμετρικό χάρτη (βαθυκύανη χρώση του πεχαμετρικού χάρτη) λόγω αύξησης του pH:
ΝΗ4+ + ΟΗ−
κίτρινος πεχαμετρικός χάρτης (ουδέτερο pH) + ΝΗ3 • Η αμμωνία μπορεί να απομακρυνθεί στο σύνολό της από το διάλυμα με παρατεταμένο βρασμό. Στην ιδιότητα αυτή βασίζεται η μέθοδος απομάκρυνσης των ιόντων αμμωνίου από τα διαλύματα, σε περιπτώσεις που τα ιόντα αυτά παρεμποδίζουν άλλες αντιδράσεις:
βρασμός • Από τις χαρακτηριστικότερες και πλέον ευαίσθητες αντιδράσεις των ιόντων ΝΗ4+ και της αμμωνίας, είναι η αντίδραση με το κλασικό αντιδραστήριο Nessler (αλκαλικό διάλυμα K2[HgI4]), η οποία περιγράφηκε για πρώτη φορά από τον Julius Nessler to 1856 και κατά την οποία σχηματίζεται κίτρινο έως καστανόχρωμο ίζημα (ανάλογα με την συγκέντρωση ΝΗ4+ ή NH3):
2[HgI4]2− + 4 OH− + NH4+ Η αντίδραση είναι εξαιρετικά ευαίσθητη και χρησιμοποιείται για την ανίχνευση αλλά και τον ποσοτικό (χρωματομετρικό) προσδιορισμό NH3 (ένδειξη μόλυνσης) στο πόσιμο νερό. • Τα δυσδιάλυτα άλατα των ιόντων ΝΗ4+ είναι ανάλογα με τα δυσδιάλυτα άλατα των ιόντων K+. 'Eτσι τα ιόντα NH4+ παρέχουν δυσδιάλυτα άλατα με: α) κοβαλτιεξανιτρώδη ιόντα, β) όξινα τρυγικά ιόντα, γ) χλωρολευκοχρυσικά ιόντα και δ) τετραφαινυλοβορικά ιόντα. Αντίθετα με τα ιόντα K+, δεν παρέχουν ίζημα με υπερχλωρικά ιόντα.
Τυπικές αντιδράσεις NH4+ 1. Iόντα OH− NH4+ + OH−
Video 01:
Άμεση ανίχνευση ΝΗ4+ με πεχαμετρικό χάρτη.
2. Αντιδραστήριο Nessler
2[HgI4]2− + 4 OH− + NH4+
Video 02:
Ανίχνευση NH4+ με αντιδραστήριο Nessler.
|
||||||||