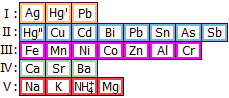 |
Ασβέστιο (Ca)
|
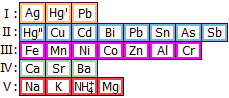 |
Ασβέστιο (Ca)
|
|
• Αργυρόλευκο, ελαφρύ και σχετικά μαλακό μέταλλο. Αν και χημικώς δραστικότατο μέταλλο, αντιδρά ήπια με το νερό με έκλυση υδρογόνου. Στον αέρα καλύπτεται από λεπτό στρώμα οξειδίου - νιτριδίου που το προστατεύει από περαιτέρω προσβολή. Μηχανικώς επεξεργάσιμο μέταλλο (π.χ. στον τόρνο). Στο εμπόριο διατίθεται και υπό τη μορφή σύρματος. Παρασκευάστηκε για πρώτη φορά από τον Sir Humphry Davy (Αγγλία, 1808) με ηλεκτρολυτική μέθοδο. Η ελληνική ονομασία του προέρχεται από την άσβεστο (CaO). Το σύμβολο Ca προέρχεται από τη λατινική ονομασία του μετάλλου "calcium", από τη λατινική λέξη "calx" : άσβεστος. • Η τοξικότητα του μετάλλου και των ανόργανων ενώσεών του θεωρείται μηδενική (εκτός αν το ανιόν των αλάτων του είναι το ίδιο τοξικό) και αποτελεί στοιχείο απαραίτητο για την ανάπτυξη όλων των οργανισμών. • Υπάρχει αφθονία ορυκτών του ασβεστίου στη φύση. Κυριότερα ορυκτά του είναι ο ασβεστίτης, CaCO3 [F01], αραγωνίτης, CaCO3 [F02], o γύψος, CaSO4·2H2O [F03], ο φωσφορίτης, Ca3(PO4)2 [F04], o φθορίτης, CaF2 [F05], o δολομίτης, CaCO3·MgCO3 [F06] κ.α. • Ετησίως, παράγονται (ηλεκτρολυτικώς) περίπου 30 χιλ. τόνοι μετάλλου ετησίως, ενώ οι ποσότητες ενώσεών του μετρούνται σε δεκάδες εκατομμύρια τόνους. • Εφαρμογές: ως μέταλλο χρησιμοποιείται σε ειδικά κράματα, ως και την παρασκευή άλλων μετάλλων ως των Zr, Th, U και των μετάλλων των σπανίων γαιών. Ως CaO χρησιμοποιείται στη μεταλλουργία, στην επεξεργασία-καθαρισμό των υδάτων, στη χημική βιομηχανία, στη παραγωγή σκυροδέματος (τσιμέντου).
Γενικές χημικές ιδιότητες των ενώσεων του Ca Οξειδωτικές καταστάσεις • Η μόνη σταθερή οξειδωτική κατάσταση του Ca είναι η Ca(II).
Διαλυτοποίηση του μετάλλου • Το Ca, ως δραστικό μέταλλο, διαλύεται σε όλα τα αραιά ισχυρά οξέα καθώς επίσης και στο οξικό οξύ με έκλυση Η2:
Ca + 2H+
• Λόγω της μεγάλης δραστικότητάς του προσβάλλεται ακόμη και από το ψυχρό ύδωρ με έκλυση H2:
Ca + 2H2Ο
Σταθερότητα των διαλυμάτων του • Τα ιόντα Ca2+ δεν υδρολύονται και έτσι δεν απαιτείται οξίνιση των διαλυμάτων τους. • Με διαλύματα ισχυρών βάσεων και από σχετικώς πυκνά διαλύματα αλάτων του Ca2+, είναι δυνατή η καθίζηση μέρους των ιόντων Ca2+ του ως Ca(OH)2, λόγω σχετικά μικρής διαλυτότητάς του. Αλκαλικά διαλύματα του Ca2+ θολώνουν λόγω αντίδρασης με το CO2 της ατμόσφαιρας:
Ca2+ + 2OH- + CO2
Σχηματισμός συμπλόκων ιόντων
• Τα ιόντα Ca2+ δεν σχηματίζουν σύμπλοκα με NH3, CN−. Τα ιόντα Ca2+, Sr2+ και Ba2+ δεν διαφέρουν σε τίποτα από άποψη χημείας. Οι μόνες διαφορές μεταξύ τους εντοπίζονται στη διαλυτότητα των επιμέρους αλάτων τους και μόνο σ' αυτές βασίζεται ο διαχωρισμός, όπως και η διάκριση μεταξύ τους. Τα γινόμενα διαλυτότητας και οι διαλυτότητες των πλέον χαρακτηριστικών και σχετικά δυσδιάλυτων αλάτων τους δίνονται στους επόμενους πίνακες:
• Με χρωμικά ιόντα δεν παρέχουν ίζημα CaCrO4 (εκτός αν τα διαλύματα είναι πολύ πυκνά ή υπάρχει μεγάλη ποσότητα αλκοόλης) σε αντίθεση με τα ιόντα Sr2+ και Ba2+ που παρέχουν ιζήματα κίτρινων χρωμικών αλάτων. [V02] • Δεν παρέχουν ίζημα με κορεσμένο διάλυμα CaSO4 σε αντίθεση με τα ιόντα Sr2+ και Ba2+ που παρέχουν λευκά ιζήματα θειικών αλάτων.
• Με διάλυμα ροδιζονικού νατρίου δεν παρέχουν ίζημα.
[V03]
Ca2+ + CO32−
CaCO3 + 2H+
2. Ιόντα SO42-
Ca2+ + SO42−
Video 01:
Αντίδραση Ca2+ με SO42−.
3. Ιόντα
CrO42−
Ca2+ +
CrO42−
Video 02:
Αντίδραση Ca2+, Sr2+, Ba2+ με CrO42−.
4. Ροδιζονικό Na (RodNa2
-βλέπε χημικό τύπο-)
Ca2+ + Rod2−
5. Πυροχημική
Τα άλατα του Ca χρωματίζουν τη φλόγα του λύχνου Bunsen
πορτοκαλόχρωμη.
Video 04:
Πυροχημική ανίχνευση Ca2+.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||