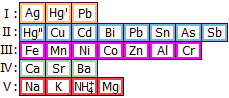 |
Ψευδάργυρος (Zn)
|
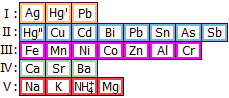 |
Ψευδάργυρος (Zn)
|
|
• Σχετικά εύθρυπτο μέταλλο με ελαφριά κυανή απόχρωση. Οξειδώνεται επιφανειακά στον αέρα. Αρκετά δραστικό μέταλλο, προσβάλλεται από όλα τα οξέα και τις ισχυρές βάσεις. Γνωστό στην Ινδία και στην Κίνα πριν από τον 15ο αιώνα. Oνομασία γερμανικής προέλευσης: "zink" ("τσίγκος", υποδηλώνει συγγένεια με το "zinn": κασσίτερος). Ο ορείχαλκος (ή μπρούντζος ψευδαργύρου) είναι κράμα χαλκού-ψευδαργύρου γνωστό από την αρχαιότητα. Με τον ορείχαλκο κατασκευάζονταν σκληρότερα και ανθεκτικότερα εργαλεία και όπλα σε σχέση με εκείνα από καθαρό χαλκό. • Η τοξικότητα του μετάλλου και των ανόργανων ενώσεών του είναι σχετικά μικρή, ωστόσο μερικές από τις ενώσεις του απεδείχθησαν πειραματικά καρκινογόνες. • Τα πλέον κοινά ορυκτά του είναι ο σφαλερίτης, Zn(Fe)S [F01] και ο σμιθσονίτης (ή καλαμίνα), ZnCO3 [F02], πιο σπάνιο ορυκτό του ψευδαργύρου είναι ο βιλλεμίτης, Zn2SiO4 [F03]. • Το 2021 εξορύχθηκε παγκοσμίως ποσότητα μεταλλεύματος, η οποία αντιστοιχεί σε 13 εκατομ. τόνους ψευδαργύρου. Κυριότερες παραγωγοί χώρες: ΗΠΑ, Καναδάς, Αυστραλία, Αυστρία, Ρωσία. • Η μεγαλύτερη ποσότητα του Zn χρησιμοποιείται για την κατασκευή συσκευών, δοχείων και σωλήνων που έρχονται σε επαφή με το ύδωρ ή εκτίθενται στον αέρα και για την επιψευδαργύρωση ελασμάτων σιδήρου (γαλβανισμένη λαμαρίνα). Μεγάλες ποσότητες χρησιμοποιούνται στην κατασκευή κραμάτων ως ο ορείχαλκος (μπρούντζος ψευδαργύρου) καθώς επίσης και στην κατασκευή μπαταριών (Zn-C). Ως ZnO χρησιμοποιείται στα ελαστικά, φαρμακευτικά, ως χρώμα και ως σταθεροποιητής πολυμερών. |
|
F01. Σφαλερίτης, Zn(Fe)S |
F02. Σμιθσονίτης ή καλαμίνα, ZnCO3 |
F03. Βιλλεμίτης, Zn2SiO4 |
|
Γενικές χημικές ιδιότητες των ενώσεων του Zn
Οξειδωτικές καταστάσεις
• Η μόνη σταθερή οξειδωτική κατάσταση του
Zn είναι η Zn(II).
Διαλυτοποίηση του μετάλλου • Ο Zn, ως δραστικό μέταλλο, διαλύεται σε όλα τα αραιά ισχυρά οξέα καθώς επίσης και στο οξικό οξύ με έκλυση Η2:
Zn + 2H+
Video 01:
Διαλυτοποίηση Zn με HCl.
• Διαλύεται και σε οξειδωτικά οξέα, όπως το πυκνό-θερμό H2SO4:
Zn + 3H2SO4
• Διαλύεται στο ΗΝΟ3 και όσο αραιότερο είναι το HNO3, τόσο χαμηλότερο
αριθμό οξείδωσης έχει το προϊόν αναγωγής του. ‘Ετσι, με πολύ αραιό HNO3
παράγονται ιόντα NH4+, ενώ με πυκνότερα διαλύματα
παράγονται NO και ΝΟ2:
4Zn + 10H+ + NO3−
3Zn + 8H+ + 2NO3−
Zn + 4H+ + 2NO3−
• Διαλυτοποιείται εύκολα σε διαλύματα ισχυρών βάσεων, με έκλυση Η2:
Zn + 2 OH− + 2H2O
Σταθερότητα των διαλυμάτων του • Τα
ιόντα Zn2+ είναι σταθερά, αλλά είναι απαραίτητη η ελαφριά οξίνιση των
διαλυμάτων τους για να περιοριστεί η έστω και σε μικρό βαθμό υδρόλυσή τους.
• Σε
αλκαλικά διαλύματα σχηματίζεται λευκό, ζελατινώδες ίζημα Zn(OH)2, το
οποίο, ως επαμφοτερίζον υδροξείδιο, διαλύεται εύκολα σε περίσσεια βάσης
σχηματίζοντας σειρά υδροξυσυμπλόκων και άλλων ανιοντικών σωματιδίων όπως:
[Zn(OH)4]2−, [Zn(OH)3]−, ΗZnO2−,
ZnO22− (ψευδαργυρικά ανιόντα) Zn2+
+ 2 OH−
Zn(OH)2 + 2 OH−
[Zn(OH)4]2−
Σχηματισμός συμπλόκων ιόντων • Τα
ιόντα Zn2+ σε υδατικά διαλύματα υφίστανται ως άχρωμα εφυδατωμένα
σύμπλοκα του τύπου [Zn(H2O)6]2+. • Ο
Zn(II) σχηματίζει σύμπλοκα με την NH3 (χαρακτηριστική διαφορά από τα
Al, Mn, Fe, Cr): Zn2+
+ 2NH3 + 2H2O
Zn(OH)2 + 4NH3
Ειδικά χαρακτηριστικά
• Σχηματίζει θειούχο άλας σε υδατικά
διαλύματα. Ο ZnS είναι το μόνο λευκό και πλέον δυσδιάλυτο θειούχο άλας της ΙΙΙης
κατιόντων και για το λόγο αυτό μέρος του Zn μπορεί να συγκαθιζάνει
με τα θειούχα άλατα της ΙΙης κατιόντων. O ZnS είναι αδιάλυτος σε
περίσσεια S2−, σε ισχυρές βάσεις, σε οξικό οξύ, αλλά διαλύεται
εύκολα σε αραιά ισχυρά οξέα:
Zn2+
+ S2−
ZnS + 2H+
• Με σιδηρικυανιούχα ανιόντα
(εξακυανοσύμπλοκο του Fe(III)) παρέχει καστανοκίτρινο ίζημα σιδηρικυανιούχου άλατος:
3Zn2+
+ 2[Fe(CN)6]3−
• Εάν η προηγούμενη αντίδραση πραγματοποιηθεί παρουσία Ν,Ν-διαιθυλανιλίνης, C6H5N(C2H5)2, τότε μέρος της οργανικής ένωσης οξειδώνεται από τα σιδηρικυανιούχα ιόντα προς έγχρωμα προϊόντα. Τα σιδηροκυανιούχα ιόντα (εξακυανοσύμπλοκο του Fe(II)), που παράγονται από την αντίδραση αυτή, αντιδρούν με τα ιόντα Zn2+ και καθιζάνει λευκό ίζημα σιδηροκυανιούχου ψευδαργύρου, το οποίο όμως προσροφά τα έγχρωμα προϊόντα της προηγούμενης αντίδρασης και χρωματίζεται έντονα ερυθρό:
[Fe(CN)6]3− + N,N-διαιθυλανιλίνη
2Zn2+
+ [Fe(CN)6]4−
Zn2[Fe(CN)6] (λευκό) + έγχρωμα προϊόντα
Τυπικές αντιδράσεις Zn2+
1. Ιόντα S2−
Zn2+
+ S2−
ZnS + 2H+
Video 02:
Αντίδραση Zn2+ με S2−.
2. Iόντα OH−
Zn2+
+ 2 OH−
Zn(OH)2 + 2 OH−
[Zn(OH)4]2−
Video 03:
Αντίδραση Zn2+ με OH−.
3. Αμμωνία Zn2+
+ 2NH3 + 2H2O
Zn(OH)2 + 4NH3
Video 04:
Αντίδραση Zn2+ με NH3.
4. Σιδηροκυανιούχα ιόντα 2Zn2+
+ [Fe(CN)6]4−
Video 05:
Αντίδραση Zn2+ με Fe(CN)64−.
5. Σιδηρικυανιούχα ιόντα 3Zn2+
+ 2[Fe(CN)6]3−
Video 06:
Αντίδραση Zn2+ με Fe(CN)63−.
6. Σιδηρικυανιούχα και Ν,Ν-διαιθυλανιλίνη
[Fe(CN)6]3− + N,N-διαιθυλανιλίνη
2Zn2+
+ [Fe(CN)6]4−
Zn2[Fe(CN)6] (λευκό) + έγχρωμα προϊόντα
Video 07:
Αντίδραση Zn2+ με Fe(CN)63− παρουσία Ν,Ν-διαιθυλανιλίνης.
|