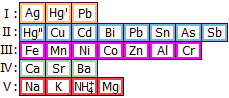 |
Σίδηρος (Fe)
|
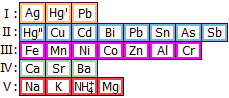 |
Σίδηρος (Fe)
|
|
Γενικά για τον Fe
• Αργυρόχρωμο μέταλλο, σχετικά μαλακό όταν είναι απολύτως καθαρό. Γνωστό από τους προϊστορικούς χρόνους με γενίκευση της χρήσης του από το 1100 π.Χ., οπότε αρχίζει η ονομαζόμενη "εποχή του σιδήρου". Ο συμβολισμός του προέρχεται από τη λατινική του ονομασία: "ferrum". • Η τοξικότητα του μετάλλου και των ανόργανων ενώσεών του είναι περιορισμένη και ο ίδιος αποτελεί ένα από τα βασικά στοιχεία κάθε οργανισμού. Οι ενώσεις του είναι τοξικές εάν ληφθούν σε μεγάλες σχετικά ποσότητες και οι ενώσεις του Fe(II) θεωρούνται ως τοξικότερες των ενώσεων του Fe(III). • Κύρια ορυκτά από τα οποία παράγεται το μέταλλο είναι εκείνα που δεν περιέχουν S, P, As, όπως ο αιματίτης, Fe2O3 [F01], o μαγνητίτης, Fe3O4 [F02], ο λειμωνίτης (κίτρινη ώχρα), Fe2O3·3H2O [F03], ενώ άλλα επίσης πολύ κοινά ορυκτά του σιδήρου είναι σιδηρίτης, FeCO3 [F04], και ο χρυσαφένιος σιδηροπυρίτης (γνωστός και ως "χρυσός του τρελλού"), FeS2 [F05] κ.α. Ελεύθερος σίδηρος ή σε κράμα με (κυρίως) νικέλιο και άλλα μέταλλα βρίσκεται σε μόνο σε μετεωρίτες [F06]. • Το 2021 παρήχθησαν παγκοσμίως 1400 εκατομ. τόνοι χυτοσίδηρου και 1900 εκατομ. τόνοι χάλυβα. Παράγεται σχεδόν σε όλες τις χώρες του κόσμου με κύριους παραγωγούς: ΗΠΑ, Καναδά, Σουηδία, Νότια Αφρική, Ρωσία, Ινδία, Ιαπωνία. • Αποτελεί το ευρύτερα χρησιμοποιούμενο μέταλλο με πλήθος εφαρμογών στις κατασκευές πλοίων, αυτοκινήτων, μηχανών, γεφυρών, σιδηροτροχιών, δομικών ράβδων. Με 0,15-1,5% C παρέχει τον χάλυβα και με επιπλέον προσθήκη άλλων μετάλλων λαμβάνονται χάλυβες (μαγγανιοχάλυβες, νικελιοχάλυβες, χρωμιοχάλυβες, βαναδιοχάλυβες) με ποικιλία ιδιοτήτων (π.χ. σκληρότητα, ελαστικότητα, αντοχή στη φθορά, αντοχή σε υψηλές θερμοκρασίες, αντοχή στη χημική διάβρωση).
Οξειδωτικές καταστάσεις • Οι σταθερές οξειδωτικές καταστάσεις του Fe σε υδατικά διαλύματα είναι η Fe(ΙΙ) και η Fe(III). Τα άλατα του Fe(ΙΙ) και Fe(III) συμπεριφέρονται ως ήπια αναγωγικά και οξειδωτικά μέσα, αντιστοίχως. Σε ισχυρώς αλκαλικά διαλύματα ισχυρά οξειδωτικά, οξειδώνουν τις ενώσεις του Fe προς τα ασταθή σιδηρικά ανιόντα, FeO42−. • Διαλύματα των αλάτων του Fe(II) οξειδώνονται σταδιακά από το O2 της ατμόσφαιρας προς τα αντίστοιχα άλατα του Fe(III). Το ίδιο ισχύει και για τα στερεά άλατα του Fe(II), τα οποία οξειδώνονται προς τα αντίστοιχα άλατα του Fe(III), αλλά με σχετικά βραδύ ρυθμό.
Διαλυτοποίηση του μετάλλου • Ο Fe διαλύεται σε HCl ή αραιό H2SO4, με παραγωγή ιόντων Fe2+: Fe + 2H+
Video 01:
Διαλυτοποίηση Fe με HCl.
• Το πυκνό H2SO4 προσβάλλει τον Fe μόνο σε υψηλή θερμοκρασία: 2Fe + 9H2SO4
• Ο Fe δεν προσβάλλεται από π.ΗΝΟ3 περιερχόμενος σε παθητική κατάσταση
(σχηματισμός επιφανειακού οξειδίου που αποτρέπει την περαιτέρω διάλυση του μετάλλου), ενώ προσβάλλεται εύκολα από αραιό ΗΝΟ3 παρέχοντας, ανάλογα με τη θερμοκρασία και την
πυκνότητα του HNO3, Fe2+, Fe3+ ή μίγμα και των δύο και σειρά προϊόντων αναγωγής του HNO3 (όσο αραιότερο είναι το HNO3,
τόσο χαμηλότερη είναι η οξειδωτική κατάσταση των προϊόντων
αναγωγής του) π.χ. 4Fe + NO3−
+ 10H+
4Fe + 2NO3−
+ 10H+
Fe + NO3− + 4H+
Fe +
3NO3− + 6H+
• Ο Fe δεν προσβάλλεται από διαλύματα ισχυρών βάσεων. Σταθερότητα των διαλυμάτων του
• Τα διαλύματα των αλάτων του Fe(II) και ιδιαίτερα του
Fe(III), απαιτούν παρουσία
περίσσειας οξέος για να αποφευχθεί η υδρόλυσή τους.
• Τα διαλύματα ιόντων
Fe2+ είναι πρακτικώς άχρωμα, ενώ σε μεγάλες συγκεντρώσεις
εμφανίζουν ένα ανοικτό κυανοπράσινο χρώμα. Το ίδιο χρώμα έχουν και τα στερεά
άλατα του Fe2+. Τα διαλύματα του Fe2+ απορροφούν με βραδύ ρυθμό
ατμοσφαιρικό
οξυγόνο και
οξειδώνονται προς Fe3+:
4Fe2+ + O2 + 4H+
και επομένως είναι σχεδόν αδύνατον να παρασκευαστούν διαλύματα αλάτων Fe(II), που να μην περιέχουν, έστω και σε πολύ μικρή αναλογία, Fe(IΙI). Για να αποφευχθεί
ο η συσσώρευση ιόντων Fe3+ (και εφόσον δεν ενδιαφέρει τόσο η σταθερότητα του διαλύματος σε συγκέντρωση ιόντων
Fe2+) συνήθως προστίθεται στις φιάλες μεταλλικός Fe, που βοηθά σε κάποιο βαθμό την εκ νέου αναγωγή των ιόντων Fe3+ προς ιόντα Fe2+:
Fe3+ + Fe
• Τα διαλύματα των αλάτων του Fe3+, που στα διαλύματα είναι πλήρως εφυδατωμένα
ως [Fe(H2O)6]3+, απαιτούν ισχυρώς όξινα διαλύματα για να περιοριστεί η
υδρόλυσή τους. Αν και τα ιόντα [Fe(H2O)6]3+ φαίνεται ότι δεν έχουν κάποιο
χαρακτηριστικό χρώμα ή είναι ελαφρώς ιώδη, ωστόσο τα διαλύματά τους εμφανίζουν ένα κίτρινο έως καστανό χρώμα, που οφείλεται σε μερικώς υδρολυμένα ιόντα,
όπως π.χ. το [Fe(H2O)5OH]2+, ή σε ανιοντικά σύμπλοκα, ως π.χ. το [FeCl4]−.
Σχηματισμός συμπλόκων ιόντων • Τα ιόντα Fe2+ και Fe3+ δεν σχηματίζουν σύμπλοκα με NH3 ή υδροξυσύμπλοκα με
διαλύματα ισχυρών βάσεων (χαρακτηριστική διαφορά από τα ιόντα Al3+ και Cr3+).
• Τόσο τα ιόντα
Fe2+ όσο και τα ιόντα Fe3+ σχηματίζουν σταθερότατα
εξακυανοσύμπλοκα με ιόντα CN−, γνωστά ως σιδηροκυανιούχα, [Fe(CN)6]4− και
σιδηρικυανιούχα ιόντα, [Fe(CN)6]3−, αντιστοίχως.
Διάκριση
Fe(II)
και Fe(III).
Μια σταγόνα διαλύματος
KSCN 0,10 M σε διαλύματα
αλάτων των δύο οξειδωτικών καταστάσεων του
σιδήρου, χρωματίζει αιματέρυθρο μόνο το διάλυμα του άλατος
Fe(III).
• Τα ιόντα
Fe3+ παρέχουν σταθερά άχρωμα σύμπλοκα με ιόντα F- του τύπου [FeFn]3−n
(n=1
−
6). 'Ετσι, η παρουσία περίσσειας ιόντων F− μπορεί να
"καλύψει" (δηλ. να κρύψει) πολλές από τις
χαρακτηριστικές αντιδράσεις των ιόντων Fe3+. • Τα ιόντα
Fe3+ παρέχουν μετρίως σταθερά κίτρινα σύμπλοκα με ιόντα Cl-, του
τύπου [FeCln]3−n (n=1
−
4). 'Ετσι, παρουσία περίσσειας HCl σχηματίζεται η ένωση
H[FeCl4] κίτρινου χρώματος που εκχυλίζεται εύκολα με διαιθυλαιθέρα. • Τα ιόντα
Fe3+ παρέχουν χαρακτηριστικά έγχρωμα σύμπλοκα με βαθύ ερυθρό
(αιματέρυθρο) χρώμα με ιόντα SCN− (θειοκυανικά ιόντα): Fe3+ + nSCN−
• Η
παραπάνω αντίδραση είναι ιδιαίτερα χαρακτηριστική αντίδραση για τα ιόντα Fe3+ και
επιτρέπει την ανίχνευσή τους σε πολύ χαμηλές συγκεντρώσεις. Η ίδια αντίδραση
μπορεί να χρησιμοποιηθεί αντίστροφα και για την ανίχνευση θειοκυανικών ιόντων.
• Αντίδραση με θειοκυανικά ιόντα δεν παρέχουν τα ιόντα
Fe2+ και αυτό αποτελεί
χαρακτηριστική διαφορά μεταξύ των ιόντων Fe2+ και Fe3+.
Ωστόσο, επειδή λόγω οξείδωσης από το ατμοσφαιρικό οξυγόνο τα διαλύματα
Fe2+ πάντοτε περιέχουν, έστω και σε μικρή αναλογία, Fe3+,
αυτά αναμένεται να δώσουν
μια ελαφριά ερυθρά χρώση με τα ιόντα SCN−.
Ειδικά χαρακτηριστικά
• Tα ιόντα Fe2+ με ΝΗ3 ή διαλύματα ισχυρών βάσεων, εφόσον είναι απαλλαγμένα από
μικροποσότητες ιόντων Fe3+, παρέχουν δυσδιάλυτο ελαφρώς πράσινο ίζημα από Fe(OH)2, το
οποίο όμως απορροφά ταχύτατα O2 και μετατρέπεται σε καστανέρυθρο
(χρώμα σκουριάς) Fe(OH)3:
Fe2+ + 2ΝΗ3 + 2H2O
Fe2+ + 2 OH−
4Fe(OH)2 + O2 + 2H2Ο
• Tα ιόντα Fe3+ με ΝΗ3 ή διαλύματα ισχυρών βάσεων παρέχουν καστανέρυθρο Fe(OH)3:
Fe3+ + 3 OH−
• Tα ιόντα Fe2+ αντιδρούν με ιόντα S2− παρέχοντας μαύρο ίζημα FeS, αδιάλυτο σε
περίσσεια θειούχων, διαλυτό σε αραιά ισχυρά οξέα, ακόμη και σε διάλυμα CH3COOH:
Fe2+ +
S2−
FeS + 2H+
• Tα ιόντα Fe3+ αντιδρούν με ιόντα S2− παρέχοντας μαύρο ίζημα Fe2S3, αδιάλυτο σε
περίσσεια θειούχων, διαλυτό σε αραιά ισχυρά οξέα, ακόμη και σε διάλυμα CH3COOH, διασπώμενο όμως προς Fe2+ και S:
2Fe3+ + 3S2−
Fe2S3 + 4H+
• Τα ιόντα Fe2+ με σιδηρικυανιούχα ιόντα παρέχουν ίζημα με βαθύ κυανό χρώμα,
γνωστό ως "κυανούν του Turnbull". Τα ιόντα Fe3+ με το ίδιο αντιδραστήριο
παρέχουν μόνο μία καστανή χροιά (χαρακτηριστική διαφορά μεταξύ των Fe2+ και
Fe3+):
Fe2+ + K+ + [Fe(CN)6]3−
• Ανάλογα, τα ιόντα Fe3+ με σιδηροκυανιούχα ιόντα παρέχουν ίζημα με βαθύ κυανό
χρώμα, γνωστό ως "κυανούν του Βερολίνου". Τα ιόντα Fe2+ με το ίδιο αντιδραστήριο
παρέχουν μόνο λευκό ίζημα ή ελαφρώς γαλάζιο, λόγω της αναπόφευκτης παρουσίας μικρών ποσοτήτων
ιόντων Fe3+ στο διάλυμα των ιόντων Fe2+ (χαρακτηριστική διαφορά μεταξύ των
ιόντων Fe2+ και Fe3+):
Fe3+ + K+ + [Fe(CN)6]4−
Μελέτες έδειξαν ότι τα αναφερόμενα στην παλαιά
χημική βιβλιογραφία σύμπλοκα ως κυανούν του Turnbull, KFeII[FeIΙI(CN)6]
και ως κυανούν του Βερολίνου, KFeIΙI[FeΙI(CN)6], είναι στην ουσία η ίδια ένωση με
τύπο KFeIΙI[FeΙI(CN)6], η οποία ως σύμπλοκο
τύπου "ανταλλαγής
φορτίου" εμφανίζει εντονότατο χρώμα.
• Τα ιόντα Fe3+ παρέχουν χαρακτηριστικά έγχρωμα σύμπλοκα με βαθύ ερυθρό
(αιματέρυθρο) χρώμα με ιόντα SCN− (θειοκυανικά ιόντα): Fe3+ + nSCN−
• Τα ιόντα Fe2+ παρέχουν σύμπλοκα χαρακτηριστικού βαθέος ερυθρού χρώματος με
οργανικά συμπλεκτικά αντιδραστήρια όπως είναι η 1,10-φαινανθρολίνη (phen) και το
α,α'-διπυριδύλιο (dipy). Αντίθετα, τα ιόντα Fe3+ δεν παρέχουν σύμπλοκα
χαρακτηριστικού χρώματος (παρέχουν ένα μόλις διακρινόμενο κυανό χρώμα):
Fe2+ + 3phen
Fe2+ + 3dipy
Τυπικές αντιδράσεις
Fe(II) και
Fe(III)
1. Iόντα S2−
Fe2+ + S2−
FeS + 2H+
2Fe3+ + 3S2−
Fe2S3 + 4H+
2. Iόντα OH−
Fe2+ + 2 OH−
4Fe(OH)2 + O2 + 2H2Ο
Fe3+ + 3 OH−
3. Αμμωνία
Fe2+ + 2NH3 + 2H2O
4Fe(OH)2 + O2 + 2H2Ο
Fe3+ + 3NH3 + 3H2O
Video 03:
Αντίδραση Fe3+ με ΝΗ3.
4. Σιδηρικυανιούχα ιόντα
Fe2+ + K+ + [Fe(CN)6]3−
5.
Σιδηροκυανιούχα ιόντα
Fe3+ + K+ + [Fe(CN)6]4−
Video 04:
Αντίδραση Fe3+ με σιδηροκυανιούχα ιόντα.
6. Ιόντα SCN− Fe3+ + nSCN−
[Fe(SCN)n]3−n + 6F−
Video 05:
Αντίδραση Fe3+ με SCN− και δέσμευσή του με Fe−.
7. 1,10-φαινανθρολίνη
Fe2+ + 3phen
Video 06:
Αντίδραση Fe2+ με 1,10-φαινανθρολίνη. |