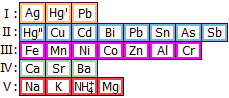 |
Χρώμιο (Cr)
|
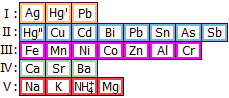 |
Χρώμιο (Cr)
|
|
• Σκληρό, αργυρόχρωμο μέταλλο με ελαφριά κυανή απόχρωση, σταθερό ως προς το οξυγόνο και το νερό. Ανακαλύφθηκε από τον N.-L. Vanquelin (Γαλλία, 1780). Η ονομασία του προέρχεται από την ελληνική λέξη "χρώμα" εξαιτίας της μεγάλης χρωματικής ποικιλίας που παρουσιάζουν τα άλατά του σε στερεή μορφή ή σε διάλυμα. • Η τοξικότητα του μετάλλου και των ανόργανων ενώσεών του είναι σημαντική. Ιδιαίτερα τοξικές θεωρούνται οι ενώσεις του Cr(VI), δηλαδή το χρωμικό οξύ και τα παράγωγά του, τα οποία επίσης θεωρούνται ως πιθανές καρκινογόνες ουσίες. • Κύριο ορυκτό από το οποίο εξάγεται το μέταλλο είναι ο χρωμίτης, FeCr2O4 [F01], όπου το χρώμιο βρίσκεται στη σταθερή του οξειδωτική κατάσταση Cr(III). Υπάρχει αριθμός σπανιότερων ορυκτών όπου το χρώμιο βρίσκεται στην οξειδωτική κατάσταση Cr(VI) και τα οποία είναι χρωμικά άλατα, με αντιπροσωπευτικότερο από αυτά τον κροκοΐτη, PbCrO4 [F02]. • Το 2021 εξορύχθηκε παγκοσμίως ποσότητα μεταλλεύματος, η οποία αντιστοιχεί σε 41 εκατομ. τόνους χρωμίου. Κυριότερες παραγωγοί χώρες: Νότια Αφρική, Καζακστάν, Ινδία. • Εφαρμογές: κράμματα με σίδηρο, όπως ο χρωμιοχάλυβας, ο οποίος με Cr μέχρι 3,5% χρησιμοποιείται στη βιομηχανία αυτοκινήτων και με Cr μέχρι 12% στην κατασκευή επιτραπέζιων σκευών και ανοξείδωτων χημικών συσκευών. Γενικά, η παρουσία Cr σε σιδηρούχα και μη κράματα προσδίδει σ' αυτά μια χημική ανθεκτικότητα έναντι της δράσης οξέων και οξειδωτικών ουσιών. Οι ενώσεις του χρησιμοποιούνται για ηλεκτρολυτικές επιμεταλλώσεις (επιχρωμιώσεις), στην παρασκευή χρωμάτων και στη βυρσοδεψία. |
|
F01. Χρωμίτης, FeCr2O4 |
F02. Κροκοΐτης, PbCrO4 |
|
Γενικές χημικές ιδιότητες των ενώσεων του Cr
Οξειδωτικές καταστάσεις • Οι σταθερές οξειδωτικές καταστάσεις του Cr σε υδατικά διαλύματα είναι η Cr(ΙΙΙ) και η Cr(VI) (ως χρωμικό ή διχρωμικό ιόν). • Επίσης υπάρχει και η οξειδωτική κατάσταση Cr(II). Τα άλατα του Cr2+ είναι ισχυρότατα αναγωγικά μέσα και σε διαλύματα οξειδώνονται ταχύτατα απορροφώντας O2 από τον αέρα.
Διαλυτοποίηση του μετάλλου • Το Cr διαλύεται αργά σε HCl ή αραιό H2SO4, με παραγωγή ιόντων Cr2+, που παρουσία O2 οξειδώνονται ταχύτατα προς τα σταθερά ιόντα Cr3+.
Cr + 2H+
4Cr2+ + O2 + 4H+ • Δεν προσβάλλεται από το ΗΝΟ3 και το π.H2SO4, διότι σχηματίζεται επιφανειακό στρώμα Cr2O3, που το προστατεύει από περαιτέρω επίδραση του οξέος. • Το Cr δεν προσβάλλεται από διαλύματα ισχυρών βάσεων.
Σταθερότητα των διαλυμάτων του • Τα διαλύματα των αλάτων του Cr(III) είναι ελαφρώς όξινα λόγω μερικής υδρόλυσης των ιόντων Cr3+ και είναι απαραίτητη η οξίνιση των διαλυμάτων του για να περιοριστεί η υδρόλυσή τους. Τα στερεά άλατα και τα διαλύματα των ιόντων Cr3+ έχουν πράσινο έως ιώδες χρώμα που εξαρτάται από το ανιόν, εφόσον μπορεί να υπεισέλθει ως υποκαταστάτης στη σφαίρα σύνταξης του κατιόντος.• Σε αλκαλικά διαλύματα σχηματίζεται αρχικά κυανοπράσινο δυσδιάλυτο Cr(OH)3, το οποίο, ως επαμφοτερίζον υδροξείδιο, διαλύεται εύκολα σε περίσσεια βάσης σχηματίζοντας το υδροξυσύμπλοκα [Cr(OH)4]− (χρωμιώδη ανιόντα):
Cr3+ + 3 OH−
Cr(OH)3 +
OH−
• Το Cr(VI) εμφανίζεται στα διαλύματα μόνο υπό τη μορφή των κίτρινων χρωμικών ιόντων, CrO42−, σε ουδέτερα ή αλκαλικά διαλύματα, ή των πορτοκαλόχρωμων διχρωμικών ιόντων, Cr2O72−, σε όξινα διαλύματα, δεδομένης της ισορροπίας:
2CrO42−
+ 2Η+
• Τα διαλύματα των ιόντων CrO42− και Cr2O72−, απουσία αναγωγικών ουσιών, είναι σταθερά. Τυπικές ενώσεις εξασθενούς χρωμίου δείχνονται παρακάτω:
Σχηματισμός συμπλόκων ιόντων
• Τα ιόντα Cr3+ σε υδατικά διαλύματα υφίστανται ως εφυδατωμένα σύμπλοκα του τύπου [Cr(H2O)6]3+, ιώδους χρώματος. • Παρουσία ιόντων Cl− υφίστανται σε ισορροπία και τα ιόντα [Cr(H2O)5Cl]2+ και [Cr(H2O)4Cl2]+, πράσινου χρώματος. H θέση ισορροπίας επομένως και το χρώμα του διαλύματος εξαρτώνται από τη θερμοκρασία (γενικά οι ισορροπίες υποκατάστασης του Cr(III) αποκαθίστανται με βραδύ ρυθμό):
[Cr(H2O)6]3+ + nCl−
• Με ισχυρές βάσεις αρχικά καθιζάνει Cr(OH)3, το οποίο ως τυπικό επαμφοτερίζον υδροξείδιο, διαλύεται σε περίσσεια ισχυρής βάσης παρέχοντας ανιοντικά σωματίδια ως το υδροξυσύμπλοκο [Cr(OH)4]− που βρίσκεται σε ισορροπία με το ανιόν, CrO2−. [V01] • Με NH3 δεν σχηματίζει σταθερά σύμπλοκα και καθιζάνει πρασινότεφρο έως κυανότεφρο ίζημα Cr(OH)3. [V02] • Τα χρωμιώδη ανιόντα [Cr(OH)4]− είναι λιγότερο σταθερά σε σχέση με τα αργιλικά ανιόντα [Al(OH)4]− και με βρασμό των διαλυμάτων τους επαναδιασπώνται προς Cr(OH)3 το οποίο επανακαθιζάνει.
[Cr(OH)4]−
Ειδικά χαρακτηριστικά • Δεν σχηματίζει θειούχο άλας με άμεση αντίδραση ιόντων Cr3+ και S2− σε υδατικά διαλύματα. Το Cr2S3 μπορεί να παρασκευαστεί με θέρμανση Cr και S στην προβλεπόμενη στοιχειομετρική αναλογία, υδρολύεται αμέσως μόλις έρθει σε επαφή με το νερό με έκλυση H2S (τα ίδια ισχύουν και για το Al2S3):
Cr2S3
+ 6H2O
'Ετσι, με επίδραση περίσσειας ιόντων S2− κατά τον διαχωρισμό των κατιόντων της ΙΙΙης ομάδας από τα κατιόντα των άλλων ομάδων, τα ιόντα Cr3+ καθιζάνουν ως Cr(OH)3 και όχι ως θειούχο άλας (ανάλογη συμπεριφορά παρουσιάζουν και τα ιόντα Al3+):
Cr3+ + 3S2−
+ 3Η2Ο
• Ιδιαίτερα χαρακτηριστική είναι η ευκολία της οξείδωσης των υδροξυσυμπλόκων του Cr(III) σε αλκαλικό διάλυμα με σχετικώς ήπια οξειδωτικά αντιδραστήρια όπως το H2O2:
2[Cr(OH)4]− + 3H2O2
+ 2 OH−
• 'Oξινα διαλύματα ιόντων Cr2O72− αντιδρούν με Η2Ο2 παρέχοντας μια βαθυκύανη υπεροξειδική ένωση με πιθανό τύπο CrO(O2)2:
Cr2O72− + 4Η2Ο2
+ 2H+
• Η ένωση CrO(O2)2 (σε παλαιότερη βιβλιογραφία συναντάται και ως H3CrO8 και αναφερόταν ως υπερχρωμικό οξύ) σε υδατικό διάλυμα είναι ασταθής και διασπάται σε λίγα δευτερόλεπτα προς ιόντα Cr3+ και Ο2:
4CrO(O2)2
+ 12H+
Η ένωση CrO(O2)2 εκχυλίζεται εύκολα από υδατικά διαλύματα με αμυλική αλκοόλη (μίγμα κ-πεντανόλης και ισοπεντανόλης, C5H11OH) ή και με άλλους οξυγονούχους οργανικούς διαλύτες (π.χ. διαιθυλαιθέρα), χρωματίζοντας βαθυκύανη τη στιβάδα του οργανικού διαλύτη, όπου παραμένει σταθερή για πολύ μεγαλύτερο χρονικό διάστημα. [V04] • Η ως άνω σειρά αντιδράσεων αξιοποιείται στη δοκιμασία, γνωστή ως δοκιμασία υπερχρωμικού οξέος. Η δοκιμασία αυτή είναι εξαιρετικά ευαίσθητη και εκλεκτική δοκιμασία, τόσο για την ανίχνευση μικρών συγκεντρώσεων Cr(VI), όσο και H2O2.
Τυπικές αντιδράσεις Cr3+
1. Ιόντα S2−
Cr3+ + 3S2− + 3Η2Ο
2. Iόντα OH−
Cr3+ + 3 OH−
Cr(OH)3 +
OH−
3. Αμμωνία
Cr3+ + 3NH3 + 3Η2Ο
Video 02:
Αντίδραση Cr3+ με NH3.
2[Cr(OH)4]− + 3H2O2
+ 2 OH−
2CrO42−
+ 2Η+
Video 03:
Αντίδραση Cr(OH)4- με Η2Ο2 και στη συνέχεια οξίνιση.
5. Δοκιμασία
υπερχρωμικού οξέος
Cr2O72− + 4Η2Ο2
+ 2H+
4CrO(O2)2 + 12H+
CrO(O2)2 (ασταθές στο H2O)
|