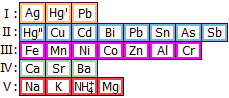 |
Κοβάλτιο (Co)
|
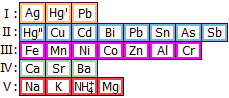 |
Κοβάλτιο (Co)
|
|
Γενικά για το Co • Σκληρό, αργυρόχρωμο μέταλλο με ελαφρά κυανή απόχρωση. Μαγνητικό μέταλλο, σταθερό στον αέρα, δεν προσβάλλεται από το νερό. Απομονώθηκε από τον N. - L. Vanquelin (Γαλλία, 1780). Ονομασία γερμανικής προέλευσης: "kobald": κακό δαιμόνιο των ορυχείων. Η ονομασία αυτή είχε αποδοθεί στα ορυκτά του από τους μεταλλωρύχους, επειδή η ανεύρεσή τους εκλαμβανόταν σαν κακοτυχία, γιατί είχε συνδεθεί με ατυχήματα στα ορυχεία. • Η τοξικότητα του μετάλλου και των ανόργανων ενώσεών του είναι σχετικά μικρή. • Σπουδαιότερα ορυκτά του είναι ο κοβαλτίτης, CoAsS [ F01] και ο σμαλτίτης (ή σκουττερουδίτης), (Co,Ni,Fe)As3 [F02].• Το 2021 εξορύχθηκε παγκοσμίως ποσότητα μεταλλεύματος, η οποία αντιστοιχεί σε 170 χιλ. τόνους κοβαλτίου. Κυριότερες παραγωγοί χώρες: Κογκό, Ζάμπια, Καναδάς, Αυστραλία, Ρωσία, Κούβα. Κοβάλτιο χρησιμοποιείται κυρίως στην παραγωγή κραμάτων και στις επικοβαλτιώσεις σιδηρών αντικειμένων. Τα κράματά του χαρακτηρίζονται από μεγάλη σκληρότητα και ανθεκτικότητα έναντι των χημικών αντιδραστηρίων. Χρησιμοποιείται στην κατασκευή μόνιμων μαγνητών. Το κράμα που είναι γνωστό ως Alnico (8-12% Al, 15-26% Ni, 5-24% Co, μέχρι 6% Cu και 1% Ti, το υπόλοιπο είναι Fe) χρησιμοποιείται για την κατασκευή ισχυρών μόνιμων μαγνητών, που είναι έως και 25 φορές ισχυρότεροι από τους μαγνήτες από χάλυβα. Ενώσεις του κοβαλτίου χρησιμοποιούνται στην κατασκευή μπαταριών ιόντων λιθίου, στην κεραμοποιία και υαλουργία (περίφημη είναι η ύαλος κοβαλτίου [F03]), στην παρασκευή χρωμάτων και ως καταλύτες.
Οξειδωτικές καταστάσεις
• Η σταθερότερη οξειδωτική κατάσταση του Co σε υδατικά διαλύματα είναι η Co(II).
Διαλυτοποίηση του μετάλλου • To Co διαλύεται αργά σε θερμό-αραιό HCl ή Η2SO4:
Co + 2H+
• Διαλύεται ταχύτερα σε αραιό HNO3, ενώ δεν προσβάλλεται από το π.ΗΝΟ3:
3Co + 8H+ + 2NO3−
• Το Co δεν προσβάλλεται από διαλύματα ισχυρών βάσεων.
Σταθερότητα των διαλυμάτων του • Τα διαλύματα των αλάτων του Co(II) είναι σταθερά. Ελαφριά οξίνιση είναι απαραίτητη για να αποφευχθεί η έστω και περιορισμένη υδρόλυσή τους. Τα άλατα και τα διαλύματα των ιόντων Co2+ εμφανίζουν ένα ρόδινο χρώμα.
Σχηματισμός συμπλόκων ιόντων • Τα ιόντα Co2+ με NH3 παρέχουν δυσδιάλυτα βασικά άλατα που διαλύονται σε περίσσεια NH3 με σχηματισμό αμμωνιοσυμπλόκων:
Co2+ + NO3− + NH3 + H2O
Co(OH)NO3 + 6NH3
τα οποία οξειδώνονται από το Ο2 του αέρα ή ταχύτερα με προσθήκη H2O2 προς αμμωνιοσύμπλοκα του Co(III). Το χρώμα του προκύπτοντος διαλύματος μπορεί να ποικίλει ανάλογα με τον τύπο του σχηματιζόμενου συμπλόκου, π.χ. διαλύματα του συμπλόκου [Co(NH3)5H2O]3+ και [Co(NH3)6]3+ έχουν ρόδινο και κίτρινο χρώμα, αντίστοιχα:
2[Co(NH3)6]2+ + 2H+ +
H2O2
• Τα ιόντα Co2+ με αλογονοϊόντα (κυρίως Cl−, Br−) ως και με θειοκυανικά ιόντα παρέχουν ανιοντικά σύμπλοκα του τύπου [CoX4]2-. • Τα ιόντα Co2+ δεν παρέχουν υδροξυσύμπλοκα με περίσσεια ισχυρών βάσεων.
Ειδικά χαρακτηριστικά • Τα ιόντα Co2+ με ιόντα S2− παρέχουν μαύρο ίζημα CoS (α-CoS), το οποίο μόνο εάν είναι τελείως πρόσφατο επαναδιαλύεται σε περίσσεια ισχυρού οξέος. Για τον λόγο αυτό το CoS δεν καθιζάνει από όξινα διαλύματα. 'Ιζημα CoS που έχει υποστεί παλαίωση διαλύεται πολύ δυσκολότερα λόγω μετατροπής του στην πολυμερούς χαρακτήρα β-μορφή (β-CoS). Ανάλογη συμπεριφορά παρουσιάζει και το NiS και ιδιότητα αυτή των θειούχων ενώσεών τους μπορεί να αξιοποιηθεί για το διαχωρισμό των Co και Ni από τα άλλα κατιόντα της ΙΙΙης ομάδας:
Co2+ + S2−
α-CoS
α-CoS + 2H+
β-CoS + 2H+
• Ενώ τα ιόντα Co2+, που στην πραγματικότητα είναι εφυδατωμένα ιόντα, [Co(H2O)6]2+, με οκταεδρική διάταξη των μορίων Η2Ο έχουν ρόδινο χρώμα, τα σύμπλοκα του τύπου [CoX4]2−, με τετραεδρική διάταξη των υποκαταστατών Χ, έχουν βαθυκύανο χρώμα. 'Ετσι, περίσσεια HCl σε διάλυμα Co2+ έχει ως αποτέλεσμα τον κυανό χρωματισμό του, ενώ αραίωσή του έχει ως αποτέλεσμα την επαναφορά του ρόδινου χρώματος:
προσθήκη περίσσειας HCl: [Co(H2O)6]2+ + 4Cl−
αραίωση με Η2Ο: [CoCl4]2− + 6H2O
• Η προηγούμενη ιδιότητα των ιόντων Co2+ επιτρέπει την ανίχνευσή του παρουσία Fe3+, που βασίζεται σε αντίδραση με περίσσεια NH4SCN με εμφάνιση του βαθυκύανου χρώματος των ιόντων [Co(SCN)4]2−. Για να αποφευχθεί η επικάλυψη του χρώματος από το επίσης έντονο, αλλά αιματέρυθρο χρώμα των ιόντων [Fe(SCN)6]3−, η αντίδραση πραγματοποιείται παρουσία περίσσειας F- τα οποία δεσμεύουν τον Fe3+ προς σταθερά φθοριοσύμπλοκα:
Fe3+ + 6F−
[Co(H2O)6]2+ + 4SCN−
Τυπικές αντιδράσεις Co 1. Iόντα S2− Co2+ + S2−
Video 01:
Αντίδραση Co2+ με S2−.
2. Iόντα OH−
Co2+ + 2 OH−
Video 02:
Αντίδραση Co2+ με OH−. 3. Αμμωνία
Co2+ +
NO3− + NH3 + H2O
Co(OH)NO3 + 6NH3
2[Co(NH3)6]2+ + 2H+ +
H2O2
Video 03:
Αντίδραση Co2+ με NH3.
4.
Cl−
[Co(H2O)6]2+ + 4Cl−
[CoCl4]2− + 6H2O
Video 04:
Αντίδραση Co2+ με περίσσεια Cl−. 5. SCN−
Co2+ + 4SCN−
Video 05:
Αντίδραση Co2+ με περίσσεια SCN−.
6. Διαφοροποίηση Co2+/ Fe3+
Co2+ + 4SCN−
Fe3+ + 6F−
[FeF6]3− + SCN−
7. Διμεθυλογλυοξίμη Co2+ + 2dmgH2 + 2NH3
Η διμεθυλογλυοξίμη είναι ένα από τα κλασικά οργανικά
αντιδραστήρια με εξαιρετική εκλεκτικότητα προς τα ιόντα Ni2+. Τα ιόντα Co2+ σε ελαφρά αμμωνιακό περιβάλλον με διμεθυλογλυοξίμη (dmgH2)
παρέχουν καστανόχρωμο διάλυμα συμπλόκου Co(dmgH)2, σε αντίθεση με τα ιόντα Ni2+
που παρέχουν έντονα ερυθρό ίζημα.
Video 07:
Διαφοροποίηση Co2+ με διμεθυλογλυοξίμη.
|
|||||||||