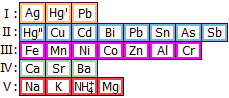 |
Κασσίτερος (Sn)
|
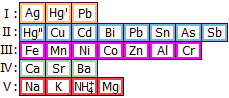 |
Κασσίτερος (Sn)
|
|
Γενικά για τον Sn • Mαλακό, αργυρόλευκο μέταλλο, σταθερό ως προς το οξυγόνο και το νερό. Κάτω από τους 13,2οC, η συνηθισμένη β-αλλοτροπική μορφή του μετάλλου (β-Sn) μετατρέπεται αργά σε σκόνη (α-αλλοτροπική μορφή, α-Sn). To φαινόμενο είναι γνωστό ως "λέπρα κασσιτέρου" (tin pest), γεγονός που οδηγεί σε σταδιακή κονιοποίηση κάθε είδους από καθαρό κασσίτερο σε χαμηλές θερμοκρασίες. • Γνωστό μέταλλο ήδη από την αρχαιότητα (παραγόταν κυρίως στις Βρετανικές νήσους, τότε γνωστές ως "Κασσιτερίδαι νήσοι") και ιδιαίτερα πολύτιμο για την παρασκευή μπρούντζου (κράμα Cu με 5-10% Sn, συχνά συγχέεται το κράμα αυτό με τον "ορείχαλκο" που είναι κράμα Cu-Zn). Με τον μπρούντζο (όπως και με τον ορείχαλκο) κατασκευάζονταν σκληρότερα και ανθεκτικότερα εργαλεία και όπλα σε σχέση με εκείνα από καθαρό χαλκό. Σύμβολο από τη λατινική ονομασία του μετάλλου: stannum. • Διαλύεται εύκολα σε υδροχλωρικό οξύ με έκλυση H2 [V01]. • Η τοξικότητα του μετάλλου και ορισμένων ανόργανων ενώσεών του είναι μικρή. • Το κυριότερο ορυκτό του κασσιτέρου είναι ο κασσιτερίτης, SnO2 [F01], αλλά σχηματίζει και πολλά μικτά θειούχα ορυκτά όπως ο σταννίτης, Cu2FeSnS4 [F02]. • Το 2021 εξορύχθηκε παγκοσμίως ποσότητα μεταλλεύματος, που αντιστοιχεί σε 300 χιλ. τόνους κασσιτέρου. Κυριότερες παραγωγοί χώρες: Κίνα, Ινδονησία, Περού, Βολιβία και Βραζιλία. • Εφαρμογές: εύτηκτα κράματα, επιμεταλλώσεις, οργανοκασσιτερικές ενώσεις όπως σταθεροποιητικά πρόσθετα πολυμερών, υφαλοχρώματα (η χρήση αυτή έχει πλέον απαγορευθεί).
Οξειδωτικές καταστάσεις • Ο Sn στις ενώσεις του εμφανίζεται με δύο εξίσου σταθερές οξειδωτικές καταστάσεις: ως Sn(II) και ως Sn(IV). • Τα άλατα του Sn(II) είναι αρκετά ισχυρά αναγωγικά μέσα, ενώ του Sn(IV) είναι ασθενή οξειδωτικά μέσα.
• Tα άλατα του Sn(II) έχουν κυρίως ετεροπολικό χαρακτήρα, ενώ του Sn(IV) έχουν
ουσιαστικά ομοιοπολικό χαρακτήρα, έτσι ενώ ο SnCl2 είναι ένυδρο κρυσταλλικό
στερεό (SnCl2·2H2O), ο SnCl4
είναι υγρό σ.ζ. 114οC,
το οποίο ατμίζει έντονα στον αέρα λόγω υδρόλυσης προς
ένυδρα SnO2 από την υγρασία της
ατμόσφαιρας, γνωστό από τους αλχημιστικούς χρόνους ως Liquor
Libavii fumansis (Andreas Libavius, Γερμανός
αλχημιστής
του 16ου αιώνα). Διαλυτοποίηση του μετάλλου • Ο Sn διαλύεται αργά σε αραιό HCl και H2SO4 και ταχύτερα στα θερμά πυκνά οξέα:
Sn + 2H+
Sn + 3H2SO4
Video 01: Διαλυτοποίηση Sn σε HCl
• Διαλύεται αργά σε αραιό ΗΝΟ3, ενώ με πυκνό-θερμό HNO3 αντιδρά ταχύτατα μετατρεπόμενος σε λευκό δυσδιάλυτο ίζημα μετακασσιτερικού οξέος, H2SnO3:
Σε αραιό ΗΝΟ3: 4Sn + 2NO3− + 10 H+
Σε πυκνό-θερμό ΗΝΟ3: 3Sn + 4NO3− + 4H+
• Επίσης διαλύεται σε βασιλικό ύδωρ (3 όγκοι π.ΗCl + 1 όγκος π.ΗΝΟ3):
3Sn + 4NO3−
+
16H+ + 18Cl−
• Ο Sn διαλύεται σε διαλύματα ισχυρών βάσεων, με σχηματισμό κασσιτερωδών ανιόντων, [Sn(OH)4]2−:
Sn + 2 OH− + 2H2O
Σταθερότητα των διαλυμάτων του • Τα διαλύματα των ενώσεων του Sn είναι σταθερά σε ισχυρώς όξινα ή ισχυρώς αλκαλικά διαλύματα. Τα διαλύματα του SnCl2 είναι σταθερά μόνο σε ισχυρώς όξινα (με HCl) διαλύματα. Αραίωση των διαλυμάτων αυτών με ύδωρ έχει ως αποτέλεσμα την υδρόλυση του SnCl2 και σχηματισμό δυσδιάλυτου βασικού άλατος: Sn2+ + Cl− + H2O
• Το ίδιο ισχύει και για τον SnCl4, που αντιδρά έντονα με το νερό εκλύοντας HCl και παρέχοντας εφυδατωμένο οξείδιο του Sn(IV): SnCl4 + (x+2)H2O
ενώ διαλύεται σε πυκνό HCl, σταθεροποιούμενο υπό μορφή χλωριοσυμπλόκου: SnCl4 + 2HCl
• Tα διαλύματα του SnCl2 σε HCl οξειδώνονται προς [SnCl6]2− από το ατμοσφαιρικό οξυγόνο: 2Sn2+ + 12Cl− + O2 + 4H+ και επομένως είναι σχεδόν αδύνατον να παρασκευαστούν διαλύματα αλάτων Sn(II), που να μην περιέχουν έστω και σε μικρή αναλογία Sn(IV). Για να αποφευχθεί ο η συσσώρευση Sn(IV) (και εφόσον δεν ενδιαφέρει τόσο η σταθερότητα του διαλύματος σε συγκέντρωση του Sn(II)), συνήθως προστίθενται στις φιάλες φύλλα μεταλλικού Sn, που βοηθούν σε κάποιο βαθμό την εκ νέου αναγωγή του Sn(IV) προς Sn(II):
[SnCl6]2− + Sn
• Το Sn(OH)2 είναι τυπικό επαμφοτερίζον υδροξείδιο (ανάλογο του Pb(OH)2) και διαλύεται σε ισχυρές βάσεις παρέχοντας κασσιτερώδη ανιόντα:
Sn(OH)2 + 2OH− • Σε αλκαλικά διαλύματα τα κασσιτερώδη ανιόντα είναι ασταθή: Οξειδώνονται εύκολα από το O2 του αέρα προς κασσιτερικά ανιόντα, όπως επίσης υφίστανται και βραδεία αυτοξειδοαναγωγή:
2[Sn(OH)4]2−
+ Ο2
+ 2Η2Ο
2[Sn(OH)4]2−
Σχηματισμός συμπλόκων ιόντων • Τόσο o Sn(II), όσο και o Sn(IV) σχηματίζουν σχετικώς σταθερά υδροξυσύμπλοκα (κασσιτερώδη και κασσιτερικά ανιόντα, αντίστοιχα). • Το καστανόχρωμο θειούχο άλας του Sn(II), δεν διαλύεται σε αλκαλικό διάλυμα θειούχων S2−, αλλά διαλύεται σε αλκαλικό διάλυμα πολυθειούχων ιόντων οξειδούμενο προς θειοκασσιτερικά ιόντα, [SnS3]2−:
SnS + [Sx]2−
Τα πολυθειούχα ιόντα παρασκευάζονται με θέρμανση διαλύματος θειούχων ιόντων, S2−, με στοιχειακό S και δρουν ως ήπια οξειδωτικά ιόντα:
(x−1)S
+ S2−
Διαλύματα πολυθειούχων παρασκευάζονται επίσης με διάλυση στοιχειακού θείου σε πυκνά-θερμά διαλύματα ισχυρών βάσεων:
(2x+2)S + 6 ΟΗ−
Το προκύπτον διάλυμα (γνωστό ως ήπαρ θείου) έχει ένα κίτρινο έως πορτοκαλί χρώμα, χαρακτηρίζεται από μια δυσώδη οσμή και παλαιότερα χρησιμοποιούταν ως αποτριχωτικό. • Τα θειοκασσιτερικά ιόντα διασπώνται με οξίνιση του διαλύματός τους προς κίτρινο SnS2, το οποίο παλαιότερα χρησιμοποιούταν ως χρυσαφένια βαφή (μωσαϊκός χρυσός, mosaic gold):
[SnS3]2− + 2H+
• Ο Sn(IV) παρέχει σταθερά σύμπλοκα με οξαλικά ιόντα, [Sn(C2O4)3]2−. 'Ετσι, παρουσία περίσσειας οξαλικών ιόντων δεν πραγματοποιείται η προηγούμενη αντίδραση (διάκριση από αντίστοιχη αντίδραση των θειοσυμπλόκων του Sb).
Ειδικά χαρακτηριστικά • Ο Sn(II) τόσο σε όξινο, όσο και σε αλκαλικό περιβάλλον δρα ως ισχυρό αναγωγικό αντιδραστήριο, παρέχοντας πολλές χαρακτηριστικές αντιδράσεις, π.χ.:
σε όξινο διάλυμα: Sn2+ + 2Hg2+ + 6Cl−
Hg2Cl2 + Sn2+ + 2Cl−
Video 02: Αντίδραση Hg2+_με Sn(II)
σε αλκαλικό διάλυμα: 2Bi(OH)3 + 3[Sn(OH)4]2−
Video 03: Αντίδραση αναγωγής Bi3+με Sn(ΙΙ)
• Χαρακτηριστική ιδιότητα του Sn(IV), που τον διακρίνει από το Sb(III), είναι το ότι σχηματίζει σταθερά σύμπλοκα με οξαλικά ιόντα.
Τυπικές αντιδράσεις Sn(II)
και Sn(IV) 1. 'Υδωρ
Sn2+ + Cl− + H2O
Sn(OH)Cl + H2O
Sn(OH)2
SnCl4 + (x+2)H2O
SnCl4 + 2Cl−
2. Ιόντα S2− Sn2+ + S2−
SnS + 2H+
SnS + [Sx]2−
Video 04: Αντίδραση Sn2+ με S2− και διαλυτοποίηση SnS με HCl
3. Ιόντα OH−
Sn2+ + 2 OH−
Sn(ΟΗ)2 + 2 OH−
4. Αναγωγικά μέσα Αναγωγή με Fe και Zn:
[SnCl6]2− + Fe
[SnCl6]2− + 2Zn
Video 05: Αναγωγή Sn2+ με μεταλλικό Zn
|