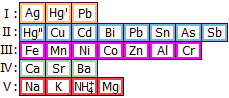 |
Βισμούθιο (Bi)
|
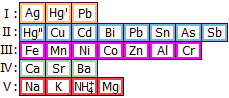 |
Βισμούθιο (Bi)
|
|
Γενικά για το Bi
• Σχετικά μαλακό, εύθραστο μέταλλο, αστραφτερό με ελαφρά ροδίζουσα απόχρωση. Γνωστό ήδη από τον 15ο αιώνα. Συχνά συγχεόταν με τον μόλυβδο και τον κασσίτερο. Ο C. Geoffroy έδειξε ότι είναι διαφορετικό μέταλλο από τον μόλυβδο το 1753. Βρίσκεται σε μικρές ποσότητες στα ορυκτά του μολύβδου. Oνομασία γερμανικής προέλευσης: "weisse masse": λευκή μάζα. • Διαλύεται εύκολα σε αραιό (1:1) νιτρικό οξύ [V01]. • Αν και "βαρύ" μέταλλο η τοξικότητά του είναι παραδόξως μικρή. • Είναι το περισσότερο διαμαγνητικό μέταλλο, όπως επίσης και το μέταλλο με τη μικρότερη θερμική αγωγιμότητα. • Κύρια δικά του ορυκτά: βισμίτης, Bi2O3 [F01], βισμουθινίτης, Bi2S3 [F02], βισμουθίτης, (BiO)2CO3 [F03], σπάνια βρίσκεται και σε ελεύθερη μεταλλική μορφή [F04]. • Το 2021 εξορύχθηκε παγκοσμίως ποσότητα μεταλλεύματος, η οποία αντιστοιχεί σε 19 χιλ. τόνους βισμουθίου, κυρίως ως παραπροϊόν της παραγωγής χαλκού, μολύβδου, κασσιτέρου, αργύρου και χρυσού. Κυριότερες παραγωγοί χώρες: Κίνα, Περού, Ιαπωνία, Μεξικό, Βολιβία, Καναδάς. • Εφαρμογές: εύτηκτα κράματα (τυπικό παράδειγμα αποτελεί το κράμα Wood: 50% Bi, 27% Pb, 13% Sn και Cd 10% , το οποίο έχει σ.τ. 70οC) φαρμακευτικά προϊόντα (π.χ. όπως BiONO3, (BiO)2CO3), καλλυντικά (ως BiOCl), ηλεκτρονικά, καταλύτες (παραγωγή ακρυλικών νημάτων) και χρώματα. Λόγω του χαμηλού σημείου τήξης και της ιδιότητάς του να διαστέλλεται κατά 3,3% κατά την πήξη, έχει χρησιμοποιηθεί και στην παραγωγή εκμαγείων υλικών ευαίσθητων σε υψηλότερες θερμοκρασίες. Έχει αρχίσει να αντικαθιστά τον τοξικό μόλυβδο στις διάφορες εφαρμογές και κράματά του με χαρακτηριστικά παραδείγματα τα κυνηγετικά σκάγια και τα βαρίδια ψαρέματος από βισμούθιο.
Οξειδωτικές καταστάσεις • H μόνη σταθερή οξειδωτική κατάσταση του Bi σε υδατικά διαλύματα είναι η Bi(III). Οι ενώσεις του Bi(V) είναι ισχυρότατα οξειδωτικά μέσα και είναι σταθερές μόνο σε στερεή κατάσταση, με τυπικό παράδειγμα το βισμουθικό νάτριο (NaBiO3), ένωση ικανή να οξειδώσει ακόμη και σε ψυχρό διάλυμα το Mn2+ προς MnO4-.
2Mn2+ + 5NaBiO3 + 14H+
Video 0 1: Αντίδραση Mn2+ με NaBiO3
Διαλυτοποίηση του μετάλλου • Το Bi διαλυτοποιείται μόνο σε οξειδωτικά οξέα (HNO3, πυκνό-θερμό H2SO4), π.χ.
Bi + NO3−
+ 4H+
Bi + 3NO 3− + 6H+2Bi + 9H2SO4Video 02: Διαλυτοποίηση Bi σε HNO3
Σταθερότητα των διαλυμάτων του • Το Bi παραμένει ως Bi3+ μόνο σε ισχυρώς όξινα διαλύματα ή ως σύμπλοκο παρουσία αλογονοϊόντων, π.χ. ως [BiCl6]3−. Αραίωση των διαλυμάτων αυτών έχει ως αποτέλεσμα την υδρόλυση του Bi3+ προς BiO+ (βισμουθύλιο)
Bi3+
+ H2O
του οποίου τα άλατα είναι δυσδιάλυτα και καθιζάνουν, π.χ.
Bi3+ + Cl−
+ H2O
Bi3+ + NO3− + H2O
• Σε αλκαλικά διαλύματα σχηματίζεται δυσδιάλυτο Bi(OH)3, το οποίο παραμένει
αδιάλυτο σε περίσσεια ισχυρής βάσης. Σχηματισμός συμπλόκων ιόντων • Το Bi(III) δεν σχηματίζει σύμπλοκα με κοινά συμπλεκτικά αντιδραστήρια όπως η NH3 και τα CN−. • Σχηματίζει σύμπλοκα με αλογονοϊόντα εκ των οποίων το πλέον χαρακτηριστικό είναι το [BiI4]−, πορτοκαλοκίτρινου χρώματος που χρησιμεύει και στην ανίχνευση του Bi. Τα σύμπλοκα αυτά δεν είναι ιδιαιτέρως σταθερά και διασπώνται εύκολα με αραίωση των διαλυμάτων τους, π.χ.
[BiI4]− + H2O
Ειδικά χαρακτηριστικά
• Το Bi(III) ανάγεται εύκολα προς μεταλλικό Bi τόσο σε όξινα, όσο και
σε αλκαλικά διαλύματα. Χαρακτηριστική αναγωγή πραγματοποιείται σε
αλκαλικό διάλυμα με κασσιτερώδη ιόντα με σχηματισμό μαύρου Bi
(σε λεπτό διαμερισμό):
Τυπικές αντιδράσεις
Bi
1. Ύδωρ
Bi3+ + NO3− + H2O
2. Iόντα S2−
2Bi3+ + 3S2−
Video 03: Αντίδραση Bi3+ με S2−
3. Ιόντα OH-
Bi3+ + 3 OH−
4. Αμμωνία
Βι3+ + 2NH3 + 2Η2Ο + ΝΟ3−
Video 04: Αντίδραση Bi3+ με ΟΗ−
5. Ιόντα Ι−
Bi3+ + 3I−
BiI3 + I−
[BiI4]− + H2O
Video 05: Αντίδραση Bi3+ με Ι−
6. Ιόντα CrO42-
2Bi3+ + CrO42− + 2H2O
Video 06: Αντίδραση Bi3+ με CrO42−
7. Αναγωγικά μέσα
2Bi3+ + 3Zn
Bi3+ + 3 OH−
Sn2+ + 2 OH−
Sn(OH)2
+ 2 OH−
2Bi(OH)3 + 3[Sn(OH)4]2−
Video 07: Αντίδραση αναγωγής Bi3+με Sn(ΙΙ)
|