Η χημική ένωση του μήνα
[Ιανουάριος 2008]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής - Κωνσταντίνος Ευσταθίου, Καθηγητής
|
Φυσικoχημικές ιδιότητες: Εμφάνιση: υγρό με πολύ ανοικτό κυανό χρώμα (όταν είναι καθαρό και σε μεγάλα στρώματα), άοσμο, με κάπως πικρή γεύση (σε διάλ. 3%). Μοριακός τύπος: Η2O2 Σχετική μοριακή μάζα: 34,015 Ειδικό βάρος: 1,44 g/cm3 (ως υγρό, στους 25οC), 1,64 g/cm3 (ως στερεό, στους -4,5οC) Σημείο τήξης: -0,43οC Σημείο βρασμού*: 150,2οC Διαλυτότητα: Αναμίξιμο με το νερό σε οποιαδήποτε αναλογία. Διάσταση: Ασθενέστατο οξύ (pKa = 11,35) Ιξώδες: 1,245 cP (στους 25οC) Διπολική ροπή: 2,26 D *Με προεκβολή των σ.β. σε χαμηλότερες πιέσεις στην πίεση των 760 mm Hg (δεδομένα από την [Αναφ. 1, 2]) |
|
|
Υπεροξείδιο του υδρογόνου Hydrogen peroxide |
"Η πιο φιλική στο περιβάλλον οξειδωτική ουσία μετά το οξυγόνο του αέρα"
|
Louis Jacques Thénard (1777-1857) |
Ιστορία - σύνθεση του υπεροξειδίου του υδρογόνου
Το υπεροξείδιο του υδρογόνου (Η2Ο2) παρασκευάστηκε σχεδόν σε καθαρή κατάσταση το 1818 από τον Γάλλο χημικό Louis Jacques Thénard με αντίδραση υπεροξειδίου του βαρίου (BaO2) με νιτρικό οξύ. Στη συνέχεια ο Thénard βελτίωσε τη μέθοδο αντικαθιστώντας το νιτρικό οξύ με υδροχλωρικό οξύ και τελικά με θειϊκό οξύ.
![]()
Το θειϊκό οξύ πλεονεκτεί έναντι των άλλων οξέων, λόγω της εύκολης απομάκρυνσης του αδιάλυτου BaSO4. Το BaO2 παρασκευάζεται σχετικά εύκολα με θέρμανση του οξειδίου του βαρίου (βαρία, BaO) στον αέρα στους 500oC. Η μέθοδος Thénard χρησιμοποιήθηκε κατά το 19ο αιώνα και μέχρι τα μέσα του 20ου [Αναφ. 1, 2].
Ο Thénard διαπίστωσε ότι το Η2Ο2 διασπάται εκλύοντας οξυγόνο και το ονόμασε οξυγονούχο ύδωρ (eau oxygénée). Η ονομασία αυτή (οξυζενέ) χρησιμοποιείται και σήμερα και περιγράφει το αραιό υδατικό του διάλυμα (3%), που διατίθεται ελεύθερα στα φαρμακεία ως ήπιο αντισηπτικό.
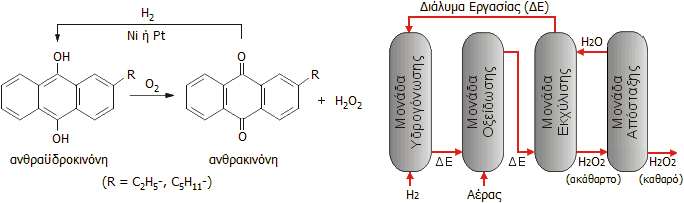
Η σύγχρονη μέθοδος παρασκευής του Η2Ο2 σε βιομηχανική κλίμακα βασίζεται σε συνεχείς κύκλους αναγωγής (με υδρογόνωση) αλκυλιωμένου παραγώγου της ανθρακινόνης προς την αντίστοιχη ανθραϋδροκινόνη και οξείδωση της τελευταίας (με το οξυγόνο του αέρα) πάλι προς ανθρακινόνη με σύγχρονη παραγωγή Η2Ο2. Επομένως, οι πρώτες ύλες είναι το υδρογόνο και ο αέρας, αφού η αλκυλιωμένη ανθρακινόνη δρα ως μόριο-διαμεσολαβητής και ουσιαστικά δεν καταναλίσκεται κατά την αντίδραση.
|
|
|
Αριστερά: Αντίδραση παραγωγής Η2Ο2 μέσω συνεχών κύκλων αναγωγής αλκυλιωμένου παραγώγου ανθρακινόνης προς την αντίστοιχη ανθραϋδροκινόνη και επανοξείδωσης της τελευταίας προς την αρχική ένωση. Δεξιά: Σχηματική παράσταση βιομηχανικής μονάδας παραγωγής που βασίζεται στον προηγούμενο κύκλο. ΔΕ (Διάλυμα Εργασίας): Διάλυμα της αλκυλιωμένης ανθρακινόνης σε μίγμα οργανικών διαλυτών. |
Σε συνοπτική μορφή, η αλληλουχία των αντιδράσεων και η σχηματική παράσταση μιας βιομηχανικής μονάδας συνεχούς παραγωγής Η2Ο2 δείχνονται στο παραπλεύρως σχήμα.
Το αναφερόμενο ως διάλυμα εργασίας (working solution) είναι το διάλυμα της αλκυλιωμένης ανθρακινόνης σε ένα μίγμα οργανικών διαλυτών. Στο διάλυμα εργασίας (ΔΕ) πραγματοποιείται ο κύκλος των αντιδράσεων στις μονάδες υδρογόνωσης και οξείδωσης. Στη μονάδα εκχύλισης το ΔΕ εκχυλίζεται με νερό που παραλαμβάνει το Η2Ο2 ως υδατικό διάλυμα και και το ΔΕ επιστρέφει στη μονάδα υδρογόνωσης.
Το αλκύλιο (R: αιθύλιο ή πεντύλιο) της ανθρακινόνης αυξάνει τη λιποφιλικότητά της και επομένως τη διατήρησή της στο ανακυκλούμενο ΔΕ. Το μίγμα των οργανικών διαλυτών πρέπει να είναι αδιάλυτο στο νερό και να αποτελείται από μίγμα διαλυτών χαμηλής πολικότητας (βενζόλιο, αλκυλοβενζόλια) και υψηλής πολικότητα (αλκοόλες). 'Ετσι διευκολύνεται η παραμονή στην οργανική φάση (δηλ. στο ΔΕ) τόσο του ελάχιστα πολικού παραγώγου της ανθρακινόνης, όσο και του πολικού παραγώγου της ανθραϋδροκινόνης [Αναφ. 3, 4].
Από τη μονάδα εκχύλισης το Η2Ο2 εξέρχεται ως ακάθαρτο υδατικό διάλυμα (15-35% w/w). Αυτό εισάγεται στη μονάδα απόσταξης όπου υφίσταται καθαρισμό και περαιτέρω συμπύκνωση με τελικό προϊόν υδατικό διάλυμα Η2Ο2 (50-70% w/w).
'Αλλοι τρόποι βιομηχανικής σύνθεσης του υπεροξειδίου του υδρογόνου, δευτερεύουσας όμως σημασίας, βασίζονται στην αυτοκαταλυτική οξείδωση της ισοπροπανόλης προς ακετόνη:
![]()
όπως και στην ηλεκτρολυτική οξείδωση αραιών διαλυμάτων θειικού οξέος ή όξινου θειικού αμμωνίου:
![]()
|
(α) |
(β) |
(γ) |
|
(α) Δεξαμενές αποθήκευσης πυκνού (50%) διαλύματος Η2Ο2. (β) Βυτία μεταφοράς Η2Ο2 σε βαγόνια σιδηροδρόμου. (γ) Διαδικασία μετάγγισης Η2Ο2 από βυτίο μεταφοράς. Το προσωπικό πρέπει να είναι πλήρως καλυμμένο με στολή από PVC [Αναφ. 5, 6]. |
||
Φυσικές και χημικές ιδιότητες του υπεροξειδίου του υδρογόνου
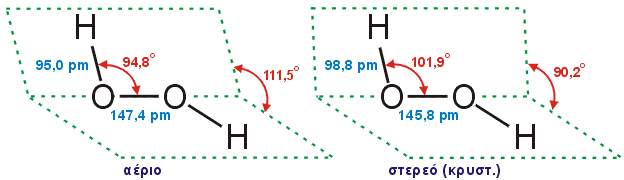
Το μόριο του Η2Ο2 έχει διεδρική διαμόρφωση με γωνία 111,5ο σε αέρια φάση και 90,2ο σε στερεή φάση. Η γωνία αυτή είναι αποτέλεσμα της άπωσης μεταξύ των ζευγών ηλεκτρονίων των ομάδων -ΟΗ. Ενδιάμεσες γωνίες εμφανίζονται σε υδατικά διαλύματα με τιμή που επηρεάζεται από δεσμούς υδρογόνου και εξαρτάται από την περιεκτικότητα και την παρουσία άλλων ουσιών [Αναφ. 2].
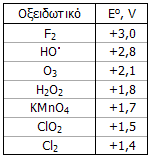
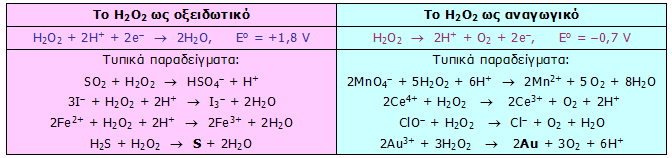
Το Η2Ο2 είναι ισχυρότατο οξειδωτικό αντιδραστήριο, ισχυρότερο και από το χλώριο (Cl2), το διοξείδιο του χλωρίου (ClO2) και τα υπερμαγγανικά ανιόντα (MnO4-). Στον Πίνακα 1 δείχνονται συγκριτικά τα αντίστοιχα κανονικά δυναμικά. Ωστόσο, είναι χαρακτηριστικό το ότι το Η2Ο2 δρα και ως ήπιο αναγωγικό μέσον, τόσο σε όξινα, όσο και σε αλκαλικά διαλύματα (με έκλυση πάντοτε Ο2). Οι χαρακτηριστικές ημιαντιδράσεις του Η2Ο2 και τυπικά παραδείγματα αντιδράσεων οξειδώσεων και αναγωγών με το Η2Ο2 δείχνονται στον Πίνακα 2.
Ως οξειδωτική ουσία το Η2Ο2 θεωρείται ως η πλέον φιλική στο περιβάλλον, αφού η οξειδωτική δράση του δεν δημιουργεί τοξικά παραπροϊόντα σε αντίθεση με άλλα ισχυρά οξειδωτικά μέσα (χλώριο, νιτρικό οξύ, όζον) και η περίσσειά του καταστρέφεται πλήρως είτε με θέρμανση είτε καταλυτικά.
Ο ογκομετρικός προσδιορισμός του Η2Ο2 βασίζεται στην αντίδρασή του (ως αναγωγικού) με πρότυπα διαλύματα υπερμαγγανικού καλίου ή δημητρίου(IV) σε όξινα διαλύματα, αλλά και ως οξειδωτικού (προσθήκη περίσσειας ιωδιούχων, οξείδωση μέρους τους από το Η2Ο2 προς ιώδιο, ογκομέτρηση του ιωδίου με πρότυπο διάλυμα θειοθειικών). Σε πολύ μικρές συγκεντρώσεις το Η2Ο2 προσδιορίζεται με μια μεγάλη ποικιλία φωτομετρικών, φθορισμομετρικών και ηλεκτροχημικών μεθόδων.
|
Πίνακας 1
|
Πίνακας 2
|
|
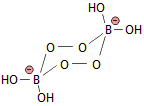
Τα υπερβορικά άλατα δεν είναι απλές μικτές ενώσεις του Η2Ο2, αλλά ενώ- σεις του βορίου με υπεροξειδικούς δεσμούς, όπως το παραπάνω υπερ- οξυβορικό ανιόν. |
Το Η2Ο2 δρα και ως ασθενέστατο οξύ διιστάμενο προς υδρογονοκατιόν και υπεροξυανιόν (ΗΟΟ-) με αποτέλεσμα τα υδατικά του διαλύματα 10-30% να εμφανίζουν ελαφρά όξινο pH (στην περιοχή 4,5-5).
![]()
Το Η2Ο2 σχηματίζει μικτές ενώσεις με διάφορα άλατα, γνωστότερα από τα οποία είναι το υπερβορικό νάτριο (NaBO2.H2O2.3H2O) και το υπερανθρακικό νάτριο (2Na2CO3.3H2O2). Τα άλατα αυτά (υπεροξυάλατα) παράγονται βιομηχανικά σε μεγάλες ποσότητες και αποτελούν ένα είδος "στερεής" μορφής του Η2Ο2. Είναι ασφαλή στη χρήση και χρησιμοποιούνται ως δραστικά συστατικά πολλών απορρυπαντικών και λευκαντικών προϊόντων οικιακής χρήσης. Είναι πιο ήπια ως προς τη δραστικότητα και λιγότερο καταστρεπτικά για τα υφάσματα από τα υποχλωριώδη (χλωρίνες). Τα άλατα αυτά χρησιμοποιούνται επίσης σε διάφορα ήπια αντισηπτικά φαρμακευτικά σκευάσματα.
Σχετικά σταθερές υπεροξειδικές οργανικές ενώσεις παρασκευάζονται με άμεση αντίδραση Η2Ο2 και των απλών ενώσεων ή παραγώγων τους, π.χ. αντίδραση του Η2Ο2 με οξικό οξύ και tert-βουτανόλη παρέχει αντίστοιχα υπεροξικό οξύ CH3CO-OOH και υπεροξυ-t-βουτανόλη (CH3)3C-OO-H, ενώ αντίδρασή του με βενζοϋλοχλωρίδιο παρέχει διβενζοϋλοϋπεροξείδιο (C6H5CO)2O2.
Σταθερότητα του υπεροξειδίου του υδρογόνου
Με την επίδραση του φωτός διασπάται ο υπεροξειδικός -Ο-Ο- δεσμός και παράγονται οι εξαιρετικά οξειδωτικές ρίζες υδροξυλίου (HO·). Το Η2Ο2 διασπάται αυτόματα σε νερό και οξυγόνο σε υψηλές θερμοκρασίες, για τον λόγο αυτόν η απομόνωση πρακτικά καθαρού Η2Ο2 από τα υδατικά του διαλύματα πραγματοποιείται με απόσταξη υπό κενό για να αποφευχθούν υψηλές θερμοκρασίες.
Πολλά μέταλλα (π.χ. ο Ag) και μεταλλικά οξείδια καταλύουν τη διάσπαση του Η2Ο2. Ιδιαίτερα έντονη είναι η καταλυτική δράση του MnO2 η επίδραση του οποίου πάνω το Η2Ο2 αποτελεί "παραδοσιακό" πείραμα επίδειξης καταλυόμενης χημικής αντίδρασης (βλ. βίντεο 1) και αποτελεί σχετικά ακίνδυνη μέθοδο παρασκευής οξυγόνου στα σχολικά εργαστήρια.
Το Η2Ο2 διασπάται από το ένζυμο καταλάση, το οποίο αποτρέπει τη συσσώρευση του Η2Ο2 στους ζωικούς ιστούς, αφού το Η2Ο2 αποτελεί προϊόν πλήθους βιοχημικών αντιδράσεων. 'Εχει υπολογισθεί ότι ένα μόριο καταλάσης διασπά 200.000 μόρια Η2Ο2 κάθε δευτερόλεπτο. Ο χαρακτηριστικός αφρισμός που προκαλείται σε μια πληγή κατά τον καθαρισμό της με οξυζενέ οφείλεται ακριβώς στη δράση της καταλάσης, η οποία προέρχεται από τα κατεστραμμένα κύτταρα.
Ορισμένες ύαλοι καταλύουν τη διάσπαση του Η2Ο2 και έτσι πυκνά διαλύματά του διατίθενται σε πλαστικές φιάλες από πολυαιθυλένιο. Ακόμη και απλά σωματίδια σκόνης μπορούν να προκαλέσουν καταλυτική διάσπαση του Η2Ο2. Στα πώματα των πλαστικών φιαλών υπάρχει συνήθως μια μικρή οπή για να αποφευχθεί η ανάπτυξη πίεσης από το παραγόμενο οξυγόνο κατά τη βραδεία διάσπαση του Η2Ο2.
Απουσία καταλυτών που θα διευκόλυναν τη διάσπασή του, το Η2Ο2 ως χημική ένωση θεωρείται σταθερή και αναφέρεται ότι διασπάται με ρυθμό μικρότερο από 1% ετησίως στους 22οC και περίπου 1% την εβδομάδα στους 66οC. Σε Ακόμη η συμβατότητα υλικών ως προς το Η2Ο2 έχει ως εξής [Αναφ. 7, 8]:
Συμβατά υλικά: Αλουμίνιο υψηλής καθαρότητας, χάλυβας χαμηλής περιεκτικότητας σε άνθρακα, πολυαιθυλένιο, τεφλόν.
Ασύμβατα υλικά: Χαλκός, ορείχαλκος, χάλυβας υψηλής περιεκτικότητας σε άνθρακα, μόλυβδος, λιπαντικά.
Εμπορικώς διαθέσιμες μορφές του υπεροξειδίου του υδρογόνου
|
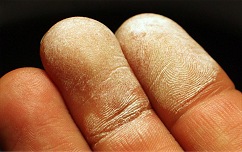
"Λευκό έγκαυμα" από πυκνό διάλυμα H2O2. |
Υδατικό διάλυμα 3% w/w Η2Ο2 διατίθεται ελεύθερα από τα φαρμακεία ως ήπιο αντισηπτικό (οξυζενέ) για καθαρισμούς τραυμάτων και ως λευκαντικό οικιακής χρήσης. Ως πυκνότερο διάλυμα (τυπικά 15% w/w) διατίθεται σε επαγγελματίες κομμωτές σε διάφορα εμπορικά καλλυντικά σκευάσματα ως "ξεβαφτικό μαλλιών". Σημειώνεται ότι διαλύματα Η2Ο2 με περιεκτικότητα ίση ή μεγαλύτερη από 8% χαρακτηρίζονται ως προς τη διακίνησή τους ως "οξειδωτικά" και πρέπει να φέρουν τη χαρακτηριστική σήμανση.
Το Η2Ο2 διατίθεται από οίκους χημικών αντιδραστηρίων σε χημικά εργαστήρια ως υδατικό διάλυμα 30-35% w/w, το οποίο είναι γνωστό ως Perhydrol. Στο Perhydrol συχνά προστίθενται μικρές συγκεντρώσεις σταθεροποιητικών ουσιών, όπως 0,02% ακετανιλίδιο (Aldrich) ή 0,006% νιτρικό αμμώνιο (Merck). Στη συγκέντρωση αυτή το Η2Ο2 είναι ιδιαίτερα καυστικό για το δέρμα στο οποίο προκαλεί λεύκανση ("λευκό έγκαυμα") και χαρακτηριστικό πόνο (σαν να μπήγονται βελόνες στο δέρμα). Αυτό οφείλεται στην είσοδο Η2Ο2 στα τριχοειδή αιμοφόρα αγγεία, όπου διασπάται εκλύοντας οξυγόνο το οποίο προκαλεί εμβολή (απόφραξη) σε αυτά καταστρέφοντας τοπικά τον ιστό. Το ίδιο αποτέλεσμα μπορεί να έχει και παρατεταμένη επαφή του δέρματος με αραιότερα διαλύματά του.
Ως πυκνότερο διάλυμα (50-70% w/w) το Η2Ο2 διατίθεται μόνο σε εξουσιοδοτημένους χρήστες, όπως π.χ. σε χημικές βιομηχανίες, βιομηχανίες χάρτου και ξυλείας, όπως και σε μονάδες επεξεργασίας λημμάτων. Εξειδικευμένοι οίκοι διαθέτουν Η2Ο2 σε ακόμη μεγαλύτερες συγκεντρώσεις (85-98% w/w), το οποίο είναι γνωστό ως hight test peroxide (HTP) και χρησιμοποιείται κυρίως ως προωθητικό πτητικών συσκευών (jetpacks) και πυραύλων. Αυτά τα πυκνά διαλύματα του Η2Ο2 συχνά σταθεροποιούνται με μικρές συγκεντρώσεις κασσιτερικού νατρίου (sodium stannate, Na2SnO3). Αυτές οι μορφές του Η2Ο2 είναι εξαιρετικά επικίνδυνες, η κάθε επαφή τους με οργανικά υλικά μπορεί να οδηγήσει σε αναφλέξεις και εκρήξεις και ο χειρισμός τους απαιτεί ιδιαίτερες προφυλάξεις (γάντια, προστατευτικά γυαλιά) και εκπαιδευμένο προσωπικό [Αναφ. 5].
'Ενας παλαιός τρόπος έκφρασης της περιεκτικότητας ενός υδατικού διαλύματος σε Η2Ο2 (που ακόμη χρησιμοποιείται) είναι η δύναμη όγκου (volume strength), που αποδίδει τον όγκο οξυγόνου που εκλύει ένας όγκος διαλύματος Η2Ο2 κατά την πλήρη διάσπασή του στους 0oC και πίεση 1 atm. Υδατικό διάλυμα Η2Ο2 30% (w/w) είναι διάλυμα 111 "όγκων", ενώ το καθαρό Η2Ο2 ισοδυναμεί προς διάλυμα 485 "όγκων" [Πλήρεις πίνακες των φυσικών ιδιοτήτων υδατικών διαλυμάτων του Η2Ο2 μπορούν να αναζητηθούν εδώ].
| Από το YouTube: Μια επιλογή από μια μεγάλη ποικιλία βίντεο σχετικών με το υπεροξείδιο του υδρογόνου: (α) Βίντεο 1: Εντυπωσιακό πείραμα που δείχνει την έντονη αντίδραση καταλυτικής διάσπασης πυκνού διαλύματος H2O2 με καταλύτη MnO2. (β) Βίντεο 2: Καταλυτική διάσπαση διαλύματος 85% H2O2 από ένα επαργυρωμένο μπρούντζινο πλέγμα. (γ) Βίντεο 3: Δοκιμή "ατομικής" πτητικής συσκευής (jetpack), όπου ως προωστική ουσία χρησιμοποιείται το H2O2. (δ) Βίντεο 4: Ένα μικρό αεροπλάνο από ίνες άνθρακα κινούμενο με τη βοήθεια πυραύλου H2O2. |
 |
Κύριες εφαρμογές του
υπεροξειδίου του υδρογόνου
|
Σύνοψη εφαρμογών Η2Ο2 |
1991 |
1995 |
|
Αποχρωματισμό υφασμάτων (bleaching) Χημική βιομηχανία (οξειδωτικό) Αποχρωματισμός χαρτιού Περιβαλλοντικές χρήσεις Ιατρικές κ.λπ. χρήσεις |
15,4% 17,5% 56,5% 3,8% 6,8% |
9,3% 15% 65,7% 3,0%
|
Βιομηχανικές εφαρμογές: Η ετήσια παραγωγή του Η2Ο2 υπολογίζεται σε 2 εκατομμύρια τόνους. 'Eχει πολλές βιομηχανικές εφαρμογές αλλά περισσότερο από το 50% της παραγωγής του φαίνεται ότι χρησιμοποιείται αποκλειστικά για τη λεύκανση του χαρτιού.
Ως πρώτη ύλη στη βιομηχανία χρησιμοποιείται: Στην παραγωγή υπερανθρακικού και υπερβορικού νατρίου για απορρυπαντικά, άλατα τα οποία δρουν ως "στερεό υπεροξείδιο υδρογόνου". Σε αποχρωματισμούς προϊόντων, όπως υφασμάτων, ξυλείας κ.α. Στην παρασκευή άλλων χημικών ενώσεων όπως διβενζοϋλοϋπεροξειδίου, υπεροξέων, εποξειδικών ενώσεων και προπυλενοξειδίου που με τη σειρά τους χρησιμοποιούνται για τη σύνθεση πλήθους χημικών προϊόντων.
 Οικιακές
εφαρμογές:
Ως διάλυμα 8-15% χρησιμοποιείται για τον
αποχρωματισμό μαλλιών (bleach human hair). Το H2O2
αντιδρά με τη μελανίνη, τη φυσική χρωστική των μαλλιών, καταστρέφει τους διπλούς
δεσμούς προκαλώντας αποχρωματισμό της τρίχας και αφήνοντάς την με το ξανθό χρώμα της
κερατίνης (peroxide blonde).
Οικιακές
εφαρμογές:
Ως διάλυμα 8-15% χρησιμοποιείται για τον
αποχρωματισμό μαλλιών (bleach human hair). Το H2O2
αντιδρά με τη μελανίνη, τη φυσική χρωστική των μαλλιών, καταστρέφει τους διπλούς
δεσμούς προκαλώντας αποχρωματισμό της τρίχας και αφήνοντάς την με το ξανθό χρώμα της
κερατίνης (peroxide blonde).
Ως υδατικό διάλυμα 3% (οξυζενέ) χρησιμοποιείται ως ήπιο αντισηπτικό για καθαρισμό πληγών. Η δράση του είναι διπλή, αφενός μεν καταστρέφει οξειδωτικά τους μικροοργανισμούς, αφετέρου με τον αφρισμό που δημιουργεί η διάσπασή του, απομακρύνει μηχανικά μολυσματικούς παράγοντες και καθαρίζει την πληγή.
Χρησιμοποιείται ως έχει ή ως υπερβορικό νάτριο ως ήπιο αντισηπτικό σε διαλύματα έκπλυσης της στοματικής κοιλότητας, σε διαλύματα καθαρισμού φακών επαφής και τεχνητών οδοντοστοιχιών. Υπό τη μορφή καρβαμιδικού υπεροξειδίου (μικτή ένωση με ουρία, H2NCONH2.H2O2)χρησιμοποιείται σε λευκαντικά σκευάσματα (π.χ. σε μορφή ζελέ) δοντιών, σε σταγόνες καθαρισμού των αυτιών και σε αποχρωματιστικά μαλλιών.
'Αλλες χρήσεις του: Μεγάλες ποσότητες Η2Ο2 χρησιμοποιούνται σε μονάδες επεξεργασίας αποβλήτων για την απομάκρυνση οσμών θειολών και άλλων θειούχων ενώσεων και ως απολυμαντικό. Για τον έλεγχο της ανάπτυξης μυκήτων σε ψάρια και αυγά ψαριών (FDA). Στην κηπουρική μερικοί προσθέτουν Η2Ο2 στο νερό ποτίσματος, γιατί η απελευθέρωση οξυγόνου φαίνεται ότι ενισχύει τις ρίζες των φυτών.
|
|
|
|
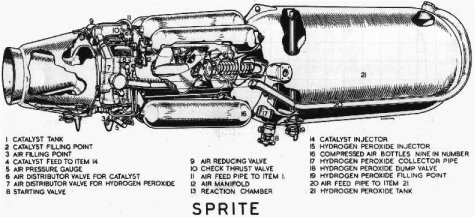
Τυπική μηχανή πυραύλου η λειτουργία της οποίας βασίζεται στην καταλυτική διάσπαση σχεδόν καθαρού Η2Ο2 κατά την επαφή με πλέγμα αργύρου με σύγχρονη έκλυση μεγάλων ποσών θερμότητας. Η πρόωση οφείλεται στην ταχύτατη έξοδο του παραγόμενου οξυγόνου και του ατμού ύδατος, που παράγονται κατά τη διάσπαση. Οι πύραυλοι με Η2Ο2 αναπτύχθηκαν κατά τη χρονική περίοδο 1940-1970 (βλ. http://www.spaceuk.org/htp/htp.htm). |
|
Στρατιωτικές εφαρμογές: Ως πυκνότερο μίγμα με το νερό (>90%) έχει χρησιμοποιηθεί ως προωστική ουσία πυραύλων: α) ως έχει, αφού με καταλύτη (συνήθως με πλέγμα αργύρου ή επαργυρωμένο ορείχαλκο), διασπάται προς οξυγόνο και υπέρθερμους ατμούς ύδατος (1 mol Η2Ο2 κατά τη διάσπασή του σε Η2Ο και Ο2 εκλύει θερμότητα 98 kJ), β) ως οξειδωτικό σε συνδυασμό με κάποια καύσιμη ουσία (παραφίνες, υδραζίνη).
Χρησιμοποιήθηκε ως οξειδωτική προωστική ουσία πυραύλων και αεροπλάνων (Messerschmitt) κατά τον 2ο Παγκόσμιο Πόλεμο. Χαρακτηριστική είναι η χρήση του σε ατομικές πτητικές συσκευές (jetpacks), δεδομένου ότι τα προϊόντα διάσπασής του (ατμοί ύδατος και οξυγόνο) δεν είναι τοξικά και δεν δημιουργείται φλόγα κατά τη διάσπασή του [Αναφ. 9].
Στα υποβρύχια το Η2Ο2 (περιεκτικότητας 90% και πλέον) έχει χρησιμοποιηθεί ως πηγή θερμότητας και οξυγόνου, αλλά και ως προωστική ουσία τορπιλών. Πιθανολογείται ότι η βύθιση του Ρωσικού υποβρυχίου Kursk, οφειλόταν στη διαρροή Η2Ο2 από μία τορπίλη του.
|
Η καταστροφή του υποβρυχίου Kursk σχετίζεται με το υπεροξείδιο του υδρογόνου; Το υποβρύχιο Kursk (φωτογραφία δεξιά) ήταν το τελευταίο πυρηνικό υποβρύχιο κατηγορίας Oscar-II που κατασκευάστηκε για το Ρωσικό ναυτικό, μήκους 155 μέτρων (διπλό σε μήκος από ένα Boeing 747). Εντάχθηκε στη δύναμη του Ρωσικού στόλου το 1994. Στις 12 Αυγούστου 2000, το Kursk συμμετείχε σε άσκηση στα ανοικτά της χερσονήσου Κόλα, κοντά στον λιμένα του Murmansk. Στις 11:28 τοπική ώρα έγινε μια έκρηξη στο σκάφος, ισοδύναμη με έκρηξη 100 kg ΤΝΤ. Αυτή η έκρηξη εικάζεται ότι οφείλεται σε διαρροή Η2Ο2 υψηλής πυκνότητας από ένα νέο τύπο τορπίλης, που προωθείτο με βενζινομηχανή και το Η2Ο2 χρησίμευε ως πηγή οξυγόνου για τη λειτουργίας της. Η έκρηξη προκάλεσε πυρκαγιά που με τη σειρά της προκάλεσε την έκρηξη πολλών άλλων τορπιλών 135 δευτερόλεπτα αργότερα. Η ισχύς της δεύτερης έκρηξης ήταν ισοδύναμη προς 7 τόνους TNT και καταγράφηκε σε απόσταση 5000 km ως σεισμική δόνηση έντασης 3,5 Ρίχτερ. Το υποβρύχιο χάθηκε σε βάθος 108 μέτρων μαζί με όλο του το πλήρωμα από 118 άνδρες. Το ατύχημα αυτό, όπως και άλλα παρόμοια αλλά μικρότερης έκτασης που είχαν συμβεί στο παρελθόν, οδήγησε στην πλήρη εγκατάλειψη του υπεροξειδίου του υδρογόνου ως οξειδωτικού για την πρόωση τορπιλών [Αναφ. 2, 10]. |
 |
Υπεροξείδιο του υδρογόνου και βιοχημικές κυτταρικές διεργασίες [Αναφ. 11-18]
|
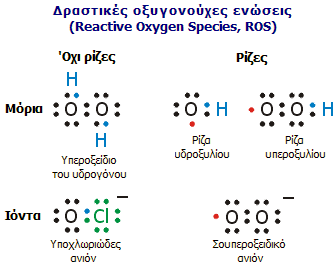
Τυπικές δραστικές οξυγονούχες ενώσεις (ROS). Στις ROS ανήκουν ρίζες και όχι ρίζες. Τα περισσότερα βιολογικά μόρια είναι όχι ρίζες και περιλαμβάνουν δύο ηλεκτρόνια ανά τροχιακό, που αποτελεί μια σταθερή διαμόρφωση σε ένα μόριο. Μια ελεύθερη ρίζα είναι ένα αυθύπαρκτο μόριο ή ιόν με ένα ή περισσότερα ασύζευκτα ηλεκτρόνια. Ασύζευκτο ηλεκτρόνιο σημαίνει ένα ηλεκτρόνιο στο τροχιακό (στο σχήμα με κόκκινο χρώμα), που αποτελεί ασταθή διαμόρφωση και καθιστά τις ελεύθερες ρίζες εξαιρετικά δραστικές (από την [Αναφ. 14]). |
Το Η2Ο2 αποτελεί παραπροϊόν της αερόβιας ζωής των έμβιων όντων, μέρος της αλυσίδας των αντιδράσεων του οξυγόνου σε αναγωγικο-οξειδωτικές φυσιολογικές λειτουργίες (ενζυμικές και μη). Λόγω της οξειδωτικής του δράσης, το Η2Ο2 όπως και άλλες δραστικές οξυγονούχες ενώσεις (reactive oxygen species, ROS) αρχικά θεωρούνταν ως βλαβερά παραπροϊόντα και ότι όσο πιο γρήγορα αποβάλλονταν από τον οργανισμό τόσο το καλύτερο για τη φυσιολογική του λειτουργία. Ωστόσο, σχετικά πρόσφατες έρευνες έδειξαν ότι το Η2Ο2 είναι απαραίτητο στην κυτταρική λειτουργία. Ως ουδέτερο μικρό μόριο διαχέεται εύκολα μέσω των κυτταρικών μεμβρανών, αλλά επίσης παράγεται και απομακρύνεται εύκολα με μια σειρά φυσιολογικών διεργασιών. Η ιδιότητες αυτές καθιστούν το Η2Ο2 ιδανικό για τη ρύθμιση της μεταγωγής (signal transduction) βιολογικών σημάτων μέσω αλυσίδας αντιδράσεων φωσφορυλίωσης/αποφωσφορυλίωσης, που καταλύονται από πρωτεϊνικές κινάσες και φωσφατάσες.
Στα τελευταία βιοχημικά συνέδρια (EMBO Conference, Ρώμη 2006 και Gordon Research Conference, Bedford, ΗΠΑ, 2006) οι ερευνητές παρουσίασαν νέα αποτελέσματα για τον ρόλο του Η2Ο2 στον κυτταρικό πολλαπλασιασμό, τη διαφοροποίηση και τη διάχυσή του στους ιστούς. Έχει τεκμηριωθεί ότι το Η2Ο2 συμμετέχει ενεργά στην οξειδοαναγωγική μεταβίβαση σημάτων (cellular redox signaling) στα κύτταρα, που αποτελεί σημαντικό φυσιολογικό μηχανισμό, αλλά και προαγωγό προβλημάτων, όπως είναι η αγγειογένεση, το οξειδωτικό stress, η κυτταρική γήρανση και διάφορες κακοήθεις νεοπλασίες.
Η2Ο2 και ανοσοποιητικό σύστημα: Η παραγωγή του Η2Ο2 έχει μελετηθεί συστηματικά στα ουδετερόφιλα (neutrophiles) κύτταρα, που παίζουν σημαντικό ρόλο στο ανοσοποιητικό σύστημα του ανθρώπου. Τα ουδετερόφιλα λευκοκύτταρα ενεργοποιούνται όταν εμφανισθεί σε ιστούς μολυσματικός παράγοντας και τον εγκλωβίζουν για να εξουδετερώσουν την παθογόνο δράση του. Η δράση αυτή του Η2Ο2 εξαρτάται άμεσα από το σύμπλοκο Nox [σύμπλοκο της οξειδάσης της NADPH -ανηγμένη μορφή του φωσφορικού νικοτιναμιδο-αδενινο-δινουκλεοτιδίου-]. Το Nox παράγει μικρές ποσότητες Η2Ο2 στο ασφαλές περιβάλλον των φαγοσωμάτων (phagosomes) για να εξουδετερωθούν με οξείδωση οι παθογόνους οργανισμοί.
Η2Ο2 - μηχανισμοί ενεργοποίησης και μεταβολές στην ενεργότητα πρωτεϊνών: Μια άλλη ενδιαφέρουσα πλευρά της φυσιολογικής δράσης του Η2Ο2 που προσπαθούν να κατανοήσουν οι επιστήμονες, είναι οι μηχανισμοί ενεργοποίησης των πρωτεϊνών που συμμετέχουν στη μεταβίβαση ή μεταγωγή ενδοκυτταρικών σημάτων. Οι βιολογικές οξειδοαναγωγικές αντιδράσεις όπου μετέχει το Η2Ο2 περιλαμβάνουν κυρίως την οξείδωση της ομάδας -SH της κυστεΐνης των πρωτεϊνών. Η οξείδωση αυτή απενεργοποιεί τις φωσφατάσες. Οι πρωτεϊνικές φωσφατάσες και κινάσες της τυροσίνης είναι ένζυμα απαραίτητα για τη φωσφορυλίωση της τυροσίνης των πρωτεϊνών. Οι επιστήμονες προσπαθούν να κατανοήσουν τον διπλό ρόλο του Η2Ο2, γιατί έχει αποδειχθεί ότι η οξειδωτική απενεργοποίηση των φωσφατασών και η αυξημένη φωσφορυλίωση της τυροσίνης των πρωτεϊνών εξαρτώνται από την παραγωγή Η2Ο2 σε διάφορα κύτταρα από διάφορους αυξητικούς παράγοντες. Η δραστικότητα των φωσφατασών μπορεί να αποκατασταθεί με κυτταρικές θειόλες που έχουν αναγωγικές ιδιότητες.
Η οξειδωτική απενεργοποίηση των φωσφατασών και η αυξημένη φωσφορυλίωση των πρωτεϊνών τυροσίνης έχει αποδειχθεί ότι εξαρτάται από την παραγωγή Η2Ο2 στα κυτταρικά διαμερίσματα με τη βοήθεια αυξητικών παραγόντων. Στις λειτουργίες αυτές το Η2Ο2 δρα ως μεταγωγέας (transducer) σημάτων. Οι επιστήμονες απορούσαν πώς ένα απλό μόριο μπορεί να αποκτήσει αυτό τον ρόλο (κάτι που αποτελούσε επί χρόνια απορία και για το μονοξείδιο του αζώτου, ΝΟ). Τελικά το μυστήριο φαίνεται ότι λύθηκε με την παρατήρηση ότι η συγκέντρωση του Η2Ο2 μπορεί να υποστεί απότομες αυξομειώσεις και πέραν από τα φυσιολογικά όρια, για να δράσει ως μεταγωγέας σημάτων μέσω της διαφοροποίησης των αντίστοιχων πρωτεϊνών.
'Ηταν γνωστό ότι τα αντιοξειδωτικά ένζυμα (καταλάσες και υπεροξειδάσες) στα διάφορα κυτταρικά διαμερίσματα αποτρέπουν τις αυξήσεις στη συγκέντρωση του Η2Ο2, ώστε να προληφθεί η οξείδωση βιομορίων. 'Ετσι, με κάποιο τρόπο επιτρέπονται ξαφνικές αυξήσεις, μεταγωγή σημάτων και μετά εξουδετέρωση. Πρόσφατες έρευνες έδειξαν ότι υπάρχουν τέτοιοι ενδοκυτταρικοί μηχανισμοί προστασίας του Η2Ο2, ώστε να λειτουργήσει ως μεταγωγέας σημάτων. Κατά την καταλυτική αναγωγή του, ένα ενεργό κέντρο των πρωτεϊνών που έχει την αναγωγική ομάδα Cys-SH (κυστεΐνη) του ενζύμου υπεροξειρεδοξίνη (peroxiredoxin) αντιδρά με Η2Ο2 και οξειδώνεται προς το αντίστοιχο σουλφενικό οξύ Cys-S-OH και τελικά προς σουλφινικό οξύ Cys-S(=O)-OH. 'Ετσι το ένζυμο απενεργοποιείται και η απενεργοποίηση αυτή, πιθανολογείται, ότι αποτελεί εσωτερικό μηχανισμό προστασίας του Η2Ο2 και του ρόλου του ως μεταγωγέα σημάτων.
|
'Ενα ιδιαίτερα χρήσιμο, απλά γραμμένο (και ευκατανόητο και από τους μη ειδικούς) άρθρο ανασκόπησης για τον βιοχημικό ρόλο του υπεροξειδίου του υδρογόνου ως οξειδοαναγωγικού ρυθμιστή των κυττάρων είναι το "Hydrogen Peroxide - From Oxidative Stressor to Redox Regulator" [Αναφ. 14] της Gabi Nindl (από το Department of Cellular and Integrative Physiology, Indiana University School of Medicine ). |
Βιολογική στρατηγική στην παραγωγή Η2Ο2 και την προστασία ως προς αυτό από τους αερόβιους οργανισμούς: Με δεδομένη την ισχυρή οξειδωτική δράση του Η2Ο2 και τις οξειδωτικές βλάβες που μπορεί να προκαλέσει σε σημαντικά βιομόρια, πρέπει εξελικτικά να έχει αναπτυχθεί μια ελεγκτική στρατηγική για να αποφευχθούν οι βλάβες και το μόριο να εκτελέσει τον σημαντικό φυσιολογικό ρόλο του στη μεταγωγή σημάτων.
Οι έρευνες των τελευταίων χρόνων επιβεβαιώνουν τέτοιους μηχανισμούς, που από τη μια πλευρά ενεργοποιούν το σύμπλοκο Nox για την παραγωγή Η2Ο2 και τη μεταγωγή σημάτων με αυξομειώσεις της συγκέντρωσής του στα κυτταρικά διαμερίσματα και από την άλλη αποτελεσματική και ταχεία εξουδετέρωση για να αποφευχθούν οι οξειδωτικές βλάβες. Τα αποτελέσματα ερευνών με κύτταρα που ενεργοποιήθηκαν με τον παράγοντα TNF-α δείχνουν ότι οι Nox πρωτεΐνες συναθροίζονται σε ειδικά υποκυτταρικά διαμερίσματα μέσα στις μεμβράνες όπου παράγεται το Η2Ο2. Επίσης, τοπικά Nox δημιουργούν και αυτά με τη σειρά τους συναθροίσεις σε συγκεκριμένα σημεία, στα οποία γίνεται παραγωγή Η2Ο2 σε περιοδεύοντα κύτταρα με μια απλή επαφή.
Μέχρι σήμερα δεν έχουν προσδιοριστεί οι τρόποι με τους οποίους το Η2Ο2 μεταφέρεται στο κυτοσόλιο (διαλυτό κυτταρόπλασμα). Υπάρχουν διάφορες θεωρίες για το πως γίνεται η είσοδος του Η2Ο2 (που παράγεται από τα ουδετερόφιλα μέσω του Nox) στο κύτταρο, όπως η διασύνδεση με αυτοκρινικούς παράγοντες ή με τη βοήθεια της ιντερλευκίνης-1 και ενός υποδοχέα της στο πλάσμα της μεμβράνης και στη συνέχεια με ενδοκυττάρωση (endocytosis).
|
Ενδοκυττάρωση: Διαδικασία εισόδου μιας ουσίας σε ένα κύτταρο χωρίς να περάσει μέσω της κυτταρικής μεμβράνης. Μηχανισμοί ενδοκυττάρωσης: (α) Πινοκυττάρωση ή κυτταροποσία (pinocytosis), (β) Φαγοκυττάρωση (phagocytosis), (γ) Ενδοκυττάρωση μέσω υποδοχέων. Η αντίστροφη διαδικασία ονομάζεται εξωκυττάρωση (exocytosis). Για περισσότερες λεπτομέρειες βλ. [Αναφ. 19]. |
Η μεταγωγή σημάτων σε οξειδοαναγωγικούς ενδοκυτταρικούς μηχανισμούς και ο ρόλος του μικρού ουδέτερου μορίου του Η2Ο2 στις βιοχημικές διεργασίες είναι ένας σχετικά πρόσφατος ερευνητικός τομέας. Η ανάπτυξη ευαίσθητων μικροαισθητήρων για την ποσοτική και δυναμική παρακολούθηση της συγκέντρωσης του Η2Ο2 σε κύτταρα in vivo θα επιτρέψει τη διερεύνηση του ρόλου του απλού αυτού μορίου, το οποίο μέχρι πρότινος θεωρούνταν ως ένα τοξικό για το κύτταρο παραπροϊόν βιοχημικών αντιδράσεων. Συγχρόνως πιστεύεται ότι οι νέες έρευνες θα διευκρινίσουν τον ρόλο των ελευθέρων ριζών και των οξυγονούχων δραστικών ενώσεων (ROS) στην ενδοκυτταρική μεταγωγή σημάτων και ενδεχομένως στη γήρανση των κυττάρων.
Βιβλιογραφία - Πηγές από το
Διαδίκτυο
1. (α) Greenwood ΝΝ, Earnshaw Α: "Chemistry of the Elements", 2nd ed., Butterworth-Heinemann, 1997, p.633 ff. (β) Wikipedia: "Hydrogen Peroxide".
2. Chemistry Department, University of Bristol, Cotton S.: "Molecule of the Month: Hydrogen Peroxide".
3. EKA Chemicals (Bohus, Sweden): "The hydrogen peroxide production process", (αρχείο PDF, 2,62 ΜΒ).
4. Chemical Engineering Tools and Information ("Cheresources"): "Hydrogen Peroxide Production".
5. Solvay Chemicals: "Hydrogen peroxide, Safety and Handling Technical Data Sheet", (αρχείο PDF, 348 KB).
6. US Peroxide Company: "INTRODUCTION TO HYDROGEN PEROXIDE, environmental application overview".
7. Clyde Co-op Co.: (α) "Hydrogen Peroxide (H2O2) TECHNICAL INFORMATION". (β) FMC: "MSDS: Hydrogen Peroxide (20 to 40%)", (αρχείο PDF, 53 KB).
8. European Chemical Industry Council (CEFIC): "Ecoprofile of hydrogen peroxide".
9. (α) Stokes PR: "Hydrogen Peroxide for Power and Propulsion", (αρχείο PDF, 173 KB). (β) Wikipedia: "High test peroxide".
10. (α) New Scientist (July 2002): "Torpedo fuel leak sank Kursk". (β) Wikipedia: "Russian submarine Kursk explosion".
11. Sundaresan M, Yu Z-X, Ferrans VJ, et al: "Requirement for generation of Η2Ο2 for platelet-derived growth factor signaling transduction", Science 270:296-299, 1995.
12. Hoidal JR: "Reactive oxygen species and cell signaling", Am J Respir Cell Mol. Biol. 25:661-663, 2001, (αρχείο PDF, 45 ΚΒ)
14. Nindl G: "Hydrogen Peroxide - From Oxidative Stressor to Redox Regulator", Cellscience Reviews, 1 (2), 2004.
15. Rhee SG: "Cell signaling. Η2Ο2, a necessary evil for cell signaling" Science 312:1882-1883, 2006.
16. EMBO Conference Series: "Redox Signaling in Human Disease and Ageing", Rome, Italy, 20-23.4.2006.
17. Linnane AW, Eastwood H: "Cellular redox regulation and prooxidant signaling system: A new perspective on the free radical theory of aging", Ann NY Acad Sci 1067:47-55, 2006 [Abstract].
18. Tonks NK: "Redox redux: revisiting PTPs (protein tyrosine phosphatase) and the control of cell signaling", Cell 121:667-670, 2006 [PubMed].
19. (α) Wikipedia: "Endocytosis". (β) Brooklyn College: "Endocytosis".
|
Αποποίηση ευθυνών: Έχει καταβληθεί κάθε προσπάθεια για να εξασφαλισθεί η ορθότητα των πληροφοριών που περιλαμβάνονται σε αυτή τη σελίδα, ωστόσο ο έχων την επιμέλεια της σελίδας αυτής και το Τμήμα Χημείας δεν αναλαμβάνουν τη νομική ευθύνη για τυχόν σφάλματα, παραλείψεις ή ανακριβείς πληροφορίες. Επιπλέον, το Τμήμα Χημείας δεν εγγυάται την ορθότητα των αναφερόμενων σε εξωτερικές ιστοσελίδες, ούτε η αναφορά μέσω συνδέσμων (links) στις ιστοσελίδες αυτές, υποδηλώνει ότι το Τμήμα Χημείας επικυρώνει ή καθ' οιονδήποτε τρόπο αποδέχεται το περιεχόμενό τους. |