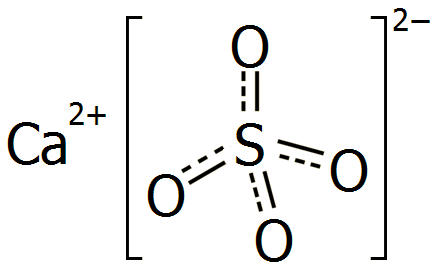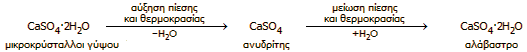|
Αγαλματίδιο (ύψος: 50 cm, πλάτος: 47 cm) του Ιταλού Adolfo Cipriani (1880) από αλάβαστρο, μια μορφή γύψου [πηγή]. |
Το θειικό ασβέστιο (CaSO4) είναι απλό ανόργανο άλας με το οποίο "ζούμε μαζί" σε όλη τη διάρκεια της ζωής μας. Οι τοίχοι και οι οροφές των χώρων που ζούμε ή εργαζόμαστε κατά κανόνα αποτελούνται από υλικά που ως βάση έχουν το θειικό ασβέστιο. Το θειικό ασβέστιο είναι άφθονο στη φύση στη μορφή διάφορων ορυκτών, τα οποία διαφέρουν μεταξύ τους κυρίως ως προς τον βαθμό εφυδάτωσης και πάντοτε βρίσκονται μαζί. Το κύριο ορυκτό του θειικού ασβεστίου είναι ο γύψος (CaSO4·2H2O) και ακολουθεί ο ανυδρίτης (CaSO4). Ακόμη, υπάρχει και το σπάνιο ορυκτό μπασσανίτης (CaSO4·1/2H2O) που σχετικώς πρόσφατα βρέθηκε σε μικρές ποσότητες μαζί με τα προηγούμενα δύο ορυκτά. [Παρατήρηση: Στην Ελληνική γλώσσα ο γύψος, εμφανίζεται και στο θηλυκό γένος: "η γύψος". Εδώ, για λόγους συνέπειας και μόνο χρησιμοποιείται αποκλειστικά το αρσενικό γένος].
Ο γύψος εμφανίζεται με μια μεγάλη ποικιλία μορφών και χρωμάτων. Μια ιδιαίτερα γνωστή ποικιλία του είναι το αλάβαστρο, ένα μαλακό ορυκτό το οποίο από την αρχαιότητα χρησιμοποιείται για την κατασκευή καλλιτεχνημάτων. Το θειικό ασβέστιο είναι κανονικό συστατικό των φυσικών υδάτων, μία από τις κύριες πηγές ιόντων ασβεστίου και σχεδόν η αποκλειστική πηγή των θειικών ιόντων τους.
Το θειικό ασβέστιο αποτελεί κύριο παραπροϊόν της βιομηχανίας φωσφορικών λιπασμάτων (φωσφογύψος), με παραγωγή εκατοντάδων εκατομμυρίων τόνων ετησίως και δημιουργεί σημαντικά προβλήματα απόθεσης. Επιπλέον, αποτελεί αξιοποιήσιμο προϊόν της διαδικασίας αποθείωσης των αερίων καύσης ορυκτών καυσίμων διαφόρων βιομηχανιών.
Το θειικό ασβέστιο σε μια αρχική μορφή επεξεργασμένου γύψου (ημιυδρικό άλας CaSO4·1/2H2O) χρησιμοποιείται ευρύτατα ως οικοδομικό και διακοσμητικό υλικό κτισμάτων, ως υλικό για την παρασκευή εκμαγείων, προπλασμάτων αλλά και κομψοτεχνημάτων, ενώ στην ιατρική ως υλικό ναρθήκων για την ανάταξη καταγμάτων, όπως και στην οδοντιατρική.
Στο χημικό εργαστήριο το άνυδρο θειικό ασβέστιο χρησιμοποιείται ευρύτατα ως ένα φθηνό, αλλά εξαιρετικά χρήσιμο και σχετικώς αδρανές ξηραντικό μέσο διαλυτών και αερίων. Στη χημική βιομηχανία χρησιμοποιείται ως αφυδραντικό στερεό σε χημικές διεργασίες όπου απαιτείται η απομάκρυνση ύδατος.
|
Το θειικό ασβέστιο, ως γύψος, υπήρξε πολύτιμο οικοδομικό υλικό ήδη από αρχαιότατους χρόνους. Μεγάλες ποσότητές του χρησιμοποιήθηκαν στην κατασκευή των πυραμίδων (κυρίως ως συγκολλητικό μέσο) και για τη διακόσμηση των ναών από τους αρχαίους Αιγυπτίους. |
Το θειικό ασβέστιο χρησιμοποιείται ακόμη ως λίπασμα και βελτιωτικό καλλιεργούμενων εδαφών, όπως επίσης και για την τεχνητή αύξηση της σκληρότητας φυσικών υδάτων, όποτε είναι τούτο απαραίτητο. Ως ουσιαστικά μη τοξικό υλικό επιτρέπεται η χρήση ως πρόσθετου τροφίμων (Ε516) λόγω της αφυδραντικής και αντισυσσωματικής δράσης του.
Το θειικό ασβέστιο στην ιστορία [Αναφ. 2]
Η αρχή της χρήσης του θειικού ασβεστίου ως οικοδομικού υλικού χάνεται στα βάθη των χιλιετιών. Ο άνθρωπος από πολύ νωρίς είχε διακρίνει μια ιδιαίτερα χρήσιμη ιδιότητα του γύψου (gypsum, CaSO4·2H2O). Διαπίστωσε ότι με σχετικώς ήπια θέρμανση ο γύψος άρχισε να "βράζει", να χάνει νερό και να μεταμορφώνεται σε ένα υλικό, τον πλαστικό γύψο (CaSO4·1/2H2O), το οποίο όταν αναμιγνυόταν με νερό παρείχε μια εύπλαστη μάζα (γυψοπολτό), η οποία ταχύτατα σκλήραινε. Την ιδιότητα αυτή ο άνθρωπος αρχικά αξιοποίησε κυρίως για οικοδομικές εργασίες (π.χ. σφράγιση διάκενων μεταξύ ογκόλιθων, σφράγιση ταφικών μνημείων, συγκόλληση επιμέρους τμημάτων μνημείων) και στη συνέχεια για διακοσμήσεις κυρίως εσωτερικών χώρων, όπως και για την κατασκευή καλλιτεχνημάτων.
Η χρήση του πλαστικού γύψου γινόταν ήδη από τους πρώτους πολιτισμούς της ονομαζόμενης Εύφορης Ημισελήνου (περιοχές Αιγύπτου έως και τη Μεσοποταμία). Τα παλαιότερα ίχνη γυψοκονιάματος έχουν ηλικία 9000 ετών και βρέθηκαν στη Συρία και στην Ανατολία. Πλαστικός γύψος χρησιμοποιήθηκε στις κατασκευές των πυραμίδων στην αρχαία Αίγυπτο, ενώ ήταν ευρύτατα διαδεδομένη η χρήση του στην αρχαία Ελλάδα. Ο Θεόφραστος (371 π.Χ. - περ. 287/5 π.Χ.) είχε περιγράψει με ακρίβεια τον τρόπο επεξεργασίας του γύψου στη Συρία και στη Φοινίκη.
Γενικά, το ελληνικό όνομα "γύψος" πέρασε στην αρχαία Ρώμη ως "gypsum". Οι ρίζες της ονομασίας αυτής είναι σημιτικής προέλευσης: στην αραμαϊκή ήταν "gassa" (αραβικά: "jibs", εβραϊκά: "gephes" που σημαίνει πλαστική ύλη). Ωστόσο, θα πρέπει πάντως να σημειωθεί ότι ο όρος "γύψος" κατά την αρχαιότητα περιελάμβανε και τον ασβέστη (CaO). Γενικά, δήλωνε ένα γεώδες υλικό το οποίο μετά από έψηση και ανάμιξη με το νερό έδινε ένα πολτώδες υλικό, που μετά από ένα σύντομο χρονικό διάστημα σκλήραινε και γινόταν συμπαγές.
Μεγάλα κοιτάσματα γύψου είχαν βρεθεί γύρω από το αρχαίο Παρίσι και αξιοποιούνταν ήδη από τους Γαλλορωμαϊκούς χρόνους. Τα γνωστότερα από αυτά ήταν τα περίφημα γυψωρυχεία του λόφου της Μονμάρτρης (Monmartre). Οι Γάλλοι ανήγαγαν την παραγωγή και χρήση του πλαστικού γύψου σε υψηλή τέχνη. Το 1700, στο Παρίσι νομοθετικά είχε επιβληθεί η κάλυψη των τοίχων των ξύλινων σπιτιών με γύψο ως μέτρο προστασίας της πόλης έναντι της επέκτασης των πυρκαγιών, παίρνοντας αφορμή από την καταστροφική πυρκαγιά του Λονδίνου του 1666. Για τον λόγο αυτό ο πλαστικός γύψος είναι ευρύτερα γνωστός ως πλαστικός γύψος των Παρισίων (Plaster of Paris).
Επιπλέον, Γάλλοι αγρότες χρησιμοποίησαν για πρώτη φορά τον γύψο ως βελτιωτικό του εδάφους στις καλλιέργειές τους με επιτυχία, πρακτική την οποία μετέφερε στην Αμερική ο διάσημος πολυμαθής, επιστήμονας, γερουσιαστής και ένας από τους σημαντικότερους πατέρες του έθνους των ΗΠΑ, ο Βενιαμίν Φραγκλίνος (Benjamin Franklin, 1706-1790). Σήμερα, μεγάλες ποσότητες γύψου χρησιμοποιούνται για εμπλουτισμό των καλλιεργούμενων εδαφών σε θείο και ασβέστιο.
 |
 |
 |
 |
|
Ζωγραφικές απεικονίσεις και φωτογραφίες από τα περίφημα γυψωρυχεία του λόφου της Μονμάρτρης (Monmartre) στο παλιό Παρίσι. Λόγω της ευθραυστότητας του γύψου και της ελαφριάς διαλυτότητάς του στο νερό είχαν συμβεί πολλές καθιζήσεις εδαφών, καταρρεύσεις κτισμάτων και σοβαρά ατυχήματα στα λατομεία αυτά. Ακόμη και μετά το οριστικό κλείσιμο των γυψωρυχείων (1860), σε ορισμένες περιοχές του λόφου απαγορεύεται η οικοδόμηση λόγω του ασταθούς εδάφους [πηγή]. |
|||
Ορυκτά θειικού ασβεστίου [Αναφ. 3]
|
Η περίφημη εκκλησία Basilique du Sacre-Cour (κτίστηκε κατά το διάστημα 1875-1914) στην κορυφή του λόφου της Μονμάρτρης. Επειδή τα εδάφη του λόφου είναι ασταθή λόγω των στρωμάτων γύψου και των παλαιών γυψωρυχείων, για τον ναό χρειάστηκαν θεμέλια βάθους 40 μέτρων. |
Κατά κύριο λόγο ο γύψος (gypsum) και ο ανυδρίτης (anhydrite) είναι τα δύο βασικά ορυκτά του θειικού ασβεστίου. Ο γύψος είναι ο διυδρίτης του CaSO4, (CaSO4·2H2O), ενώ ο ανυδρίτης δεν περιέχει κρυσταλλικό ύδωρ. Και τα δύο ορυκτά ανήκουν στην κατηγορία των εβαποριτών (evaporites), δηλ. ορυκτών που προέκυψαν από την εξάτμιση διαλυμάτων τους. 'Ετσι, τα ορυκτά του θειικού ασβεστίου βρίσκονται σε άφθονες ποσότητες σε περιοχές που παλαιότερα καλύπτονταν από θάλασσα. Ως λιγότερο ευδιάλυτα από τα άλλα άλατα συσσωρεύτηκαν και σχημάτισαν κυρίως επιφανειακά στρώματα και συνήθως βρίσκονται μαζί με κοιτάσματα αλίτη (ορυκτό NaCl) και θείου (S).
Ο γύψος (CaSO4·2H2O) είναι το κυριότερο από τα δύο ορυκτά. Όταν είναι καθαρός, είναι ένα λευκό ορυκτό με μικρή σκληρότητα (1,5-2 κλίμακας Mohs) και απαντάται υπό μια μεγάλη ποικιλία μορφών.
Ο ανυδρίτης (CaSO4) ακολουθεί πάντοτε τον γύψο σε περιοχές όπου ευνοείται ο σχηματισμός του. Κρύσταλλοι ανυδρίτη μπορούν να ληφθούν με βραδεία εξάτμιση κορεσμένων διαλυμάτων CaSO4 που περιέχουν περίσσεια NaCl και KCl και σε θερμοκρασίες μεγαλύτερες από 40ºC. Ο ανυδρίτης είναι η πιο σκληρή μορφή ορυκτού CaSO4 με σκληρότητα 3,0-3,5 της κλίμακας Mohs και ειδικώς βαρύτερη.
O φυσικός ανυδρίτης εκτεθειμένος στην ατμόσφαιρα απορροφά υγρασία με εξαιρετικά βραδύ ρυθμό μετατρεπόμενος σε γύψο. Αναφέρεται ότι ακόμη και σε γεωλογικούς χρόνους η μετατροπή αυτή είναι ελάχιστη, εκτός αν βρίσκεται σε εξαιρετικά λεπτό διαμερισμό (π.χ. σε μορφή σκόνης) [Αναφ. 1β]. Ωστόσο, συλλέκτες ορυκτών συνιστούν τη φύλαξη δειγμάτων ανυδρίτη σε κλειστούς ξηρούς χώρους και παρουσία ξηραντικού υλικού (π.χ. silica gel) [Αναφ. 3δ].
Ο μπασσανίτης (CaSO4·1/2H2O) είναι ένα σπάνιο ορυκτό του θειικού ασβεστίου, το οποίο εντοπίστηκε για πρώτη φορά το 1910 στον Βεζούβιο από τον Ιταλό παλαιοντολόγο Francesco Bassani (1853-1916). Συναντάται μαζί με τις άλλες μορφές ορυκτών του θειικού ασβεστίου. Πρόκειται για ορυκτό, το οποίο έχει την ίδια σύσταση με εκείνη του κύριου προϊόντος επεξεργασίας του γύψου, του πλαστικού γύψου.
Ποικιλίες γύψου. Ο σεληνίτης (selenite) είναι μια ποικιλία του ορυκτού γύψου της οποίας χαρακτηριστική ιδιότητα είναι η μεγάλη διαφάνεια των κρυστάλλων της, όπως και η λεπιδοειδής μορφή τους. 'Ενα σπήλαιο με τεράστιους κρυστάλλους σεληνίτη (μήκους μέχρι και 12 μέτρων), το Cave of Crystals (Σπήλαιο των Κρυστάλλων), ανακαλύφθηκε σχετικώς πρόσφατα στην επαρχία Chihuahua του Μεξικού. Το σπήλαιο βρίσκεται σε βάθος 300 μέτρων, όπου επικρατούν θερμοκρασίες οι οποίες ξεπερνούν τους 50ºC εξαιτίας της γειτνίασής του με διεισδύσεις μάγματος και σχετική υγρασία 90-100%. Οι συνθήκες αυτές το καθιστούν μη επισκέψιμο για το ευρύ κοινό, παρά μόνο από ειδικευμένο προσωπικό (γεωλόγοι, σπηλαιολόγοι) για ερευνητικούς σκοπούς, για σύντομα χρονικά διαστήματα και εφόσον φέρει ειδικές προστατευτικές στολές.
'Αλλες ποικιλίες γύψου είναι το ονομαζόμενο τριαντάφυλλο της ερήμου (desert rose), του οποίο χαρακτηριστικό είναι οι πεταλοειδείς σχηματισμοί, που θυμίζουν ανθισμένο τριαντάφυλλο, και οι σατινένιοι κρύσταλλοι (saten spar), συσσωματώματα βελονοειδών κρυστάλλων με ινώδη, μαργαριτοειδή και απαλή υφή.
Μια ενδιαφέρουσα μορφή γύψου είναι το αλάβαστρο (alabaster). Πρόκειται για μια σχετικώς μαλακή και συμπαγή μορφή πολυκρυσταλλικού γύψου, συχνά με μια κοκκινωπή χροιά λόγω προσμίξεων, με σκληρότητα μόλις 1,5-2 της κλίμακας Mohs. Το αλάβαστρο χρησιμοποιείται για την κατασκευή καλλιτεχνημάτων (συνήθως μικρών γλυπτών), επειδή μπορεί πολύ εύκολα να λαξευτεί και να αποκτήσει τελείως στιλπνή επιφάνεια με στιλβωτικά μέσα (π.χ. γυαλόπανα) βαθμιαία μειούμενου κόκκου.
 |
 |
 |
 |
 |
|
Συσσωμάτωμα κρυστάλλων ανυδρίτη (CaSO4) [πηγή]. |
Τυπική μορφή ορυκτού γύψου (CaSO4·2H2O) [πηγή] |
Ποικιλία γύψου: Σεληνίτης [πηγή]. |
Ποικιλία γύψου: "Ρόδο ερήμου" [πηγή]. |
Ποικιλία γύψου: "Σατινένιοι κρύσταλλοι" [πηγή]. |

Σπάνιας ομορφιάς (συλλεκτικού χαρακτήρα) έγχρωμες ποικιλίες ορυκτού γύψου. 'Ιχνη μεταλλοϊόντων (π.χ. Cu, Fe) προσδίδουν διάφορους χρωματισμούς στους κρυστάλλους.
Λίγες επιπλέον πληροφορίες για το αλάβαστρο [Αναφ. 4]Το αλάβαστρο σχηματίζεται από μικρούς κρυστάλλους γύψου (CaSO4·2H2O) οι οποίοι καθιζάνουν από κορεσμένα διαλύματά του σε λίμνες, καθώς τα ύδατά τους σταδιακά εξατμίζονται. Οι αποθέσεις αυτών των μικρών κρυστάλλων γύψου "θάβονται" κάτω από άλλα φερτά ιζήματα με αποτέλεσμα τη σταδιακή αύξηση της ασκούμενης σ' αυτούς πίεσης. Όταν φθάσουν σε βάθη περίπου 200 m ή περισσότερο κάτω από τον πυθμένα και σε συνθήκες αυξημένης θερμοκρασίας, απομακρύνονται τα μόρια ύδατος από τον γύψο και αυτός μετατρέπεται σε ανυδρίτη (CaSO4). Στη συνέχεια, αν οι συνθήκες αλλάξουν λόγω ανύψωσης του εδάφους ή διάβρωσής του και μειωθεί η ασκούμενη πίεση, τα μόρια ύδατος επαναπροσλαμβάνονται και αναγεννάται ο γύψος, αλλά υπό τη μορφή αλαβάστρου, μιας μορφής γύψου αποτελούμενου από συσσωματώματα μικροκρυστάλλων. Ο προηγούμενος τρόπος σχηματισμού αλαβάστρου συνοψίζεται ως εξής:
Η όλη διαδικασία συμπίεσης/αποσυμπίεσης του γύψου από ιζηματογενή στρώματα ευνοεί τον εγκλεισμό μικροσωματιδίων Fe2O3 από τα υπερκείμενα ιζήματα και έτσι το αλάβαστρο συχνά παρουσιάζει μια πορτοκαλόχρωμη απόχρωση. Τα μεγαλύτερα λατομεία αλαβάστρου βρίσκονται σήμερα στην περιοχή Fuentes de Ebro της επαρχίας της Αραγωνίας στην Ισπανία. Η ονομασία του ορυκτού θεωρείται ότι προέρχεται από την αρχαία Αίγυπτο και από τη λέξη "a-labaste" που αναφέρεται στα αλαβάστρινα βάζα για μυρωδικά λάδια με αναπαράσταση της θεάς Bast ή Bastet, μιας "γατόμορφης" θεάς - προατάτιδας κατά των μεταδοτικών ασθενειών και των κακόβουλων πνευμάτων. Σους αρχαίους 'Ελληνες ήταν γνωστή ως Βούβαστις και την είχαν ταυτίσει με τη θεά 'Αρτεμη. 'Αλλοι πιστεύουν ότι η ονομασία του ορυκτού προέρχεται από την αρχαία αιγυπτιακή πόλη Alabastron. Οι αρχαίοι 'Ελληνες ονόμασαν το τεχνούργημα από αλάβαστρο "αλάβαστον" και από τους Έλληνες διαδόθηκε το όνομα αυτό στην υπόλοιπη Ευρώπη. Πρέπει να σημειωθεί ότι όταν γίνεται αναφορά στο υλικό "αλάβαστρο", αυτό μπορεί να είναι: (α) ένυδρο θειικό ασβέστιο (CaSO4·2H2O) ή (β) ασβεστίτης (calcite, CaCO3), γνωστό και ως αλαβαστρίτης λίθος από τον Θεόφραστο (371 π.Χ. - περ. 287/5 π.Χ.). Τα δύο τελείως διαφορετικά ορυκτά, αλλά με το ίδιο όνομα (ως υλικά όμως), ξεχωρίζουν εύκολα από τη διαφορετική σκληρότητά τους. Το αποτελούμενο από θειικό ασβέστιο μπορεί εύκολα να χαραχθεί με το νύχι, όχι όμως το δεύτερο. Επίσης, σταγόνες διαλύματος HCl στο αλάβαστρο από ασβεστίτη προκαλεί αφρισμό (έκλυση CO2), ενώ δεν παρατηρείται αντίδραση με το αλάβαστρο από γύψο. Το αλάβαστρο (από θειικό ασβέστιο), λόγω της μικρής σκληρότητάς του και του σχετικώς μικρού κόστους του (αν και πολύ ακριβότερο σε σχέση με τον κοινό γύψο), είναι εύκολα επεξεργάσιμο και χρησιμοποιείται ευρύτατα για την κατασκευή κομψοτεχνημάτων από επαγγελματίες και ερασιτέχνες γλύπτες. |
||||
 |
 |
|
Δύο από τις πλέον παράδοξες εμφανίσεις του θειικού ασβεστίου (ως γύψος) στη φύση. Αριστέρα: Εμφάνιση στη φύση του γύψου (CaSO4·2H2O) υπό μορφή άμμου είναι σπανιότατη, ωστόσο τα μεγαλύτερα αποθέματά του βρίσκονται ακριβώς σε αυτή τη μορφή στην περιοχή γνωστή ως White Sands (Λευκή 'Αμμος) της Πολιτείας του New Mexico των ΗΠΑ, μια έκταση περίπου 750 τετραγωνικών χιλιομέτρων, η οποία καταλαμβάνεται από αμμόλοφους μικροσκοπικών κρυστάλλων γύψου. Η περιοχή έχει χαρακτηρισθεί ως εθνικό μνημείο και απαγορεύεται κάθε είδους εκμετάλλευση της άμμου. Στα βόρεια όρια αυτής της περιοχής έγινε το 1946 η δοκιμή της πρώτης πυρηνικής βόμβας (πλουτωνίου). Ένθετη πάνω αριστερά είναι μια μικροφωτογραφία των κόκκων γύψου που συνιστούν την άμμο της περιοχής αυτής. Δεξιά: Τεράστιοι κρύσταλλοι σεληνίτη (μέχρι και μήκους 12 μέτρων), μιας σχεδόν διαφανούς ποικιλίας γύψου, στο σπήλαιο Cave of Crystals (Σπήλαιο των Κρυστάλλων), το οποίο ανακαλύφθηκε το 2000 στην περιοχή Naica της πολιτείας Chihuahua του Μεξικού. Το σπήλαιο βρίσκεται σε βάθος 300 μέτρων, η θερμοκρασία του φθάνει τους 58ºC και η υγρασία βρίσκεται στο 90 έως 100%, γεγονός που υποχρεώνει τους επισκέπτες του να φορούν ειδικές στολές [πηγή]. |
|
Παρασκευή θειικού ασβεστίου στο εργαστήριο - Διαλυτότητά του στο νερό [Αναφ. 5]
Για ένα υλικό όπως το θειικό ασβέστιο, το οποίο αφθονεί στη φύση και επιπλέον αποτελεί παραπροϊόν πλήθους βιομηχανιών, είναι αυτονόητο πώς δεν έχει κανένα νόημα η βιομηχανική παρασκευή του. Στο εργαστήριο μπορεί εύκολα να παρασκευασθεί θειικό ασβέστιο με αντίδραση θειικού οξέος και κονιοποιημένου ανθρακικού ασβεστίου. Επίσης, θειικό ασβέστιο μπορεί να ληφθεί και με αντίδραση σχετικώς πυκνών διαλυμάτων ευδιάλυτων θειικών αλάτων (π.χ. Na2SO4) με αντιστοίχως πυκνά διαλύματα ευδιάλυτων αλάτων του ασβεστίου (π.χ. CaCl2). Η αντίδραση ευνοείται λόγω της σχετικώς μικρής διαλυτότητας του θειικού ασβεστίου, το οποίο μπορεί να ληφθεί με διήθηση και έκπλυσή του με νερό, π.χ.
H2SO4 + CaCO3
![]() CaSO4 + H2O + CO2
Ca2+ + SO42-
CaSO4 + H2O + CO2
Ca2+ + SO42-
![]() CaSO4
CaSO4
 Το
θειικό ασβέστιο
είναι ένα σχετικώς δυσδιάλυτο ουδέτερο άλας, αν και είναι το πλέον ευδιάλυτο από τα τρία χαρακτηριστικώς δυσδιάλυτα
θειικά άλατα
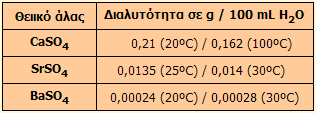
της 2ης ομάδας του περιοδικού πίνακα, οι διαλυτότητές τους
των οποίων παρέχονται στον πίνακα δεξιά (τιμές διαλυτοτήτων από την Wikipedia).
Τα θειικά άλατα των δύο πρώτων στοιχείων της 2ης ομάδας (βηρυλλίου και
μαγνησίου) είναι εξαιρετικώς ευδιάλυτα. Τα ιόντα Ca(II), Sr(II) και
Ba(II) συνιστούν την 4η ομάδα κατιόντων στη συστηματική ποιοτική ανάλυση
κατιόντων ("ομάδα μετάλλων που σχηματίζουν δυσδιάλυτα θειικά άλατα").
Το
θειικό ασβέστιο
είναι ένα σχετικώς δυσδιάλυτο ουδέτερο άλας, αν και είναι το πλέον ευδιάλυτο από τα τρία χαρακτηριστικώς δυσδιάλυτα
θειικά άλατα
της 2ης ομάδας του περιοδικού πίνακα, οι διαλυτότητές τους
των οποίων παρέχονται στον πίνακα δεξιά (τιμές διαλυτοτήτων από την Wikipedia).
Τα θειικά άλατα των δύο πρώτων στοιχείων της 2ης ομάδας (βηρυλλίου και
μαγνησίου) είναι εξαιρετικώς ευδιάλυτα. Τα ιόντα Ca(II), Sr(II) και
Ba(II) συνιστούν την 4η ομάδα κατιόντων στη συστηματική ποιοτική ανάλυση
κατιόντων ("ομάδα μετάλλων που σχηματίζουν δυσδιάλυτα θειικά άλατα").
Η γραμμομοριακότητα κορεσμένου διαλύματος θειικού ασβεστίου στους 20ºC είναι περίπου 0,015 Μ. Η διαλυτότητα του θειικού ασβεστίου σε διάφορα συστήματα ηλεκτρολυτών έχει γίνει αντικείμενο πολλών μελετών. Ο κανόνας είναι ότι η διαλυτότητά του αυξάνει σε διαλύματα αλάτων λόγω μείωσης της ενεργότητας των συστατικών ιόντων του (φαινόμενο γνωστό ως: επίδραση "μη κοινού ιόντος" ή "ιοντικής ισχύος"). 'Ετσι, η διαλυτότητά του σε υδατικό διάλυμα KNO3 15%, γίνεται περίπου 0,057 Μ [Αναφ. 4ε]. Το ίδιο ισχύει και με άλλους ηλεκτρολύτες είτε αυτοί είναι άλατα είτε είναι ισχυρά οξέα, δηλ. επέρχεται μια περιορισμένη αύξηση στη διαλυτότητα του θειικού ασβεστίου, χωρίς όμως να επέλθει ολοκληρωτική διαλυτοποίησή του
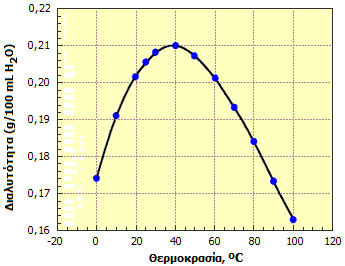
Οι διάφορες πηγές δεν συμφωνούν ως προς τις ακριβείς τιμές της διαλυτότητας του θειικού ασβεστίου σε διάφορες θερμοκρασίες. Προφανώς, η διαλυτότητά του εξαρτάται και από την προέλευσή του ή τον τρόπο παρασκευής του (κρυσταλλικό ένυδρο ή άνυδρο, φυσικής προέλευσης, προϊόν πρόσφατης καθίζησης, ήπιας ή ισχυρής θέρμανσης, κ.λπ.). Για παράδειγμα, στους 20ºC η διαλυτότητα του ημιυδρικού θειικού ασβεστίου είναι περίπου τετραπλάσια του διυδρικού θειικού ασβεστίου. Ωστόσο, όλες οι πηγές συμφωνούν ως προς το ότι η διαλυτότητα του θειικού ασβεστίου παρουσιάζει το κάπως ασυνήθιστο φαινόμενο της εμφάνισης ενός ακρότατου (μέγιστο) σε μια περιοχή θερμοκρασιών, που βρίσκεται στην περιοχή 35ºC-40ºC. Το φαινόμενο αυτό αναφέρεται ως παλίνδρομη διαλυτότητα (retrograde solubility). 'Ενα τυπικό διάγραμμα της διαλυτότητας του θειικού ασβεστίου δείχνεται παρακάτω.
 |
 |
 |
| Αριστερά: Διαλυτότητα του CaSO4 στο νερό ως συνάρτηση της θερμοκρασίας [πηγή]. Μέσον: Ανάμιξη διαλυμάτων Na2SO4 και CaCl2 παρέχει σχετικώς μικρές ποσότητες ιζήματος CaSO4 [πηγή]. Δεξιά: Αποθέσεις θειικού ασβεστίου στο εσωτερικό σωλήνα [πηγή]. | ||
Η μείωση της διαλυτότητας του θειικού ασβεστίου σε υψηλές θερμοκρασίες σε αρκετές περιπτώσεις δημιουργεί πρόβλημα στους βραστήρες, στους εναλλάκτες θερμότητας, όπως και στις εγκαταστάσεις αφαλάτωσης του θαλασσινού νερού. Το πρόβλημα οφείλεται στο ότι η αύξηση της θερμοκρασίας προκαλεί καθίζηση θειικού ασβεστίου του οποίου οι αποθέσεις (calcium sulfate scales), μαζί με εκείνες του ανθρακικού ασβεστίου, καλύπτουν τις σωληνώσεις μειώνοντας τη θερμική αγωγιμότητά τους.
Σε αντίθεση με τις αποθέσεις ανθρακικών αλάτων ασβεστίου και μαγνησίου, οι αποθέσεις θειικού ασβεστίου δεν είναι δυνατόν να απομακρυνθούν με διαλύματα ισχυρών οξέων. Αυτό είναι αναμενόμενο αφού το θειικό ασβέστιο είναι άλας ισχυρού οξέος και η πρωτονίωση των θειικών ιόντων από άλλα ισχυρά οξέα είναι ουσιαστικά μηδενική.
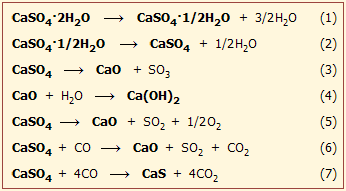 Θερμική διάσπαση του φυσικού γύψου
[Αναφ. 6]
Θερμική διάσπαση του φυσικού γύψου
[Αναφ. 6]
Η θερμική διάσπαση του διυδρικού θειικού ασβεστίου, δηλ. του φυσικού γύψου (CaSO4·2H2O) έχει μελετηθεί διεξοδικά και υπό διάφορες συνθήκες λόγω της μεγάλης πρακτικής και οικονομικής σημασίας και του πλήθους των εφαρμογών των λαμβανόμενων προϊόντων. Ο φυσικός γύψος που θα χρησιμοποιηθεί μπορεί να περιέχει διάφορες προσμίξεις (CaCO3, MgCO3, SiO2, Al2O3, Fe2O3 κ.α.), οι οποίες μέχρι ένα ποσοστό 6% είναι ανεκτές τουλάχιστον για τα κοινά προϊόντα γύψου.
Πρέπει να σημειωθεί ότι υπάρχουν πολλές μέθοδοι μετατροπής του φυσικού γύψου σε ημιυδρικό γύψο (CaSO4·1/2H2O) και άνυδρο γύψο (CaSO4), ανάλογα με την ποιότητα της διατιθέμενης πρώτης ύλης, την επιθυμητή διαδικασία ενυδάτωσης, την εφαρμογή και τις ιδιότητες του προϊόντος ενυδάτωσης. Εδώ περιγράφονται οι γενικές αρχές των μεθόδων αυτών.
|
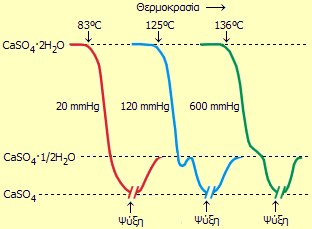
Θερμογραφήματα του γύψου (CaSO4·2H2O) σε τρία διαφορετικά επίπεδα μερικής πίεσης υδρατμών. Όσο μεγαλύτερη είναι η μερική πίεση των υδρατμών, τόσο μεγαλύτερη είναι η θερμοκρασία έναρξης της απόσπασης του κρυσταλλικού ύδατος [πηγή]. |
Ημιυδρικός γύψος. Κατά τη σταδιακή θέρμανση ("έψηση", calcination) του φυσικού γύψου αρχίζει η απόσπαση ύδατος ήδη από τους 80ºC, ενώ επιταχύνεται στην περιοχή θερμοκρασιών 100ºC-120ºC, όπου ο φυσικός γύψος τήκεται και αρχίζει ο κοχλασμός (ο γύψος αρχίζει να "βράζει"). Σε θερμοκρασία περίπου 150ºC, ο γύψος θα έχει χάσει περίπου το 20% του βάρους του ως ύδωρ ή περίπου το 75% του κρυσταλλικού ύδατος. Το προϊόν είναι ο ονομαζόμενος πλαστικός γύψος (plaster of Paris) (αντίδραση 1) .
Οι ακριβείς τιμές των θερμοκρασιών διάσπασης εξαρτώνται από την μερική πίεση των υδρατμών, δηλ. από τη σχετική υγρασία, όπως δείχνουν τα θερμογραφήματα δεξιά (θερμογράφημα: Καταγραφή της μάζας ενός σώματος κατά τη διάρκεια προγραμματισμένης μεταβολής της θερμοκρασίας του).
Το πορώδες και η κρυσταλλικότητα των κόκκων του λαμβανόμενου προϊόντος εξαρτάται και από την πίεση κατά τη θέρμανση. Για παράδειγμα, με θέρμανση στους 115ºC υπό ατμοσφαιρική πίεση λαμβάνεται σκόνη με πορώδεις κόκκους, ακανόνιστου σχήματος (β-ημιυδρίτης, κοινός πλαστικός γύψος). Εάν η θέρμανση πραγματοποιηθεί υπό πίεση, οι κόκκοι έχουν κανονικότερο σχήμα και είναι λιγότερο πορώδεις. Το λαμβανόμενο προϊόν (α-ημιυδρίτης) αναφέρεται ως οδοντική πέτρα (dental stone). Η θέρμανση υπό πίεση αναφέρεται ως υγρή έψηση (wet calcination) αφού πραγματοποιείται σε αυτόκλειστα και σε θερμοκρασίες από 110ºC έως 130ºC και συχνά μέσα σε υδατικό διάλυμα CaCl2 30%.
|
|
 |
|
Η κρυσταλλικότητα των κόκκων του ημιυδρικού γύψου (CaSO4·1/2H2O) εξαρτάται από την πίεση κατά τη θέρμανση. Αριστερά: β-ημιυδρίτης (πορώδης ακανόνιστος κόκκος, γύψος κατάλληλος για κατασκευή εκμαγείων). Δεξιά: α-ημιυδρίτης (συμπαγής, σκληρός κρυσταλλικός κόκκος, γύψος κατάλληλος για οδοντικές εργασίες) [πηγή]. |
|
Σε θερμοκρασία 170ºC-180ºC, σχηματίζεται εν μέρει και ανυδρίτης (CaSO4) (αντίδραση 2). Το μίγμα (CaSO4·1/2H2O + CaSO4) αφήνεται να ψυχθεί σε ειδικούς θαλάμους ελεγχόμενης υγρασίας, επαναπροσροφά υγρασία και σταθεροποιείται στη σύσταση CaSO4·1/2H2O.
Στο εμπόριο διατίθεται καθαρός πλαστικός γύψος (plaster of Paris) με χρόνο πήξης από 5 έως 20 min, ή με διάφορες προσμίξεις, όπως ζωική κόλλα και άμμο (hard wall plaster) με χρόνο πήξης περίπου 1 hr. O πρώτος χρησιμοποιείται κυρίως για την κατασκευή χυτών γύψινων αντικειμένων και για διάφορα διακοσμητικά στοιχεία εσωτερικών χώρων και μικρής έκτασης και επιδιορθωτικού χαρακτήρα οικοδομικές εργασίες, ενώ ο δεύτερος είναι κατάλληλος για κάλυψη τοίχων και για την παραγωγή γυψοσανίδων.
'Ανυδρος γύψος. Σε θερμοκρασία 190ºC-220ºC χάνεται ολοκληρωτικά το κρυσταλλικό ύδωρ και λαμβάνεται ο ονομαζόμενος διαλυτός ανυδρίτης (γ-CaSO4, soluble anhydrite) ή βιομηχανικός γύψος, ο οποίος μπορεί να επανυδατωθεί προς διυδρίτη.
Αυτό το είδος γύψου παρέχει ιδιαίτερα σκληρή επιφάνεια και χρησιμοποιείται κυρίως για επιστρώσεις δαπέδων (flooring plaster) και έχει χρόνο πήξης από 1 έως 16 hr. 'Εχει επίσης ειδικές χρήσεις στην οδοντιατρική και μπορεί να χρησιμοποιηθεί ως ξηραντικό μέσο στα χημικά εργαστήρια, αλλά και στη βιομηχανία. Επίσης διατίθεται και ως μίγμα με Al2(SO4)3 ή Na2B4O7 (Hard Finish Plaster).
Σε θερμοκρασία 300ºC αρχίζει και στους 500ºC-600ºC ολοκληρώνεται η μετατροπή του διαλυτού ανυδρίτη σε αδιάλυτο ανυδρίτη ή νεκρό γύψο (dead-burned anhydrite, β-CaSO4), ο οποίος από κρυσταλλική άποψη είναι παρόμοιος με το ορυκτό ανυδρίτη (φυσικός ανυδρίτης). Ο γύψος αυτός δύσκολα πλέον επανυδατώνεται και χρησιμοποιείται στην παραγωγή τσιμέντου και σε μαρμαροκονιάματα.
Εάν η θερμοκρασία φθάσει στους 1000ºC-1100ºC αρχίζει η μερική διάσπαση του CaSO4 στα συστατικά του οξείδια (αντίδραση 3). Το παραγόμενο SO3 απομακρύνεται ως πτητικό αφήνοντας ως υπόλειμμα το CaO. Αποτέλεσμα της αντίδρασης αυτής είναι η παρατηρούμενη αλκαλικότητα του διαλύματος (ορθότερα: αιωρήματος) ισχυρώς πυρακτωμένου CaSO4, λόγω του σχηματισμού της ισχυρής βάσης Ca(OH)2 από τις μικρές ποσότητες CaO που έχουν σχηματιστεί (αντίδραση 4). Το λαμβανόμενο προϊόν ονομάζεται τραχύς γύψος (CaSO4 + μικρές ποσότητες CaO).
Ο τραχύς γύψος επανυδατώνεται με πολύ βραδύ ρυθμό προς CaSO4·2H2O. Η πήξη του διαρκεί από ημέρες έως και εβδομάδες, όμως στο τέλος παρέχει μικροκρυσταλλικό στερεό κατά πολύ συμπαγέστερο και στερεότερο από εκείνο που παρέχει ο πλαστικός γύψος. Οι διάφοροι τύποι γύψου περιγράφονται συνοπτικά στο επόμενο διάγραμμα. Οι αναφερόμενες θερμοκρασίες είναι οι συχνότερα αναφερόμενες στη βιβλιογραφία.

|
|
|
|
|
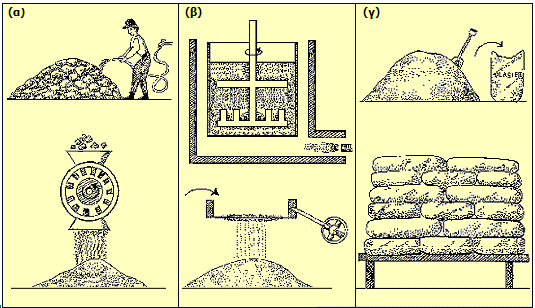
Σχηματική παράσταση παρασκευής πλαστικού γύψου: (α) Ο φυσικός γύψος (CaSO4·2H2O) εκπλένεται με νερό για την απομάκρυνση γαιωδών και φυτικών προσμίξεων και λειοτριβείται σε λεπτή σκόνη. (β) Ο γύψος θερμαίνεται στους 150ºC για καθορισμένο χρονικό διάστημα (ακριβής θερμοκρασία και χρόνος καθορίζονται από τις επιθυμητές ιδιότητες του προϊόντος υπό συνεχή μηχανική ανάδευση και ο λαμβανόμενος πλαστικός γύψος (CaSO4·1/2H2O) κοσκινίζεται. (γ) Μετά την ψύξη του πλαστικού γύψου μεταφέρεται σε αδιάβροχους σάκους (συνήθως πολυαιθυλενίου) και αποθηκεύεται σε υπερυψωμένες βάσεις (παλέτα) [πηγή]. |
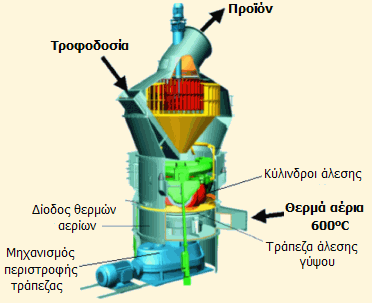
Σύγχρονη μονάδα παραγωγής προϊόντων έψησης γύψου συνεχούς λειτουργίας: Μύλος MPS πύρωσης, άλεσης, αεροταξινόμησης γύψου (MPS vertical roller mill της Gebr-Pfeifer). Παρέχει τη δυνατότητα επιλογής του είδους προϊόντος έψησης και επιπλέον μέσω μεθόδου αεροδιαχωρισμού, μπορεί να επιλεγεί το μέγεθος κόκκων του προϊόντος [πηγή]. |
'Ολες οι αντιδράσεις αφυδάτωσης του διυδρικού θειικού ασβεστίου είναι ενδόθερμες, δηλ. απορροφάται θερμότητα η οποία αποδίδεται κατά την επανυδάτωση. Το γεγονός αυτό επιβραδύνει την επέκταση μιας πυρκαγιάς από τον έναν χώρο στον άλλο, όταν αυτοί χωρίζονται με γυψοσανίδες, αφού η θερμότητα απορροφάται από τον γύψο και η θερμοκρασία του διατηρείται σταθερά στην περιοχή των 100ºC-150ºC όσο γίνεται η μετατροπή του σε ημιυδρικό ή άνυδρο θειικό ασβέστιο.
Σε πολύ υψηλές θερμοκρασίες (ενδεικτικά: 1300ºC) επέρχεται πληρέστερη διάσπαση του CaSO4 (διάσπαση του SO3) με σχηματισμό οξυγόνου, δηλ. το CaSO4 αρχίζει να δρα ως οξειδωτικό μέσο διευκολύνοντας τη συντήρηση της πυρκαγιάς (αντίδραση 5). Η διάσπαση του CaSO4 σε υψηλές θερμοκρασίες διευκολύνεται παρουσία αναγωγικών αερίων, όπως π.χ. το CO (αντίδρασεις 6, 7).
Επανυδάτωση του γύψου
|
Γυψαδόρος των αρχών του 19ου αιώνα επί το έργον. Ζωγραφικός πίνακας του John Cranch (1751-1821) [πηγή]. |
Κατά την
ανάμιξη του πλαστικού γύψου με νερό, πραγματοποιείται η αντίστροφη
αντίδραση της αντίδρασης 1, δηλ. η ενυδάτωση του πλαστικού γύψου (κονία,
plaster) προς διυδρικό θειικό ασβέστιο:
CaSO4·1/2H2O
+ 3/2H2O
![]() CaSO4·2H2O.
Το λαμβανόμενο εύπλαστο (αρχικά) μίγμα αποτελεί τον γυψοπολτό
(κονίαμα, cement).
CaSO4·2H2O.
Το λαμβανόμενο εύπλαστο (αρχικά) μίγμα αποτελεί τον γυψοπολτό
(κονίαμα, cement).
Θεωρητικά, με βάση την αντίδραση επανυδάτωσης η κατά βάρος αναλογία ανάμιξης (πλαστικός γύψος):(νερό) θα έπρεπε να είναι ίση προς 100:19. Ωστόσο, στην αναλογία αυτή σωστή ανάμιξη είναι αδύνατη. Το λαμβανόμενο μίγμα είναι "σβωλιασμένο", ανομοιογενές και καθόλου εύπλαστο. Οι συνιστώμενες αναλογίες κυμαίνονται από 100:40 έως 100:90 και εξαρτώνται σε σημαντικό βαθμό από τον τρόπο παρασκευής του πλαστικού γύψου, από τα τυχόν τροποποιητικά πρόσθετα που περιέχει, ως επίσης και από τις επιθυμητές ιδιότητες του προϊόντος ενυδάτωσης.
Για εκμαγεία συνιστάται σχετικώς μεγάλη αναλογία ως προς το νερό, ώστε ο γυψοπολτός να είναι λεπτόρρευστος και να διεισδύει σε λεπτομέρειες του αποτυπούμενου αντικειμένου. Μικρή αναλογία συνιστάται σε περιπτώσεις που απαιτείται μηχανική ανθεκτικότητα στον στερεοποιημένο γυψοπολτό.
Ο κάθε παραγωγός πλαστικού γύψου προτείνει την καταλληλότερη αναλογία για δεδομένη χρήση. Αν δεν υπάρχει σχετική πληροφόρηση, μια αναλογία ανάμιξης (πλαστικός γύψος):(νερό) 100:50 θα ήταν μια καλή δοκιμαστική αρχή. Η πέραν της θεωρητικής ποσότητα ύδατος εξατμίζεται σταδιακά από τη στερεοποιημένη μάζα καθιστώντας την πορώδη. Λεπτομερείς οδηγίες ως προς τον τρόπο ανάμιξης παρέχονται από διάφορες πηγές (π.χ. [Αναφ. 6γ-δ]).
Η ενυδάτωση του πλαστικού γύψου συνοδεύεται από έκλυση θερμότητας και αρχικά με μια ελαφριά διαστολή (περίπου 0,3%) του στερεοποιούμενου γυψοπολτού. Συνήθως, η πήξη (στερεοποίηση) αρχίζει περίπου μετά από 10 min (: χρόνος στερεοποίησης, setting time) από την παρασκευή του γυψοπολτού και ολοκληρώνεται περίπου μετά από 45 min. Στο εμπόριο διατίθενται πλαστικοί γύψοι ειδικών χρήσεων (π.χ. για κατασκευή εκμαγείων) με πρόσθετα που εξασφαλίζουν βραδεία στερεοποίηση ("20-minute casting plaster", "30 minute casting plaster")
 'Οσο υψηλότερη είναι θερμοκρασία έψησης του φυσικού γύψου, τόσο
μεγαλύτερος είναι ο χρόνος πήξης του λαμβανόμενου γυψοπολτού. Κατά το
τελευταίο στάδιο της πήξης αρχίζει η θερμοκρασία να μειώνεται και
επέρχεται μια μικρή συστολή, η οποία διευκολύνει την απομάκρυνση των
εκμαγείων από τις μήτρες (καλούπια) τους. Οι τελικές ιδιότητες (διαστάσεις,
σκληρότητα, πορώδες, υφή) σταθεροποιούνται μετά από 3 έως 4 ημέρες.
'Οσο υψηλότερη είναι θερμοκρασία έψησης του φυσικού γύψου, τόσο
μεγαλύτερος είναι ο χρόνος πήξης του λαμβανόμενου γυψοπολτού. Κατά το
τελευταίο στάδιο της πήξης αρχίζει η θερμοκρασία να μειώνεται και
επέρχεται μια μικρή συστολή, η οποία διευκολύνει την απομάκρυνση των
εκμαγείων από τις μήτρες (καλούπια) τους. Οι τελικές ιδιότητες (διαστάσεις,
σκληρότητα, πορώδες, υφή) σταθεροποιούνται μετά από 3 έως 4 ημέρες.
O χρόνος πήξης του γυψοπολτού μπορεί σκόπιμα να αυξηθεί ή να μειωθεί με την εκ των προτέρων προσθήκη διάφορων υλικών στον πλαστικό γύψο ή κατά την παρασκευή του γυψοπολτού. Για παράδειγμα, επιβράδυνση επιτυγχάνεται με την προσθήκη επιβραδυντών (retarders), όπως είναι τα: ανθρακικό νάτριο, βόρακας, δεξτρίνη, παράγωγα της κυτταρίνης, ζωική κόλλα, ή με τη χρήση νερού που περιέχει ποσότητα ασθενούς οξέος (εμπειρικά προστίθεται ποσότητα ξυδιού ή χυμού λεμονιού, αν και πολλοί δεν συνιστούν κάτι τέτοιο) κατά την παρασκευή του γυψοπολτού. Επιτάχυνση της πήξης μπορεί να επιτευχθεί με την προσθήκη κοινού άλατος (NaCl) ή με τη χρήση θερμού νερού.
Επιτάχυνση της πήξης του γυψοπολτού μπορεί να προκληθεί από μικρές ποσότητες άψητου γύψου ή στερεοποιημένου γυψοπολτού (δηλ. διυδρικού ασβεστίου), οι κόκκοι των οποίων δρουν κατά κάποιο τρόπο ως "πυρήνες κρυστάλλωσης". Επομένως επιβάλλεται χρήση καθαρών εργαλείων και καλουπιών (από προηγούμενες χρήσεις) για να αποφευχθεί η πρόωρη πήξη του γυψοπολτού. Για τον ίδιο λόγο δεν πρέπει ποτέ υγρά εργαλεία (σπάτουλες) να βυθίζονται στους σάκκους γύψου.
Σε γενικές γραμμές, επιτάχυνση της πήξης του γυψοπολτού αποφεύγεται διότι δεν παρέχει ανθεκτικά προϊόντα (π.χ. εκμαγεία), ενώ αυξάνεται πολύ και η θερμοκρασία του γυψοπολτού (η ίδια θερμότητα εκλύεται σε μικρότερο χρονικό διάστημα) και επομένως η διαστολή του. Πρέπει να σημειωθεί ότι μικροί χρόνοι πήξης αποτελούν ένδειξη ακατάλληλου τρόπου αποθήκευσης του πλαστικού γύψου ("μπαγιάτικος γύψος"), αφού θα έχει εν μέρει απορροφήσει υγρασία και επομένως θα περιέχει διυδρικό γύψο, ο οποίος επιταχύνει την πήξη.
 |
ΠΡΟΣΟΧΗ: Η θερμοκρασία του γυψοπολτού κατά την πήξη του, ιδιαίτερα όταν αυτή είναι ταχεία, μπορεί να ξεπεράσει τους 50ºC και επομένως μπορεί να προκαλέσει σοβαρά εγκαύματα σε μέλη του σώματος, αν αυτά εγκλωβιστούν στον σχεδόν στερεοποιημένο γυψοπολτό. Το 2009 είχε αναφερθεί ένα σοβαρότατο ατύχημα σε μαθήτρια σχολείου στο εργαστήριο καλλιτεχνικών. Τα χέρια της μαθήτριας παγιδεύτηκαν στον γυψοπολτό κατά τη διάρκεια της στερεοποίησής του. Καλό θα ήταν να αποφεύγεται η επαφή γυμνού δέρματος με τον γυψοπολτό. Επίσης κατά την εργασία με πλαστικό γύψο θα πρέπει οι εργαζόμενοι να φορούν απλή ιατρική μάσκα για να αποφευχθεί η εισπνοή της συνήθως λεπτότατης σκόνης του. |
|
|
Πλαστικός γύψος (plaster of Paris) διάφορων κατασκευαστών και για διάφορες χρήσεις (οικοδομικές εργασίες, καλλιτεχνήματα, εκμαγεία, ιατρική χρήση, κ.α.). Σε όλες τις περιπτώσεις πρόκειται για μερικώς ενυδατωμένο θειικό ασβέστιο (CaSO4·nH2O, n=0,5-0,7) που έχει προκύψει με θέρμανση (έψηση) του ορυκτού γύψου (CaSO4·2H2O) στην περιοχή των 130-170ºC. Οι διάφορες εμπορικές ποικιλίες διαφέρουν ως προς τον χρόνο πήξης (κατά κανόνα αύξηση της θερμοκρασίας έψησης αυξάνει τον χρόνο ενυδάτωσης και επομένως πήξης του γυψοπολτού) και ως προς την περιεκτικότητα σε διάφορα πρόσθετα, ανάλογα με την επιθυμητή χρήση. |
 |
 |
 |
|
Υπαίθριο γυψωρυχείο στο Αλτσί του Δήμου Σητείας με παραγωγική ικανότητα 300 χιλιάδων τόνων ετησίως [πηγή]. |
Στοά υπόγειου γυψωρυχείου έξω από την πόλη Grand Rapids της Πολιτείας Michigan των ΗΠΑ [πηγή]. |
Μονάδα βιομηχανικής παραγωγής γύψου διαφόρων ποιοτήτων της πολιτείας Maharashtra της Ινδίας [πηγή]. |
Παραγωγή γύψου [Αναφ. 7]
|
Ο εικονιζόμενος σωρός φωσφογύψου βρίσκεται στην κομητεία Polk, στη Φλόριντα των ΗΠΑ. Εκτιμάται ότι αποτελείται από 1 δισεκατομμύριο τόνους φωσφογύψου και κάθε χρόνο προστίθενται άλλα 32 εκατομμύρια τόνοι [πηγή]. |
Η κυριότερη χημική ένωση που απαντά στη φύση το θειικό ασβέστιο είναι ο φυσικός γύψος (CaSO4·2H2O), που συναντάται σε πολλές περιοχές του πλανήτη. Συνήθως γίνεται εξόρυξη σε επιφανειακά ορυχεία αλλά και σε υπόγειες στοές. Η παγκόσμια παραγωγή γύψου το 2012 είχε εκτιμηθεί στα περίπου 150 εκατομμύρια τόνων. Αυτός ο γύψος υφίσταται θερμική επεξεργασία σε ειδικές βιομηχανικές μονάδες και διατίθεται σε διάφορες μορφές πλαστικού γύψου, διαλυτού ανυδρίτη (βιομηχανικού γύψου) ή αδιάλυτου ανυδρίτη (νεκρού γύψου).
Τεράστιες ποσότητες διυδρικού θειικού ασβεστίου (CaSO4·2Η2Ο) παράγονται και από άλλες βιομηχανικές διεργασίες, όπως κατά την αποθείωση των αερίων εκπομπών (Flue-Gas Desulfurization, FGD) των διυλιστηρίων ορυκτών καυσίμων, των βιομηχανιών παραγωγής τσιμέντου και πλήθους άλλων βιομηχανιών, που καταναλίσκουν ορυκτά καύσιμα ως πηγή ενέργειας.
Το διοξείδιο του θείου, το οποίο προέρχεται από την καύση θειούχων οργανικών ενώσεων που συνοδεύουν σε μικρές αναλογίες το πετρέλαιο ή τις διάφορες μορφές γαιάνθρακα, δεσμεύεται καθώς τα αέρια καύσης διέρχονται μέσω εναιωρήματος ανθρακικού ασβεστίου ή υδροξειδίου του ασβεστίου και το αρχικά σχηματιζόμενο θειώδες ασβέστιο οξειδώνεται προς θειικό ασβέστιο κατά την αποθήκευση, σύμφωνα με τις αντιδράσεις:
CaCO3 +
SO2 ![]() CaSO3
+ CO2
Ca(OH)2
+ SO2
CaSO3
+ CO2
Ca(OH)2
+ SO2
![]() CaSO3
+ H2O
CaSO3
+ 1/2O2
CaSO3
+ H2O
CaSO3
+ 1/2O2
![]() CaSO4
CaSO4
Ο γύψος ο παραγόμενος από την αποθείωση των αερίων εκπομπών, είναι γνωστός ως γύψος FGD (FGD gypsum), ως γύψος εξαιρετικής καθαρότητας χρησιμοποιείται ευρύτατα στη βιομηχανική κατασκευή γυψοσανίδων. Το 2010, στις ΗΠΑ χρησιμοποιήθηκαν για τον σκοπό αυτό περίπου 8 εκατομμύρια τόνοι γύψου FGD, ποσότητα η οποία αποτελεί το 50% του συνολικώς χρησιμοποιούμενο γύψου στη χώρα.
Το θειικό ασβέστιο αποτελεί το κύριο παραπροϊόν της βιομηχανίας φωσφορικού οξέος (H3PO4) και φωσφορικών λιπασμάτων, όπου τα ορυκτά φωσφορικά άλατα ασβεστίου, όπως ο απατίτης, Ca5(PO4)3X (X = F, Cl, OH), υπόκεινται σε επεξεργασία με θειικό οξύ και το θειικό ασβέστιο καθιζάνει αποτελώντας το κύριο παραπροϊόν της διαδικασίας. Ανάλογα, θειικό ασβέστιο παράγεται κατά τη βιομηχανική παραγωγή υδροφθορίου (HF) από τον φθορίτη, CaF2:
Ca5(PO4)3X
+ 5H2SO4 +
10H2O
![]() 3H3PO4
+ 5CaSO4·2H2O
+ HX
CaF2 + H2SO4
3H3PO4
+ 5CaSO4·2H2O
+ HX
CaF2 + H2SO4 ![]() CaSO4 + 2HF
CaSO4 + 2HF
Ειδικά ο γύψος ο οποίος προέρχεται από τη βιομηχανία φωσφορικού οξέος και φωσφορικών λιπασμάτων, γνωστός ως φωσφογύψος (phosphogypsum) και παράγεται σε ποσότητες εκατοντάδων εκατομμυρίων τόνων ετησίως, αποτελεί ένα σημαντικό περιβαλλοντικό πρόβλημα λόγω της αυξημένης φυσικής ραδιενέργειάς του, όπως και της σχετικώς μεγάλης περιεκτικότητάς του σε μικροποσότητες του τοξικού καδμίου. Τα χαρακτηριστικά αυτά ουσιαστικά δεν επιτρέπουν την οικοδομική χρήση του. Να σημειωθεί ότι για κάθε kg φωσφορούχου λιπάσματος, παράγονται 5 kg φωσφογύψου.
Η ραδιενέργεια του φωσφογύψου οφείλεται στις σχετικώς αυξημένες ιχνοποσότητες θορίου (232-Th) και ραδίου (226-Ra), θυγατρικοί πυρήνες της διάσπασης του 238-U, που εμπεριέχεται σε ίχνη στον φωσφοαπατίτη. Αλλά, από πού προέκυψε αυτή η ραδιενέργεια και η μεγάλη περιεκτικότητα σε κάδμιο; Ο απατίτης σχηματίστηκε με βραδεία καθίζηση φωσφορικού ασβεστίου στους αρχέγονους ωκεανούς και συσσώρευσή του στον πυθμένα. Το ίζημα του φωσφορικού ασβεστίου σε λεπτότατο διαμερισμό και ως εναιώρημα έχει την ιδιότητα να προσροφά πολλά από τα μεταλλοϊόντα που βρίσκονται σε ιχνοσυγκεντρώσεις στα θαλάσσια ύδατα, με αποτέλεσμα τόσο τα ραδιενεργά στοιχεία, όσο και το κάδμιο (και όχι μόνο) να υπόκεινται σε ένα είδος εμπλουτισμού τους και να βρίσκονται σε σχετικώς μεγάλες περιεκτικότητες στον σχηματιζόμενο απατίτη.
Η χρησιμοποίηση του φωσφογύψου ως οικοδομικού υλικού θα ήταν επικίνδυνη, ιδιαίτερα σε κλειστούς χώρους, λόγω της συνεχούς εκπομπής του αερίου ραδονίου (radon, 222-Rn), ενός ισχυρώς α-ραδιενεργού στοιχείου. Ωστόσο, έχει προταθεί η χρήση του φωσφογύψου σε ανοιχτούς χώρους, όπως π.χ. για εμπλουτισμό εδαφών σε θείο. 'Εχει εκτιμηθεί ότι μόλις το 14% του φωσφογύψου αξιοποιείται σε σχετικές εφαρμογές, το 28% απορρίπτεται σε υδάτινους όγκους (θάλασσα, λίμνες) και το υπόλοιπο έχει σωρεύεται σε ανοικτές εκτάσεις ως τεχνητοί λόφοι (phosphgypsum piles), οι οποίοι οπωσδήποτε συνιστούν σημαντικό περιβαλλοντικό πρόβλημα.
 |
 |
 |
 |
|
Τυπικές εφαρμογές διαφόρων εμπορικών μορφών γύψων: Γυψοσανίδες [πηγή], εσωτερικές διακοσμίσεις [πηγή], γλυπτά εσωτερικών χώρων (συνήθως προϊόντα χύτευσης) [πηγή]. Ακόμη και η γνωστή "κιμωλία" δεν έχει καμιά σχέση με το ορυκτό κιμωλία (CaCO3), αλλά κατασκευάζονται με χύτευση πλαστικού γύψου στον οποίο μπορούν να προστεθούν διάφορα οργανικά χρώματα [πηγή]. |
|||
 |
 |
 |
|
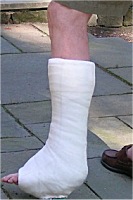
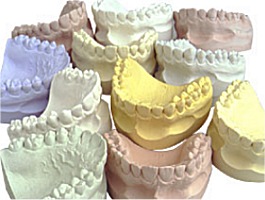
Ο γύψος αποτελεί το υλικό επιλογής για του ορθοπεδικούς ιατρούς για την ανάταξη καταγμάτων. Στο εμπόριο διατίθενται επίδεσμοι που εμπεριέχουν γύψο (γυψογάζες) για τον σκοπό αυτό. Επίσης ευρύτατη χρήση γύψου γίνεται από τους οδοντοτεχνίτες για την κατασκευή εκμαγείων οδοντοστοιχειών. |
||
Χρήσεις του γύψου [Αναφ. 8]
Οι χρήσεις του γύψου είναι άφθονες σε πολλά και διαφορετικά τεχνικά και επιστημονικά πεδία. Εδώ περιγράφονται συνοπτικά μόνο οι σπουδαιότερες από αυτές.
Στον κατασκευαστικό τομέα. Ο συνηθισμένος πλαστικός γύψος (CaSO4·1/2H2O), που χρησιμοποιείται για απλές οικοδομικές εργασίες χρησιμοποιείται για προϊόντα χύτευσης και ελαφρά διακοσμητικά στοιχεία εσωτερικών χώρων. Μια ενδεικτική τιμή πλαστικού γύψου για καλλιτεχνήματα ("καλλιτεχνικός γύψος") σε ποσότητες μερικών kg είναι περίπου 0,5 ευρώ/kg.
Μεγάλες ποσότητες αυτού του γύψου χρησιμοποιούνται για την κατασκευή των γυψοσανίδων (drywalls, plasterboards, wallboards, gypsum boards), οι οποίες διατίθενται σε πλαίσια τυποποιημένων διαστάσεων. Κατασκευάζονται με πίεση πλαστικού γύψου μεταξύ παχιών φύλλων χαρτιού.
Οι γυψοσανίδες χρησιμοποιούνται ευρύτατα για την κατασκευή εσωτερικών τοίχων οικοδομών. Ο χρησιμοποιούμενος γύψος εμπεριέχει ίνες χαρτιού ή υαλοβάμβακα, κάποιον πλαστικοποιητή, αφριστικό μέσο, όπως και σκόνη γύψου που δρα ως επιταχυντής, μυκητοκτόνες ουσίες, κηρούς και οργανοπυριτικές ενώσεις. Το πλεονέκτημα της χρήσης των γυψοσανίδων είναι το μικρό κόστος τους, η ευκολία της εγκατάστασης και η μικρή θερμική αγωγιμότητά τους η οποία ανακόπτει την ταχύτητα επέκτασης πυρκαγιών. 'Οπως προαναφέρθηκε, σε περίπτωση πυρκαγιάς σε ένα χώρο, ο γύψος προσφέρει ένα βαθμό μόνωσης, αφού δεν ανεβαίνει η θερμοκρασία του τοίχου του διπλανού χώρου πάνω από 100ºC-150ºC, έως ότου ο γύψος αφυδατωθεί πλήρως. Ειδικές ποιότητες γυψοσανίδων προσφέρουν και εξαιρετική ηχομόνωση (acoustic grade plasterboard).
|
Οστική αποκατάσταση με εμβολιασμό (grafting) θειικού ασβεστίου στο σημείο του προβλήματος [πηγή]. |
Ο διαλυτός ανυδρίτης ή βιομηχανικός γύψος (γ-CaSO4) χρησιμοποιείται για οικοδομικές εργασίες περιλαμβάνεται χρησιμοποιείται επίσης για τοιχοποιίες και επιστρώσεις πατωμάτων. Μεγάλες ποσότητες γύψου στη μορφή αδιάλυτου ανυδρίτη ή νεκρού γύψου (β-ανυδρίτη) χρησιμοποιούνται στη βιομηχανία παραγωγής τσιμέντου. Τυπικά, το τσιμέντο τύπου Portland περιέχει 5% CaSO4.
Στην ιατρική. Ειδικές ποιότητες πλαστικού γύψου χρησιμοποιείται στην ορθοπεδική για την ανάταξη καταγμάτων. Συνήθως διατίθεται υπό τη μορφή επιδέσμων γύψου (Plaster of Paris bandages) γνωστών ως "γυψογάζες". Στην οδοντιατρική χρησιμοποιείται ο πλαστικός γύψος (plaster of Paris), όπως και μια μορφή διαλυτού ανυδρίτη για την κατασκευή εκμαγείων οδοντοστοιχιών. Για οδοντιατρικές εργασίες διατίθεται μια μεγάλη ποικιλία γύψων ειδικής κατασκευής (θέρμανση του διυδρίτη υπό υψηλές πιέσεις).
Το θειικό ασβέστιο είναι βιοσυμβατό υλικό και χρησιμοποιείται ως υλικό οστικής αναγέννησης και στα οδοντικά εμφυτεύματα. 'Οταν εμφυτευθεί στο σώμα, αρχίζει να διαλύεται με βραδύ ρυθμό παρέχονται ιόντα ασβεστίου και θειικά ιόντα. Τα ιόντα ασβεστίου συνδέονται με τα φωσφορικά ιόντα των σωματικών υγρών και σχηματίζουν φωσφορικό ασβέστιο. Αυτό συνδέεται με το υπάρχον κρυσταλλικό πλέγμα του οστικού απατίτη και επιφέρει δημιουργία οστικής μάζας στο σημείο που απαιτείται.
Στη γεωργία και στο περιβάλλον. Θειικό ασβέστιο χρησιμοποιείται για τον εμπλουτισμό καλλιεργούμενων εδαφών σε θειικά ιόντα, τα οποία διατίθενται από το άλας βαθμιαία λόγω της περιορισμένης διαλυτότητάς του. Βελτιώνει την υφή του εδάφους, την ικανότητα παγίδευσης υγρασίας και μειώνει την αλκαλικότητά του. Βελτιώνει τις αποδόσεις καλλιεργειών που έχουν ανάγκη σχετικώς μεγάλες ποσότητες θειικών, όπως του αλφάλφα, του σίτου, του καλαμποκιού και του βάμβακα.
|
|
 |
|
|
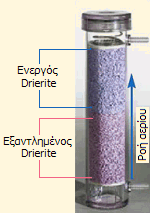
Αριστερά: Drierite με δείκτη κορεσμού υγρασίας (φρέσκος και εξαντλημένος). Μέσον: Φύσιγγα ξήρανσης αερίων με Drierite. Δεξιά: Τυπική εμπορική συσκευασία Drierite [πηγή]. |
Θειικό ασβέστιο προστίθεται στα θολά νερά μικρών λιμνών ως ένα αβλαβές για τους υδρόβιους οργανισμούς διαυγαστικό μέσο και αποτρεπτικό της ανάπτυξης ορισμένων ανεπιθύμητων οργανισμών (άλγη). Ακόμη, προστίθεται στα νερά άρδευσης αμπελώνων, όπως και στο νερό που χρησιμοποιείται για τις ζυμώσεις στη ζυθοποιία, ως σταθεροποιητικό της σκληρότητάς του και της περιεκτικότητάς του σε θειικά ιόντα.
Στο χημικό εργαστήριο. Στο χημικό εργαστήριο, στη μορφή χονδρόκοκκου διαλυτού ανυδρίτη χρησιμοποιείται ως ξηραντικό μέσο αερίων και διαλυτών με την εμπορική ονομασία Drierite. Αν και η χωρητικότητά του Drierite σε νερό είναι περιορισμένη (περίπου 10%), ωστόσο πλεονεκτεί κατά το ότι είναι σχετικώς χημικώς αδρανής, μπορεί να αναζωογονηθεί εύκολα με θέρμανση στους 200ºC και να ξαναχρησιμοποιηθεί.
Στο εμπόριο διατίθεται Drierite με 3% CoCl2 ως δείκτη κορεσμού. Το άλας CoCl2 ενυδατωμένο ([Cο(H2O)6]Cl2: οκταεδρική διάταξη υποκαταστατών) έχει ρόδινο χρώμα (ένδειξη "εξαντλημένου" Drierite), ενώ αφυδατωμένο (Co[CoCl4]: τετραεδρική διάταξη υποκαταστατών) έχει κυανό χρώμα.
'Αλλες εφαρμογές. Το θειικό ασβέστιο στη μορφή του αδιάλυτου ανυδρίτη χρησιμοποιείται στη χαρτοβιομηχανία ως καλυπτικό μέσο του χαρτιού, ως πληρωτικό (filler) και επιβραδυντικό καύσης πλαστικών αντικειμένων, στη βιομηχανία χρωμάτων, στη μεταλλουργία του ψευδαργύρου. Επίσης, το θειικό ασβέστιο ως ουσιαστικά μη τοξική χημική ένωση, χρησιμοποιείται στη βιομηχανία τροφίμων ως αντιαφριστικό, ως σταθεροποιητικό και ενισχυτικό ζύμης και ως αντισυσσωματικό (anti-caking) πρόσθετο (Ε516). Θειικό ασβέστιο χορηγείται ως πηγή ασβεστίου σε διάφορα διατροφικά πρόσθετα.
Μια παλιά χρήση του γύψου, ως πηγής ιόντων ασβεστίου, για την τεχνητή αύξηση της οξύτητας των οίνων με βάση την αντίδραση:
TartH- + Ca2+ ![]() TartCa
+ H+
(TartH2:
HOCOCH(OH)CH(OH)COOH, τρυγικό οξύ)
TartCa
+ H+
(TartH2:
HOCOCH(OH)CH(OH)COOH, τρυγικό οξύ)
σήμερα πλέον δεν επιτρέπεται, διότι αυξάνει την περιεκτικότητα του οίνου σε θειικά ιόντα.
 |
 |
 |
 |
 |
|
Ορισμένα από τα βιβλία της Amazone που αφορούν το θειικό ασβέστιο και τον πλαστικό γύψο και τις χρήσεις τους. |
||||